Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.29 no.1 Ciudad de la Habana ene.-mar. 2013
ARTÍCULO DE REVISIÓN
Células madre mesenquimales: aspectos relevantes y aplicación clínica en la medicina regenerativa
Mesenchymal stem cells: relevant aspects and clinical applications in regenerative medicine
Lic. Bertha Beatriz Socarrás-Ferrer,I Lic. Lázaro Orlando del Valle-Pérez,I Lic. Karelys de la Cuétara-Bernal,II Dra. Vianed Marsán-Súarez,I Dra. Miriam-Sánchez Segura,I Dra.C.M. Consuelo Macías-AbrahamI
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Centro Internacional de Restauración Neurológica (CIREN). La Habana, Cuba.
RESUMEN
Se describen los aspectos más relevantes de las células madre mesenquimales que incluyen su plasticidad hacia diversos linajes celulares, como condrocitos, osteocitos y adipositos, entre otros. Dichas células se pueden obtener principalmente de médula ósea, sangre de cordón umbilical y tejido adiposo, de donde se han logrado establecer cultivos que permiten estudiar sus propiedades funcionales y fenotípicas. Estas expresan antígenos CD73, CD90 y CD105 en ausencia de antígenos hematopoyéticos CD34 y CD45, así como diferentes receptores para citocinas y moléculas de adhesión. Futuras investigaciones permitirán conocer diversos aspectos biológicos de estas células, de importancia en su utilización en la medicina regenerativa como medida terapéutica para solucionar una amplia variedad de enfermedades.
Palabras clave: células madre mesenquimales, médula ósea, sangre de cordón umbilical, tejido adiposo.
ABSTRACT
The main features of multipotent mesenchymal stem cells are described, which includes its plasticity to various cell lineages such as chondrocytes, osteocytes and adipocytes, among others. These cells can be obtained mainly from bone marrow, umbilical cord blood and adipose tissue, where it has been possible to establish crops that allow the study of their functional and phenotypic properties. They express antigens CD73, CD 90 and CD105 in the absence of CD34 and CD45 hematopoietic antigens, as well as cytokine receptors and adhesion molecules. Future investigations will make it possible to know various biological aspects of these cells of importance for their use in regenerative medicine as a therapeutic mean to solve a wide variety of diseases.
Key words: mesenchymal stem cells, bone marrow, umbilical cord blood, adipose tissue.
INTRODUCCIÓN
Las células madre mesenquimales (CMM) son células adultas multipotentes, con morfología fibroblastoide y plasticidad hacia diversos linajes celulares como condrocitos, osteocitos y adipocitos, entre otros. Estas pueden ser aisladas y expandidas en medio de cultivo debido a sus propiedades de adhesión al plástico, diferenciación y proliferación in vitro.1-10
Las CMM se caracterizan por presentar una morfología en forma de huso con núcleo alargado, central, que contienen de 2 a 3 nucleolos. En estudios de citometría de flujo se han descrito tres subpoblaciones de estas células. Una de células pequeñas, fusiformes y agranulares a las que denominaron RS-1; otra de células pequeñas y agranulares nombrada RS-2; y la última, conformada por células grandes y granulares a las que denominaron células mesenquimales maduras o CMMm. También se ha reportado la presencia de 2 tipos morfológicos en los cultivos, uno con forma fibroblastoide, que es el predominante, y otro representado por células de mayor tamaño y forma romboide.1,11-16
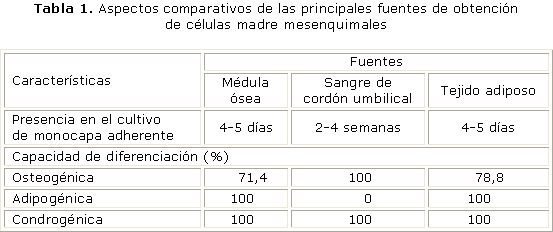
Las CMM pueden ser aisladas de diferentes fuentes, entre ellas: la médula ósea, la sangre de cordón umbilical, tejido adiposo, páncreas, hígado, músculo esquelético, dermis, membrana sinovial y pulpa dental. Varios grupos de investigaciones publicadas han señalado la posibilidad de obtener también estas células de otras fuentes alternativas, como el líquido amniótico y la gelatina de Wharton del cordón umbilical. No obstante, los tejidos más empleados son la médula ósea, la sangre del cordón umbilical y el tejido adiposo. Estudios recientes han señalado que no existen
diferencias morfológicas ni inmunofenotípicas entre las células obtenidas de estos tejidos, pero los resultados indicaron que aunque la sangre de cordón umbilical tiene un mayor potencial de expansión, su potencial de diferenciación es menor, al no hacerlo hacia un linaje adipogénico.13-17
CARACTERÍSTICAS DE LAS CMM
En cuanto al aislamiento y cultivo a partir de tejido adiposo, las células obtenidas tienen una morfología, fenotipo y capacidad de diferenciación similar a la médula ósea pero con mayor potencial de proliferación. La obtención de muestras de este tejido es poco invasiva y puede hacerse a través de procedimientos como liposucción o abdominoplastia.13,15 (tabla 1).
Para que las CMM se puedan clasificar como tales deben expresar los antígenos mesenquimales CD73, CD90 y CD105 y no tener antígenos hematopoyéticos como CD34, CD45, CD14 y CD11b. Además, se ha planteado que las CMM pueden expresar los siguientes antígenos: CD13, CD29, CD44, CD116 y el receptor a del factor de crecimiento derivado de las plaquetas.
Por otro lado, se ha comprobado que las CMM son positivas para otros factores de crecimiento y de matriz celular como: el receptor del factor de crecimiento neuronal, los receptores de factores de necrosis tumoral I y II y los receptores de las interleucinas 1(CD121), 3(CD123), 4(CD124), 6(CD126) y 7(CD127). Expresan diferentes moléculas de adhesión: ICAM-1 (CD54), ICAM-2 (CD102), ICAM-3 (CD50), VCAM (CD106), L selectina (CD62L), LFA-3 (CD58), ALCAM (CD66), NCAM (CD56), endoglobina (CD 105) y CD 72. Por otro lado, estas células son negativas a las reacciones citoquímicas: fosfatasa alcalina, fosfatasa ácida y negro sudán.3,14-20
Existen moléculas de gran relevancia en la hematopoyesis que son producidas y secretadas por las CMM. Estas moléculas incluyen componentes de la matriz extracelular como los colágenos I, III, IV y VI, fibronectina, entre otras; y citocinas que incluyen la interleucina 6 (IL-6), el factor inhibitorio de leucemia, el factor estimulante de colonias de macrófagos, el factor de crecimiento de fibroblastos 1 (FGF-1) y 2 (FGF-2), el factor de crecimiento vascular endotelial (VEGF), etcétera.17,18
CMM Y SUS EFECTOS INMUNOMODULADORES
Debido a la capacidad inmunomoduladora que poseen estas células, pueden evitar el rechazo alogénico mediante diferentes mecanismos. Numerosos estudios han demostrado que las CMM no permiten el reconocimiento de antígenos al interferir en la función de las células dendríticas y de los linfocitos T, por lo que tienen un efecto inmunosupresor local debido a su capacidad de secretar citocinas. Este efecto se potencia cuando las células son expuestas a un medio con actividad inflamatoria o caracterizada por la presencia de altos niveles de interferón gamma.19,21,22
En estudios in vitro se ha demostrado que las CMM no expresan los antígenos del sistema principal de histocompatibilidad de clase II, lo que indica que constituyen un potencial terapéutico en la enfermedad injerto contra huésped porque pueden reducir o suprimir las reacciones inmunes inducidas.19,23,24
Además, pueden afectar el funcionamiento del sistema inmune por otros mecanismos. Se ha indicado que las CMM pueden inhibir la proliferación de linfocitos inducida por aloantígenos y mitógenos como fitohemaglutinina y concavalina A, así como su activación por anticuerpos anti CD3 y CD28. También se ha señalado que las CMM pueden inhibir la expresión de moléculas involucradas en la presentación de antígenos y en cocultivo con células mononucleares de sangre periférica, incrementan la proporción de subpoblaciones de linfocitos T con fenotipo de células reguladoras.25,26
Se ha sugerido que muchos de estos efectos son mediados predominantemente por factores paracrinos, pues las CMM secretan un número considerable de factores inmunomoduladores. También se ha planteado que la acción inmunosupresora pudiera estar vinculada con la participación de otros sistemas inmunorregulatorios.
Como complemento de los datos antes expuestos, se puede acotar que las CMM in vitro pueden inhibir la proliferación de los linfocitos T y B, apoyan el desarrollo de células T reguladoras, disminuyen la actividad lítica de las células citotóxicas naturales o asesinas naturales (en inglés, natural killer cells) y de los linfocitos T citotóxicos, inhiben la diferenciación de monocitos en células dendríticas.27
APLICACIONES CLÍNICAS DE LAS CMM
Debido a la gran capacidad multipotencial, plasticidad y acciones de las CMM, resultan de gran interés para la aplicación clínica (tabla 2). Sus características permiten utilizarlas para modular reacciones inmunes en enfermedades autoinmunes y en el trasplante de médula ósea; para regenerar tejidos destruidos o dañados como sucede en enfermedades neurodegenerativas, la diabetes o en cardiopatías. Además, podrían ser utilizadas como vehículo terapéutico de genes; como por ejemplo, en enfermedades monogénicas como la hemofilia.19,20
El uso clínico de las CMM está basado en una serie de investigaciones preclínicas en modelos animales, que han demostrado la utilidad de estas células en la regeneración de órganos y tejidos, y además se ha observado que modulan reacciones inmunes en distintas enfermedades.19-22
En la reparación del miocardio se reportan diferentes efectos de las CMM sobre el tejido cardíaco, como son su diferenciación in situ en cardiomiocitos, además de la liberación de factores solubles y su fusión con células cardíacas. Esta aplicación se ha demostrado en el corazón porcino donde se ha observado una reducción importante del tamaño del tejido lesionado, neovascularización y reducción de los niveles de apoptosis.21,24
Otra aplicación clínica de las CMM es en la reparación de hueso. Se ha demostrado in vivo en ratones y perros con defectos cráneo-faciales y de los huesos largos, que con la administración directa de estas células y con el uso sobre matrices como la hidroxiapatita/fosfato tricálcico, los resultados son satisfactorios. Recientemente se ha planteado la posibilidad de usar este proceder para optimizar los implantes dentales. En la actualidad, los ensayos clínicos en niños con osteogénesis imperfecta han logrado obtener osteoblastos funcionales que aumentan el contenido mineral del hueso.20,23
En el campo de la oftalmología, la utilización de las CMM empieza a dar sus resultados en el tratamiento de las úlceras corneales y en las degeneraciones retinianas.
Por otro lado, se han obtenido resultados prometedores en el área de la cirugía general en el tratamiento de fístulas de distintas localizaciones como el tracto respiratorio y digestivo. Además, se están realizando importantes estudios en la diabetes mellitus, en enfermedades neurodegenerativas y en la regeneración hepática.1,19,24
Con resultados muy positivos se emplean estas células en quemados, en lesiones cutáneas secundarias a radioterapia, donde se ha demostrado una regeneración epitelial, angiogénesis y una importante hidratación hística. Se están realizando diferentes estudios para la utilización de las CMM en la cicatrización de las heridas, ya sea mediante una administración sistémica o por aplicación tópica en el sitio de la herida. Debido a la naturaleza expuesta de la piel, la aplicación directa de estas células en casos de individuos politraumatizados y en quemaduras graves es una opción muy prometedora. El uso de las CMM en el tratamiento de las heridas crónicas tiene objetivos múltiples: acelerar la reparación del tejido, para amortiguar eventos inflamatorios y para reducir o eliminar la formación de cicatrices.
Otra alternativa es utilizar las CMM para estimular la angiogénesis. Algunos estudios han demostrado que estas células tienen un efecto positivo en la recuperación del flujo sanguíneo, lo cual se explica por la evidencia experimental que indica la generación e incorporación de células endoteliales derivadas de las CMM, a los capilares en su formación y por los resultados de estudios recientes que han demostrado que estas células también promueven la angiogénesis por la secreción de citocinas como VEGF-A, FGF-2 y la IL-6.17,20-25
A pesar de los avances obtenidos, los mecanismos celulares y moleculares por los cuales las CMM ejercen sus influencias están todavía bajo investigación.22,24 La profundización en la caracterización fenotípica, ontogénica y funcional de las CMM, así como los avances en la identificación de sus funciones biológicas, ha permitido la apertura de nuevas vías y opciones para su utilización en la medicina regenerativa en una amplia variedad de enfermedades, lo que seguramente se irá ampliando a medida que se adquiera mayor experiencia en este campo.
REFERENCIAS BIBLIOGRÁFICAS
1. Beyer N, Da Silva L. Mesenchymal stem cells: Isolation in vitro, expansion and characterization. Handb Exp Pharmacol. 2006;(174):249-82. PMID 16370331.
2. Gnecchi M, Melo LG. Bone marrow-derived mesenchymal stem cells: isolation, expansion, characterization, viral transduction, and production of conditioned medium. Methods Mol Biol. 2009;482:281-94.
3. Rodríguez V. Células madre: Conceptos generales y perspectivas de investigación. Universitas Scientiarum. 2005 Ene-Jun;10(1):5-14.
4. Friedenstein AJ, Petrakova KV, Kurolesova AI, Frolova GP. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation 1968 Mar;6(2):230-47. PMID 5654088.
5. Friedenstein AJ, Chailakhjan RK, Lalykina KS. The development of fibroblast colonies in monolayer cultures of guinea-pig bone marrow and spleen cells. CellTissueKinet. 1970 Oct;3(4):393-403. PMID 5523063.
6. Friedenstein AJ, Ivanov-Smolenski AA, Chajlakjan RK, Gorskaya UF, Kuralesova AI, Latzinik NW, et al. Origin of bone marrow stromal machanocytes in radiochimeras and heterotopic transplants. Exp Hematol. 1978 May;6(5):440-4. PMID 350596.
7. Owen M, Friedenstein AJ. Stromal stem cells: marrow derived osteogenic precursors. Ciba Found Symp. 1988;136:42-60. PMID 3068016.
8. Jones R, Lebkowski J, McNiece I. Stem cells. Biol Blood Marrow Transplant. 2010 Jan;16(Suppl 1):S115-S118. PMCID: PMC 3086546.
9. Haniffa MA, Wang XN, Holtick U, Rae M, Isaacs JD, Dickinson AM, et al. Adult human fi broblasts are potent immunoregulatory cells and functionally equivalent to mesenchymal stem cells. J Immunol. 2007 Aug;179(3):1595-1604.
10. Pittenger MF, Mackay AM, Bewck SC, Jaiswal RK, Douglas R, Mosca JD, et al. Multilineage potential of adult human mesenchymal cells. Science 1999 Apr;8(5411):143:7. PMID 10102814.
11. Tramain N, Korkko J, Ibberson D, Kopen GC, Di Girolamo C, Phinney DG. MicroSage analysis of 2353 expressed genes in a single cell-derived colony undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages. Stem Cells. 2001 Sep;19(5):408-18. DOI: 10.1634/stemcells. 19-5-408.
12. Prockop DJ, Sekiya I, Colter DC. Isolation and characterization of rapidly self- renewing stem cells from cultures of human stromal cells. Cytotherapy. 2001;3(5):393-6.
13. Jewett A, Arasteh A, Tseng HC, Behel A, Arasteh H, Yang W, et al. Strategies to rescue mesenchymal stem cells(MSCs) and dental pulp stem cells(DPSCs) from NK cell mediated cytotoxicity. Plos One. 2010 Mar;5(3):e9874. PMID 20360990.
14. Alongi DJ, Yamaza T, Song Y, Fouad AF, Romberg EE, Shi S, et al. Stem/progenitor cells from inflamed human dental pulp retain tissue regeneration potential. Regen Med. 2010 Jul;5(4):617-31.
15. Kern S, Eichler H, Stoeve J, Klüter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. StemCells. 2006 May;24(5):1294-1301. PMID 16410387.
16. Krampera M, Passini A, Pizzolo G, Cosmi L, Romagni S, Annunziato F. Regenerative and immunomodulatory potential of mesenchymal stem cells. Curr Opin Pharmacol. 2006 Aug;6(4):435-41. PMID 16777484.
17. Ren G, Zhao X, Zhang L, Zhang J, L Huillier A, Ling W, et al. Inflammatorycytokine-induced intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 inmesenchymal stem cells are critical for immunosuppresion. J Immunol. 2010 Mar;184(5):2321-28. PMID 20130212.
18. Zisa D, Shabbir A, Mastri M, Suzuki G, Techung L. Intramuscular VEGF repairs the failing heart: role of host-derived growth factors and mobilization of progenitor cells. Am J Physiol Regul Integr Comp Physiol. 2009 Nov;297(5):R1503-15. PMID 19759338.
19. Macías C, del Valle L, Hernández P, Ballester J.Características fenotípicas y funcionales de las células madre mesenquimales y endoteliales. Rev Cubana Hematol Inmunol Hemoter. 2010 Dic;26(4):256-75.
20. Ghannam S, Bouffi C, Djouad F, Jorgensen CH, Noël D. Immunosuppression by mesenchymal stem cells: mechanisms and clinical applications. Stem Cell Res Ther. 2010 Mar 15;1(1):2.
21. Hamou C, Chang EI, Grogan R. Mesenchymal stem cells can participate in ischemic neovascularization. PlastReconstr Surg. 2009 Feb;123(Suppl 2):45S-55S. PMID 19182663.
22. Wen Z, Zheng S, Zhou C, Wang J, Wang T. Repair mechanisms of bone marrowmesenchymal stem cells in myocardial infarction. J Cell Mol Med. 2011 May;15(5):1032-43. doi: 10.1111/j.1582-4934.2010.01255.x.
23. Sorrell JM, Caplan AI. Topical delivery of mesenchymal stem cells and their function in wounds. StemCell Res Ther. 2010 Sep;1(4):30. PMID: 20863417.
24. Yi T, Song SU.Immunomodulatory properties of mesenchymal stem cells and their therapeutic applications. Arch Pharm Res. 2012 Feb;35(2):213-21.
25. Griffin MD, Ritter T, Mahon BP. Immunological aspects of allogeneic mesenchymalstem cell therapies. Hum Gene Ther. 2010 Dec;21(12):1641-55.
26. Duffy MM, Ritter T, Ceredig R, Griffin MD. Mesenchymalstem cell effects on T-cell effector pathways. Stem Cell Res Ther. 2011 Aug 11;2(4):34.
27. Rankin S. Mesenchymal stem cells. Thorax. 2012 Jun;67(6):565-6.
Recibido: 1 de noviembre de 2012.
Aprobado: 20 de noviembre de 2012.
Lic. Bertha Beatriz Socarrás-Ferrer. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: rchematologia@infomed.sld.cu
Website: http://www.sld.cu/sitios/ihi