Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.29 no.4 Ciudad de la Habana oct.-dic. 2013
ARTÍCULO ORIGINAL
Caracterización clínica y de laboratorio del mieloma múltiple en el Instituto de Hematología e Inmunología
Clinical and laboratory characterization of multiple myeloma at the Institute of Hematology and Immunology
Dr. Luis G. Ramón Rodríguez, Dr. Carlos Rivera-Keeling, Dr. Alberto Arencibia-Núñez, Dr. Onel M. Avila-Cabrera, Dra. Lissete Izquierdo-Cano, Dr. Edgardo Espinosa-Estrada, Dra. Leslie González-Pinedo, Dra. Yamilé Quintero-Sierra, Dra. Adys Gutiérrez-Díaz, Dr. Carlos Hernández-Padrón
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Introducción: el mieloma múltiple es una enfermedad de distribución universal, con mayor incidencia en regiones de Europa y América.
Objetivos: describir las características demográficas, los parámetros clínicos y de laboratorio, la sobrevida libre de eventos y la sobrevida global, así como los factores pronósticos de los pacientes con esta enfermedad atendidos en el Instituto de Hematología e Inmunología.
Método: se realizó un estudio descriptivo retrospectivo que incluyó 88 pacientes con el diagnóstico de mieloma múltiple atendidos en el Servicio de Adultos del Instituto de Hematología e Inmunología desde el año 2000 hasta el 2010.
Resultados: la edad promedio fue de 60,7 años; fue más frecuente en el sexo masculino y en los pacientes con el color de la piel blanca. Los dolores óseos, la astenia y la palidez cutáneo-mucosa fueron los hallazgos principales al inicio de la enfermedad. La anemia, la eritrosedimentación acelerada, las cifras elevadas de creatinina, hipoalbuminemia e hipergammaglobulinemia fueron las manifestaciones de laboratorio más llamativas en el momento del diagnóstico. La sobrevida global fue de 5,2 años y la sobrevida libre de eventos de 3,3 años. Los pacientes que no respondieron al primer esquema de inducción tuvieron una sobrevida más corta (p < 0,01), al igual que los pacientes con una cifra inicial de hemoglobina inferior a 8 g/dL (p = 0,043) y una albúmina menor de 30 g/L (p = 0,035).
Conclusión: las características del grupo de pacientes estudiados no difieren de los hallazgos realizados por otros autores.
Palabras clave: mieloma múltiple, anemia, sobrevida global.
ABSTRACT
Introduction: multiple myeloma is a disease of worldwide distribution with higher incidence in regions of Europe and America.
Objectives: we describe the demographic characteristics of the patients with this disease, the clinical and laboratory parameters, event-free survival and overall survival and prognostic factors.
Method: a retrospective study was made which included 88 patients diagnosed with multiple myeloma treated at the Adult Service in the Institute of Hematology and Immunology from 2000 to 2010.
Results: mean age was 60,7 years and the disease was more frequent in males and Caucasian patients. Bone pain, fatigue and pallor were the main findings early in the disease. Anemia, erythrocyte sedimentation rate, high levels of creatinine, hypoalbuminemia and hypergammaglobulinemia were the most striking laboratory findings at diagnosis. Overall survival was 5,2 years and the event-free survival was 3,3 years. Patients who did not respond to the first induction scheme had a shorter survival (p < 0,01), as well as patients with a baseline hemoglobin below 8 g/dL (p = 0,043) and a lower albumin 30 g/L (p = 0,035).
Conclusion: the characteristics of this group of patients did not differ from the findings of other authors.
Keywords: multiple myeloma, anemia, overall survival.
INTRODUCCIÓN
El mieloma múltiple (MM) es una enfermedad de distribución universal cuyo conocimiento se remonta a la clásica descripción de Sir Henri Bence Jones. 1 Es una proliferación maligna de células plasmáticas de la médula ósea que en la mayoría de los casos sintetizan una proteína monoclonal o componente M, constituida por inmunoglobulinas o sus cadenas ligeras.2
Aunque en términos generales no tiene predilección por áreas geográficas, se constata una mayor incidencia en regiones de Europa y América.3,4 En los Estados Unidos de América (EUA) el MM constituye el 1 % de todas las neoplasias en blancos y el 2 % en negros. En ese país la incidencia anual es de 2-4 por cada 100 000 habitantes. La incidencia en los países del norte de Europa es similar a los EUA, mientras que es 4 veces más baja en Asia. En todas las poblaciones hay un ligero predominio en los hombres y se presenta con mayor frecuencia en varones entre 60-70 años.5-7 Excepcionalmente aparece por debajo de los 30 años8 y su presencia en mujeres embarazadas es poco frecuente. 9
El MM se caracteriza por destrucción esquelética, fallo renal, anemia e hipercalcemia y los síntomas más frecuentes con que se presentan los pacientes son: fatiga, dolores óseos e infecciones recurrentes.10 Los criterios diagnósticos requieren la presencia de al menos el 10 % de células plasmáticas en la médula ósea (o una biopsia de tejido con células plasmáticas monoclonales), la presencia de una proteína monoclonal en el suero u orina y evidencias de daño orgánico manifestado por hipercalcemia, insuficiencia renal, anemia o lesiones óseas conocido como CRAB por sus siglas en inglés.11
Por lo general es una enfermedad progresiva con una sobrevida media de 2,5 a 3 años. La sobrevida mayor de 10 años ocurre solo en el 4-5 % de los pacientes. 12
A pesar de que el MM es incurable con los tratamientos actuales, la introducción de la talidomida y el desarrollo de análogos más seguros y activos representa un mayor avance en la terapia de esta enfermedad.13-16 Recientemente, el tratamiento con inhibidores de proteosomas como el bortezomib y el calfizomib, constituye una nueva esperanza para estos pacientes cuya sobrevida global se ha visto favorecida.17,18
En el Instituto de Hematología e Inmunología (IHI) se ha trabajado de manera ardua para introducir los avances en el tratamiento, sin embargo, no existe ninguna caracterización del MM. Cuál es su incidencia, cómo se presentan los pacientes, qué características tienen, cuáles son las complicaciones, cuál es la sobrevida y los factores pronósticos, entre otras, son las interrogantes que han quedado sin respuesta durante muchos años. El presente trabajo pretende de manera sencilla y concreta responder algunas de estas interrogantes y de esa manera, conocer a profundidad el universo de pacientes durante los últimos 11 años de trabajo.
MÉTODOS
Se realizó un estudio descriptivo retrospectivo en el servicio de adultos del IHI, con el objetivo de caracterizar a los pacientes con MM diagnosticados y atendidos en el período comprendido entre enero de 2000 y diciembre de 2010. El universo incluyó 88 pacientes con MM atendidos en dicho servicio en el período señalado. Se incluyeron los pacientes con diagnóstico de MM mayores de 18 años seguidos en la consulta externa de la institución.
Se tomaron en cuenta las variables siguientes al inicio de la enfermedad: edad, sexo, color de la piel, enfermedades concomitantes y síntomas iniciales. Desde el punto de vista de laboratorio se analizaron las variables: cifras de hemoglobina, leucocitos, plaquetas, eritrosedimentación, creatinina, albúmina y globulinas, prueba de Coombs directa, la subclase de inmunoglobulina monoclonal (proteína monoclonal) y el porcentaje de infiltración de células plasmáticas en la médula ósea. Se determinó el grado de insuficiencia renal según las cifras de creatinina. Se recogieron los datos de la enfermedad ósea constituida por lesiones osteolíticas, osteoporosis y fracturas patológicas evidenciadas en el estudio radiográfico, así como la enfermedad extramedular constituida por plasmocitomas óseos o de partes blandas al diagnóstico o de manera evolutiva. Igualmente se determinaron los pacientes que presentaron infecciones al diagnóstico o de manera evolutiva, así como su focalización.
La respuesta al tratamiento de inducción se basó en los siguientes criterios:
Respuesta completa:
- Reducción del 75 % o más de la concentración inicial de la proteína monoclonal en suero.
- Menos de 10 % de células plasmáticas en la médula ósea.
- No signos clínicos, radiológicos ni de laboratorio de progresión de la enfermedad.
Respuesta parcial:
- Reducción de 50-75 % de la proteína monoclonal en suero.
- Menos de un 30 % de células plasmáticas en la médula ósea.
Mejoría:
- Reducción entre el 25-50 % de la proteína monoclonal sérica.
No respuesta o refractario:
- Reducción de la proteína monoclonal < del 25 %.
Análisis estadístico
Los datos obtenidos mediante la revisión de las historias clínicas se recogieron en una planilla de recolección de datos. Se confeccionó una base de datos mediante el programa Excel. Los análisis estadísticos se realizaron por el programa SPSS versión 12.0.0. Las variables cualitativas se presentaron utilizando las frecuencias absolutas y relativas. En las variables cuantitativas se determinaron la media, mediana, rango y desviación estándar.
La sobrevida libre de eventos (SLE) se calculó desde el primer día de tratamiento hasta la recaída, la progresión, la muerte o la última evaluación del paciente. La sobrevida global (SG) se determinó desde la fecha de diagnóstico hasta la muerte o la última evaluación del paciente, independientemente del tratamiento de inducción utilizado. La probabilidad de supervivencia se determinó mediante el método de Kaplan-Meier y los resultados se compararon mediante la prueba de log-rank. Para los análisis de supervivencia las variables cuantitativas se convirtieron en categóricas a partir de la distribución por percentiles. Se aplicó el test de regresión de Cox para determinar el impacto de las covariables sobre la SG. La significación estadística se estableció para p < 0.05.
RESULTADOS
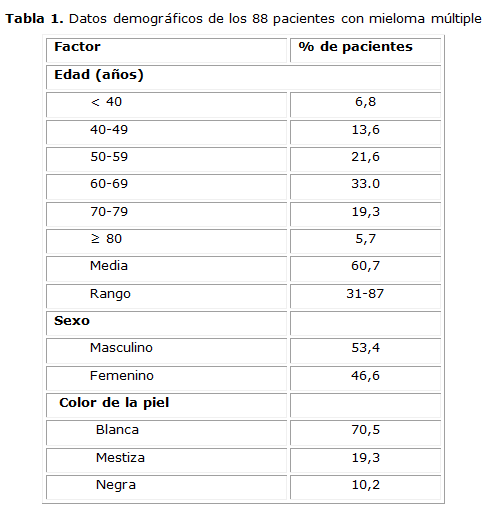
Se incluyeron en total 88 pacientes con una edad media de 60,7 años y un rango de 31 a 87 años. Predominó el grupo de 60 a 69 años (33 %) y el 6,8 % de los casos tenían menos de 40 años. La enfermedad se presentó más en hombres con una relación de 1.17:1, mientras que el color de la piel fue blanca en el 70,5 % de los enfermos (Tabla 1).
Gran parte de los pacientes (36,4 %) refirió tener antecedentes de salud, mientras que el 35,2 % padecía hipertensión arterial. Se recogieron antecedentes de otras enfermedades como diabetes mellitus (15,9 %), cardiopatía isquémica (6,8 %) y con menor frecuencia, asma bronquial, insuficiencia cardiaca, osteoartrosis, hipotiroidismo, neoplasias, entre otras. Uno de los pacientes tenía una gammapatia monoclonal de significado indeterminado (GMSI) de 15 años de evolución, mientras que otro era portador de una hemoglobina S y una paciente se encontraba en estado de gestación.
Entre los síntomas iniciales la mayoría de los pacientes refirió dolores óseos (90,9 %) y astenia (65,9 %). Otros síntomas menos frecuentes fueron: pérdida de peso, anorexia, déficit neurológico, sangramientos y disnea de esfuerzo. En el examen físico inicial solo se destacó la palidez cutáneo-mucosa.
En la tabla 2 se describen los principales hallazgos de laboratorio iniciales. En el hemograma se destacó la anemia con niveles de hemoglobina media de 8,9 g/dL, los niveles medios de leucocitos y plaquetas estuvieron dentro de valores normales, aunque de manera evolutiva 2 (2,3 %) pacientes presentaron leucocitosis debido a una transformación a leucemia de células plasmáticas. La cifra media de la eritrosedimentación fue de 122 mm/h; de manera similar las cifras medias de la creatinina y las gammaglobulinas séricas estuvieron elevadas con valores de 145 mmol/L y 45,6 g/L, respectivamente. La cifra media de la albúmina sérica fue normal (37,6 g/L).
Al inicio de la enfermedad, 39 (44,3 %) pacientes presentaron insuficiencia renal y en la mayoría de ellos (22) esta insuficiencia fue grado 1.
En la tabla 3 se muestra la distribución de las proteínas monoclonales que se identificaron en 76 de los 78 pacientes en los cuales estuvieron disponibles estos resultados. En 50 (64 %) pacientes la proteína monoclonal fue IgG y en 17 (21,8 %) fue IgA. En ambas proteínas monoclonales predominó la cadena ligera kappa. Siete (9 %) pacientes tenían una cadena ligera en orina sin proteína monoclonal en el suero (MM de Bence-Jones). Se identificó un caso (1,3 %) con dos proteínas monoclonales IgG kappa y lambda (MM biclonal) y otro (1,3 %) con una proteína monoclonal IgM (MM IgM). En dos (2,6 %) pacientes no se identificó proteína monoclonal ni en suero u orina y se consideraron como portadores de un MM no secretor.
Todos los pacientes presentaron más del 20 % de infiltración de la médula ósea por células plasmáticas con una media del 63,6 % y un rango que osciló de 25 a 95 %. El 18 % de los casos tuvo más del 80 % de infiltración.
La enfermedad ósea estuvo presente en un número importante de enfermos. En 67 (76,1 %) se identificaron lesiones osteolíticas y en 40 (45,5 %) osteoporosis. Las fracturas patológicas estuvieron presentes al diagnóstico en 9 (10,2 %) casos y de manera evolutiva en 8 (9,1 %).Las fracturas más frecuentes fueron costales (31,6 %). Otras localizaciones fueron: húmero, fémur, vértebras, caderas y clavículas.
Los plasmocitomas fueron menos frecuentes al diagnóstico (3 pacientes). Durante la evolución se presentaron en 13 casos. La localización fundamental de los plasmocitomas fue en las costillas (25 % del total) y le siguieron en orden decreciente: vértebras (18,8 %), cráneo (12,5 %) y con igual porcentaje (6,3 %) esfenoides, húmero, clavícula, pulmón, sistema nervioso central (meninges), piel y testículo.
Las infecciones se presentaron al inicio en 12 (13,6 %) pacientes y de manera evolutiva en 13 (14,8 %). La neumonía (64 %) fue la focalización más frecuente seguida por la sepsis urinaria (28 %). Un paciente presentó un absceso cutáneo y otro una osteomielitis. Otra de las complicaciones fue el síndrome de hiperviscosidad (SHV) que se identificó en el 5,7 % de los casos y se relacionó con la paraproteína IgA. Los síntomas más frecuentes fueron los mareos, la somnolencia, la obnubilación, el estupor y en dos de los casos se detectaron infartos cerebrales lacunares mediante la resonancia magnética nuclear, sin secuelas posteriores.
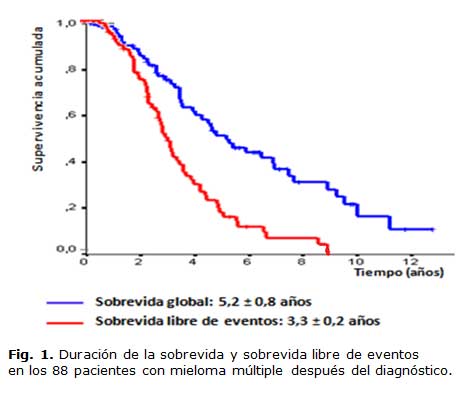
La SG, así como la SLE se describen en la figura 1. La SG fue de 5,2 años y la SLE fue de 3,3 años. En cuanto a la respuesta al primer esquema de tratamiento el 49 % de los pacientes obtuvo una remisión completa (RC), el 22 % una remisión parcial (RP), mientras que el 18 % fue refractario. La respuesta no pudo ser evaluada en el 11 % de los casos. La SG fue directamente proporcional a la respuesta alcanzada después del primer esquema de inducción. Los pacientes que lograron una RC tuvieron una SG de 8,9 años, los que obtuvieron una RP alcanzaron una SG de 4,3 años y los pacientes refractarios una SG de 2,6 años. Estos resultados fueron estadísticamente significativos (p <0.01 para todos los estratos).
Se analizó la influencia de algunas variables en la supervivencia de los pacientes (tabla 4). Los casos con cifras de hemoglobina e» 8 g/dL tuvieron una SG de 5,9 años comparados con 3,5 años para los pacientes con cifras < 8 g/dL. Estos resultados tuvieron significación estadística (p =,0.043).
De manera similar las cifras de albúmina sérica en el momento del diagnóstico tuvieron significación estadística. Los pacientes con niveles e» 30 g/L tuvieron una SG de 5,8 años, mientras que los casos con < 30 g/L presentaron una SG de 3,4 años (p = 0.035).
Los pacientes con edades < 70 años tuvieron una mayor supervivencia (6,5 años) comparados con los casos que tenían una edad e» 70 años (3,8 años), aunque estos datos no fueron significativos desde el punto de vista estadístico (p = 0.188). En cuanto a la presencia de insuficiencia renal sucedió algo similar. Los resultados no fueron estadísticamente significativos, sin embargo aquellos pacientes sin daño inicial de la función renal tuvieron una SG de 7,4 años comparados con los que lo presentaron (4,8 años) (p = 0.179).
Por último, aunque se puede observar una diferencia importante en la SG en los pacientes con < 70 % de infiltración (6,9 años) comparados con 4,6 años en los pacientes con un porcentaje e» 70 %; esta diferencia no fue estadísticamente significativa (p=0.311).
DISCUSIÓN
Más de siglo y medio ha transcurrido desde los primeros estudios realizados por Sir Henry Bence Jones1 en la orina de un paciente en cuya autopsia se reveló la infiltración por células con una descripción similar a las del MM.19 Transcurrió más de un siglo hasta que en 1975 se publicara la revisión de 869 pacientes atendidos en la Clínica Mayo desde 1960 hasta 1971, estudio que reveló de una manera significativa los hallazgos clínicos y la historia natural de esta enfermedad. 20 Este estudio fue actualizado y en el año 2003 se publicaron los resultados de 1 027 pacientes atendidos en ese mismo centro entre 1985 y 1998, investigación que se considera una de las más importantes de este tipo realizadas hasta el momento.10
El MM es una enfermedad del adulto mayor y con un ligero predominio del sexo masculino. En el estudio que se presenta, la distribución de la edad y el sexo de los pacientes fue bastante similar a los resultados del estudio antes mencionado de Kyle y col, donde hubo un ligero predominio del sexo masculino y el grupo de edades entre 60 y 69 años; sin embargo, un porcentaje mayor de casos tenían menos de 40 años. 10 Este último resultado es superior a lo reportado en otros estudios que describen grandes series donde entre el 1 y el 2 % de los pacientes fueron menores de 40 años, 21 lo que puede estar en relación con el número menor de casos incluidos en la presente investigación. En el estudio de la Clínica Mayo, el 38 % de los casos tenía más de 70 años, 10 mientras que la cantidad pacientes mayores de 70 años en la presente investigación fue mucho menor. En el MM, la edad media al diagnóstico es de 71 años y la relación masculino-femenino es 1.4:1,21 cifras ligeramente superiores a las obtenidas en el presente estudio. El aumento observado en la edad de presentación de la enfermedad puede estar en relación con el envejecimiento poblacional y con la mayor accesibilidad a los servicios de salud. Por otra parte, la incidencia en los pacientes caucásicos es de 4,2 por 100 000 por año, mientras que en pacientes afroamericanos es de 9,3 por 100 000 por año. 21 En este trabajo predominaron los pacientes con el color de la piel blanca, probablemente por las características de la muestra.
En uno de los pacientes se recogió el antecedente de una GMSI de 15 años de evolución. Se ha observado que la prevalencia de la GMSI es de hasta el 3,2 % y el 5,3 % en personas mayores de 50 y 70 años, respectivamente; y que el clon de células plasmáticas tiene características genéticas y fenotípicas similares a las que se observan en las células plasmáticas mielomatosas. La transformación maligna anual es del 1 %, con una probabilidad de progresión a los 10 y 20 años de seguimiento que oscila entre el 12 y el 17 % y entre el 25 y el 34 %, respectivamente.22
Otro de los pacientes era portador de una hemoglobina S. Se ha descrito una posible asociación cromosómica entre la drepanocitosis y la leucemia, que al igual que el MM es una hemopatía maligna. Además, la interleucina-6 (IL-6) tiene una función muy importante en la patogénesis del MM. Esta interleucina está aumentada también en pacientes con drepanocitosis.23 Sin embargo, existen pocos casos reportados de la asociación del MM y la drepanocitosis. Por otra parte, las investigaciones en individuos portadores de hemoglobina S no han demostrado un aumento de la incidencia del MM en esta población.24
El diagnóstico de MM se realizó en una paciente durante la gestación. Aunque esta asociación no es frecuente, cada día las mujeres se embarazan a edades más tardías y como el cáncer, se ha convertido en la principal causa de muerte en la mujer entre los 40 y 49 años de edad; los obstetras y los hematólogos deben estar preparados para enfrentar esta eventualidad.9
En general, las manifestaciones clínicas fueron similares a las reportadas por otros autores.10,25 Las síntomas más comunes que presentaron los pacientes en este estudio fueron los dolores óseos y la astenia. Otras manifestaciones menos frecuentes fueron la anorexia y el déficit neurológico que se presentó en dos pacientes en forma de paraparesia por compresión medular. Los sangramientos no fueron frecuentes, como se reporta en otros estudios, y en el examen físico inicial solo se destacó la palidez cutáneo-mucosa.
Como era esperado, la anemia fue la manifestación más frecuente del MM y estuvo presente inicialmente en el 92 % de los pacientes. Otras series reportan anemia en el 40-73 % de los casos. 10,25
Típicamente, la eritrosedimentación está acelerada en el MM. En la serie estudiada por Kyle y col10 el 84 % de los pacientes tenían una eritrosedimentación mayor de 20 mm/h, y más del 30 % una cifra mayor que 100 mm/h. En el estudio presentado una cifra mayor de pacientes tuvieron una eritrosedimentación por encima de 100 mm/h.
En la mayoría de los pacientes las cifras de leucocitos y plaquetas estuvieron dentro de parámetros normales. No es frecuente su elevación o disminución en el MM, lo que puede evidenciar la concomitancia de otras enfermedades. Ante la presencia de leucocitosis debe descartarse la leucemia de células plasmáticas (LCP). Cuando se diagnostica al inicio se le conoce como LCP primaria y cuando forma parte de la evolución de un MM previamente diagnosticado se le denomina LCP secundaria. Entre el 1 % y el 4 % de los casos con MM pueden evolucionar hacia la LCP y se desarrolla por lo general en pacientes de mayor longevidad. 26 Esta complicación estuvo presente en el 2,3 % de los pacientes de manera evolutiva.
La insuficiencia renal es otra de las manifestaciones del MM que se presentó con resultados similares a los reportados por otros autores.25 Los factores que contribuyen al daño renal incluyen: hipercalcemia, proteinuria de cadenas ligeras libres, deshidratación, hiperuricemia y drogas nefrotóxicas. La lesión histológica típica del riñón de mieloma es la presencia de cadenas ligeras monoclonales en los túbulos renales formando moldes densos y laminados que contienen además albúmina y proteína de TammHorsfall. Se identifican otras causas menos frecuentes que producen insuficiencia renal en el MM que incluyen la pielonefritis aguda y crónica, la infiltración por células plasmáticas y el depósito de sustancia amiloide. Más raramente el MM se asocia al síndrome de Fanconi adquirido.27
En cuanto a los tipos de proteínas monoclonales identificadas, los resultados son muy similares a los obtenidos por otros autores.10 Fue más frecuente la proteína monoclonal IgG, seguida por la IgA e igualmente predominó la cadena ligera kappa. Se identificaron menos casos con MM de cadenas ligeras libres en orina (MM de Bence Jones) y el porcentaje de pacientes sin proteína monoclonal identificable en suero u orina fue similar (MM no secretor). El MM IgM representó sólo el 1,3 % de los casos. Esta variedad de MM se presenta en menos del 1 % de los pacientes y no debe confundirse con la macroglobulinemia de Waldenström. 25 Igualmente inusual fue el hallazgo de un paciente con un MM biclonal.
Los resultados de la infiltración de la médula ósea por células plasmáticas en este estudio fueron superiores a los encontrados por otros autores que describen el 17 % de pacientes con menos del 20 % de infiltración y una cifra promedio de 50 %.10 En general, en el MM hay una correlación entre los niveles de la proteína monoclonal y el grado de plasmocitosis medular. En ocasiones estas células recuerdan a las células plasmáticas normales, en el 15 % de los casos tienen morfología plasmablástica y en otras, aspecto linfoplasmocítico. La cantidad, patrón de crecimiento y las características morfológicas de las células plasmáticas en la médula ósea son variables, sin embargo, no se ha demostrado consistentemente que estas diferencias tengan importancia pronóstica.28-30
Las técnicas de radiografía convencional revelaron lesiones osteolíticas y osteoporosis al inicio de la enfermedad en un porcentaje elevado de pacientes. Estos resultados fueron superiores a los obtenidos por Kyle y col,10 que describieron osteolisis en el 67 % de los casos y osteoporosis en el 23 %. Las fracturas patológicas al inicio de la enfermedad se presentaron en menos de la mitad de los pacientes en comparación con los hallazgos del estudio antes mencionado.
La lesión ósea tiene una gran relevancia en la morbimortalidad del mieloma. Del 80 al 90 % de los pacientes tiene lesiones óseas radiológicamente visibles, cifra que podría llegar al 100 % si se emplearan técnicas de resonancia magnética nuclear o evaluación microscópica. Estas lesiones provocan dolor y los denominados eventos relacionados con el esqueleto que están presentes al diagnóstico en el 43 % de los pacientes, distribuidos del siguiente modo: fracturas vertebrales (21 %), radioterapia ósea (14 %), fracturas patológicas no vertebrales (10 %), hipercalcemia (8 %), compresión espinal (8 %) y cirugía ósea (5 %).31,32 El estudio presentado reveló una mayor frecuencia de fracturas patológicas en las costillas; otras localizaciones fueron: húmero, fémur, vértebras, caderas y clavículas. Sin embargo, esta complicación es más frecuente en las vértebras, aunque también se presentan en los huesos antes mencionados.10 La menor frecuencia de fracturas vertebrales encontradas en el presente estudio puede estar relacionada con el menor uso de técnicas imagenológicas como la resonancia magnética nuclear o la tomografía axial computarizada, en la evaluación de las alteraciones de la columna vertebral.
La afección extramedular en el MM se conoce desde hace muchos años. En la muestra presentada fue más frecuente de manera evolutiva como se describe en otros estudios. La incidencia de los plasmocitomas en pacientes con MM de nuevo diagnóstico oscila entre el 7 y el 18 %. Por otra parte, entre el 6 y el 20 % de los pacientes presentan plasmocitomas a lo largo de su evolución.33,34
Predominaron los plasmocitomas de hueso, aunque un paciente presentó nódulos cutáneos e infiltración testicular, lo que representó alrededor del 1 % del total de pacientes. Entre los casos con mieloma múltiple, la incidencia de plasmocitoma que afecta al testículo es de entre 0,6 % y 2,7 % del total.35 Otro de los casos presentó infiltración del sistema nervioso central con afectación leptomeníngea. Esta localización es rara y puede presentarse en alrededor del 1 % de los casos, 36 como se observó en este estudio.
Las infecciones se presentaron al inicio y evolutivamente en la misma proporción de pacientes. La neumonía fue la focalización más frecuente seguida por la sepsis urinaria, resultados que son similares a los reportados.37 Las infecciones bacterianas recurrentes son una complicación frecuente en los pacientes con MM y la primera causa de muerte. Aunque de origen multifactorial, las complicaciones infecciosas son debidas principalmente a una disfunción celular B que ocasiona la disminución de la producción de inmunoglobulinas normales. Los microorganismos más frecuentemente implicados son el Streptococcus pneumoniae y el Haemophilus influenzae, aunque en pacientes con fracaso renal o enfermedad avanzada, más del 90 % de los episodios infecciosos son debidos a bacilos Gram negativos o a Staphylococcus aureus.38
Otra de las complicaciones fue el SHV. Este síndrome se presenta en menos del 10 % de los pacientes con MM. A pesar de que aparece en una proporción mayor de pacientes con macroglobulinemia de Waldenström, la hiperviscosidad se relaciona más al mieloma por ser este 10 veces más frecuente.12 En el MM, el SHV se observa tanto con la proteína monoclonal IgG como con la IgA; sin embargo, es más común que se produzca con la IgA. Las características intrínsecas de su molécula le confieren la propiedad de formar puentes disulfuro que facilitan la polimerización y la formación de grandes conglomerados, responsables de la mayor frecuencia del SHV en el MM IgA.39
La SG de los pacientes de esta investigación fue de 5,2 años. Este resultado fue superior al encontrado por Kyle y col 10 que reportaron una SG de 2,8 años en los 1 027 pacientes estudiados desde 1985 hasta 1998. El número menor de casos del presente estudio y la disponibilidad de la talidomida desde el año 2003 en el IHI, son dos hipótesis que pudieran explicar esta diferencia.
El desarrollo del tratamiento con altas dosis de quimioterapia seguido del trasplante de precursores hematopoyéticos, así como el surgimiento de la talidomida, la lenalidomida y el bortezomib, han mejorado significativamente la SG en el MM en la última década.40 Con anterioridad, el objetivo del tratamiento era el control de la enfermedad con un rango de respuesta del 50 % y con respuestas completas en casos aislados. La media de la SG era de 2 a 3 años. En la actualidad esta cifra se ha duplicado y se han alcanzado valores de 4 a 6 años en pacientes de mayor edad y de 8 a 10 años en pacientes más jóvenes. Sin embargo, no debemos estar satisfechos con estas cifras, sobre todo en pacientes jóvenes, por lo tanto, la meta en el MM es la curación.41
Los primeros reportes de curación en el MM conciernen a pacientes que fueron sometidos a trasplante de médula ósea alogénico. No obstante, la alta mortalidad relacionada con el trasplante alogénico, la edad avanzada de los pacientes y las pocas probabilidades de obtener un donante, limitan esta opción terapéutica a un número muy reducido de casos y su utilidad en el MM permanece bajo investigación.42
En la actualidad, el uso del trasplante autólogo de stem celsl precedido por altas dosis de quimioterapia, ha mostrado muy buenos resultados, con un mayor porcentaje y prolongación de las remisiones. Sin embargo, el advenimiento de la talidomida, la lenalidomida y el bortezomib han limitado su uso y la tendencia actual en el MM es la personalización de la terapia de acuerdo con la edad del paciente, su vulnerabilidad y a la estratificación de la enfermedad según los factores de riesgo.43,44
Numerosos son los factores pronósticos que de una manera independiente o relacionados entre ellos, se han planteado en el MM. En la presente investigación los pacientes que presentaron cifras de hemoglobina < 8 g/dL o albúmina < 30 g/L al inicio de la enfermedad tuvieron una menor SG. De manera similar los casos que no obtuvieron una respuesta completa con el primer esquema de inducción o que fueron refractarios tuvieron una SG menor. Los pacientes con una edad e»70 años, insuficiencia renal y con un porcentaje de células plasmáticas en la médula ósea e»70 %, también presentaron una SG menor, aunque estos últimos resultados no fueron estadísticamente significativos.
La duración de la sobrevida de los pacientes con MM varía desde unos pocos meses hasta más de 10 años. Esta heterogeneidad se relaciona con las características propias del tumor o del huésped. Muchas de estas características están vinculadas entre ellas y sólo unas pocas tienen valor como factores pronósticos independientes en análisis multivariados. Algunas de ellas son la edad, la estadificación, la función renal, las alteraciones citogenéticas y moleculares, la actividad proliferativa de las células plasmáticas tumorales, la b2 microglobulina, la albúmina, entre otros.45 El nuevo Sistema Internacional de Estadificación del MM y la división de los pacientes en grupos de riesgo de acuerdo con las alteraciones citogenéticas, ha permitido personalizar el tratamiento con el objetivo de obtener mejores resultados.43
REFERENCIAS BIBLIOGRÁFICAS
1- Bence Jones H. On a New Substance Occurring in the Urine of a Patient with Mollities Ossium. Phil Trans R Soc Lond.1848; 138: 55-62.
2- Kyle RA. Multiple Myeloma. Review of 869 cases. Mayo Clin Proc. 1975; 50: 29-35.
3- Kyle RA, Finkelstein S, Elveback LR, Kurland LT. Incidence of monoclonal protein in Minnesota Community with cluster of multiple myeloma. Blood. 1972; 40: 719-26.
4- Talerman A. Clinico-pathological study of multiple myeloma in Jamaica. Br J Cancer. 1969; 23: 285-89.
5- Kyle RA, Nobrega FT, Kurland LT. Multiple Myeloma in Olmstead County, Minnesota. Blood. 1969; 33: 739-44.
6- Waterhouse JA, Muir C. Cancer Incidence in Five Continents, vol 3 (IARC publ No 42) Lyon, France, International Agency for Research on Cancer, 1976. pp 142.
7- Riedel A, Pottern LM, Blattner WA. Epidemiology of Multiple Myeloma. In: Wiernick PH, Canellos GP, Kyle RA. Neoplastic Diseases of the Blood. 2nd ed, New York:Churchill Livingstone; 1991. p. 347.
8- Kyle RA. Gammapatías monoclonales de significado oscuro. Historia natural de 241 casos. Am J Med. 1975; 7: 375-80.
9- Ramón L, Agramonte O, Hernández C, Espinosa E, Losada R, Cabrera O et al. Mieloma múltiple y embarazo: Primer reporte de caso en Cuba. Rev Cubana Hematol Inmunol Hemoter. 2010; 26(1): 70-5.
10- Kyle RA, Gertz MA, Mitzig TE. Review of 1027 patients with newly diagnosed multiple mieloma. Mayo Clin Proc. 2003; 78: 21-33.
11- International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report for the International Myeloma Working Group. Br J Haematol. 2003; 121: 749-57.
12- Kyle RA, Greipp PR. Multiple Myeloma and other plasma cell disorders. In Blood and blood forming organs. Philadelphia: WB Saunders Co. 1991.p. 593.
13- Singhal S, Mehta J, Desikan R. Anti-tumour activity of thalidomide in refractory multiple myeloma. N Eng J Med. 1999; 341:156571
14- Kumar S, Rajkumar SV. Thalidomide and lenalidomide in the treatment of multiple myeloma. Eur J Cancer. 2006; 42: 1612-22.
15- Ramón L, Hernández CR, Buchillón RJ, Palsencia A, Agramonte O, Hernández P. Empleo de la Talidomida en un paciente con mieloma múltiple refractario. Rev Cubana Hematol Inmunol Hemoter. 2002;18 (3): 61-3.
16- Rajkumar SV. Thalidomide in Multiple Myeloma. Oncology. 2000; 13: 11-6
17- Kumar SK, Rajkumar SV, Dispenzieri A. Survival improved in multiple mieloma and impact of novel herapies. Blood.2007; 111: 2516-20.
18- Mateos MV, San Miguel JF. Bortezomib in Multiple Myeloma. Best Prac Res Clin Haematol. 2007; 20: 701-5.
19- Kyle RA. Henry Bence Jones-physician, chemist, scientist and biographer: a man for all seasons. Br J Haematol. 2001; 115:13-18.
20- Kyle RA. Multiple myeloma: review of 869 cases. Mayo Clin Proc. 1975; 50: 29-40.
21- Howe HL. Annual report to the nation on the status of cancer (1973 through 1998), featuring cancers with recent increasing trends. J Natl Cancer Inst. 2001; 93: 82442.
22- Bladé J. De la gammapatía monoclonal de significado incierto al mieloma múltiple. Haematologica/edición española. 2011; 96: 51-7.
23- Adegoke OJ. Is sickling trait associated with an increased risk for multiple myeloma? Medical Hypotheses. 2003; 60: 60710.
24- Schultz WH, Ware RE. Malignancy in patients with sickle cell disease. Am J Hematol. 2003; 74:24953.
25- Dispenzieri A, Kyle RA. Multiple myeloma: clinical features and indications for therapy. Best Prac Res Clin Haematol. 2005; 18: 553-68.
26- Albarracin F, Fonseca R. Plasma cell leukemia. Blood Rev. 2011; 25: 107-12.
27- Analysis and management of renal failure in fourth MRC myelomatosis trial. MRC working party on leukaemia in adults. Br Med J (Clin Res Ed) 1984; 288: 14116.
28- Cavo M. Prognostic values of bone marrow plasma cell infiltration in stage I multiple myeloma. Br J Haematol. 1983; 55: 68390.
29- Rajkumar SV. Methods for estimation of bone marrow plasma cell involvement in myeloma: predictive value for response and survival in patients undergoing autologous stem cell transplantation. Am J Hematol. 2001; 68: 26975.
30- Pasqualetti P. Prognostic factors in multiple myeloma: selection using Cox's proportional hazard model. Biomed Pharmacother. 1996; 50: 2935.
31- Roodman GD. Pathogenesis of myeloma bone disease. Leukemia. 2009; 23: 435-41.
32- Garcia-Sanz R, Alegre A, Capote FJ, Hernandez JM, Rosinol L, Rubia JL, et al. Guidelines for the use of bisphosphonates in multiple myeloma: recommendations of the expert committee of the Spanish Myeloma Group from the PETHEMA group. Med Clin (Barc). 2010; 134: 268-78.
33- Wu P, Davies F, Boyd K. The impact of extramedullary disease at presentation in the outcome of myeloma. Leuk Lymphoma. 2009; 50: 230-5.
34- Varettoni M, Corso A, Pica G. Incidence, presenting features and outcome of extramedullary disease in multiple myeloma: a longitudinal study on 1003 consecutive patients. Ann Oncol. 2009; 21: 325-30.
35- Garrido P, Coloma A, Bocardo G, Jiménez M, Herranz LM, Arellano R, et al. Plasmocitoma testicular bilateral secundario. Aportación de un caso y revisión de la literatura. Actas Urol Esp. 2008; 3210:1039-42.
36- Fassas AB, Ward S, Muwalla F. Myeloma of the central nervous system: strong association with unfavourable chromosomal abnormalities and other high-risk disease features. Leuk Lymphoma. 2004; 45: 291-300.
37- Blade J, Rosiñol L. Renal, hematologic and infectious complications in multiple myeloma. Best Prac Res Clin Haematol. 2005; 18: 63552.
38- Lahuerta JJ, Rosiñol L. Mieloma múltiple: complicaciones y formas especiales. Haematologica/edición española.2011; 96: 287-06.
39- Hall CG, Abraham GN. Size, shape, and hydration of a selfassociating human IgG myeloma protein: axial asymmetry as a contributing factor in serum hyperviscosity. Arch Biochem Biophys. 1984; 233:3307.
40- Rajkumar SV. Multiple myeloma: 2012 update on diagnosis, risk-stratification, and management. Am J Hematol. 2012; 87:7988.
41- San-Miguel JF, Mateos MV. Can multiple myeloma become a curable disease? Haematologica. 2011; 96: 1248-56.
42- Lokhorst H, Einsele H, Vesole D, Bruno B, San Miguel J, Pérez-Simon JA, et al. International Myeloma Working Group consensus statement regarding the current status of allogeneic transplantation for multiple myeloma. J Clin Oncol. 2010; 28:4521-30.
43- Giralt S. Stem Cell Transplantation for Multiple Myeloma: Current and Future Status. Hematology. 2011; 98: 191-6.
44- Palumbo A, Bringhen S, Ludwig H, Dimopoulos MA, Bladé J ,Mateos MV, et al. Personalized therapy in multiple myeloma according to patient age and vulnerability: a report of the European Myeloma Network (EMN). Blood. 2011; 118: 4519-29.
45- San Miguel JF, García-Sanz R. Prognostic features of multiple myeloma. Best Prac Res Clin Haematol.2005; 18: 569-83.
Recibido: Noviembre 20, 2012
Aceptado: Marzo 30,2013
Dr. Luis G Ramón Rodríguez. INSTITUTO DE HEMATOLOGÍA E INMUNOLOGÍA. Apartado 8070, La Habana, CP 10800, CUBA
Tel: (537) 643 8695, 8268
Fax: (537) 644 2334
Email: rchematologia@infomed.sld.cu