Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.30 no.3 Ciudad de la Habana jul.-set. 2014
ARTÍCULO ORIGINAL
Recuperación temprana de linfocitos como factor pronóstico en el trasplante hematopoyético
Early lymphocyte recovery as a prognostic factor after hematopoietic stem cell transplantation
Dr. Juan C. Jaime FagundoI, Dr. Adrián Romero GonzálezII, Dr. Ainel Anoceto MartínezI, Dr. Alberto A. Arencibia NúñezI
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Hospital Militar Central Dr. Luis Díaz Soto. La Habana, Cuba.
RESUMEN
Introducción: la recuperación temprana de linfocitos es un factor pronóstico que está relacionado con una mayor supervivencia libre de eventos y supervivencia global en pacientes sometidos a trasplante hematopoyético.
Objetivo: determinar el valor pronóstico del recuento absoluto de linfocitos (RAL).
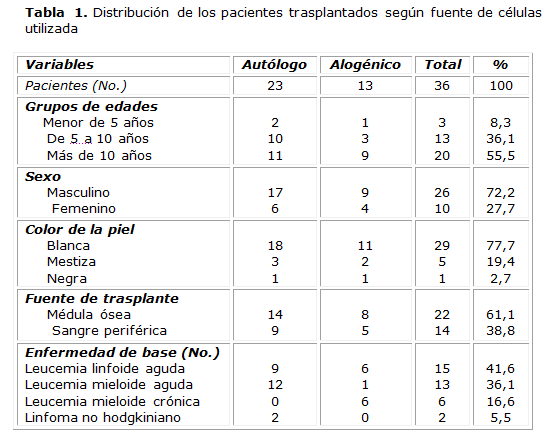
Métodos: se realizó un estudio observacional analítico, transversal, ambispectivo, en pacientes pediátricos con hemopatías malignas trasplantados en el Instituto de Hematología e Inmunología de La Habana, Cuba, entre 1986 y 2008. Se estudiaron 36 pacientes: 15 con leucemia linfoide aguda, 13 con leucemia mieloide aguda, 6 con leucemia mieloide crónica y 2 con linfoma no hodgkiniano. Veintitrés trasplantes fueron autólogos y 13 alogénicos; 22 de médula ósea y 14 de sangre periférica.
Resultados : de los trasplantes antólogos, el 60,9 % alcanzó un RAL el día + 15 (RAL-15) ≥ 500 x mm3, mientras en los alogénicos este se alcanzó en el 53,8 %. La sangre periférica tuvo un RAL-15 mayor que la médula ósea y se obtuvo en el 78,6 % y el 45,4 % de los enfermos, respectivamente (p = 0.049). Los factores pronósticos asociados a una peor supervivencia global fueron la sepsis (p <0.001), el RAL-15 < 500 x mm3 ( p= 0.001) y la recaída (p = 0.03). Las curvas de Kapplan-Meier mostraron una mejor supervivencia global y libre de eventos a los cinco años, en los pacientes con RAL-15 ≥ 500 x mm3 (85 % vs 15 %; p <0.001).
Conclusiones: el RAL-15 ≥ 500 x mm3 es una herramienta simple y útil para predecir un mejor resultado en pacientes pediátricos sometidos a trasplante hematopoyético.
Palabras clave: recuento absoluto de linfocitos, factores pronósticos, trasplante hematopoyético.
ABSTRACT
Introduction: early lymphocyte recovery is a prognostic factor related to a higher event-free survival and overall survival in patients who have received hematopoietic transplantation.
Objective: to determine the prognostic value of absolute lymphocyte count (ALC).
Method: a study in pediatric patients with hematological malignancies transplanted at the Institute of Hematology and Immunology from 1986 to 2011 was performed. The study group included 36 patients: 15 with acute lymphoid leukemia, 13 with acute myeloid leukemia, 6 with chronic myeloid leukemia and 2 with non Hodgkin lymphoma. Twenty transplants were autologous and 13 allogeneic. As stem cell source, bone marrow was used in 22 patients and peripheral blood in 14.
Results : 60,9 % of the autologous transplants reached an absolute lymphocyte count ≥ 500 x mm3 on day 15 (ALC-15), whereas in the allogeneic this was achieved in 53,8 %. Peripheral blood had a higher ALC-15 than bone marrow, 78,6 % and 45,4 %, respectively (p = 0.049). Prognostic factors associated to worse overall survival were sepsis (p <0.001), ALC-15 <500 x mm3 (p = 0.001) and relapse (p = 0.03). Kapplan-Meier curves showed better overall survival and event-free survival after five years in patients with ALC-15 ≥ 500 x mm3 (85 % vs. 15 %, p <0.001).
Conclusions: the ALC-15 ≥ 500 x mm3 is a simple and useful tool to predict a better outcome in pediatric patients undergoing hematopoietic transplantation.
Keywords: absolute lymphocyte count, prognostic factors, hematopoietic transplantation.
INTRODUCCIÓN
El trasplante de células progenitoras hematopoyéticas (TCPH) consiste en la infusión de estas células a un receptor que ha sido previamente acondicionado para recibir el injerto, destinado a establecer una función hematopoyética e inmune normales.1
La repoblación linfocitaria después del trasplante tiene una función importante, tanto en la prevención de infecciones, como en la destrucción de las células neoplásicas residuales que han sobrevivido al régimen de acondicionamiento por el efecto del injerto contra el tumor (EICT). Esto ha tenido un impacto significativo para evitar la recaída.2-4
Muy relacionado con este aspecto han sido las descripciones de Ehrlich5 en 1909 y Burnet6 en los años 60 del pasado siglo, acerca de la vigilancia inmune, conocida como la destrucción de células cancerígenas por los linfocitos. Sin embargo, a pesar de esta vigilancia, los tumores crecen en presencia de un sistema inmunológico íntegro; por tanto, el concepto de vigilancia inmune es parte de una interacción en la cual el sistema inmunológico es modificado por el tumor, y el tumor -a su vez- es modificado por el sistema inmunológico.
Se ha demostrado que después del TCPH la actividad citolítica de las células CD8+ está comprometida. Esto se manifiesta en la respuesta inefectiva frente al virus de Epstein-Barr (VEB).7 Por otra parte, la fase final de la recuperación inmune celular está dada por la emergencia de nuevas células T, generadas de precursores pretímicos del donante en el caso del trasplante alogénico.8
Varios estudios han demostrado que un recuento absoluto de linfocitos (RAL) más alto después de la recuperación del trasplante alogénico, está relacionado con un mejor pronóstico.9,10 De igual forma, en varias hemopatías malignas se ha reportado una supervivencia mayor en pacientes con un RAL en el día +15 (RAL- 15) ≥ 500 x mm3. 11,12 En la actualidad, la recuperación de linfocitos después del trasplante es considerado un importante factor pronóstico para la predicción de la recaída y la supervivencia global (SG), de forma tal, que los que poseen recuentos superiores tendrán un riesgo menor de fallecer por proceso maligno u otra complicación.
Teniendo en cuenta estos antecedentes, nos propusimos evaluar la influencia del recuento absoluto de linfocitos (RAL) como factor pronóstico, así como su independencia en el análisis multivariado de pacientes en edad pediátrica sometidos a trasplante hematopoyético en el Instituto de Hematología e Inmunología de La Habana.
MÉTODOS
Se analizaron los pacientes pediátricos hasta 18 años de edad sometidos a trasplante de células progenitoras hematopoyéticas, realizados en el período comprendido desde abril de1986 hasta diciembre de 2008. Solo se tuvieron en cuenta casos con enfermedades malignas, y se excluyó un paciente que falleció antes del día 15 postrasplante y una historia clínica que no mostraba el hemograma del día 15. De esta forma, 36 pacientes conformaron el universo de la investigación: 15 con leucemia linfoide aguda (LLA), 13 con leucemia mieloide aguda (LMA), 6 con leucemia mieloide crónica (LMC) y 2 con linfomas no hodgkinianos (LNH).
En todos los casos de trasplantes alogénicos los donantes fueron hermanos HLA idénticos. Se consideró como el día del implante, el primero de tres días consecutivos en que el conteo absoluto de neutrófilos alcanzó de forma mantenida la cifra de 500 x mm3 o más. En el acondicionamiento se utilizó busulfán y ciclofosfamida en pacientes con LMC, e irradiación corporal total y, ciclofosfamida en la LLA, la LMA y en los linfomas. Como profilaxis de la enfermedad injerto contra huésped (EICH) en los trasplantes alogénicos, se utilizó metotrexato y ciclosporina A. Los pacientes con LMC estaban en primera fase crónica de la enfermedad y aquellos con leucemia aguda y LNH se encontraban en remisión antes del trasplante y todos tuvieron recuperación hematológica.
Análisis estadístico
Los informes obtenidos se almacenaron en una base de datos con soporte en el programa Excel y el análisis estadístico se realizó con el programa SPSS, versión 11.5. La comparación de variables categóricas se realizó a través de la prueba de Chi cuadrado. El análisis univariado y multivariado se realizó mediante la regresión de Cox. El nivel de confianza se estableció en el 95 %. La SG y la supervivencia libre de eventos (SLE) a los cinco años, se determinaron por el método de Kaplan Meier y se analizaron las diferencias entre las curvas con la prueba de Log Rank. La significación estadística se consideró con una p<0.05. Se obtuvo consentimiento informado de los padres y el estudio fue revisado y aprobado por el Comité de Ética de la institución.
RESULTADOS
De los 36 pacientes estudiados predominaron los mayores de 10 años con el 55,5 %. Un total de 29 pacientes presentaron color de piel blanco y el 72,2 % fueron del género masculino.
Los trasplantes autólogos predominaron en la LMA y la LLA, 12 y 9 casos, respectivamente, mientras los alogénicos se realizaron principalmente en los pacientes con diagnóstico de LMC y LLA, con un total de seis para cada grupo, como muestra la tabla 1. En todos los pacientes se logró la recuperación hematopoyética. En relación con la fuente de progenitores hematopoyéticos, el tiempo de recuperación de hematopoyética fue de 18,1 y 11,1 días para los trasplantes de médula ósea (MO) y sangre periférica (SP), respectivamente. En cuanto al tipo de trasplante, la recuperación fue de 15,2 días para los autólogos y de 15,7 días para los alogénicos.
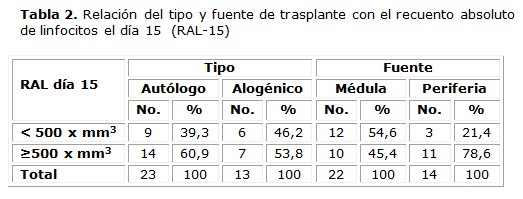
En la tabla 2 se puede observar que el 60,9 % de los trasplantes autólogos y el 53,8 % de los alogénicos presentaron un RAL-15 ≥ 500 x mm3 (p = 0.68).
La relación de la fuente del trasplante con el RAL-15 mostró significación estadística a favor de la sangre periférica (p = 0.049), pues el 78,6 % de ellos tuvieron recuentos ≥500 x mm3 al día 15 de infundidas las células hematopoyéticas; en cambio, solo el 45,4 % para TCPH de MO, presentó este recuento (tabla 2).
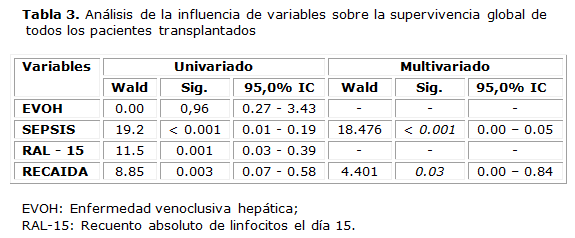
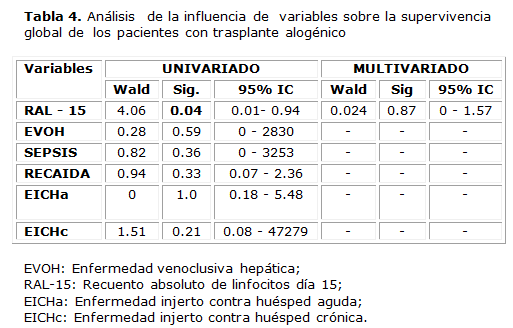
Los análisis univariado y multivariado para la SG de todos los pacientes transplantados se muestra en la tabla 3. En el análisis univariado se observó la influencia significativa de factores determinantes de muerte en el TMO, como la sepsis, único parámetro que tuvo significación estadística, y la recaída. El RAL-15 tuvo un comportamiento similar (p = 0.001). Al realizarse el análisis multivariado de las variables que tuvieron significación estadística, se encontró que solo reflejaron un comportamiento significativo la sepsis y la recaída, que fueron las únicas variables que se comportaron de forma independiente como determinantes de muerte, con 7 y 5 pacientes, respectivamente. En la tabla 4 se muestra el análisis univariado y multivariado de diferentes variables para la SG de los pacientes con trasplante alogénico, donde el RAL-15 fue el único factor pronóstico que mostró significación estadística en el análisis univariado. En este grupo de pacientes no hubo significación para el análisis multivariado.
En este estudio se comprobó de manera significativa una SG y SLE de 85 % a los cinco años, para aquellos pacientes con cifras de RAL iguales o superiores a 500 x mm3 (figura).
DISCUSIÓN
La actividad anticélulas malignas mostrada por linfocitos alogénicos, propició que Lowdellet, et al iniciaran un estudio en el año 2000, con el objetivo de valorar la función de la inmunidad autóloga en pacientes oncohematológicos, sobre la base de la influencia que tiene la actividad de las células asesinas naturales (NK, del inglés natural killers) en la supervivencia de pacientes con hemopatías malignas trasplantados de forma autóloga. En ese estudio se demostró que aquellos pacientes en remisión posterior a esquemas de quimioterapia y trasplantes hematopoyéticos, que presentaban una elevada actividad citolítica por células NK contra células leucémicas, tenían menos riesgo de recaer y mayor sobrevida que aquellos pacientes con baja actividad.13,14
Otras investigaciones confirman la influencia del RAL como un fuerte predictor independiente de supervivencia y recaída en pacientes con leucemias agudas y otras hemopatías malignas, como linfomas, mieloma múltiple y mielodisplasias, posterior a regímenes intensivos de quimioterapia o TCPH autólogos, y demuestran la importancia de la inmunidad autóloga celular en la cura de estas enfermedades.15,16
La implicación pronóstica del RAL también se ha visto en pacientes pediátricos con LMA después de la quimioterapia de inducción, con una SG a los cinco años del 85 %, en aquellos que han tenido un RAL ≥ 350 x mm3, al igual que los pacientes pediátricos con LLA, que evidencian una SG a los seis años, del 87 %.17
En la presente investigación, el trasplante autólogo y la MO fueron los más utilizados como tipo y fuente de células hematopoyéticas, respectivamente, lo que se corresponde con la tendencia mundial, donde en pacientes pediátricos sometidos a trasplantes alogénicos, la MO ocupó el 51 % seguida de la SP con el 27 %, según reporte del CIBMTR ( Center for International Blood and Marrow Transplant Research), entre los años 2006 y 2011.18
No se obtuvo significación estadística del RAL entre los trasplantes autólogos y alogénicos; sin embargo, es conocido que el efecto antitumoral es mayor en el trasplante alogénico que en el autólogo, basado en el efecto del injerto contra el tumor(19). No obstante, Porrata y col plantean una sobrevida superior en pacientes con RAL-15 ≥ 500 x mm3 en diferentes enfermedades malignas con trasplante autólogo, lo que habla a favor de un efecto antitumor del propio sistema inmune del paciente (inmunidad autóloga).20
Cuando se compararon los resultados de las fuentes utilizadas, se encontró que la SP presentó una recuperación temprana de linfocitos mayor que la MO, lo que se corresponde con estudios realizados por Pidala.21 Sin embargo, otro estudio no encontró diferencias significativas en la sobrevida global entre la SP y la MO, a pesar de que la primera tuvo una recuperación hematológica más temprana.22
El presente estudio reveló la influencia del RAL-15 < 500 x mm3, la sepsis y la recaída como factores pronósticos de forma univariada para la predicción de la muerte.
En el análisis multivariado no se encontró que el RAL-15 < 500 x mm3 fuera un factor pronóstico independiente como determinante de muerte, como se ha encontrado en muchos estudios de supervivencia que demuestran que el RAL-15 ≥ 500 x mm3 después del trasplante hematopoyético, constituye un factor pronóstico independiente. 23 Esto puede deberse a la heterogeneidad de la muestra que no permite estudiar grupos mayores y hacer correlaciones con otras variables.
Estos hallazgos demuestran la implicación del RAL en el pronóstico de los pacientes trasplantados, pues la SLE y la SG a los cinco años fue significativamente superior para pacientes con RAL-15 ≥ 500 x mm3 en comparación con aquellos con cifras menores. Similares resultados han sido reportados por Porrata, quien demuestra que los pacientes con un RAL-15 ≥ 500 x mm3 tuvieron una SG y una SLE superior con respecto a aquellos que no obtuvieron este recuento.24 Barrett reportó el estado general y la linfopenia como los dos únicos factores de riesgo independientes para predecir la muerte temprana, después de la quimioterapia convencional.25
Recientemente se ha señalado a las células NK como el subtipo de linfocito clave que conduce a la mejoría de la sobrevida postrasplante, puesto que los pacientes con RAL-15 < 500 x mm3, pero con número normal de células NK, alcanzaron una sobrevida similar a aquellos con número de células NK normal y RAL-15 ≥ 500 x mm3, lo que sugiere que las células NK son un mejor marcador de inmunidad del hospedero que el RAL en el mecanismo antitumoral en el trasplante.26,27
En conclusión, en los pacientes trasplantados con sangre periférica el RAL-15 ≥ 500 x mm3 fue significativamente superior que aquellos que recibieron médula ósea y no mostró diferencias según el tipo de trasplante.
El RAL-15 < 500 x mm3, la sepsis y la recaída fueron variables significativas en el análisis univariado como determinantes de muerte de los pacientes trasplantados, pero el primero no resultó ser un factor pronóstico independiente en la predicción de la muerte, aunque sí mostró significación estadística para la SLE y SG.
Por todo lo anterior, se considera que el valor del RAL-15 constituye un factor pronóstico y es una herramienta simple y útil que debe ser incorporada de forma sistemática en pacientes sometidos a trasplante de progenitores hematopoyéticos.
REFERENCIAS BIBLIOGRÁFICAS
1. Jaime JC, Dorticós E, Pavón V, Cortina Rosales L. Trasplante de células progenitoras hematopoyéticas: tipos, fuentes e indicaciones. Rev Cubana Hematol Inmunol Hemoter. Ago 2004 [citado 11 Feb 2013 ];20(2). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864- 02892004000200002&lng=es
2. Fedele R, Martino M, Garreffa C, Messina G, Console G, Princi D, et al. The impact of early CD4+ lymphocyte recovery on the outcome of patients who undergo allogeneic bone marrow or peripheral blood stem cell transplantation. Blood Transfus. April 2012;10(2):174-80.
3. Thomas MD, Huneke TJ, DeCook LJ, Johnson ND, Wiegand RA, Litzow MR, et al. Peripheral blood lymphocyte and monocyte recovery and survival in acute leukemia postmyeloablative allogeneic hematopoietic stem cell transplant. Biol Blood Marrow Transplant.
Apr 2012;18(4):600-7.
4. Remberger M, Mattsson J, Hentschke P, Aschan J, Barkholt L, Svennilson J, et al. The graft-versus-leukemia effect in haematopoietic stem cell transplantation using unrelated donors. Bone Marrow Transplant. Dec 2002;30(11):761-8.
5. Ehrlich P. Ueber den jetzigen Stand der Karzinomforschung, Nederlands Tijdschrift voor Geneeskunde.1909;5:273-90
6. Burnet M. Cancer; a biological approach. I. The processes of control. Br Med J. Apr 6 1957;1(5022):779-86.
7. Comoli P, Basso S, Zecca M. Preemptive therapy of EBV-related lymphoproliferative disease after pediatric haploidentical stem cell transplantation. Am J Transplant. Jun 2007;7(6):1648-55.
8. Haynes BF, Markert ML, Sempowski GD, Patel DD, Hale LP. The role of the thymus in immune reconstitution in aging, bone marrow transplantation, and HIV-1 infection. Annu Rev Immunol. 2000;18:529-60.
9. Takasaki H,Numata A,Tachibana T,Tanaka M,Maruta A, Ishigatsubo Y, et al. Relationship between early lymphocyte recovery and prognosis after allogeneic hematopoietic stem cell transplantation for acute leukemia in remission. Rinsho Ketsueki. Jan 2011;52(1):1-7.
10. Pavletic S, Joshi S, Pirruccello J. Lymphocyte reconstitution after allogeneic blood stem cell transplantation for hematologic malignancies Bone Marrow Transplant. Jan 1998;21(1):33-41.
11. Porrata F, Gertz A, Litzow R. Early lymphocyte recovery predicts superior survival after autologous hematopoietic stem cell transplantation for patients with primary systemic amyloidosis. Clin Cancer Res. 1 Feb 2005;11(3):1210.
12. Joao C, Porrata LF, Inwards DJ, Ansell SM, Micallef IN, Johnston PB, et al. Early lymphocyte recovery after autologous stem cell transplantation predicts superior survival in mantle-cell lymphoma. Bone Marrow Transplant. May 2006;37(9):865-71.
13. Lowdell MW, Craston R, Samuel D, Wood ME, O'Neill E, Saha V. Evidence that continued remission in patients treated for acute leukemia is dependent upon autologous natural killer cells. Br J Haematol. Jun 2002;117(4):821-7.
14. Moretta L, Locatelli F, Pende D, Marcenaro E, Mingari MC, Moretta A. Killer Ig-like receptor-mediated control of natural killer cell alloreactivity in haploidentical hematopoietic stem cell transplantation. Blood. 20 Jan 2011;117(3):764-71
15. Matthews K, Lim Z, Pearce L, Pagliuca A, Madrigal AJ, Mufti GJ. Rapid recovery of lymphocyte subsets is not associated with protection from relapse of myelodysplastic syndromes and acute myeloid leukaemia after haematopoietic stem cell transplantation using a reduced intensity conditioning regimen and alemtuzumab. Br J Haematol. Jun 2010;149(6):879-89
16. Jacobs NL, Holtan SG, Porrata LF, Markovic SN, Tefferi A, Steensma DP. Low absolute lymphocyte count (ALC) at diagnosis is an IPSS-independent predictor of poorer survival in myelodysplastic syndrome (MDS). Blood [abstract 3633]. vol. 112, 2008.
17. De Angulo G, Hernandez M, Morales-Arias J, Herzog CE, Anderson P, Wolff J. Early lymphocyte recovery as a prognostic indicator for high-risk Ewing sarcoma. J Pediatr Hematol Oncol. Jan 2007;29(1):48-52.
18. Pasquini MC, Wang Z. Current use and outcome of hematopoietic stem cell transplantation: CIBMTR Summary Slides.2012 [citado 2 de febrero 2013] Disponible en: http://www.cibmtr.org/ReferenceCenter/SlidesReports/StatReport/pages/index.aspx
19. Porrata LF,Litzow MR, Markovic SN. Immune reconstitution after autologous hematopoietic stem cell transplantation. Mayo Clin Proc. Apr 2001;76(4):407-12.
20. Porrata LF, Markovic SN. Is Absolute Lymphocyte Count Just Another Prognostic Factor in Cancer? SRX Medicine. 2010 (2010): Article ID 812304. doi:10.3814/2010/812304
21. Pidala J,Anasetti C,Kharfan-Dabaja MA,Cutler C,Sheldon A, Djulbegovic B. Decision analysis of peripheral blood versus bone marrow hematopoietic stem cells for allogeneic hematopoietic cell transplantation. Biol Blood Marrow Transplant. Nov 2009;15(11):1415-21.
22. Stem Cell Trialists' Collaborative Group . Allogeneic peripheral blood stem-cell compared with bone marrow transplantation in the management of hematologic malignancies: an individual patient data meta-analysis of nine randomized trials. J Clin Oncol. Aug 2005;23(22):5074-87. 24. Porrata LF,Inwards DJ,Ansell SM,Micallef IN,Johnston PB, Gastineau DA, et al. Early lymphocyte recovery predicts superior survival after autologous stem cell transplantation in non-Hodgkin lymphoma: a prospective study. Biol Blood Marrow Transplant. Jul 2008;14(7):807-16.
25. Barrett AJ, Savani BN. Does chemotherapy modify the immune surveillance of hematological malignancies? Leukemia. Jan 2009;23(1):53-8.
26. Marcenaro E, Carlomagno S, Pesce S, Della Chiesa M, Moretta A, Sivori S. Role of alloreactive KIR2DS1(+) NK cells in haploidentical hematopoietic stem cell transplantation. J Leukoc Biol. 2011 Oct;90(4):661-7
27. Locatelli F, Pende D, Mingari MC, Bertaina A, Falco M, Moretta A, et al. Cellular and molecular basis of haploidentical hematopoietic stem cell transplantation in the successful treatment of high-risk leukemias: role of alloreactive NK cells. Front Immunol. 2013 Feb; 4:15
Recibido: Enero 17, 2014
Aceptado: Febrero 2, 2014
Correspondencia a:
Dr. Juan Carlos Jaime Fagundo. INSTITUTO DE HEMATOLOGÍA E INMUNOLOGÍA. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 643 8268. Fax (537) 644 2334. Email: rchematologia@infomed.sld.cu