Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.30 no.3 Ciudad de la Habana jul.-set. 2014
ARTÍCULO ORIGINAL
Obtención de sobrenadante de cultivo aglutinador de hematíes portadores del antígeno de grupo sanguíneo B
Obtention of cell culture supernatant for erythrocyte agglutination of blood group B antigen
MSc. Alejandro Miranda Ariza, Lic. Anathais Carola Justiz Limonta, Lic. Yany Leidys Mures Díaz, Téc. Yisnelis Romaguera Fuentes
Laboratorio de anticuerpos y biomodelos experimentales (CCIM-LABEX). Centro de Inmunología Molecular. La Habana, Cuba.
RESUMEN
Introducción: la obtención de anticuerpos monoclonales en líquido ascítico ha ido decayendo paulatinamente por la aparición de alternativas de producción in Vitro, que permiten alcanzar mayores volúmenes y un control más riguroso del proceso productivo, lo que incrementa la reproducibilidad de procesos y la calidad de los productos.
Objetivo: evaluar dos métodos de producción de sobrenadante de cultivo rico en una inmunoglobulina de ratón del tipo IgG2b, aglutinadora de hematíes humanos portadores del antígeno del grupo sanguíneo B, según el sistema ABO; la cual es secretada por el hibridoma C6G4.
Métodos: se evaluaron dos métodos de producción del anticuerpo con el empleo de un biorreactor CELLine, útil como modelo para la obtención de anticuerpos monoclonales en cultivos de alta densidad celular. Los métodos se diferenciaron esencialmente en la densidad celular de siembra en el biorreactor y en la duración del periodo de fermentación entre la siembra y la cosecha del caldo de cultivo rico en anticuerpos. Para cada método se determinó la concentración específica de anticuerpos y la potencia de aglutinación del sobrenadante, así como la densidad y la viabilidad celular del cultivo alcanzadas en el momento de la cosecha.
Resultados: se observó que ambos métodos generaron sobrenadantes de cultivo con una potencia de aglutinación similar, a pesar de que se encontraron diferencias en el resto de las variables medidas. Si bien uno de los métodos produjo una mayor concentración de anticuerpos en el sobrenadante, no se observaron diferencias en la potencia de aglutinación de los sobrenadantes obtenidos por ambas alternativas.
Conclusiones: los dos métodos estudiados permitieron obtener volúmenes semejantes de sobrenadante anti-B con diferentes concentraciones de anticuerpos, pero con una potencia de aglutinación similar. La principal diferencia residió en que uno de los métodos permitió obtener el mismo volumen del producto en un tiempo sensiblemente menor.
Palabras clave : hibridoma, anticuerpo monoclonal, producción in Vitro, biorreactor CELLine, hemaglutinación.
ABSTRACT
Introduction : The obtention of monoclonal antibodies in ascite fluid has been declining gradually due to the appearance of alternative in vitro production that achieve higher volumes and a more precise monitoring of the production process, which increases the reproducibility of processes and the quality of products.
Objective : To evaluate two methods to make cell culture supernatant rich in murine monoclonal IgG2b type, with agglutinating activity against human red cell of blood group antigen B (ABO system), which is secreted by murine hybridoma C6G4.
Methods : Two methods were evaluated for antibody production in cell culture supernatant using as model a CELLine bioreactor for the production of monoclonal antibodies in high cell density culture. Both methods essentially differed in the seeding cell density in the bioreactor and the fermentation period between seeding and harvesting of the culture broth rich in antibodies. The specific antibody concentration and potency of agglutination was determined in the obtained supernatant and also the cell density and cell viability of the culture reached at the time of harvest.
Results : Both methods generated culture supernatants with similar agglutination strength despite differences found in the rest of the variables measured. Even when one of the methods produced a higher antibody concentration in the supernatants, no differences in potency of the supernatants agglutination obtained by both alternatives were observed.
Conclusions : Both methods generated supernatant anti-B with different concentrations of antibodies but similar potency of agglutination. The main difference was that with one of the methods the same volume of the product was obtained in a considerably minor time.
Keywords: hybridoma, monoclonal antibody, in vitro production, CELLine bioreactor, hemagglutination.
INTRODUCCIÓN
La tecnología del hibridoma permitió, por vez primera, la obtención de anticuerpos monoclonales (AcM) con una especificidad deseada y en cantidades considerables, mediante la generación de líquido ascítico en ratones, previamente inoculados con un hibridoma en particular. 1 La producción de AcM en líquido ascítico se destaca por el bajo costo de producción y la alta concentración de producto, en el orden de los miligramos de anticuerpo por lote, simplificando o abaratando el procesamiento de la materia prima. No obstante, la producción comercial por esta vía ha ido decayendo paulatinamente, gracias a la aparición de alternativas de producción in vitro que permiten alcanzar mayores volúmenes de producción y un control más riguroso del proceso productivo, lo que incrementa la reproducibilidad de procesos y la calidad de los productos.2
En la producción en pequeña escala, la obtención de AcM en ascitis también ha encontrado inconvenientes.3 La composición indefinida del líquido ascítico, el alto nivel de impurezas que este presenta -incluye anticuerpos endógenos de ratón en el material biológico-, así como la imposibilidad de obtener determinados tipos de anticuerpos por esta vía, han conducido al diseño y comercialización de sistemas de producción con volúmenes de producto a escala de laboratorio.4-6 Estos sistemas responden a variados diseños geométricos y modos de funcionamiento, cuyas características se reflejan en la facilidad de manipulación, los riesgos de contaminación microbiana del cultivo, la cantidad y concentración del anticuerpo en el sobrenadante de cultivo, y en los costos asociados a su uso.
Entre los diversos modelos que se ofertan en el mercado biotecnológico se destacan los biorreactores desechables, que introducen nuevas ventajas en los procesos fermentativos, tanto en la industria como en el laboratorio.7,8 El biorreactor CELLine, en particular, está diseñado para soportar el cultivo a altas densidades celulares, al encontrarse las células contenidas en cámaras con membranas porosas que permiten el acceso del medio de cultivo hacia el interior de la cámara celular mediante difusión y a la vez retiene las células y el producto8.
En el presente trabajo se evaluaron dos métodos de fermentación del hibridoma múrido anti-B (derivado del clon C6G4) en un biorreactor CELLine para determinar cuál permite generar el sobrenadante de cultivo con mayor potencia de aglutinación de hematíes portadores del antígeno de grupo sanguíneo B.
MÉTODOS
Línea celular y expansión en cultivo
Para el experimento se utilizó el hibridoma múrido C6G4, secretor de inmunoglobulina del tipo IgG2b, la cual reconoce al antígeno B en la superficie de hematíes humanos según el sistema de grupos sanguíneos ABO, lo que provoca su aglutinación. Este anticuerpo ha sido empleado en la producción de un reactivo comercial mediante un proceso basado en la generación de ascitis en ratones. Para el experimento, el hibridoma se adaptó previamente a crecer en el medio libre de suero PFHM II y se conservó en nitrógeno líquido. Para la ejecución del experimento se descongeló un criovial y las células se expandieron en cultivo estacionario, en frascos estándares de cultivo. Los cultivos se incubaron a 37 °C en atmósfera húmeda enriquecida con CO2 al 5,0 %.
Corrida fermentativa en CELLine
Se emplearon biorreactores CELLine modelo CL1000 (Integra Biosciences, Suiza). Se ejecutaron dos métodos de corrida fermentativa:
Método1 : se prepararon inóculos de 30 millones de células en un volumen de 15 mL (2,0 x 106 células viables/mL) de medio de cultivo. El biorreactor se mantuvo en incubación durante 7 días, momento en que se realizó la primera cosecha. Se realizaron cosechas seriadas reinoculando el biorreactor con la misma concentración de siembra y el mismo período de incubación.
Método 2 : se prepararon inóculos de100 millones de células en un volumen de 15 mL (6,7 x 106 células viables/mL) de medio de cultivo. El biorreactor se mantuvo en incubación durante 3 días, momento en que se realizó la primera cosecha. Se realizaron cosechas seriadas reinoculando el biorreactor con la misma concentración de siembra y el mismo período de incubación.
Para la interpretación de los resultados se calcularon los valores medios de cada variable.
Técnicas analíticas
Determinación de la concentración celular : la concentración y la viabilidad celulares se determinaron por conteo de células en cámara de Neubauer, empleando el método de exclusión con azul tripán para diferenciar células muertas y células viables.
Concentración específica de anticuerpo : se determinó mediante un ELISA tipo sandwich. Se recubrieron placas para ELISA con un reactivo policlonal anti-IgG de ratón producido en carnero (Sigma) y se incubaron durante 2 horas a 37°C. Se lavaron los pozos tres veces con solución de lavado (tampón fosfato salino 1X - Tween 20 al 0,05 %). Se aplicó cada muestra por triplicado en dos diluciones (1:500 - 1:1 000 para las menos concentradas y 1:1 000 - 1:2 000 para las más concentradas) en solución de ensayo (solución de lavado suplementada con BSA al 0,25 %). Las placas se incubaron durante una hora a 37°C. Posteriormente se lavó tres veces con solución de lavado y se aplicó un reactivo anti-IgG de ratón producido en carnero, conjugado con peroxidasa de rábano picante (Sigma). Se incubó durante una hora a 37°C. Se lavaron los pozos con solución de lavado y se aplicó la solución sustrato (2,0 mg de OPD - 5,0 mL de tampón citrato fosfato pH5 - 10,0 µL de peróxido de hidrógeno al 37 %) y se incubó a 25°C durante 30 min. Se detuvo la reacción por adición de ácido sulfúrico al 10 % y se midió la absorbancia de cada muestra a 490 nm. La concentración se determinó extrapolando los valores en una curva patrón de IgG2b (procedente de un lote productivo de IgG murina, purificado y posteriormente liberado por control de la calidad) de 0 a 200 ng/mL.
Actividad biológica : se realizaron diluciones del sobrenadante de cultivo dobles sucesivas hasta 1:1 024, en una suspensión de hematíes al 2 % en solución salina fisiológica. Se incubaron los tubos a 25°C durante 5 min. Se centrifugó a 1 000 rpm durante 1 min a 25°C y se procedió a interpretar la aglutinación como sigue:
4+ , aglutinación total de los eritrocitos en un solo cúmulo grande;
3+ , dos o tres aglutinados grandes;
2+ , aglutinados pequeños de igual tamaño;
1+ , aglutinados muy pequeños, pero definidos;
0 , ausencia de aglutinación.
El valor de potencia se determinó en el inverso de la mayor dilución en la que se observó una aglutinación de 1+. Esta técnica se montó con hematíes pertenecientes a los grupos sanguíneo A, B, A1B y O. Como patrones de referencia se montaron en el mismo ensayo muestras de líquido ascítico murino, obtenido a partir de ratones Balb/c inoculados previamente con el hibridoma C6G4, y muestras de sobrenadante de cultivo de baja densidad, obtenidos a partir de cultivos sembrados en placas de 24 pozos con una concentración de 0,2 x 106 células viables/mL e incubados durante 7 días antes de colectar el sobrenadante.
RESULTADOS
Los dos métodos, diferenciados en las concentraciones celulares de siembra y en la extensión del período de incubación entre cosechas, se ejecutaron simultáneamente a partir del mismo cultivo expandido previamente. Los resultados de cada uno se exponen a continuación:
Método 1 (menor densidad celular de siembra-mayor tiempo en cultivo):
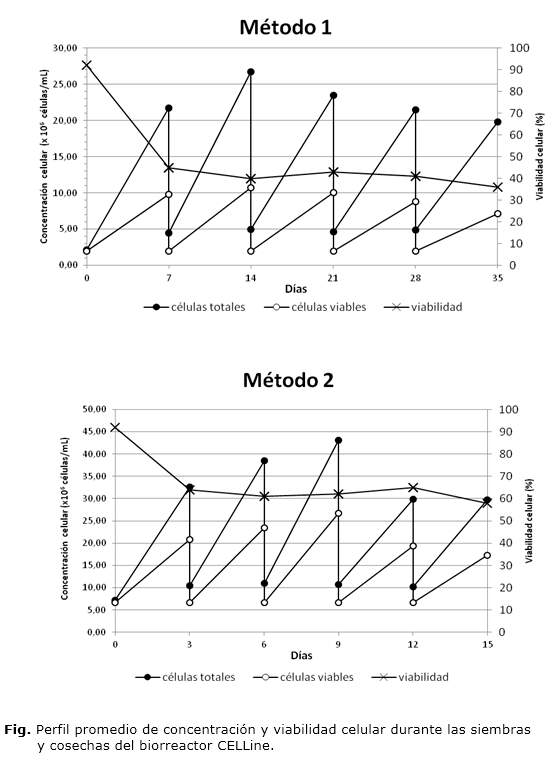
El biorreactor CELLine se inoculó con 2,0 x 106 células viables/mL y una viabilidad celular del 92 % en 15 mL de medio de cultivo. Durante los 35 días que duró la corrida fermentativa se realizaron 5 cosechas de volumen entre 27 y 31 mL. La concentración máxima de células totales durante la corrida alcanzó un valor medio de 22,64 x 106 células/mL, una cantidad de células superior a los 500 millones en todos los casos (figura). Los valores de células viables resultaron ser muy inferiores a los de células totales, con un valor medio de 9,30 x 106 células/mL. La viabilidad celular media registrada en el momento de la cosecha fue de 41 %.
Los sobrenadantes de cultivo de las diferentes cosechas se mezclaron y se determinó una concentración de anticuerpos con un valor promedio de 2,99 mg/mL en un volumen de 29,4 mL; para una cantidad total de IgG de 440,7 mg en 147 mL (tabla 1).
Los resultados de la actividad biológica del anticuerpo en el sobrenadante de cultivo mostraron una potencia de 256 con hematíes de grupo B (tabla 2)
Método 2 (mayor densidad celular de siembra-menor tiempo en cultivo):
El biorreactor CELLine se inoculó con 4,0 x 106 células viables/mL y una viabilidad celular del 92 %, en 15 mL de medio de cultivo. Se realizaron 5 cosechas en un período de 15 días y se obtuvo un volumen final de cosecha de 146 mL. Por este método, la concentración de células totales fue de 34,76 x 106 células/mL, 1,5 veces mayor que el valor obtenido en el método 1 y se obtuvieron más de 800 millones de células en cada cosecha (figura). La viabilidad celular medida en las cosechas fue notablemente superior, con un valor promedio del 62 %, 21 puntos porcentuales sobre la viabilidad promedio obtenida en el método 1.
La concentración promedio de IgG en el sobrenadante de cosecha fue de 1,98 mg/mL, para una cantidad total de IgG de 288,5 mg (tabla 3). Este valor resultó notablemente inferior al obtenido en el método1, lo que contrasta con los resultados de concentración y viabilidad celulares expuestos anteriormente.
Los ensayos de aglutinación mostraron los mismos valores de potencia, a pesar de la diferencia en la concentración de producto (tabla 2).
DISCUSIÓN
Los resultados obtenidos en las mediciones de concentración celular y de producto fueron iguales o superiores a los reportados por firmas comercializadoras de este sistema de producción.9,10
La viabilidad celular del cultivo del método 1 fue inferior a la del 2 en más de 20 puntos porcentuales. Esta notable diferencia en la cantidad de células muertas provoca que las moléculas de anticuerpo en formación sean liberadas al citoplasma, entre ellas, cadenas polipeptídicas sin ensamblar o ensambladas parcialmente, que pueden haber sido cuantificadas en la técnica de ELISA e interpretadas en el resultado de cuantificación específica de IgG como moléculas completas y maduras en su actividad inmunoquímica. Es decir, puede que una parte importante de la concentración de anticuerpo del sobrenadante del método 1 se deba al aporte de moléculas inmaduras liberadas desde el citoplasma celular al medio al morir las células y perder la integridad de la membrana celular.
Otro factor que pudo haber contribuido al aumento de moléculas inactivas en el citoplasma es la presencia de proteasas liberadas al citoplasma a partir de células muertas, que trae consigo degradación del producto en un ambiente caracterizado por valores de pH relativamente bajos. 11,12 Este análisis también sería válido en el método 2, pero en una extensión menor, teniendo en cuenta la viabilidad celular del cultivo en este último caso. Esta interpretación resulta coherente con los resultados obtenidos en la medición de potencia de hemaglutinación de los sobrenadantes, siendo de igual valor en ambos casos a pesar de la diferencia de concentración de anticuerpo, pues la diferencia quedaría reducida a las concentraciones de moléculas de anticuerpo inmunoquímicamente activas.
Desde nuestro punto de vista, la causa de la baja viabilidad registrada en el método 1 está en que durante un periodo de 7 días sin reposición de medio, el intercambio de nutrientes con la cámara de medio a través de la membrana, al realizarse por difusión, no garantiza el suministro eficiente de nutrientes en un ambiente con alta densidad celular. De igual manera se dificulta la remoción de los subproductos metabólicos que tienen efectos tóxicos sobre los cultivos celulares a través de la membrana, la cual tiene solo 10 kDa de porosidad 13. Esta notable diferencia se atribuye precisamente a reajuste de un período de incubación menor al del caso anterior, combinado con concentración de partida de células viables más de tres veces superior.
A pesar de las diferencias detectadas en la concentración celular y de producto, en términos prácticos, es decir, observando su uso como reactivo de hemaglutinación, el volumen de producto obtenido en ambos métodos fue el mismo. No obstante, el método 2 presentó ventajas en cuanto al tiempo empleado para generar el mismo volumen de producto (si se entiende como producto el sobrenadante aglutinante), la cantidad celular y la viabilidad del cultivo superiores, y si la interpretación de los resultados expuesta fuese corroborada, la calidad del sobrenadante en cuanto a la razón IgG activas/ IgG total y al nivel de impurezas provenientes de las mismas células sería igualmente superior, por lo que se recomienda su aplicación en la práctica de producción.
REFERENCIAS BIBLIOGRÁFICAS
1. Zhang C. Hybridoma technology for the generation of monoclonal antibodies. En: Proetzel G, Ebersbach H, Editores. Antibody Methods and Protocols. New York: Humana Press; 2012. p. 117-35.
2. Vermasvuori R, HurmeM. Economic comparison of diagnostic antibody production in perfusion stirred tank and in hollow fiber bioreactor processes. Biotechnol Prog. 2011 Nov-Dec;27(6):1588-98.
3. Hendriksen CF, de Leeuw W. Production of monoclonal antibodies by the ascites method in laboratory animals. Res Immunol. 1998 Jul-Aug; 149(6):535-42.
4. Bareither R, Pollard D. A review of advanced small scale-parallel bioreactor technology for accelerated process development: Current state and future need. BiotechnolProg. 2011 Jan-Feb;27(1):2-14.
5. Karuppaiya A, Cheah SH, Mohd S, Kamal WH, Zulkifli MH. Generation and characterization of monoclonal antibodies against prostate-specific antigen. Hybridoma (Larchmt). 2009 Apr;28(2):133-7.
6. Eibl R, Kaiser S, Lombriser R, Eibl D. Disposable bioreactors; the current state-of-the-art and recommended applications in biotechnology. Appl Microbiol Biotechnol. 2010 Mar;86(1):41-9.
7. Trujillo-Roldán MA, Valdez-Cruz NA. El uso de biorreactores desechables en la industria biofarmacéutica y sus implicaciones en la ingeniería. Dyna.2009 Jun; 76(158):275-83.
8. Diekmann S, Dürr C, Herrmann A, Lindner I, Jozic D, ed. Single use bioreactors for the clinical production of monoclonal antibodies-a study to analyze the performance of a CHO cell line and the quality of the produced monoclonal antibody. BMC Proceedings. 2011 Nov 22;5(8):103.
9. Bruce MP, Boyd V, Duch C, White JR. Dialysis-based bioreactorsystems for the production of monoclonal antibodies. Alternatives toascites production in mice. J Immunol Methods. 2002 Jun 1;264(1-2):59-68.
10. Mittermaier J, Zang-Gandor MO. Long-Term High Level Protein Expression in Adherent, Protein-free Growing BHK Cells Using INTEGRA CELLine adhere 1000 Bioreactor Flasks. Genetic Engineering News. 2004;24(12):42.
11. Schlaeger EJ, Eggimann B, Gast A. Proteolytic activity in the culture supernatants of mouse hybridoma cells. DevBiol Stand. 1987;66:403-8.
12. Spens E, Häggström L. Protease activity in protein-free NS0 myeloma cell cultures in vitro cell. DevBiolAnim. 2005 Nov-Dec;41(10):330-6.
13. CELLine Operating instructions. INTEGRA Biosciences. [citado 11 jun 2013]. Disponible en: http://www.integra-biosciences.com/sites/pdf/operating_instructions/90100_V04_OI_CELLine_EN.pdf
Recibido: 24 de octubre de 2013.
Aprobado: 26 de diciembre de 2013.
Correspondencia a:
Dr. Alejandro Miranda Ariza
CIM-LABEX. Prolongación de Calle 23 s/n y Carretera del Caney, Reparto "Vista Alegre", Santiago de Cuba, Cuba.
E mail: amiranda@cim.sld.cu; Teléfono: 022-644463 ext.121