Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.1 Ciudad de la Habana ene.-mar. 2016
ARTÍCULO ORIGINAL
Protocolo ALLIC-BFM 2002 en el Instituto de Hematologia e Inmunologia: experiencia de 10 añosDecember 21, 2015
ALLIC-BFM 2002 protocol in the Institute of Hematology and Inmunology: ten years of experience
Alejandro González Otero, Alberto Arencibia Núñez, Sergio Machín García, Andrea Menéndez Veitía, Adys Gutiérrez Díaz, Ileana Nordet Carrera, Jesús Serrano Mirabal, Valia Pavón Morán, Maryuri Villatoro Villatoro, Eva Svarch, Consuelo Macías Abraham, Ana María Amor Vigil, Kalia Lavaut Sánchez, Vianed Marsán Suárez, Rosa María Lam Díaz
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Introducción: la leucemia linfoide aguda (LLA) es la enfermedad maligna más frecuente en la infancia y la primera que se trató con un protocolo común en Cuba.
Objetivo: presentar los resultados alcanzados en el tratamiento de la LLA con el protocolo del grupo ALLIC-BFM 2002 en el Instituto de Hematología e Inmunología.
Métodos: fueron incluidos 125 pacientes pediátricos tratados en el período comprendido entre enero de 2002 y diciembre de 2011. Se clasificaron en grupos de riesgo de acuerdo con la edad y el número inicial de leucocitos, las alteraciones moleculares y la respuesta al tratamiento.
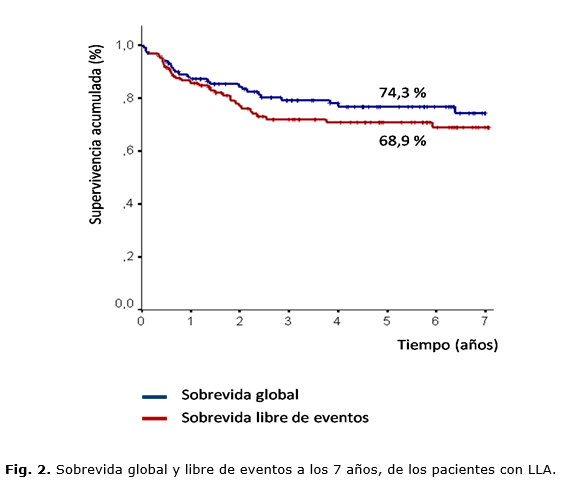
Resultados: las medianas de seguimiento y edad fueron 5,8 y 5,2 años, respectivamente. Predominó el sexo masculino, relación 1,5:1. La frecuencia de la LLA B fue del 81,3 % y el reordenamiento más común el TEL-AML1 (24,1 %). La respuesta a la profase con prednisona fue favorable en el 95,2 % y se alcanzó remisión inicial en el 91,6 % de los enfermos, con 4,0 % de muertes en la inducción. La sobrevida global y libre de eventos a los 7 años fue del 74,3 % y el 68,9 %, respectivamente; en el grupo de riesgo estándar fue del 84,2 % y el 82,0 %; en el intermedio, del 71,8 % y el 68,5 %; y en el de riesgo alto, del 25,4 % para ambas variables. Al momento de la evaluación, el 75 % de los pacientes estaban en remisión.
Conclusiones: los valores de sobrevida fueron comparables a los alcanzados por otros centros que utilizan protocolos similares.
Palabras clave: leucemia linfoide aguda, supervivencia libre de eventos, supervivencia global, Protocolo ALLIC-BFM.
ABSTRACT
Introduction: acute lymphoid leukemia (ALL) is the most common malignancy in childhood and it was the first disease treated with a common protocol in Cuba.
Objective: to show therapeutic results achieved at the Instituto de Hematología e Inmunología, La Habana, with protocol ALL-IC BFM 2002 from 2002 to 2008.
Methods and Patients: 125 children treated from January 2002 and December 2011 were included in the study. Patients were classified in prognostic groups according to age at diagnosis, initial leukocyte count, molecular rearrangement studies and response to therapy.
Results: median follow up was 5,8 years; median of age was 5,2 years, and there were more boys than girls with a 1,5/1 ratio. Percentage of ALL of B-cell origin was 81,3 % and TEL-AML1 genetic rearrangement was the most common one with 24,1 %.There were a good response to prednisone prophase in 95,2 % and initial remission was obtained in 91,6 % of the patients and 4% died during the induction phase. Overall survival and event free survival for the whole group after seven years were 74,3 % and 68,9 %, respectively. In standard risk patients results were 84,2 % and 82 %. In Intermediate risk group were 71,8 % and 68,5 %; and in the high risk group were 25,4% for both curves. At the moment of the evaluation 75 % of the patients were in remission.
Conclusions: percentages of overall survival and event free survival were similar to the ones obtained by other centers that use similar protocols elsewhere.
Keywords: acute lymphoid leukemia, ALLIC-BFM protocol, event free survival, overall survival.
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) es la neoplasia más frecuente en la edad pediátrica; representa el 23 % de los diagnósticos de cáncer en menores de 15 años y aproximadamente el 75 % de todas las leucemias de la infancia. Su incidencia es de 3 - 4 x 100 000 niños al año. En Cuba se reportan entre 55 y 60 casos nuevos anualmente.1
Se han descrito numerosos factores pronósticos para la estratificación de los pacientes con LLA: clínicos, de laboratorio y, más importante aún, según la respuesta terapéutica. A partir de ellos se asigna el grupo de riesgo a cada paciente, de modo que aquellos de menor riesgo reciben un tratamiento menos agresivo para minimizar la toxicidad, mientras que los de alto riesgo requieren un tratamiento más intensivo.2
Dentro de las variables clínicas y hematológicas, la edad y la cifra de leucocitos en el momento del diagnóstico se consideran las más importantes.1,3 Los progresos obtenidos en los últimos años en la inmunología, la citogenética y la biología molecular han definido mejor los grupos de riesgo. El factor más importante es la respuesta al tratamiento.4,5
En los últimos años, el porcentaje de supervivencia y curación de la LLA del niño alcanza entre el 70 y el 80 %.6-8 Un factor que ha contribuido a los logros obtenidos es la creación de grupos cooperativos que utilizan protocolos comunes en varios países; ello permite unificar los esquemas terapéuticos y obtener resultados confiables y reproducibles. Los protocolos de tratamiento del grupo alemán Berlín-Frankfurt-Munster (BFM), adoptados por varios países, han contribuido significativamente a los logros de los últimos años. 9,10
En el Instituto de Hematología e Inmunología (IHI), el tratamiento de la LLA en la edad pediátrica comenzó a realizarse con protocolos establecidos y de una forma organizada, a partir del año 1973. Desde el año 1982, el grupo incorporó los esquemas basados en las recomendaciones del grupo BFM, con una mejoría significativa de los resultados. Sin embargo, no se comenzó a realizar un tratamiento uniforme en todo el país hasta 1986 en que se conformó el Grupo de Estudio y Tratamiento de Hemopatías Malignas en Cuba (GETHMAC). Hasta el año 2002 se trataron más de 900 niños menores de 18 años, con diferentes protocolos y resultados que mejoraron progresivamente.11,12
En el año 2002 se estableció el grupo cooperativo ALLIC (Acute Lymphoblastic Leukemia Intercontinental), que emplea un protocolo terapéutico de tipo BFM y en el que participan más de 20 países de diferentes continentes. Cuba pertenece a este grupo, con el IHI como centro rector. Anualmente se tratan entre 15 y 20 pacientes con LLA, lo que constituye la tercera parte de los pacientes del país. De ahí la gran importancia de conocer las características clínicas y hematológicas de los enfermos tratados en este centro, así como los resultados del tratamiento según el protocolo ALLIC-BFM 2002 a 10 años de su implementación.
MÉTODOS
Se realizó un estudio longitudinal, prospectivo y descriptivo que incluyó a 125 pacientes pediátricos con LLA tratados en el servicio de Pediatría del IHI, en el período de enero de 2002 a diciembre de 2011. Se evaluaron los resultados del tratamiento ALLIC-BFM 2002 aplicado a los pacientes incluidos.
Los criterios de inclusión fueron: diagnóstico de LLA, edad entre 1 y 18 años, y el consentimiento informado de los padres para participar en el estudio.
Los criterios de estratificación en grupos pronósticos se basaron en la edad y el número de leucocitos en el momento del diagnóstico, la presencia de alteraciones moleculares desfavorables y la respuesta al tratamiento de acuerdo con lo considerado por el grupo ALLIC.13
El protocolo de investigación fue revisado y discutido por el consejo científico y el comité de ética de la investigación del centro, previo a su aprobación. Se garantizó la seguridad y confidencialidad de la información. Todos los padres/tutores de los pacientes incluidos firmaron el documento de consentimiento informado.
Análisis estadístico
El análisis estadístico se realizó mediante el programa SPSS versión 12.0 a partir de una base de datos en Excel. Se utilizaron como medidas de resumen, las frecuencias absolutas y relativas para las variables cualitativas y la media, la mediana y el rango para las cuantitativas. La supervivencia se estimó por el método de Kaplan-Mier, y las diferencias entre curvas se validaron mediante la prueba de log-rank. Se excluyeron del análisis de supervivencia los pacientes con LLA Ph+ que recibieron mesilato de imatinib junto al tratamiento de quimioterapia (protocolo EsPhALL-2004). Se realizó el análisis multivariado por regresión de Cox para determinar los factores pronósticos de la supervivencia libre de eventos (SLE). El nivel de significación estadística fue del 95 % (p ≤ 0,05) para todas las pruebas realizadas.
RESULTADOS
Del total de pacientes incluidos, 75 (60 %) fueron del sexo masculino. La mediana de edad al diagnóstico fue de 5,2 años (rango: 1,1 - 17,9 años), con una frecuencia mayor entre los 2 y 4 años (figura 1).
Los datos generales del grupo se muestran en la tabla 1. En relación con el número de leucocitos resulta llamativo que el 22,2 % de los pacientes tuvieron recuentos mayores de 20 x 109/L, que ya los clasificó como de riesgo intermedio.
Tabla 1. Características generales del grupo estudiado
| Aspectos evaluados | Parámetros | ||
| Hallazgos al examen físico, radiológico y del sistema nervioso central (SNC) (n, %) | Esplenomegalia | 95 | 76 |
| Hepatomegalia > 3 cm | 80 | 64, | |
| Adenopatías mediastinales | 7 | 5,6 | |
| Infiltración del SNC | 5 | 4 | |
| Hallazgos del hemograma (media, rango) | Hemoglobina (g/L) | 8,6 | 3,4 -13,4 |
| Leucocitos (x109/L) | 8,4 | 1,2 - 320 | |
| Plaquetas (x109/L) | 62 | 1 - 420 | |
| Estudios moleculares (n, %) 87 estudiados | Ninguno | 62 | 71,3 |
| TEL/AML 1 | 21 | 24,1 | |
| bcr/abl | 3 | 3,4 | |
| MLL/AF4 | 1 | 1,2 | |
| Inmunofenotipo (n, %) 91 estudiados | B | 74 | 81,3 |
| T | 1 | 16,5 | |
| Híbrido | 2 | 2,2 | |
| Clasificación en grupos pronósticos (n, %) (n =125) | Estándar | 44 | 35,2 |
| Intermedio | 67 | 53,6 | |
| Alto | 14 | 11,2 | |
| Respuesta Terapéutica a la prednisona, día 8 (n, %) | >1000 blastos/mm3 | 6 | 4,8 |
| <1000 blastos/mm3 | 119 | 95,2 | |
| Medulograma por aspiración, día 15 (n, %) | > 25 % blastos | 7 | 5,6 |
| Medulograma por aspiración, día 33 (n, %) | > 5 % blastos | 5 | 4,0 |
| Localización de las recaídas (n, %) | Medular aislada | 10 | 8 ,7 |
| Medular combinada | 4 | 3,5 | |
| SNC. | 4 | 3,5 | |
| Testicular | 3 | 4* | |
| Otra ( ganglionar) | 1 | 10,9 | |
| Causa directa de la muerte (n, %) | Progresión de la leucemia | 15 | 48,4 |
| Infecciones | 8 | 25,8 | |
| Hemorragias | 7 | 22,6 | |
| Complicaciones debidas al trasplante | 1 | 3,2 | |
* - de los varones
En los enfermos con inmunofenotipo B, 60,4 % tenía la variedad B común y 12,1 % fueron pre-B. La variedad T madura fue la más frecuente en los pacientes con este inmunofenotipo. En 34 enfermos no estuvieron disponibles los resultados por diferentes causas y algo similar ocurrió en 35 enfermos en relación con los estudios moleculares.
El 91,6 % de los enfermos alcanzaron la remisión al final de la inducción; 3,2 % durante la consolidación y uno (0,8 %) tuvo enfermedad refractaria.
Las recaídas se presentaron en 22 pacientes (18,4 %); la mayoría (13 pacientes, 56,5 % del total de recaídas) se consideraron tardías, por ocurrir después de los 18 meses de iniciado el tratamiento.
En el momento de su última evaluación, el 70,4 % de los pacientes se mantenían en remisión completa continua, 6 (4,8 %) estaban en segunda remisión y 31 (24,8 %) habían fallecido. La mayor parte de las muertes ocurrieron después de la recaída (14,4 %); sin embargo, 5 pacientes fallecieron en la inducción (4,0 %) y el 6,4 % murieron en remisión por complicaciones del tratamiento.
En el análisis multivariado por regresión de Cox se incluyeron las covariables que mostraron una tendencia a la asociación con la SLE en el análisis univariado (tabla 2). Los factores de riesgo desfavorables fueron la edad ≥ 6 años, los leucocitos, la presencia de reordenamiento BCR-ABL y MLL-AF4, el conteo de blastos el día 8 ≥ 1000/mm3 y la no remisión en la inducción.
Para el análisis de la supervivencia global (SG) y la SLE a los 7 años (figura 2) se excluyeron tres pacientes con LLA Ph+ que recibieron, además, inhibidores de la tirosina quinasa. Sin embargo, el análisis por intención de tratamiento no modificó de forma significativa los resultados presentados. La SG a los 7 años fue del 74,3 ± 0,04 %, con una supervivencia promedio de 5,7 años (IC-95 %: 5,23 – 6,14). La SLE a los 7 años fue del 68,9 ± 0,05 %, con una supervivencia promedio de 5,3 años (IC-95 %: 4,79 – 5,79).
Según la fecha de inicio del tratamiento se formaron dos grupos: el primero (2002 y 2006) incluyó 69 pacientes y el segundo (2007 - 2011), 56. La SG en el período 2007 - 2011 fue mayor que en el primer período (83,1 % vs. 70,1 %; log rank = 1,80; p = 0,179).
Las probabilidades de SG y SLE a los 7 años para cada uno de los grupos de riesgo (figura 3), fueron del 94,2 % y el 82,0 %, respectivamente, para los pacientes de riesgo estándar; significativamente superior a los pacientes con riesgo intermedio (SG = 71,8 %; SLE = 68,5 %) y de riesgo alto (SG = 25,4 %; SLE = 25,4 %). En este grupo ningún enfermo sobrevivió a la recaída.
DISCUSIÓN
En las últimas décadas ha ocurrido una mejoría significativa en los resultados del tratamiento de los niños con LLA, como consecuencia de la creación de grupos cooperativos.17 Los aportes del BFM al tratamiento de las leucemias en el niño han sido adoptados por otros grupos, de modo que gran cantidad de países realizan tratamientos similares.9,18 El grupo ALLIC, al que pertenece Cuba, emplea protocolos del tipo BFM desde el año 2002.
La relación masculino/femenino (1,5:1) fue superior a la comunicada por otros grupos. 16 Se ha planteado que los varones tienen menor supervivencia, sobre todo debido a la recaída testicular; no obstante, también hay mayor frecuencia de recaídas a otro nivel por razones no conocidas.17
Con relación a la edad del diagnóstico, se describe un aumento en la incidencia en los niños de 2 a 3 años, disminuye entre los 8 y 10 años, y alcanzan el mínimo en la adolescencia.1 En este sentido, los datos coinciden con la literatura.
Aunque el grupo ALLIC considera las edades entre 1 y 5 años como de buen riesgo,14 otros grupos aumentan la edad hasta los nueve. 18,19 Los adolescentes tienen mayor riesgo de complicaciones relacionadas con el tratamiento,20-22 con resultados peores que los de los niños menores,23 debido a la asociación con factores desfavorables 24. En el presente estudio, los pacientes con edad ≥ 6 años, presentaron una probabilidad 2,4 veces mayor de presentar algún evento (p = 0,041).
Las manifestaciones clínicas de la LLA dependen de la infiltración medular y extramedular. La presencia de hepatomegalia y esplenomegalia fueron comunes al diagnóstico, con baja frecuencia de infiltración mediastinal y del sistema nervioso central (SNC).
Una cohorte de 2 000 pacientes mostró una incidencia de estatus 2 y 3 del SNC en el 2,4 % para cada uno. Estos pacientes recibieron un tratamiento intensificado que incluyó radioterapia.32 En los últimos años, los principales grupos de tratamiento han disminuido el número de pacientes que reciben radioterapia craneal al 5 – 10 %, con resultados prometedores y una reducción significativa de la toxicidad a largo plazo.9, 33-35 La aplicación de radioterapia craneal en el IHI fue superior (20 % de los pacientes), aunque de acuerdo con los criterios del protocolo empleado.
Las citopenias provocan las manifestaciones típicas de la enfermedad; sin embargo, en algunos pacientes pueden estar ausentes. En el 20 % de los casos la Hb fue normal; mientras en el 35 % el recuento plaquetario fue mayor de 150 x 109/L. Estos datos deben alertar a los médicos de atención primaria y secundaria sobre la posibilidad del diagnóstico de LLA en niños con conteos hematológicos normales, que presenten síntomas inespecíficos como fiebre, dolores osteoarticulares o un síndrome general.
El recuento de leucocitos es otro de los factores pronósticos en la LLA del niño pues los valores altos expresan una mayor masa tumoral. La leucocitosis mayor de 100 x 109/L se asocia con complicaciones al inicio del tratamiento como síndrome de lisis tumoral y leucoestasis, que pueden comprometer la vida del paciente 28. Algunos grupos utilizan un punto de corte más alto (50 x 109/L) que el establecido por el ALLIC para definir un peor pronóstico;5,26,29 sin embargo, en este estudio los pacientes con leucocitos mayor de 20 x 109 /L tuvieron 2,1 veces menos probabilidades de permanecer en remisión (p = 0,084).
Las alteraciones citogenéticas y moleculares en la LLA tienen importancia pronóstica. La mutación TEL-AML1 confiere un buen pronóstico y se presenta en el 20 - 25 % de los pacientes,38,39 similar a lo encontrado en el estudio. La translocación t(9;22) (BCR/ABL), presente entre el 3 y 5 % de los niños con LLA, se asocia con pobre respuesta terapéutica y mal pronóstico,5,40 lo que coincide con lo observado. La frecuencia de la t (4; 11) (MLL/AF4) es del 2 % de los casos de LLA mayores de un año de edad y tiene un pronóstico desfavorable, como sucedió con el único enfermo del estudio.41
Otras alteraciones genéticas importantes son la t (1; 19)42 y las deleciones del gen IKZF1 que se presentan en el 5 y el 28 %, respectivamente, en los pacientes con LLA de precursores B43. Esta variedad representa del 80 al 85 % de los casos de la LLA infantil y coincidió con los resultados obtenidos. La LLA de células T se relaciona con características clínicas y biológicas distintivas con mayor edad, masa mediastínica, infiltración del SNC y mutaciones del gen NOTCH1,44 así como resistencia al metotrexate. 45 A pesar de esto, con una terapia más intensa estos niños tienen una evolución similar al resto,44 como ocurrió en nuestro estudio.
A pesar de los avances en la caracterización de la LLA, el principal factor pronóstico sigue siendo la respuesta al tratamiento. La respuesta temprana evaluable tras siete días de prednisona es uno de los aportes más destacados del grupo BFM y ha sido adoptado por otros grupos cooperativos.46 En este estudio, la respuesta a la prefase esteroidea fue el factor predictivo de mayor impacto sobre la SLE.
La evaluación de la respuesta al día 15 de tratamiento es otro elemento utilizado para definir el riesgo de recaída; sin embargo, no constituyó un factor pronóstico en este estudio. Quizás debido a la ausencia de métodos de estudio más precisos, como el estudio de la enfermedad mínima residual (EMR) por cualquiera de las técnicas establecidas.38
La remisión hematológica al final de la inducción se logra en más del 95 % de los niños con LLA. Hay factores de riesgo ya descritos que influyen en el fracaso.48 En el estudio FRALLE-93, la tasa de SG a los cinco años de los pacientes con fallo de la inducción fue del 30 %.49
Aunque la proporción de pacientes resistentes fue la esperada, hubo un mayor número de muertes en la inducción que lo reportado por centros de Norteamérica y Europa Central;41 sin embargo, fue similar a lo comunicado por centros de Latinoamérica y Europa del Este que realizan protocolos similares.16,42
En relación con la distribución por grupos de riesgo, ALLIC establece una frecuencia esperada del 33 % para riesgo estándar, 48 % para intermedio y 19 % para alto riesgo. Se encontró una frecuencia mayor para el riesgo estándar e intermedio en detrimento del grupo de riesgo alto. Esto puede deberse a la imposibilidad de realizar los estudios moleculares en la totalidad de los pacientes.
La clasificación en grupos de riesgo es una estrategia utilizada universalmente para reducir la toxicidad en los pacientes de pronóstico favorable e intensificar la terapia en los de pronóstico desfavorable.2,52 La asignación de tratamiento de acuerdo con el riesgo exige que se disponga de factores pronósticos confiables para predecir el resultado. El hecho de encontrar asociación significativa solo para los factores implicados en la asignación de riesgo alto del ALLIC demuestra su validez.
A pesar de que los regímenes actuales de quimioterapia logran la remisión en más del 95 % de los niños con LLA, todavía uno de cada cinco puede recaer. Los factores más importantes para predecir el curso de la enfermedad tras la recaída son el momento en que esta ocurre, la localización y el inmunofenotipo de los blastos.53 Otros factores que se señalan son el grupo de riesgo al inicio de la enfermedad y la edad de los pacientes al momento de la recaída.54
La proporción de recaídas de forma general fue similar a la descrita por otros dentro del ALLIC.16,46 Además, coincide con la literatura en lo referente a la localización y el momento de aparición de la recaída.47,48 No obstante, el número de pacientes vivos en segunda remisión en el momento de la evaluación (26,1 %) fue inferior a lo reportado por otros centros.16,49 Debe señalarse que los pacientes de alto riesgo con recaída son elegibles para TCPH, relacionado o no, en segunda remisión;50 sin embargo, la baja disponibilidad de donantes limitó su utilización y por esto la SLE y la SG fueron similares en este grupo.
La SG y la SLE a los 7 años en los pacientes tratados con el protocolo ALLIC-BFM 2002 fueron comparables a las alcanzadas por centros que utilizan protocolos similares en países de Europa,4,19,56,60 así como otros que utilizan protocolos diferentes, radicados en Inglaterra y España.57,61 Los resultados obtenidos superan los alcanzados por países como El Salvador 20 y Colombia;51 pero son inferiores a los reportados en Alemania,10 Japón 62 y EE.UU.29,63
La SG y la SLE a los 7 años en los pacientes de riesgo estándar fueron comparables a las comunicadas por otros investigadores; sin embargo, en los pacientes de riesgo intermedio y sobre todo en los de alto, fue inferior a la esperada.
Como se señaló, la dificultad para realizar los estudios moleculares a todos los enfermos incluidos ocasionó que algunos pacientes con translocaciones de mal pronóstico no fueran clasificados correctamente y por tanto, recibieran un tratamiento menos intensivo que el requerido. Desde el punto de vista terapéutico, los factores principales que lastraron los resultados fueron la imposibilidad de emplear variantes de L-asparaginasa para los pacientes que tuvieron alergia y las dificultades para realizar TCPH cuando estaba indicado. A pesar de esto, los resultados fueron similares a los obtenidos por el ALLIC a los 6 años 54 y a los alcanzados en todo el país a los 4 años.13
Al comparar la SG a los 5 años de los pacientes diagnosticados en el período 2002 – 2006, con los diagnosticados en entre 2007 – 2011, se pudo observar una mejoría de los resultados. Esta diferencia se justifica por la adquisición de experiencia del equipo y los avances en el tratamiento de soporte. Como ejemplo se puede señalar que cuatro de las cinco muertes en la inducción ocurrieron en el primer período. Este comportamiento ha sido descrito por otros centros.23,26,45,55 No hay dudas de que hay que mejorar los resultados en los enfermos de alto riesgo.
El análisis de estos datos ha permitido evaluar las fortalezas y debilidades del centro en la aplicación de un protocolo de tratamiento de alta complejidad, que implica la acción coordinada y multidisciplinaria de todo el equipo. La mejoría de los resultados a lo largo del tiempo, y la experiencia alcanzada con este protocolo, nos permite enfrentar la implementación del ALLIC-BFM-2009, con el propósito de mejorar la supervivencia de los niños con LLA.
Agradecimientos
A los hematólogos que se relacionan a continuación, por su aporte y seguimiento de pacientes en el servicio en el período de estudio: Tamara Delgado, Aramís Núñez, Tania García, Marlén Domínguez, Juan Carlos Jaime, Libet Boch, Carlos Rivera. A todo el personal técnico y de enfermería, y a los pacientes y familiares que contribuyeron a que este estudio se hiciera realidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Pui CH. Acute lymphoblastic leukemia: introduction. Semin Hematol. 2009 Jan;46(1):1-2.
2. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med. 2006 Jan 12;354(2):166-78.
3. González A, Vergara B. Las leucemias en pediatría. En: Pediatría III. La Habana: Pueblo y Educación; 1997. p. 25-31.
4. Conter V, Arico M, Basso G, Biondi A, Barisone E, Messina C, et al. Long-term results of the Italian Association of Pediatric Hematology and Oncology (AIEOP) Studies 82, 87, 88, 91 and 95 for childhood acute lymphoblastic leukemia. Leukemia. 2010 Feb;24(2):255-64.
5. Gandemer V, Auclerc MF, Perel Y, Vannier JP, Le Gall E, Demeocq F, et al. Impact of age, leukocyte count and day 21-bone marrow response to chemotherapy on the long-term outcome of children with Philadelphia chromosome-positive acute lymphoblastic leukemia in the pre-imatinib era: results of the FRALLE 93 study. BMC Cancer. 2009;9:14.
6. Silverman LB, Declerck L, Gelber RD, Dalton VK, Asselin BL, Barr RD, et al. Results of Dana-Farber Cancer Institute Consortium protocols for children with newly diagnosed acute lymphoblastic leukemia (1981-1995). Leukemia. 2000 Dec;14(12):2247-56.
7. Pui CH, Mulligan CG, Evans W, Reiling MV, Ribeiro RC, Howard SC, et al. Pediatric Acute lymphoblastic leukemia : Where are we going and how do we get there. Blood. 2012:120 (6):1165-74.
8. Silverman LB, Stevenson KE, O'Brien JE, Asselin BL, Barr RD, Clavell L, et al. Long-term results of Dana-Farber Cancer Institute ALL Consortium protocols for children with newly diagnosed acute lymphoblastic leukemia (1985-2000). Leukemia. 2010 Feb;24(2):320-34.
9. Kamps WA, Bokkerink JP, Hakvoort-Cammel FG, Veerman AJ, Weening RS, van Wering ER, et al. BFM-oriented treatment for children with acute lymphoblastic leukemia without cranial irradiation and treatment reduction for standard risk patients: results of DCLSG protocol ALL-8 (1991-1996). Leukemia. 2002 Jun;16(6):1099-111.
10. Moricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gardner H, et al. Long term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the BFM ALL study group from 1981 to 2000. Leukemia. 2010;24(2):265-64.
11. Svarch E, González A, Lagarde M, Vergara B. Tratamiento de la LLA del niño. Bol Med Hosp Infantil México. 1980;37:707-14.
12. Svarch E, González A, Vergara BC, Campo M, Méndez J, Fernández O, et al. Tratamiento de la leucemia linfoide aguda ( LLA) en el niño. Sangre. 1993;38:251-7.
13. González-Otero A, Menéndez-Veitía A, Machín-García S, Svarch E, Campo-Díaz M, Fernández-Nodarse R, et al. Resultados del tratamiento de la leucemia linfoide aguda del niño en Cuba. Rev Cubana Hematol Inmunol Hemoter. 2014 Dic;30(1):36-46.
14. Biondi A, Baruchel A, Hunger S, Masera G, Schmiegelow K, Schrappe M, et al. The Eleventh International Childhood Acute Lymphoblastic Leukemia Workshop Report: Ponte di Legno, Italy, 6-7 May 2009. Leukemia. 2009 Dec;23(12):2318-24.
15. Arico M, Valsecchi MG, Rizzari C, Barisone E, Biondi A, Casale F, et al. Long-term results of the AIEOP-ALL-95 Trial for Childhood Acute Lymphoblastic Leukemia: insight on the prognostic value of DNA index in the framework of Berlin-Frankfurt-Muenster based chemotherapy. J Clin Oncol. 2008 Jan;26(2):283-9.
16. Olah E, Balogh E, Pajor L. Jakar Z and the Hungarian Pediatric Oncology network: Ten years experiences on initial genetic examinations in childhood acute lymphoblastic leukemia in Hungary (1993-2002). Technical approaches and clinical implementation. Pathol Oncol Res. 2011;17(1):81-90.
17. Pui CH, Carrol W, Mechinhi L, Arceci RJ. Biology risk stratification and therapy of pediatric acute lymphoblastic leukemia: An update. J Clin Oncol. 2011;29(5):551-6.
18. Gaynon PS, Angiolillo AL, Carroll WL, Nachman JB, Trigg ME, Sather HN, et al. Long-term results of the children's cancer group studies for childhood acute lymphoblastic leukemia 1983-2002: a Children's Oncology Group Report. Leukemia. 2010 Feb;24(2):285-97.
19. Solano-Genesta M, Tarh-Arzaga L, Velasco-Ruiz I, Lutz-Presno JA, Gonzalez-LLano Q, Macias-Guerra C, et al. CD20 expression in childhood B-cell precursor acute lymphoblastic leukemia is common in mexican patients and lacks a prognostic value Hematology. J Pediatr Hematol Oncol. 2012; 17(2):66-70.
20. Te WinkelML, Peters R, Wind EJ, Bessen s JH, van der Heuvel-Ebrink MM. Management and treatment of osteonecrosis in chidren and adolescents with acute lymphoblastic leukemia. Haematologica. 2014;99(3):430-6.
21. Mitchell L, Lambers M, Flege S, Kenet G, Li-Thiao-Te V, Holzhauer S, et al. Validation of a predictive model for identifying an increased risk for thromboembolism in children with acute lymphoblastic leukemia: results of a multicenter cohort study. Blood. 2010 Jun;115(24):4999-5004.
22. Raja RA, Schmlegelow K, Frandsen TL. Asparaginase associated pancreatitis in children. Br J Haematol. 2012;159(1):18-27.
23. Schultz KR, Devides M, Bowman WP, Aledo A, Slayten WB, Sather H, et al. Philapelphia chromosome negative very high risk acute lymphoblastic leukemia in children and adolescents Results from the Children's Oncology Group study AALL 0031. Leukemia. 2014;28(4):964-7.
24. Lauter M, Moricke A, Beller R, Zimmermann M, Stamuller M, Helssnter A, et al. Prediction of outcome asessed by early bone marrow response in childhood acute lymphoblastic leukemia treated by ALL BFM 95. Differential effects in precursor B cell and in T cell leukemias. Haematologica. 2012;97(7):1048-56.
25. Sirvent N, Suciu S, RiallandK, Millot F, Benoit Y, Plantaz D, et al. Prognostic significance ot the initial cerebrospinal fluid (CSF)involvement in children with acute lymphoblastic leukemia (ALL)treated without cranial irradiation Results of the European Organization for Research and Treatment of Cancer (EORTC) Children Leukemia Group Study 5888. Eur J Cancer. 2011;67(2):289-47.
26. Liang DC, Yang CP, Lin DT, Hung IJ, Lin KH, Chen JS, et al. Long-term results of Taiwan Pediatric Oncology Group studies 1997 and 2002 for childhood acute lymphoblastic leukemia. Leukemia. 2010 Feb;24(2):397-405.
27. Reddick WE, Taghpour DJ, Glass JD, Ashford Jj, Xiong X, Wu S, et al. Prognostic factors that increase the risk for reduced white matter volumen and deficits in attention and learning for survivors of childhood cancers. Pediatr Blood Cancer. 2014;61(6):1074-9.
28. Jaime-Fagundo JC, Arencibia-Núñez A, Gutiérrez-Díaz A, Ramón-Rodríguez L, Díaz-Durán C. Urgencias en Hematología: alteraciones metabólicas y leucocitarias. Rev Cubana Hematol Inmunol Hemoter. 2012 Mar;28(1):3-21.
29. Pui CH, Pei D, Campana D, Bowman WP, Sandlund JT, Kaste SC, et al. Improved results for older adolescents with acute lymphoblastic leukemia. J Clin Oncol. 2011;29(4):386-91.
30. Rubnitz JE, Wichlan D, Devidas M, Shuster J, Linda SB, Kurtzberg J, et al. Prospective analysis of TEL gene rearrangements in childhood acute lymphoblastic leukemia: a Children's Oncology Group study. J Clin Oncol. 2008 May 1;26(13):2186-91.
31. Ribera JM, Oriol A, Gonzalez M, Vidriales B, Brunet S, Esteve J, et al. Concurrent intensive chemotherapy and imatinib before and after stem cell transplantation in newly diagnosed Philadelphia chromosome-positive acute lymphoblastic leukemia. Final results of the CSTIBES02 trial. Haematologica. 2010 Jan;95(1):87-95.
32. Sam TN, Kersey JH, Linaberry AM, Reston K. MLL gene rearrangements in infant leukemia vary with age at diagnosis and selected demographic factors: A Children's Oncology Group (COG) survey . Pediatr Blood Cancer. 2012;58(6):636-9.
33. Bhatia S. Disparities in cancer outcome. Lessons learned from children with cancer. Pediatr Blood Cancer. 2012:56(5):994-1002.
34. Mullighan CG, Su X, Zhang J, Radtke I, Phillips LA, Miller CB, et al. Deletion of IKZF1 and prognosis in acute lymphoblastic leukemia. N Engl J Med. 2009 Jan;360(5):470-80.
35. Pui CH. T cell acute lymphoblastic leukemia: NOTCHing the way toward a better treatment outcome. Cancer Cell. 2009 Feb 3;15(2):85-7.
36. Sorich MJ, Pottier N, Pei D, Yang W, Kager L, Stocco G, et al. In vivo response to methotrexate forecasts outcome of acute lymphoblastic leukemia and has a distinct gene expression profile. PLoS Med. 2008 Apr 15;5(4):e83.
37. Manabe A, Ohara A, Hasegawa D, Tsuchida M, Kumagai M, Shimada H, et al. Significance of the complete clearance of peripheral blasts after 7 days of prednisolone treatment in children with acute lymphoblastic leukemia: the Tokyo Children's Cancer Study Group Study L99-15. Haematologica. 2008 May;93(8):1155-60.
38. Flotho C, Coustan-Smith E, Pei D, Cheng C, Song G, Pui CH, et al. A set of genes that regulate cell proliferation predicts treatment outcome in childhood acute lymphoblastic leukemia. Blood. 2007 Aug;110(4):1271-7.
39. Olsson L, Castor A, Behrendtz M, Biloglav A, Forrester E, Paulsson K, et al. Deletions of IKZF-1 and SPRED -1 are associated with poor prognosis pn a population based series of pediatric B cell precursor acute lymphoblastic leukemia diagnosed between 1992 and 2011. Leukemia. 2014;28(2):302-10.
40. Gandemer V, Chevret S, Petit A, Vermylen C, Leblanc T, Michel C, et al. Excellent prognosis of late relapses of ETV6! Runx1positive childhood acute lymphoblastic leukemia Lessons from the FRALLE 93 protocol. Haematologica. 2012;97(11):1743-50. doi 103324haematol 2011.
41. Conter V, Valsecchi MG, Parasie R, Puti MC, Locatelli F, Barisone E, et al. Childhood high risk acute lymphoblastic leukemia in first remission results after chemotherapy or transplant from the AIEOP 2000 study. Blood. 2014;120(10):1470-8.
42. Buendia MT, Lozano JM, Suarez GE, Saavedra C, Guevara G. The impact of acute lymphoblastic leukemia treatment on central nervous system results in Bogota, Colombia. J Pediatr Hematol Oncol. 2008 Sep;30(9):643-50.
43. Ribera JM, Oriol A, Morgades M, Montesino S, Perma J, Gonzalez-Campos J, et al. Treatment of high risk Philadelphia chromosome negative acute lymphoblastic leukemia in adolescents and adults according to early cytologic response and minimal residual disease after consolidation assessed by flow cytometry. Final results of the PETHEMA ALL-AR-93 trial. J Clin Oncol. 2014;32(15):1595-604.
44. Tallen G, Ratei R, Mann G, Kaspers G, Niggli F, Karachunsky A, et al. Long-term outcome in children with relapsed acute lymphoblastic leukemia after time-point and site-of-relapse stratification and intensified short-course multidrug chemotherapy: results of trial ALL-REZ BFM 90. J Clin Oncol. 2010 May;28(14):2339-47.
45. Nguyen K, Devidas M, Cheng SC, Su X, Zhang J, Cao X, et al. Factors influencing survival after relapse from acute lymphoblastic leukemia: a Children's Oncology Group study. Leukemia. 2008;22(12):2142-50.
46. Stary J, Gajdos P, Blazek B, Ptoszkova H, Mihal V, Pospisilova D, et al. Improved results in children with acute lymphoblastic leukemia treated with the ALL-BFM 90 protocol in the Czech Republic. Cas Lek Cesk. 2003;142(7):404-9.
47. Pastorczak AF, Fendler W, Zalewska-Szewckyk B, Gomiak P, Neiman M, Trelwska J, et al. Polish Pediatric Leukemia/Lymphoma Study Group. Asparagine synthetase (ASNS) gene polymorphim is associated with the outcome of childhood acute lymphoblastic leukemia affecting early response to treatment. Leuk Res. 2014 Feb;38(2):160-3.
48. Rives S, Estella J, Camos M, Garcia-Miguel P, Verdeguer A, Couselo JM, et al. T cell pediatric acute lymphoblastic leukemia. Analysis of survival and prognostic factors in four consecutive protocols of the spanish cooperative group (SHOP). Med. Clin (Barc). 2012 jul;139(4):141-9.
49. Talen G, Patel R, Mann G, Kaspers G, Niggl F, Karachuns A, et al. Long-term outcomes in children with relapsed acute lymphoblastic leukaemia after time-point and site of relapse stratification and intensified short courses of multidrug chemotherapy. Results of ALL-REZ BFM 90. J Clin Oncol. 2010;28(14):2339-47.
50. Klingebiel T, Cornish J, Labopin M, Locatelli F, Darbyshire P, Handgretinger R, et al. Results and factors influencing outcome after fully haploidentical hematopoietic stem cell transplantation in children with very high-risk acute lymphoblastic leukemia: impact of center size: an analysis on behalf of the Acute Leukemia and Pediatric Disease Working Parties of the European Blood and Marrow Transplant group. Blood. 2010 Apr 29;115(17):3437-46.
51. Maloney KW, Shuster JJ, Murphy S, Pullen J, Camitta BA. Long-term results of treatment studies for childhood acute lymphoblastic leukemia: Pediatric Oncology Group studies from 1986-1994. Leukemia. 2000 Dec;14(12):2276-85.
52. Tsuchida M, Ohara A, Manabe A, Kumagai M, Shimada H, Kikuchi A, et al. Long-term results of Tokyo Children's Cancer Study Group trials for childhood acute lymphoblastic leukemia, 1984-1999. Leukemia. 2010 Feb;24(2):383-96.
53. Pui CH, Pei D, Sandlund JT, Ribeiro RC, Rubnitz JE, Raimondi SC, et al. Long-term results of St Jude Total Therapy Studies 11, 12, 13A, 13B, and 14 for childhood acute lymphoblastic leukemia. Leukemia. 2010 Feb;24(2):371-82.
54. Stary J, Zimmermann M, Campbell M, Castillo L, Dibar E, Donska S, et al. Intensive Chemotherapy for Childhood Acute Lymphoblastic Leukemia: Results of the Randomized Intercontinental Trial ALL IC-BFM 2002. J Clin Oncol. 2014 Jan;32(3):174-85.
55. Kamps WA, van der Pal-de Bruin KM, Veerman AJ, Fiocco M, Bierings M, Pieters R. Long-term results of Dutch Childhood Oncology Group studies for children with acute lymphoblastic leukemia from 1984 to 2004. Leukemia. 2010 Feb;24(2):309-19.
Recibido: diciembre 19, 2014.
Aceptado: agosto 17, 2015.
Alejandro González Otero . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 8268. Email: rchematologia@infomed.sld.cu