Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.2 Ciudad de la Habana abr.-jun. 2016
ARTÍCULO DE REVISIÓN
Proteinuria en gammapatías monoclonales
Proteinuria in monoclonal gammopathies
Maydelin Miguel Morales, Olga M Agramonte Llanes
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
La presencia de proteínas en la orina se denomina proteinuria, en adultos se define clínicamente por una excreción urinaria de proteínas superior a 150 mg en 24 horas y se produce por una alteración en la barrera de filtración glomerular, que permite el escape de las proteínas en la orina. La proteinuria es frecuente en diferentes enfermedades, particularmente en las gammapatías monoclonales. Los criterios para el diagnóstico de estas entidades incluyen la presencia de células plasmáticas anormales en la médula ósea, una proteína monoclonal en suero aumentada, una proteína monoclonal en orina o lesiones osteolíticas. Para el diagnóstico, evaluación y monitoreo del tratamiento de las gammapatías monoclonales se realizan los estudios electroforéticos de proteínas plasmáticas o proteinogramas séricos y urinarios, técnica que permite la separación de proteínas en función de su migración diferencial al ser sometidas a un campo eléctrico.
Palabras clave: proteinuria, gammapatías, mieloma multiple, enfermedad renal.
ABSTRACT
The presence of protein in urine is called proteinuria in adults is clinically defined by a urinary excretion of more than 150 mg in 24 hours and proteins occurs by a change in the glomerular filtration barrier, which allows the escape of proteins in urine. Proteinuria is common in various diseases, particularly monoclonal gammopathies. The criteria for diagnosis of these entities include the presence of abnormal plasma cells in the bone marrow, a monoclonal protein increased serum, a monoclonal protein in urine or osteolytic lesions. For diagnosis, evaluation and treatment monitoring of monoclonal gammopathies, electrophoretic studies proteins plasma or serum and urinary proteinograms technique that allows separation of proteins based on their differential migration when subjected to an electric field is performed.
Keywords: proteinuria, gammopathy, multiple mieloma, renal disease.
INTRODUCCIÓN
La presencia de proteínas en la orina se denomina proteinuria, en adultos se define clínicamente por una excreción urinaria de proteínas superior a 150 mg en 24 horas. En los niños el criterio varía según la edad y el peso, de manera que en los neonatos (< 30 días) es de 145 mg/m2/24 horas; en los lactantes (hasta 1 año de edad) 110 mg/m2/24 horas y en niños (2 a 10 años), 85 mg/m2/24 horas. La proteinuria se produce por una alteración en la barrera de filtración glomerular, que permite el escape de las proteínas en la orina1.
En el mieloma múltiple (MM) la insuficiencia renal es un hecho frecuente; está presente en el 20-40 % de los casos al momento del diagnóstico y constituye un factor de mal pronóstico. Aunque también existen otros factores que contribuyen al fallo renal como son la hipercalcemia, los depósitos glomerulares, la hiperuricemia, las infecciones recurrentes y la infiltración ocasional del riñón por células del mieloma. Algunas de las complicaciones que favorecen la proteinuria son las lesiones osteolíticas, la amiloidosis, la deshidratación y el fallo renal 2-5.
Existen varios métodos diagnósticos para la detección del daño renal; el más simple, que actualmente sigue vigente y es aplicable en todos los laboratorios, es la microscopía donde se verifica la presencia patológica de todos los elementos del sedimento urinario como son: los hematíes, leucocitos, cilindros hialinos, céreos y los grasos, los que se consideran de muy mal pronóstico en la enfermedad renal. También existen métodos inmunológicos que son altamente sensibles para las determinaciones de proteínas, entre los que se encuentran la determinación de microalbuminuria y el método de Benedict e Imbert; las recién introducidas tiras reactivas (química seca) para lectura visual o con empleo de un reflectómetro y, como un indicador de mucho valor en el diagnóstico de las enfermedades renales, la medición cuantitativa de la proteinuria6. El examen de albúmina urinaria mide la cantidad de proteína en la orina y se utiliza como un marcador de lesión renal por lo que se ha convertido en uno de los datos más importantes para el nefrólogo. Sin embargo, enfermedades tan comunes como la hipertensión arterial y la diabetes mellitus frecuentemente manifiestan la afectación renal que provocan con la presencia de proteinuria7,8.
CLASIFICACIÓN DE LAS PROTEINURIA
La proteinuria puede ser transitoria o permanente; ortostática o de sobrecarga y monoclonal9. En los pacientes con daño renal la presencia de proteinuria se puede clasificar en diferentes tipos: fisiológica, tubular, glomerular y mixta. También se puede dividir en dos grandes grupos: la proteinuria aislada (no asociado a enfermedad renal o sistémica) y la proteinuria asociada que muestra evidencia de enfermedad renal o sistémica10.
Entre las proteinurias aisladas se incluyen entidades como:
- Proteinuria funcional, denominada así porque no existen defectos renales estructurales ni funcionales 11.
- Proteinuria transitoria idiopática, bastante frecuente en niños, adolescentes y adultos jóvenes. Representa la variedad más común de las proteinurias benignas.
- Proteinuria ortostática (postural) de la que existen dos variedades: la transitoria, que solo se hace evidente en ocasiones y probablemente corresponde a una proteinuria funcional y la persistente, que se presenta a lo largo de los años; generalmente mejora y desaparece con el crecimiento o durante la adolescencia12.
- Proteinuria aislada persistente que no guarda relación con la posición de pie o acostado, no presentan enfermedad asociada o alteraciones en las pruebas de función renal 13.
Proteinuria asociada
La proteinuria fisiológica es débil, en general inferior a 120 mg/24 horas. El 50 % de la proteinuria fisiológica corresponde a proteínas de origen plasmático, sobre todo albúmina (5-30 mg/día), mientras que la otra mitad corresponde a proteínas cuyo origen está en los túbulos y el tracto urinario, que corresponden en una gran proporción a la proteína de Tamm-Horsfall14,15 (Fig. 1A).
En la proteinuria tubular, generalmente no supera los 2 g/día, predominan las proteínas de bajo peso molecular que se diferencian mediante inmunoelectroforesis de proteínas en orina concentrada o análisis específicos para alguna de ellas como la ß2-microglobulina 16. La determinación de ß2-microglobulina es útil en la detección precoz de lesión renal en pacientes con sospecha de algunas dolencias, como la enfermedad de Wilson o cistinosis, con factores de riesgo como la exposición a metales pesados como plomo, cadmio, mercurio u otros tóxicos o como en la nefropatía de los Balcanes y en la de «hierbas chinas». Las tiras reactivas para proteinuria no detectan este tipo de proteínas16,17 (Fig. 1B).
La proteinuria glomerular es el resultado de un aumento de la permeabilidad de la pared capilar del glomérulo al paso de macromoléculas, como la albúmina17,18. La microalbuminuria se detecta temprano en los pacientes diabéticos y se puede usar como un marcador pronóstico de la nefropatía diabética en pacientes insulino-dependientes19. En los estudios de electroforesis esta proteinuria se caracteriza por la presencia solamente de la fracción de albúmina; la ausencia de proteína Bence Jones (BJ) indican una proteinuria glomerular selectiva (Fig. 1C) pero si en el carril del antisuero trivalente, donde están presentes las inmunoglobulinas G, A, M (GAM), se revela además una banda policlonal, es una proteinuria glomerular tipo no selectiva. La presencia de una reacción positiva con el antisuero antiαM indica el paso de moléculas de elevado peso molecular a través del glomérulo 20 (Fig. 1D).
La proteinuria mixta se caracteriza por la presencia simultánea de proteínas marcadoras de afectación renal tubular y glomerular, es decir reveladas por los antisueros anti-Tub y anti-Alb/αM, anti-Ig GAM y anticadenas ligeras κ y l 21 (Fig. 1E).
La proteinuria BJ pueden estar presentes en la orina como moléculas intactas, formas incompletas o fragmentos y diferentes polímeros de masa molecular variable y se caracteriza por la presencia de proteínas, que no son más que cadenas ligeras libres monoclonales (κ y l) de inmunoglobulinas o sus fragmentos, producidas en exceso y secretadas por células B derivadas de un clon que prolifera 21,22 .
La proteína de BJ son cadenas ligeras monoclonales (k y l) de las Ig o sus fragmentos, producidos o secretados por las células B derivadas de un clon que prolifera de forma anómala, puede ser demostrada en la orina en más del 80 % de los pacientes con MM y constituye en el 20 % de los casos el único componente monoclonal. La concentración de esta proteína excretada depende principalmente de la masa tumoral y de la función renal 23,24.
Proteinuria por sobrecarga filtrada
En situaciones en las que aumenta la concentración plasmática de una proteína de bajo peso molecular, su carga filtrada puede superar la capacidad de reabsorción del túbulo proximal para esa proteína y provocar una proteinuria específica. Esto puede ocurrir por producción anómala o excesiva23,24.
MÉTODOS DE LABORATORIO PARA DETERMINAR LA PROTEINURIA
Existen diferentes opciones para determinar o cuantificar la presencia de proteínas en la orina. Las tiras reactivas (dipstick) tienen la ventaja de ser un método rápido y barato; sin embargo, da muchos falsos positivos. Se basa en un método colorimétrico y da los resultados en rangos: negativo (0-10 mg/dL), trazas (10-20 mg/dL), + (30 mg/dL), ++ (100 mg/ dL), +++ (300 mg/dL) y ++++ (1000 mg/dL). Es bastante sensible para la albúmina, pero no detecta proteínas pequeñas como las macro y microglobulinas ni las proteínas de BJ9, 25,26.
Existe otro método, menos usado en la actualidad, que se basa en el uso del ácido sulfosalicílico (SSA). Es una prueba cualitativa basada en la turbidez comparada que es más sensible para proteínas de bajo peso y logra detectar niveles de proteínas desde 4 mg/dL 27.
La orina de 24 horas sigue siendo la prueba de oro para el estudio de la proteinuria. Se descarta la primera orina del día y se continúa la colecta hasta la primera del día siguiente. Tiene como ventaja la posibilidad de cuantificar la proteinuria total y también permite identificar cuáles proteínas se están secretando para clasificar la proteinurias y orientar en el posible mecanismo fisiopatológico 28.
En los últimos años se ha comenzado a utilizar más la relación proteinuria/creatinuria, con el fin de cuantificar la proteinuria en una muestra aislada. Se ha observado una buena correlación con la orina de 24 horas, lo que facilita la interpretación por ejemplo: una relación de 0.2 = 0.2 g proteínas /24 horas; 3.5 =3.5 g /24 horas. No se debe utilizar la primera muestra matutina para esta relación dado que los cambios en la tasa de filtración renal, por estar acostado mucho tiempo, podría dar un resultado mayor de lo real29.
Otro de los estudios más utilizados es la electroforesis de proteínas o proteinogramas en suero y orina, que permite la separación de proteínas en función de su migración diferencial al ser sometidas a un campo eléctrico. Con la técnica Hydragel Urine Profil (e) de Sebia, las proteínas urinarias y las inmunoglobulinas monoclonales, indicadoras de gammapatia, son detectadas mediante una electroforesis de proteínas seguida de inmunofijación usando anticuerpos, lo que permite la identificación de las proteínas y de las bandas monoclonales detectadas en la electroforesis. El resultado de este análisis identifica las fracciones proteicas o las bandas monoclonales y clasifica la proteinuria en fisiológica, tubular, glomerular, mixta y de BJ29,30.
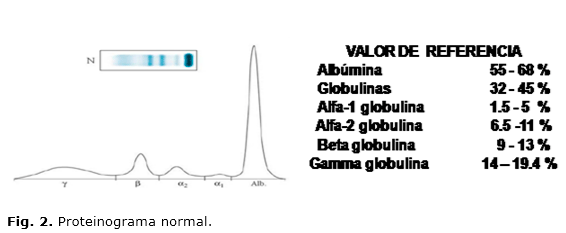
PROTEINOGRAMA SÉRICO Y URINARIO EN LA DETECCIÓN DE GAMMAPATÍAS MONOCLONALES
Es una representación gráfica de la distribución de las distintas fracciones de las proteínas plasmáticas, basada en su separación en función de su masa y carga, tras someterlas a un campo eléctrico. Esta representación densitométrica de las bandas obtenidas después de someter el suero a electroforesis es complementaria a la determinación de proteínas totales en suero31.
Fracciones del proteinograma (Fig. 2)
1. Fraccion de albúminas: Compuesta por 2 proteínas: albúmina sérica y prealbúmina
- Albúmina sérica es la banda mayoritaria del proteinograma (53-66 %). Sus valores normales son 2,7 g/100 mL en mujeres; 2,9 g/100 mL en neonatos y 6,1 g/100 mL en varones adultos. Su función es de transporte y mantenimiento de la presión oncótica del plasma, también es marcador del estado nutricional.
- Prealbúmina : es una glicoproteína sintetizada en el hígado con una baja concentración en el suero, 100 veces menor que la albúmina, con poca acción en el espectro de electroforesis y con una vida media de dos días, lo que la hace un indicador sensible de cambios que afectan su catabolismo y síntesis, es considerada como una proteína de transporte y constituye un marcador muy sensible en enfermedades hepáticas, en inflamaciones agudas y de actividad tumoral 32,33.
2. Fracción a-1. Contiene a-1-antitripsina, que es una reactante de fase aguda, tiene función antiproteasa y constituye el 90 % del total de la región a-1..
- a-1-glicoproteína ácida, llamada también factor orosomucoide, implicada en el proceso inflamatorio.
- a-1-fetoproteína, presente mayoritariamente en la circulación fetal; es útil en adultos como marcador de cáncer hepatocelular y tumores testiculares de células germinales.
- a-1-lipoproteína, proteína transportadora de lípidos que corresponde a la fracción HDL colesterol.
También migran en esta fracción la transcortina y la globulina fijadora de tiroxina.
En general, la fracción a-1 aumenta en procesos inflamatorios agudos, neoplasias, y cuadros de infarto y de necrosis34 .
3. Fracción a-2. Contiene la haptoglobina que transporta oxihemoglobina en el plasma y es una reactante de fase aguda.
- a-2-macroglobulina que forma complejos con proteasas e inhibe la lisis de compuestos proteicos de gran tamaño, tiene relación con el síndrome nefrótico.
- Ceruloplasmina, proteína transportadora de cobre e implicada en el metabolismo del hierro. Es una catalizadora de procesos oxidativos y reactante de fase aguda.
- a-2-lipoproteína corresponde a la fracción VLDL colesterol, tiene relación con el metabolismo de triglicéridos, sobre todo los de síntesis endógena35,36.
4. Fracción ß-1, contiene:
- Transferrina o siderofilina que es la proteína transportadora de hierro, aumenta en la deficiencia del mineral y se relaciona con el síndrome nefrótico y hepatitis agudas.
- Hemopexina que actúa ligando grupos hemo.
- ß-lipoproteína que corresponde con la fracción LDL-colesterol, transporta lípidos y se relaciona con el síndrome nefrótico y el hipotiroidismo.
- C4: factor del complemento es un reactante de fase aguda37.
5. Fracción ß-2, contiene
- Fibrinógeno que es un reactante de fase aguda y precursor de la formación del coágulo de fibrina. Su aparición en el proteinograma se evita, en gran medida, con el uso de suero en lugar de plasma.
- ß -2-microglobulina constituyente de cadena ligera de los antígenos de histocompatibilidad leucocitarios (HLA), es un marcador de insuficiencia renal y se relaciona con cuadros de amiloidosis.
- C3 es un factor del complemento y reactante de fase aguda.
- Fibronectina aumentada en síndrome nefrótico, colestasis, neoplasias y disminuida en politraumatismos, quemaduras, sepsis.
- ß-2-glicoproteína, cofactor desencadenante en el síndrome antifosfolípido.
- Lactógeno placentario, hormona placentaria con función estimuladora en la resistencia insulínica y la intolerancia a hidratos de carbono.
- SP-1-glicoproteína, glicoproteína específica del embarazo38,39.
6. Fracción g -1, contiene
- Inmunoglobulina A (IgA), inmunoglobulina que predomina en las secreciones mucosas y a veces migra a la fracción ß, cerca del fibrinógeno; al igual que éste puede migrar a la fracción g-1. Aumenta en procesos inflamatorios, cirrosis alcohólica, hepatitis, artritis, lupus eritematoso, tuberculosis y otras infecciones crónicas, fibrosis quística, enfermedad celiaca, cáncer gastrointestinal y gammapatia monoclonal IgA; en el MM, aunque de forma inespecífica, entre otras. La IgA aumenta Disminuye en la gammaglobulinemia IgA, en la inmunodeficiencia combinada severa, en la ataxia-telangiectasia, en inmunodeficiencias adquiridas, neoplasias malignas, con el uso de fármacos como quimioterapia o corticoides, y en la gastroenteropatía perdedora proteínas.
La IgA secretora es una variante especial de IgA que aumenta en fumadores, alcohólicos, cánceres orofaríngeos y de pulmón, procesos inflamatorios orales, infecciones bacterianas y disminuye en enfermedades senopulmonares, enfermedades autoinmunes como artritis reumatoide o lupus, fármacos, síndromes malabsortivos40-43.
7. Fracción g-2, contiene
- Inmunoglobulina M (IgM) que se ve aumentada en la macroglobulinemia de Waldeström, la artritis reumatoide, el lupus eritomatoso, la brucelosis, el linfosarcoma, la cirrosis biliar primaria, las enfermedades autoinmunes, la mononucleosis y otras enfermedades virales.
- Inmunoglobulina G (IgG) que aumenta en las infecciones crónicas, la hiperinmunización, la sarcoidosis, la fiebre reumática, la artritis reumatoide, la hepatitis crónica activa, la cirrosis, el MM IgG, el SIDA y disminuye en la hipogammaglobulinemia ligada al sexo, en la inmunodeficiencia combinada severa, en el síndrome nefrótico, en la gastroenteropatía perdedora de proteínas, en las pérdidas cutáneas, la amiloidosis, la preclampsia y las leucemias.
En múltiples ocasiones, es útil la determinación de subclases de IgG (IgG 1, 2, 3, 4) 44.
- Inmunoglobulina E (IgE), glicoproteína sintetizada en amígdalas, adenoides, ganglios linfáticos bronquiales y peritoneales, mucosa nasal, respiratoria y gastrointestinal. Se eleva en el síndrome hiperIgE, las parasitosis, la lepra, la aspergilosis broncopulmonar alérgica, el SIDA y disminuye en la ataxia telangiectasica, el déficit de IgE y la hipogammaglobulinemia45 .
Patrones de proteinograma alterado (Fig. 3)
Se observan en enfermedades en las que ocurre proliferación de un único clon de células B que produce una proteína anormal de tipo Ig homogénea formada por dos cadenas pesadas de una misma clase (G, A, M, D o E) y dos cadenas ligeras de una única clase (κ o l). Pueden observarse en:
- Gammapatia monoclonal: principal utilidad clínica del proteinograma como se verá más adelante.
- Reacción de fase aguda: caracterizada por aumento extremo de proteína C reactiva (PCR) y proteína S amiloide del suero (SAA) con aumento moderado de a-1-antitripsina, a-1-glicoproteína ácida, ferritina, IgG, complemento (C3 y C4) y ceruloplasmina; y disminución de albúmina y transferrina, lo que se traduce en aumento a nivel de a-1 y a-2, sin aumento en la fracción g.
- Inflamación crónica: caracterizada por aumentos a nivel de a-1, a-2 y g.
- Cirrosis o hepatopatía crónica: con aumento a nivel de a-2 y g que describen una curva continuada ascendente denominada solapamiento β-g.
- Bisalbuminemia: doble pico a nivel de la fracción de albúmina sin significación a nivel clínico.
- Síndrome nefrótico: caracterizado por un descenso a nivel de la fracción de albúmina y aumento a nivel de la fracción a-246,47.
GAMMAPATIAS MONOCLONALES (tabla)
Las gammapatías policlonales aparecen como bandas anchas y difusas que se localizan en la región g del proteinograma y se originan en enfermedades inflamatorias, infecciosas o reactivas. En cambio, las gammapatías monoclonales se reflejan como bandas estrechas o densas en la fracción b o g y casi nunca en la zona a (Fig. 3). En estos casos, para identificar la proteína anómala se trata el suero del paciente con anticuerpos específicos para cada una de las cadenas pesadas y ligeras. El nuevo patrón electroforético mostrará pérdida del pico correspondiente a la cadena sobreproducida 48,49.
Las gammapatías monoclonales pueden clasificarse en clínicamente activas (incluyen MM y sus variantes, enfermedades linfoproliferativas como la macroglobulinemia de Waldeström, leucemia linfoide crónica y linfoma no hodgkiniano; y otras enfermedades como la amiloidosis, la crioglobulinemias y las coagulopatías) y clínicamente silentes, como las gammapatías monoclonal de significado incierto o las gammapatías monoclonales transitorias como las que pueden ocurrir en infecciones víricas y en las reacciones de hipersensibilidad a drogas .49(Fig. 3 A,C).
La gammapatía monoclonal de significado incierto es la más frecuente de estas entidades que se detectan en el laboratorio. Su origen es desconocido y su prevalencia aumenta con la edad. Suele ser secundaria a hepatopatías víricas y enfermedades autoinmunes. Su pronóstico y evolución son inciertos. Si se produce la muerte, suele deberse a otras causas ajenas a la gammapatía. En algunas ocasiones, aunque limitadas, evolucionan a enfermedades malignas como MM, macroglobulinemia de Waldeström o amiloidosis. En otros casos desaparece espontáneamente.
Se caracteriza por presentar niveles de proteína monoclonal menores de 3 g/dL en el suero y menos del 10 % de células plasmáticas en la medula ósea sin anemia ni lesiones osteoliticas, albúmina sérica en valores normales, con pequeñas cantidades de proteína monoclonal en orina o sin ella. Estos pacientes deben seguirse todo el tiempo pues en la mayoría de los casos no hay evidencia de la progresión de la enfermedad50.
Mieloma múltiple : los criterios para su diagnóstico incluyen la presencia de al menos 10 % de células plasmáticas anormales en la medula ósea y de una proteína monoclonal en suero mayor 3 g/dL, una proteína monoclonal en orina o de lesiones osteolíticas. Los pacientes con MM deben diferenciarse de los pacientes con gammapatías de significado incierto. La presencia de proteína de BJ brinda información importante sobre el índice de masa tumoral y permite monitorear la enfermedad y diferenciar una gammapatía de significado incierto de las enfermedades con proliferación maligna de células plasmáticas51.
Existe también el MM quiescente, que se distingue por presentar una proteína monoclonal mayor de 3 g/dL y más del 10 % de células plasmáticas atípicas en la médula ósea. Frecuentemente tiene una pequeña cantidad de proteína monoclonal en la orina e inmunoglobulinas de valor reducido sin afectaciones en el suero. A pesar de estas características los pacientes no presentan anemia, insuficiencia renal ni lesiones osteoliticas; se mantienen estables durante la enfermedad y para usar tratamiento tienen que estar presentes hallazgos de laboratorio progresivos o que aparezcan síntomas de mieloma 52,53.
Existen otras variantes de mieloma como son el mieloma no secretor, el mieloma de inmunoglobulina D, el mieloma osteoclerótico, plasmocitoma solitario del hueso, plasmocitoma extramedular.
En el mieloma secretor hay ausencia de proteína monoclonal en suero y orina, hay menor afectación renal y mayor supervivencia que en el MM típico y se diferencia del mieloma de inmunoglobulina D donde se observa un pico monoclonal pequeño y la proteinuria BJ del tipo l es la más frecuente. Los plasmocitomas extracelulares, las leucemias plasmáticas y la amiloidosis son frecuentes en el mieloma tipo IgD y llevan el mismo tratamiento que el MM.
El mieloma osteoclerótico tiene como aspecto clínico importante una polinueropatia desmielinizante inflamatoria crónica con incapacidad motora. A diferencia del MM, presenta niveles de Hb normales, los trombocitos están presentes y al menos presenta 5 % de células plasmáticas en medula ósea y una proteína monoclonal l. Se caracteriza por la proliferación en médula ósea de células plasmáticas y sobreproducción de Ig monoclonal completa, que puede ser de tipo IgG, IgA, IgD o IgE (este último constituye el 1 % de los MM) o de cadenas ligeras, k o l. Su edad media de aparición es a partir de la sexta década de la vida. En el proteinograma se presenta como una banda compacta, estrecha de migración β, g o con menos frecuencia, a-2. Clínicamente hay dolores óseos y fracturas patológicas; en sangre, hipercalcemia e hiperproteinemia; en orina se presenta proteinuria de BJ y en médula ósea se observan más del 10 % de células plasmáticas54.
La principal lesión glomerular que se produce en el mieloma es la amiloidosis, que origina una pérdida masiva de proteínas y ocasiona un síndrome nefrótico. Esta proteinuria debe distinguirse de la proteinuria de BJ. La amiloidosis se produce en alrededor del 6-15 % de los pacientes con MM. En ellos, las cadenas ligeras eliminadas en orina tienen una capacidad "amiloidogénica", pueden precipitar en forma de fibrillas amiloides (amiloidosis AL) similar a los depósitos amiloides encontrados en la amiloidosis primaria. Sin embargo, se han descrito algunos casos de MM con depósitos mixtos de amiloide.
Las grandes cantidades de cadenas ligeras monoclonales filtradas por el glomérulo son las responsables de la lesión renal más típica de estos pacientes (riñón del mieloma), que se caracteriza por el depósito intratubular de grandes cilindros de cadenas ligeras, que ocasionan una atrofia de los túbulos y fibrosis intersticial. Esta tubulopatía sólo se produce cuando hay proteinuria de BJ y su gravedad se relaciona directamente con la excreción neta en orina de cadenas ligeras. La presencia de una gran cantidad de cadenas livianas monoclonales es causa relativamente común de proteinuria por sobrecarga; otras incluyen: la hemoglobinuria por anemia hemolítica, la mioglobinuria en la rabdomiolisis severa y la lisosimuria en la leucemia mielomonocítica55.
Macroglobulinemia de Waldeström: se caracteriza por proliferación de células plasmáticas anormales que invaden médula ósea, ganglios linfáticos y bazo. Hay sobreproducción de Ig monoclonal completa tipo IgM, k o l. Cursa con hiperviscosidad sanguínea y puede afectar a jóvenes, aunque suele darse más en varones mayores de 65 años. No presenta lesiones óseas y cursa con hepatomegalia, adenopatías, fenómenos hemorrágicos, neuropatías y trastornos visuales. En el laboratorio se encuentra anemia normocítica, normocrómica con hiperviscosidad sanguínea 56.
La diferenciación de las gammapatías monoclonales es compleja y la electroforesis de proteínas es una herramienta de gran utilidad para su diagnóstico y monitoreo. Hacer un uso correcto y racional de esta importante herramienta diagnóstica es una obligación de los profesionales de las ciencias médicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Dimopulos MA, Kastritis E, Rosnol L, Blade J, Ludwig H. Pathogenesis and treatment of renal failure in multiple myeloma. Leukemia. 2008;22:1485-93.
2. Pinney JH, Lachmann HJ, Bansi L, Wechalekar AD, Gilbertson JA, Rowczenio D, et al Outcome in renal AL amyloidosis after chemotherapy. J Clin Oncol. 2011; 29:674–81. doi: 10.1200/JCO.2010.30.5235.
3. García-Sanz R, Mateos MV, San Miguel JF. Mieloma múltiple. Med Clin (Barc). 2007; 129(3):104-15.
4. San Miguel J. Multiple myeloma: a model for scientific and clinical progress. Hematology Am Soc Hematol Educ Program. 2014 Dec 5;2014(1):1-7. doi: 10.1182/asheducation-2014.1.1.
5. Pallin DJ, Ronan C, Montazeri K, Wai K, Gold A, Parmar S, et al. Urinalysis in acute care of adults: pitfalls in testing and interpreting results. Open Forum Infect Dis. 2014 Jun 23;1(1):ofu019. doi: 10.1093/ofid/ofu019. eCollection 2014.
6. Hemmelgarn BR, Manns BJ, Lloyd A,Klarenbach S,Quinn RR, Wiebe N, et al. Relation between kidney function, proteinuria, and adverse outcomes. JAMA. 2010; 303: 423–9.
7. Hsu CY, Ordonez JD, Chertow GM, Fan D, McCulloch CE, Go AS, et al. The risk of acute renal failure in patients with chronic kidney disease. Kidney Int. 2008; 74:101–7.
8. Ulate G. Fisiología renal. San José: Editorial de la Universidad de Costa Rica. 2006.
9. Caridi G, Zoccali C. Pathogenesis of renal failure in hypertension. The role of genetic factors, low weight at birth and endothelial dysfunction. Recenti Prog Med. 2005 Apr;96(4):205-10.
10. Eravica R, Aabarkapa V, Ilinčić B, Sakač V, Mijović R, Nikolić S, et al. Plasma endothelin-1 level, measured glomerular filtration rate and effective renal plasma flow in diabetic nephropathy. BMC Nephrol 2015 Feb 17:1-6.
11. Mazzoni MB, Kottanatu L, Simonetti GD, Ragazzi M, Bianchetti MG, Fossali EF, et al. Renal vein obstruction and orthostatic proteinuria: a review. Nephrol Dial Transplant. 2011 Feb;26(2):562-5. doi: 10.1093/ndt/gfq444.
12. Lamb EJ, MacKenzie F, Stevens PE. How should Proteinuria be detected and measured? Ann Clin Biochem 2009; 46: 205–17.
13. Torffvit O, Melander O, Hulten U. Urinary excretion rate of Tamm- Horsfall protein is related to salt intake in humans. Nephron Physiol. 2004; 97: 31-36.
14. Devuyst O, Dahan K, Pirson Y. Tamm–Horsfall protein or uromodulin: new ideas about an old molecule. Nephrology dialysis transplantation. 2005 Jul; 20:1290-4.
15. Tryggvason K, Pettersson E. Causes and consequences of proteinuria: the kidney filtration barrier and progressive renal failure. J Intern Med. 2003; 254:216-24.
16. D’Amico G, Bazzi C. Pathophysiology of proteinuria. Kidney Int. 2003; 63: 809 -25.
17. Lambers HJ, Gansevoort RT, Brenner BM, Cooper ME, Parving HH, Shahinfar S, et al. Comparison of different measures of urinary protein excretion for prediction of renal events. J Am Soc Nephrol. 2010;21:1355-60.
18. Venkat K. Proteinuria and microalbuminuria in adults: Significance, evaluation and treatment. Southern Medical J. 2004; 97: 969 -78.
19. Joly D, Choukroun G, Combe C, Dussol B, Fauvel JP, Halimi JM, et al. Glycemic control according to glomerular filtration rate in patients with type 2 diabetes and overt nephropathy: A prospective observational study. Diabetes Res Clin Pract. 2015 Apr;108(1):120-7. doi: 10.1016/j.diabres.2015.01.029.
20. Graziani M, Merlini G, Petrini C. Guidelines for the analysis of Bence Jones protein. Clin Chem Lab Med 2003; 41(3): 338-46.
21. Yesil EE, Paker N, Yesil A, Kayatas K, Laleli Y, Ari E. Urinary gamma-glutamyl transferase-to-creatinine ratio as an indicator of tubular function in Bence Jones proteinuria. Ren Fail. 2014 Apr; 36(3):390-2. doi:10.3109/0886022X.2013.867784.
22. Katzmann JA, Abraham RS, Dispenzieri A, Lust JA, Kyle RA. Diagnostic performance of quantitative κ and λ free light Caín assays in clinical practice. Clin Chem. 2005; 51(5):878-81.
23. Garg AX, Kiberd BA, Clark WF, Haynes RB, Clase CM. Albuminuria and renal insufficiency prevalence guides population screening: Results from t he NHANES III. Kidney Int 2002; 61:2165-75.
24. Prakash J, Niwas SS, Parekh A, Vohra R, Wani IA, Sharma N, Usha Multiple myeloma--presenting as acute kidney injury. Assoc Physicians India. 2009 Jan; 57:23-6.
25. Zamora-Ortiz G, Velázquez-Sánchez-de-Cima S, Hernández-Reyes J, Martagón-Herrera NA, Ruiz-Argüelles A, Ruiz-Delgado GJ, et al. Poor performance of the total kappa/lambda light chain quantification in the diagnosis and follow-up of patients with multiple myeloma. Rev Invest Clin. 2014 Jul-Aug;66(4):314-8.
26. Camaré C, Caussé E. Urinary protein electrophoresis, which analysis to select? A simplified interpretation. Ann Biol Clin (Paris). 2013 Nov-Dec; 71(6):667-78. doi: 10.1684/abc.2013.0913.
27. Car J. Urinary tract infections in women: diagnosis and management in primary care. BMJ 2006; 332:94.
28. Nisell H, Trygg M, Back R. Urine albumin/creatinine for the assessment of albuminuria in pregnancy hypertension. Acta Obstet Gynecol Scand 2006;85:1327
29. Vassalotti JA, Stevens LA, Levey AS. Testing for chronic kidney disease: a position statement from the National Kidney Foundation. Am J Kidney Dis. 2007; 50:169-80.
30. Prakash J, Niwas SS, Parekh A, Vohra R, Wani IA, Sharma N, Usha. Multiple myeloma--presenting as acute kidney injury. J Assoc Physicians India. 2009 Jan;57:23-6.
31. Bergón E, Granados R, Fernández-Segoviano P, Miravalles E, Bergón M. Classification of renal proteinuria: a simple algorithm. Clin Chem Lab Med. 2002 Nov; 40(11):1143-50.
32. Vaidya VS, Ferguson MA, Bonventre JV. Biomarkers of Acute Kidney Injury. Ann Rev Pharmacol Toxicol. 2008; 48:463–93.
33. Iseki K. Proteinuria and the risk of developing end stage renal disease. Kidney Int. 2003; 63: 1468-74.
34. Hart P. Maximum reduction of proteinuria in renal disease. Kidney. 2004; 13:99 – 103.
35. Atkins RC, Briganti EM, Zimmet PZ, Chadban SJ. Association between albuminuria and proteinuria in the general population: the AusDiab Study. Nephrol Dial Transplant.2003;18:2170-4.
36. Garg AX, Kiberd BA, Clark WF, Haynes RB, Clase CM. Albuminuria and renal insufficiency prevalence guides population screening: Results from t he NHANES III. Kidney Int.2002;61:2165-75.
37. Stamatelopoulos K, Sibbing D, Rallidis LS, Georgiopoulos G, Stakos D, Braun S, Gatsiou A,et al. Amyloid-Beta (1-40) and the risk of death from cardiovascular causes in patients with coronary heart disease. J Am Coll Cardiol. 2015 Mar 10;65(9):904-16. doi: 10.1016/j.jacc.2014.12.035.
38. Car J. Urinary tract infections in women: diagnosis and management in primary care. BMJ. 2006;332:94.
39. Suvannasankha A, Chirgwin JM. Role of bone-anabolic agents in the treatment of breast cancer bone metastases. Breast Cancer Res. 2014 Dec 31;16(6):484.
40. Di Angelantonio E, Chowdhury R, Sarwar N, Aspelund T, Danesh J, Gudnason V. Chronic kidney disease and risk of major cardiovascular disease and non-vascular mortality: prospective population based cohort study. BMJ. 2010;341: c4986.
41. Hemmelgarn BR, Manns BJ, Lloyd A, James MT, Klarenbach S, Quinn RR, et al. Relation between kidney function, proteinuria, and adverse outcomes. JAMA. 2010;303:423-9.
42. Van der Velde M, Halbesma N, de Charro FT, Bakker SJL, de Zeeuw D, de Jong PE, et al. Screening for albuminuria identifies individuals at increased renal risk. J Am Soc Nephrol. 2009;20:852-62.
43. Rojas-Torres DS, Bastidas-Yaguana DK, Sierra-Santos L, Aguilar-Shea AL Importance of selective immunoglobulin A deficiency. Semergen. 2014 Apr;40(3):e65-8. doi: 10.1016/j.semerg.2013.01.013.
44. Wu M, Zhang F, Liang Y, Wang R, Chen Z, Lin J, et al. Isolation and purification of immunoglobulin G from bovine colostrums by hydrophobic charge-induction chromatography. J Dairy Sci. 2015 Mar 5. pii: S0022-0302(15)00156-3. doi: 10.3168/jds.2014-9142.
45. Choi JH, Jang YS, Oh JW, Kim CH, Hyun IG. Bee Pollen-Induced Anaphylaxis: A Case Report and Literature Review. Allergy Asthma Immunol Res. 2014 Oct 15.
46. Udla V, Pika T, Minařík J. The role of the assessment of heavy/light chain pairs of immunoglobulin in monoclonal gammopathies. Vnitr Lek. 2015 Jan;61(1):60-71.
48. Stelmach-Gołdyś A, Czarkowska-Paczek B. Monoclonal gammopathy of undetermined significance--potential risk factor of multiple myeloma Przegl Lek. 2012;69(5):194-6.
49. Leung N, Bridoux F, Hutchison CA, Nasr SH, Cockwell P, Fermand JP, et al. International Kidney and Monoclonal Gammopathy Research Group Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. Blood. 2012 Nov 22; 120(22):4292-5. doi: 10.1182/blood-2012-07-445304.
50. Faiman BM, Mangan P, Spong J, Tariman JD, The International Myeloma Foundation Nurse Leadership Board . Renal complications in multiple myeloma and related disorders: survivorship care plan of the International Myeloma Foundation Nurse Leadership Board. Clin J Oncol Nurs. 2011 Aug; 15 Suppl:66-76. doi: 10.1188/11
51. Mian M, Franz I, Wasle I, Herold M, Griesmacher A, Prokop W, et al "Idiopathic Bence-Jones proteinuria": a new characterization of an old entity. Ann Hematol. 2013 Sep;92(9):1263-70. doi: 10.1007/s00277-013-1739-8.
52. Todinova S, Krumova S, Radoeva R, Gartcheva L, Taneva SG Calorimetric markers of Bence Jones and nonsecretory multiple myeloma serum proteome. Anal Chem. 2014 Dec 16;86(24):12355-61. doi: 10.1021/ac503677d.
53. Kasi PM, Ansell SM, Gertz MA. Waldenstrom macroglobulinemia. Clin Adv Hematol Oncol. 2015 Jan;13(1):56-66.
54. Liu SJ,Zhai YP,Yu YP,Liu HN,Li F, Song P, et al. Significance of low molecular weight urinary protein for assessment of early renal damage in patients with multiple myeloma. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2013 Apr;21(2):410-4. doi: 10.7534/j.issn.1009-2137.2013.02.031.
55. Fermand JP, Bridoux F, Kyle RA, Kastritis E, Weiss BM, Cook MA, et al; International Kidney and Monoclonal Gammopathy Research Group How I treat monoclonal gammopathy of renal significance (MGRS). Blood.2013 Nov; 122(22):3583-90. doi: 10.1182/blood-2013-05-495929.
56. Zagouri F, Kastritis E, Symeonidis AS, Giannakoulas N, Katodritou E, Delimpasi S, et al. The Greek Myeloma Study Group. Immunoglobulin D myeloma: clinical features and outcome in the era of novel agents. Eur J Haematol. 2014 Apr;92(4):308-12. doi: 10.1111/ejh.12255.
Recibido: septiembre 23, 2015.
Aceptado: enero 15, 2016.
Lic. Maydelin Miguel Morales . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 8268
Email: rchematologia@infomed.sld.cu