Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.32 no.4 Ciudad de la Habana oct.-dic. 2016
ARTÍCULO ORIGINAL
Correlación entre morfología y citometría de flujo en la Leucemia Linfoide Aguda Infantil
Correlation between morphology and flow cytometry in Acute Lymphoblastic Leukemia (ALL)
Vianed Marsán Suárez I, Lázaro O del Valle Pérez I, Gabriela Díaz DomínguezI, Consuelo Macías Abraham I, Sergio Machín GarcíaI, Rosa María Lam DíazI, Orestes Cháguez Leyva II, César Valdés Sojo III, Martha B. García Caraballoso IV, María Josefa Plá del ToroV
I Instituto de Hematología e Inmunología. La Habana, Cuba.
II Hospital Pediátrico "Juan Manuel Márquez". La Habana, Cuba.
III Hospital Pediátrico Docente "Pepe Portilla". Pinar del Río, Cuba.
IV Hospital Pediátrico Universitario "José Luis Miranda". Villa Clara, Cuba.
V Hospital Pediátrico "Eduardo Agramonte Piña". Camagüey, Cuba.
RESUMEN
Introducción: La leucemia linfoide aguda (LLA) constituye del 75 al 80 % del total de leucemias agudas (LA) en la edad pediátrica.
Objetivo : Establecer la correspondencia entre los criterios morfológicos e inmunológicos por citometría de flujo (CMF), en un grupo de niños con diagnóstico de LA y pancitopenia grave.
Métodos: se realizó un estudio en niños con LA procedentes de varios servicios oncohematológicos del país, entre enero de 2008 y mayo de 2015. El inmunofenotipaje celular de la médula ósea se realizó por CMF.
Resultados: Del total de enfermos, 150 fueron LLA por CMF. En 111 (74 %) pacientes se diagnosticó LLA de fenotipo B y en 39 (26 %) LLA de fenotipo T. En 122 enfermos (81,3 %) hubo correspondencia entre la morfología linfoide de los blastos y el diagnóstico de LLA por CMF. En 28 pacientes no se encontró correspondencia entre el diagnóstico morfológico e inmunológico. En 26 de estos niños, la morfología no identificó el linaje celular leucémico y el diagnóstico de LLA se realizó exclusivamente por la CMF. En un paciente, donde la morfología de los blastos mostró características de precursores mieloides, la CMF evidenció la expresión de antígenos inmaduros de la línea linfoide y se concluyó como una LLA pro-B. En un paciente con pancitopenia grave, diagnosticó una LLA pre-T por CMF.
Conclusiones: Estos resultados demuestran que la CMF es una técnica altamente sensible y específica, no solo para definir el linaje celular leucémico sino, además, para identificar aquellos subtipos de LLA de difícil diagnóstico morfológico, lo que permite la instauración del tratamiento antileucémico específico.
Palabras clave: leucemia linfoide aguda; morfología; citometría de flujo.
ABSTRACT
Introduction: Acute lymphoblastic leukemia (ALL) is 75 to 80 % of all acute leukemias in childhood .
Objective: To stablish correspondance between morphologic and immnunologic, by flow cytometry (FCM), criteria in a group of children with acute leukemia (AL) and severe pancytopenia.
Methods: Between January 2008 and May 2015 a study with children with AL, from different Oncology and Hematological services of the country was carried out. The cell bone marrow immunophenotyping was performed FCM.
Results: O f these, 150 were ALL for FCM. B cell -ALL was diagnosed in 111 (74 %) patients, and T- ALL in 39 (26 %) with phenotype T -ALL. In 122 patients (81.3 %) there was correspondence between the morphology of lymphoid blasts and diagnosis of ALL, by FCM. In 28 patients no correlation between morphological and immune diagnosis was found. In 26 of these children, morphology did not identify the leukemic cell line and the diagnosis of ALL was performed exclusively by FCM. In a patient where the morphology of blasts showed features of myeloid precursors, the FCM showed expression of immature antigens of lymphoid precursors and concluded as a pro-B ALL. In a patient with severe pancytopenia, pre-T ALL was diagnosed by FCM.
Conclusions: These results demonstrate that CFM is a highly sensitive and specific technique, not only to define the leukemic cell line but also to identify those subtypes of difficult morphological diagnosis, allowing the introduction of specific anti-leukemic treatment.
Keywords : acute lymphoblastic leukemia; morphology; flow cytometry.
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) es la neoplasia más frecuente en la infancia, representa del 30 al 40 % de los tumores malignos en la edad pediátrica, tiene una incidencia global anual de 3 a 4 casos por cada 100 000 niños menores de 15 años, constituye de 75 a 80 % del total de leucemias agudas (LA) y es la segunda causa de muerte, en este periodo de la vida1-3.
El Grupo Franco-Americano-Británico (FAB) para el estudio de las leucemias agudas (LA), basa su clasificación en las características morfológicas de los blastos4. A través de las técnicas de inmunofenotipaje celular (IFC), la LLA se clasifica en distintos subtipos inmunológicos, que se basan en los modelos de diferenciación y maduración linfocitaria5.
La citometría de flujo (CMF) constituye una técnica de avanzada, automatizada y altamente sensible, muy útil para el estudio del inmunofenotipo de las células normales y tumorales. Esta ofrece una información simultánea de varios parámetros celulares, tales como: tamaño, granulosidad interna, expresión de antígenos de superficie y citoplasmáticos y coexpresión de marcadores aberrantes sobre el mismo blasto 6,7.
El objetivo de esta investigación fue evaluar la correspondencia entre los criterios morfológicos e inmunológicos por CMF, en un grupo de niños con diagnóstico de LA y pancitopenia grave.
MÉTODOS
Se estudiaron todos los pacientes pediátricos con LA procedentes de los diferentes servicios oncohematológicos del país, entre enero de 2008 y mayo de 2015. El IFC se desarrolló por la técnica de CMF, en el departamento de Inmunología del Instituto de Hematología e Inmunología, con el empleo de anticuerpos monoclonales (AcMo) dirigidos contra los antígenos de diferenciación linfoides y mieloides:
| Anticuerpos monoclonales | Fluorocromos | Clones |
| Anti- CD2 | Isotiocianato de flouresceína (FITC)* | MT910 |
| Anti- CD3 | Ficoeritrina (PE)* | UCHT1 |
| Anti- CD5 | PE* | DK23 |
| Anti- CD7 | FITC* | CBC.37 |
| Anti- CD4/CD8 | FITC/PE* | Multi MixTM |
| Anti- CD10/CD19 | FITC/PE* | Multi MixTM |
| Anti- CD20 | PE* | B- Ly1 |
| Anti- CD79a | FITC* | SN8 |
| Anti- CD13 | PE* | WM- 47 |
| Anti- CD14 | FITC* | TÜK4 |
| Anti- CD15 | FITC* | C3D- 1 |
| Anti- CD33 | FITC* | WM- 54 |
| Anti- CD34 | PE* | BIRMA- K3 |
| Anti- CD38 | FITC* | AT13/5 |
| Anti- CD45 | Aloficocianina (APC)* | T29/33 |
| Anti- CD117 | PE* | 104D2 |
| Anti- HLA-DR | PE* | AB3 |
| Anti- mieloperoxidasa (MPO) | FITC* | - 7 |
*: DAKO, **: Beckman Coulter.
En todos los casos, los AcMo conjugados directamente a los fluorocromos: FITC, PE y APC, fueron previamente titulados. Se utilizó la dilución óptima de fluorescencia del reconocimiento de la reacción antígeno-anticuerpo, no solo con fines económicos sino, también, para evitar la sobresaturación del antígeno.
Para determinar la cantidad en µL de médula ósea (MO) a utilizar para cada determinación antigénica, se utilizó la siguiente fórmula:
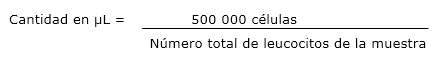
Las muestras se incubaron durante 20 a 30 min, protegidas de luz y a temperatura ambiente. Para la detección de los antígenos intracitoplasmáticos (CD3, CD79a y MPO), se empleó previamente 250 µL del reactivo permeabilizador-estabilizador BD Cytofix/Cytoperm TM, el cual se incubó por 30 min, a temperatura ambiente. El lisado de los hematíes se llevó a cabo con cloruro de amonio, durante 10 min, a temperatura ambiente. Posteriormente, las células fueron lavadas en dos ocasiones con cloruro de sodio al 0,9 % y centrifugadas durante 10 min a 1 500 rpm. Las células se fijaron con 300 μL de formaldehido a 1 % para conservar su viabilidad y luego, fueron guardadas a 4oC hasta ser leídas en un citómetro GALLIOS, Beckman Coulter.
Los datos obtenidos se analizaron con el empleo del programa informático Kaluza, versión 1.2.
Se consideró positivo, si el porcentaje fue igual o mayor que el 20 % de los blastos que expresaron el antígeno en la membrana celular e igual o mayor que el 10 %, para los antígenos intracitoplasmáticos.
Las LLA se clasificaron inmunológicamente, según los criterios del Grupo EGIL 8 basados en los diferentes marcadores antigénicos expresados sobre los blastos. Se excluyeron los enfermos con diagnóstico morfológico de LLA y que por CMF se concluyeron como leucemias agudas híbridas.
Como medidas de resumen para las variables cualitativas se utilizaron las frecuencias absolutas y los porcentajes. Para validar los resultados en términos de significación estadística se utilizó un nivel de confianza de 95 % y se consideró significativo todo valor de p < 0,05.
RESULTADOS
Del total de pacientes estudiados, 89 (59,3 %) fueron del sexo masculino y 61 (40,7 %) del femenino, con un promedio de edad de 7,3 años y un rango de 2 meses a 18 años. Del total de LA, 150 fueron diagnosticadas como LLA por CMF. De estas, 111 (74 %) de fenotipo B y 39 (26 %) de fenotipo T. La variedad B común predominó (51,3 %) en relación con el resto de los subtipos inmunológicos. Los enfermos con LLA-T temprana (pro-T y pre-T) prevalecieron sobre aquellos con la variedad T madura.
En la tabla se muestra la correspondencia entre los diagnósticos morfológico e inmunológico por CMF de los pacientes estudiados.
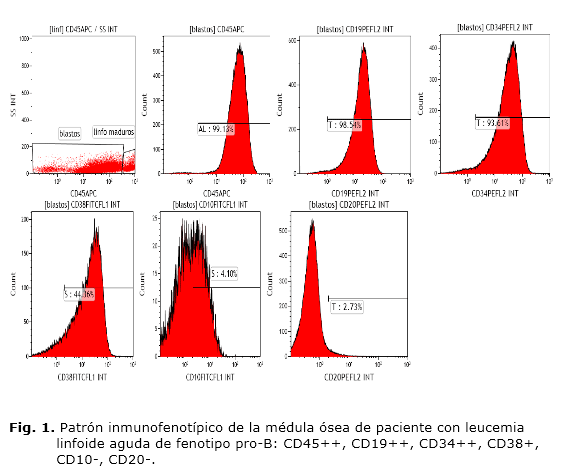
En 122 enfermos (81,3 %) hubo correspondencia entre la morfología linfoide de los blastos y el diagnóstico inmunológico de LLA por CMF. De estos, 63 (51,6 %) presentaron un fenotipo B común. En 28 pacientes no se encontró correspondencia entre el diagnóstico morfológico y el inmunológico. En 26 de estos niños, la morfología no identificó el linaje celular leucémico y el diagnóstico de LLA se realizó exclusivamente por la CMF. En este grupo de enfermos, también predominó la variedad B común (53,8 %). En el paciente donde la morfología de los blastos mostró características de precursores mieloides, la CMF evidenció la expresión de antígenos inmaduros de la línea linfoide y se concluyó como una LLA pro-B (figura 1).
En el paciente con pancitopenia grave, el aspirado medular tan escaso no permitió a la morfología convencional dar una definición precisa del linaje de la LA. En este caso, la CMF diagnosticó una LLA pre-T (figura 2), diagnóstico que fue corroborado por inmunohistoquímica, a partir de la biopsia medular.
DISCUSIÓN
El diagnóstico inmunológico por CMF de las LA es primordial para confirmar el diagnóstico morfológico, definir el estado de maduración celular leucémico y clasificar a la LLA, en distintos subtipos inmunológicos9,10.
En este estudio, los pacientes presentaron una distribución por edad y sexo similar a lo que muestran otros investigadores11-13.
La LLA de fenotipo B fue más frecuente que la de fenotipo T, similar a lo que describen otros grupos de trabajo. La LLA-B común predominó sobre el resto de las variedades inmunológicas de la LLA en el niño, este subtipo inmunológico pudiera resultar de una respuesta anómala a una infección habitual, probablemente viral, que ocurre tardíamente en la infancia en los países más desarrollados 14 -16.
La LLA-T se comportó de forma similar a la de países desarrollados y menor que, en India, Egipto, África ecuatorial y niños mapuches chilenos, lo que se pudiera explicar por la precocidad y recurrencia de las infecciones en la infancia en los países menos desarrollados, debido al hacinamiento y a una menor protección por vacunas que estimulan la inmunidad17,18.
En la mayoría de los pacientes (81,3 %), se encontró una correspondencia entre la morfología linfoide de los blastos y el diagnóstico inmunológico por CMF de LLA, lo cual coincide con otros autores19-21. Sin embargo, en 26 niños con LA las técnicas morfológicas convencionales no permitieron definir el linaje celular leucémico, el cual solo pudo precisarse por la CMF.
En el paciente con diagnóstico morfológico de LANL, se concluyó por CMF como una LLA de fenotipo pro-B. Esta variedad anteriormente denominada nula, predomina en menores de un año de edad y en ella la trasformación leucémica ocurre en el primer estadio de diferenciación linfoide B11,17. En el 5 al 40 % de los enfermos con este subtipo inmunológico, los blastos pueden expresar además, antígenos mieloides fundamentalmente, CD15 y CD65, lo cual pudiera explicar su apariencia mieloide 22,23.
Algunos investigadores reportan que entre 8 y el 12 % de las LLA se presentan con pancitopenia y alrededor de 2 % con una MO hipocelular, lo cual dificulta su diagnóstico por morfología y, en algunos enfermos, puede erróneamente diagnosticarse una anemia aplásica 24-27. En este estudio, se diagnosticó por CMF una LLA pre-T en un paciente que debutó con pancitopenia grave.
Villareal y cols, reportan dos enfermos con pancitopenia que desarrollaron una LLA de fenotipo B, seis meses después24. Ambos pacientes tuvieron en común infecciones virales y bacterianas previio a la pancitopenia, con recuperación espontánea o inducida por tranfusión y, posteriormente, una linfoproliferación monoclonal.
Raja y cols demostraron en 22 pacientes pediátricos con pancitopenia, que la CMF tiene una sensibilidad y especificidad del 100 %, respectivamente en el diagnóstico de la LLA27. La mayoría de estos pacientes presentaron fenotipos de LLA B común y pre-B, asociados con un gran número de anormalidades citogenéticas, tales como: t(4;11), t(9;22) y amplificación intracromosomal del cromosoma 21. Estos autores, refieren que el proceso de leucemogénesis pudiera ser explicado por la asociación de varios factores implicados, tales como: una posible disrupción clonal con un estado preleucémico real, coexistencia de infección viral o bacteriana, incremento en las concentraciones de corticoesteroides endógenos, exposición a toxinas exógenas y finalmente, proliferación linfoblástica no controlada. En estos enfermos, la recuperación espontánea de la MO aplásica, pudiera ser parte de la historia natural de presentación de la LLA o un pródromo de esta.
Los resultados obtenidos en esta investigación demostraron que la CMF es una técnica altamente sensible y específica, no solo para definir el linaje celular leucémico, clasificar a la LLA en distintas variedades inmunológicas sino, además, para identificar aquellos subtipos de difícil diagnóstico morfológico, particularmente, en enfermos con pancitopenia grave, como una forma más de presentación de la enfermedad.
REFERENCIAS BIBLIOGRÁFICAS
1. Lassaletta A. Leucemias. Leucemia linfoblástica aguda. Pediatr Integral. 2012;16:453-62.
2. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2012;61:69-90.
3. Khoury MJ, Lam TK, Loannidis JP, Hartge P,Spitz MR, Buring JE, et al. Transforming epidemiology for 21st century medicine and public health. Cancer Epidemiol Biomarkers Prev. 2013;22(4):508-16.
4. Benett JM, Catovski D, Daniel MT. French-American-British (FAB) Cooperative Group: The morphological classification of Acute Lymphoblastic Leukemia. Concordance among observes and clinical correlations. Br J Haematol. 1981;47:553.
5. Nadler LM, Korsmeyer SJ, Anderson KC, Boyd AW, Slaughenhoupt B, Park E, et al. B cell origin of non-T cell acute lymphoblastic leukemia. J Br Clin Invest. 1984;74:332-40.
6. Van Dongen JJ, Lhermitte L, Botteher S. Euro Flow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leucocytes. Leukemia. 2012;26:1908-75.
7. Tario J, Wallace P. Reagent and cell staining for immunophenotyping by flow cytometry. In: McManus L, Mitchell R, editors. Pathobiology of Human Diseases. San Diego: Elsevier;2014. p.3678-3701.
8. Bene MC, Castoldi G, Knapp W, Ludwig WD, Matutes E, Orfao A, et al. Proposals for the immunological classification of acute leukemias. Leukemia. 1995;9:1783-6.
9. Bagwell C. A new paradigm for cytometric analysis. In: Kottke-Marchant K, Davis BH, eds. Laboratory Hematology Practice. Oxford: Wiley-Blackwell Publishing Ltd; 2012.
10. Kalina T, Flores-Montero J, van der Velden VH, Martin-Ayuso M, Bottcher S, Ritgen N, et al. Euro Flow standardization of flow cytometer instrument settings and immunophenotyping protocols. Leukemia. 2012;26:1986-2010.
11. Soriano I. Vásquez E, Niquén S, Fernández M, Castañeda K, Fernández J. Caracterización inmunofenotípica de leucemias agudas diagnosticadas en un Hospital Nivel III en el periodo 2010-2013, Chiclayo-Perú. Rev Cuerpo Méd HNAAA. 2015;8(1):5-9.
12. Pui CH, Yang JJ, Hungrer SP, Pieters R, Schrappe M, Biondi A, et al. Childhood Acute Lymphoblastic Leukemia: Progress Through Collaboration. J Clin Oncol. 2015;33(27):2938-48.
13. Hunger SP, Mullighan CG. Acute Lymphoblastic Leukemia in Children. N Engl J Med. 2015;15;373(16):1541-52.
14. González W, Olarte I, Gutiérrez M, Montaño E, Martínez C, Ramos C. Frecuencia de leucemias agudas en un hospital de referencia. Rev Med Inst Mex Seguro Soc. 2012;50(2):167-71.
15. Lustosa de Sousa DW, de Almeida FV, Cavalcanti FH, de Oliveira MV. Acute lymphoblastic leukemia in children and adolescents: prognostic factors and analysis of survival. Res Bras Hematol Hemoter. 2015;37(4):223-9.
16. Zheng YH, Yin YF, Xu RY, Zhou YZ, Huang YQ. Analysis of Immunophenotypes in 329 Patients with B-ALL at Different Ages. Zhonqquo Shi Yan Xue Ye Xue Za Zhi. 2015;23(5):1225-30.
17. Cabrera ME, Labra SG, Ugarte SU, Matutes E, Greaves MF. Inmunofenotipo, características clínicas y laboratorio de la leucemia linfoblástica aguda en Chile. Estudio de 500 niños y 131 adultos. Rev Med Chile. 1996; 124: 293-9.
18. Dorantes E, Medina A, Dávila K, López B. Clasificación inmunológica de las leucemias agudas linfoblásticas del Hospital Infantil de México Federico Gómez, de acuerdo al EGIL (European Group for the Immunological Classification of Leukemia). Gac Mexicana Oncol.2013;12(3):136-42.
19. van Lochem EG, van der Velden VH, Wind HK, Marvelde JG, Westerdaal NA, van Craig FE, et al. Flow cytometric immunophenotyping for hematologic neoplasms. Blood. 2008;111:3941- 67.
20. Craig F, Foon K. Flow cytometric immunophenotyping for hematologic neoplasms. Blood. 2008;111(8):3941-67.
21. Hedley B, Keeney M. Technical issues: flow cytometry and rare event analysis. Int J Lab Hem. 2013;35:344-50.
22. Novoa V, Núñez NA, Carballo OG, Lessa CF. Aberrant immunophenotypes in acute leukemia in a Buenos Aires' hospital population. Medicina (B Aires). 2013;73(1):9-16.
23. Gupta A, Goyal M, Nidamanuri KR, Dattatreya PS. Your dilemma, my identity: unusual immunogenetic profiles of pediatric B cell acute lymphoblastic leukemia. Indian J Pathol Microbiol. 2014;57(1):78-80.
24. Villarreal L, Jaime JC, Rodríguez M, González O, Gómez D. Acute lymphoblastic leukemia of childhood presenting as aplastic anemia: report of two cases. Rev Bras Hematol Hemoter. 2012;34(2):165-7.
25. Kulkami KP, Marwaha RK. Acute lymphoblastic leukemia with pancytopenia at presentation: Clinical correlates, prognostic impact, and association with survival. J Pediatr Hematol Oncol. 2013;35:573-6.
26. Zeb J, Zahid B, Ahmad S, Gul Z. Pancytopenia in children: A 6-year spectrum of patients admitted to Pediatr Department of Rehman Medical Institute, Peshawar. Park J Med Sci. 2013;291153-7.
27. Raja S, Renjitha F, Xavier J, Latha MS, Rajenderan A, Ethican A. Pancytopenia. An obstacle in the diagnosis and outcome of pediatric acute lymphoblastic leukemia. South Asian J Cancer. 2015;4(2):68-71.
Recibido: diciembre 19, 2015.
Aceptado: mayo 26, 2016.
Dra. Vianed Marsán Suárez . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, Cuba.Tel (537) 643 8695, 8268. Email: rchematologia@infomed.sld.cu