Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Hematología, Inmunología y Hemoterapia
versión impresa ISSN 0864-0289versión On-line ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.34 no.4 Ciudad de la Habana oct.-dic. 2018
ARTÍCULO DE REVISIÓN
Sobrecarga de hierro: complicación frecuente del trasplante de progenitores hematopoyéticos
Iron Overload: frequent complication of hematopoietic stem cell transplantation
Mariela Forrellat Barrios
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
La sobrecarga de hierro es común en pacientes receptores de trasplante de progenitores hematopoyéticos. En estos pacientes, la ferritina y la saturación de transferrina, pre- y postrasplante, están aumentadas debido a las frecuentes transfusiones de sangre. Además, la sobrecarga de hierro postrasplante puede relacionarse con otras complicaciones como las infecciones, las mucositis y la enfermedad injerto contra hospedero. Una ferritina elevada antes del trasplante alogénico es un factor de mal pronóstico para la sobrevida y la mortalidad no relacionada. Para el monitoreo y diagnóstico de la sobrecarga de hierro se cuenta con diversa herramientas entre las que la ferritina continúa siendo una de las más utilizadas.
Palabras clave: sobrecarga de hierro, trasplante de progenitores hematopoyético, ferritina.
ABSTRACT
Iron overload is common in hematopietic stem cell transplantation (HSCT) recipients. In these patients, pre- and early post-transplant ferritin and transferrin saturation were found to be highly elevated due to high transfusion requirements. In addition to that, post-HSCT iron overload may be related to other complications such as infections, mucositis, and acute graft-versus-host disease. An elevated ferritin level before allogeneic HSCT is an adverse prognostic factor for overall and nonrelapse mortality. There are several diagnostic tools for iron overload but ferritinis still one of the most used.
Keywords: iron overload, hematopoietic stem cell transplantation, ferritin.
INTRODUCCIÓN
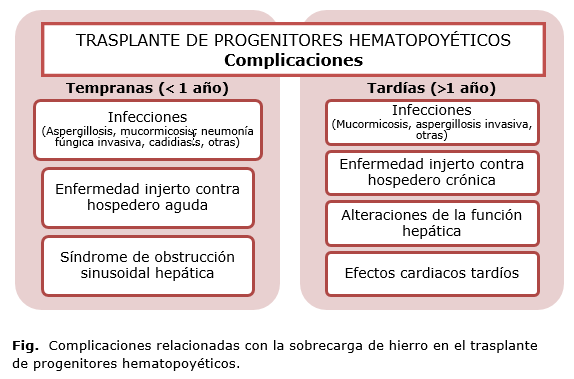
El trasplante de progenitores hematopoyéticos (TPH) es un proceder terapéutico bien establecido fundamentalmente para enfermedades hematológicas; sin embargo, su mortalidad y morbilidad son aún elevadas, a pesar de los avances en los regímenes de acondicionamiento y el manejo de las infecciones. El espectro de complicaciones de este proceder es extremadamente amplio y abarca desde las infecciones y las mucositis, las más frecuentes y tempranas; hasta complicaciones graves que afectan a todo el organismo, así como la aparición de malignidades secundarias (Fig.). 1-3
Sobrecarga de hierro y complicaciones del trasplante de progenitoreshematopoyéticos
La sobrecarga de hierro (SH) es muy común en pacientes con hemopatías malignas receptores de TPH. Su incidencia es aproximadamente del 34 % en el TPH autólogo y entre 30 y 60 % en el alogénico.4-6 Su principal causa son las transfusiones de sangre durante el tratamiento de la enfermedad de base y en el periodo peritrasplante. Adicionalmente, la prolongada diseritropoyesis, el aumento de la absorción de hierro debido a la mucositis asociada a la quimioterapia y la liberación de hierro de los tejidos dañados aumentan el hierro a niveles no deseados.3,6 El daño asociado a la quimio y radioterapia también pueden contribuir a la liberación de las reservas del mineral y a disminuir las síntesis de transferrina. 1,3
En modelos animales de TPH se detectó SH con el incremento de la toxicidad debido a interacciones fármacodinámicas del melfalán y busulfán.7 En un estudio reciente se demostraron efectos interactivos de la irradiación corporal total y el trasplante de células en la expresión de genes que contribuyen a la SH.8
Se han realizado diversos estudios para evaluar la relación de la SH, determinada a través de los niveles de ferritina sérica (FS), y el TPH. El análisis retrospectivo del impacto de los altos niveles pretrasplantede FS en pacientes sometidos a TPH mieloablativo, mostró fuerte correlación entre los niveles de esta y la supervivencia global y libre de eventos a los 5 años. 9
En un análisis multivariado para evaluar el efecto de la hiperferritinemia en el TPH alogénico en pacientes con linfoma, se encontró una menor supervivencia global y mayor riego de mortalidad no relacionada.10
La evaluación de la hiperferritinemia en pacientes con linfoma de Hodgkin y no Hodgkin sometidos a TPH autólogo mostró que los niveles de FS pretrasplante >685 ng/mL se asocian con supervivencia global y libre de eventos significativamente menores y al incremento de las recaídas y de la mortalidad relacionada.11 En un metanálisis, la SH pretrasplante fue relacionada con una pobre sobrevida global y con elevada incidencia de mortalidad.12 Además se ha demostrado una relación significativa de la sobrevida global con los niveles de ferritina al día 30 y un año después del TPH.13
El estudio del impacto de la SH postrasplante en pacientes con TPH alogénico mieloablativo evidenció que la FS y la saturación de transferrina (ST) estaban elevadas antes yque luego aumentaban en los primeros meses, como resultado de los altos requerimientos transfusionales. El hierro plasmático fue variable, dependiente de la ingesta alimentaria y la hora del día. Después del pico en los tres primeros meses post-TPH, lo niveles de FS disminuyeron gradualmente. La hiperferritinemia tuvo un efecto negativo en la supervivencia en todos los periodos y no tuvo relación con los requerimientos transfusionales o la enfermedad injerto contra hospedero (EICH).14
Por otro lado, al evaluar prospectivamente el efecto de los parámetros del hierro sérico así como los depósitos hepáticos y cardiacos del mineral en pacientes que recibieron TPH alogénico mieloablativo, no se encontró aumento significativo en los niveles de FS y el contenido de hierro hepático y cardiaco en los 12 meses después del TPH. La FS pretrasplante (como reflejo del contenido de hierro en hígado) no mostró estar relacionada con el incremento de la mortalidad, recaídas o EICH.15
La SH post-TPH está asociada con las infecciones, hepatitis, síndrome de obstrucción sinusoidal, mucositis, disfunción hepática y EICH aguda.1, 3 La acumulación de Fe puede causar aumento del crecimiento y virulencia de las especias de Aspergillosis. Se ha demostrado asociación de la SH con la mucormicosis en receptores de TPH alogénico y se ha sugerido que valores de FS pre-TPH muy elevados (usualmente por encima de 1550 ng/mL) se asocian con neumonía fúngica invasiva en receptores TPH alogénico. Además, se detectó riesgo incrementado de candidiasis hepatoesplénica en pacientes con FS pretrasplante elevada. También se han observado otras infecciones bacterianas en receptores de TPH con SH.1,6, 16-18
A partir del estudio de la disfunción hepática en pacientes sometidos a TPH alogénico, con biopsias pre y post-TPH se sugirió que la hepatotoxicidad inducida por hierro es multifactorial y combina el estrés oxidativo y la modulación de la expresión de genes en los macrófagos hepáticos. Las especies reactivas del oxígeno (ERO) generadas por el hierro y la peroxidación de los lípidos de las membranas también pueden causar daños celular.19,20
Los datos para determinar la relación de la SH con la patogénesis de la EICH son controversiales y requieren ser confirmados por otros estudios. Se ha sugerido que la EICH aguda es más común en pacientes con altos niveles de FS(>1000 ng/mL), con un evento de inicio de patogénesis definido como exposición de antígenos seguido del incremento del daños tisular mediado por ERO.1 Otros investigadores demostraron la disminución de la incidencia de EICH crónica asociada con niveles de FS preTPH superiores a 1910 ng/mL en pacientes con TPH alogénico mieloablativo. En otros estudios no encontraron relación entre los niveles de FS y la EICH aguda/crónica.21,22
A pesar de los avances en los tratamientos y técnicas de soporte que han incrementado la supervivencia de los receptores de TPH, la SH es aun un reto y puede estar asociada con fibrosis hepática, fallo cardiaco, hipogonadismo, diabetes y endocrinopatías, conocida como "diabetes broncínea" en receptores de TPH como complicaciones a largo plazo. 23
Diagnóstico de la sobrecarga de hierro
Las guías de los grupos internacionales de TPH promueven el monitoreo los niveles de ferritina en el periodo postrasplante para determinar el riesgo de SH.24 Generalmente, el punto de corte para la FS aceptado es 1000 ng/mL para la detección de SH.25 Se recomienda que los pacientes con pruebas de función hepática elevadas, altos requerimientos transfusionales y hepatitis C, deben ser monitoreados subsecuentemente hasta que los niveles de ferritina estén por debajo 500 ng/mL.1
El nivel de FS es el soporte principal para la evaluación clínica de la SH y los macrófagos y las células T son la fuente principal de ferritina. Las transfusiones y las reacciones inflamatorias pueden acompañar altos niveles de FS. Adicionalmente, la inflamación, la eritropoyesis inefectiva y la enfermedad hepática pueden también estar asociadas con altos niveles de FS.1,3
Diversas hipótesis apuntaban a que las concentraciones elevadas de FS podrían estar relacionadas con la EICH-asociada a inflamación en pacientes pediátricos, pero las investigaciones concluyeron que la FS no es un buen biomarcador de la EICH aguda o crónica.26 De hecho, los niveles de FS parecen tener pobre correlación con la concentración hepática de hierro en niños con talasemia y drepanocitosis.27
La FS puede ser una buena prueba de monitoreo pero un pobre predictor de SH tisular por lo que se recomienda estimar el hierro hepático antes de iniciar cualquier medida quelante.5 Está reportado que la ferritina en combinación con la ST tiene un valor pronóstico superior para determinar la SH. 5,23
Un marcador alternativo para determinar la SH es el hierro no unido a la transferrina (NTBI), que es una forma de hierro de bajo peso molecular que aparece cuando la transferrina está saturada y es incapaz de unir el exceso del mineral.28
Los estudios para evaluar la prevalencia de SH en adultos con TPH alogénico por FS y NTBI, mostraron que ambos marcadores correlacionaron bien, pero el NTBI resultó ser un marcador más débil que la ferritina en términos de detección de SH. Ello se debe a que NTBI solo se refiere al hierro en el plasma unido a otros ligandos diferentes de la transferrina; sin embargo, la FS correlaciona con el número de concentrado de eritrocitos recibidos en pacientes sin infección activa, recaída o segunda neoplasias.29
A pesar de que la biopsia hepática es el estándar de oro para evaluar la SH; 25 su uso es limitado en los pacientes con TPH por ser un proceder invasivo no aplicable a pacientes con bajos conteos de plaquetas, como es el caso de los pacientes trasplantados. Por ello ha ganado importancia la medición de la concentración de hierro hepático por resonancia magnética puesto que es no invasiva, rápida y disponible.26
En conclusión, la SH es una complicación común y su posibilidad puede ser considerada en todos los receptores de TPH. Para su monitoreo y diagnóstico se cuenta con diversa herramientas (tabla) entre las que la FS continúa siendo una de las más utilizadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Atilla E, Toprak SK, Demirer T. Iron Overload in Hematopoietic Stem Cell Transplantation. Turk J Hematol 2017;34:1-9. DOI: 10.4274/tjh.2016.0450
2. Jagasia MH, Greinix HT, Arora M, Williams KM, Wolff D, Cowen EW, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versusHost Disease: I. The 2014 Diagnosis and Staging Working Group report. Biol Blood Marrow Transplant 2015;2:389-401.
3. Sirvent A, AuquierP, Oudin C, Bertrand Y, Bohrer S, Chastagner P, et al. Prevalence and risk factors of iron overload afterhematopoietic stem cell transplantation for childhood acute leukemia: a LEA study. Bone Marrow Transplant. 2017 Jan;52(1):80-7. DOI:10.1038/bmt.2016.205.
4. Majhail NS, DeFor TE, Lazarus HM, Burns LJ. Iron-overload after autologoushematopoietic cell transplantation. Leuk Res. 2009;33:578-9.
5. Majhail NS, DeFor T, Lazarus HM, Burns LJ. High prevalence of iron overload in adult allogeneic hematopoietic cell transplant survivors. Biol BloodMarrow Transplant 2008;14:790-4.
6. Majhail NS, Lazarus HM, Burns LJ. Iron overload in hematopoietic celltransplantation. Bone Marrow Transplant 2008;41:997-1003.
7. Boulingand J, Richard C, Valteau-Couanet D, Orear C, Mercier L, Kessari R, et al. Iron overload exacerbates busulfan-melphalan toxicity through a pharmacodynamic interaction in mice. Pharm Res 2016;33:1913-22.
8. Karoopongse E, Marcondes AM, Yeung C, Holman Z, Kowdley KV, CampbellJS, et al. Disruption of iron regulation after radiation and donor cellinfusion. Biol Blood Marrow Transplant 2016;22:1173-81.
9. Armand P, Kim HT, Virtanen JM, Parkkola RK, Itala-Remes MA, Majhail NS, et al. Iron overload in allogeneic hematopoietic cell transplantation outcome: a meta-analysis. Biol Blood Marrow Transplant. 2014 Aug;20 (8):1248-51
10. Barba P, Valcarcel D, Perez-Simon JA, Fernandez-Aviles F, Pinana JL, MartinoR, et al. Impact of hyperferritinemia on the outcome of reduced intensity conditioning allogeneic hematopoietic cell transplantation for lymphoid malignancies. Biol Blood Marrow Transplant 2013;19:597-601.
11. Mahindra A, Bolwell B, Sobecks R, Rybicki L, Pohlman B, Dean R, et al. Elevated ferritin is associated with relapse after autologous hematopoietic stem cell transplantation for lymphoma. Biol Blood Marrow Transplant 2008;14:1239-44.
12. Wang Z, Jia M, Zhao H, Cheng Y, Luo Z, Chen Y, et al. Prognostic impact of pretransplantationhyperferritinemia in adults undergoing allogeneic hematopoietic SCT: a meta-analysis. Bone Marrow Transplant.2014;49:1339-40.
13. Nakamae M, Nakamae H, Koh S, Nishimoto M, Nakashima Y, Nakane T, et al. Prognostic value and clinical implication of serum ferritin levels following allogeneic hematopoietic cell transplantation. Acta Haematol.2015;133:310-6.
14. Meyer SC, O'Meara A, Buser AS, Tichelli A, Passweg JR, Stern M. Prognostic impact of posttransplantation iron overload after allogeneic stem cell transplantation. Biol Blood Marrow Transplant. 2013;19:440-4.
15. Armand P, Sainvil MM, Kim HT, Rhodes J, Cutler C, Ho VT, et al. Does iron overload really matter in stem cell transplantation? Am J Hematol. 2012;87:569-72.
16. Shankar J, Tiwari S, Shishodia SK, Gangwar M, Hoda S, Thakur R, et al. Molecular Insights Into Development and Virulence Determinants of Aspergilli: A Proteomic Perspective. Front Cell Infect Microbiol. 2018 May 29;8:180. DOI: 10.3389/fcimb.2018.00180.
17. Chitasombat MN, Kontoyiannis DP. Treatment of mucormycosis in transplant patients: role of surgery and of old and new antifungal agents. Curr Opin Infect Dis. 2016 Aug;29(4):340-5. DOI: 10.1097/QCO.0000000000000277.
18. Sivgin S, Baldane S, Kaynar L, Kurnaz F, Pala C, Sivgin H, et al. Pretransplant iron overload may be associated with increased risk of invasive fungal pneumonia (IFP) in patients that underwent allogeneic hematopoietic stem cell transplantation (alloHSCT). Transfus Apher Sci 2013;48:103-8.
19. PullarkatV. Iron Toxicity in Hematopoietic Stem CellTransplantation: Strike while the Iron Is Labile. Acta Haematol. 2014;131:220-1.DOI: 10.1159/000355827
20. Duca l, Cappelline MD, Baronciani D, Pilo F, Targhetta C, Visani G, et al.Non-transferrin-bound iron and oxidative stress during allogeneic hemopoietic stem cell transplantation in patients with or without iron overload. Am J Hematol. 2018 Sep;93(9):E250-E252.DOI: 10.1002/ajh.25201
21. Mahindra A, Bolwell B, Sobecks R, Rybicki L, Pohlman B, Dean R, et al. Elevated pretransplant ferritin is associated with a lower incidence of chronic graft-versus host-disease and inferior survival after myeloablative allogeneic hematopoietic stem cell transplantation. Br J Haematol 2009;146:310-316.
22. Wahlin A, Lorenz F, Fredriksson M, Remberger M, Wahlin BE, Hägglund H. Hyperferritinemia is associated with low incidence of graft versus host disease, high relapse rate and impaired survival in patients with blood disorders receiving allogeneic hematopoietic stem cell grafts. Med Oncol 2011;28:552-58.
23. Maximova N, Gregori M, Boz G, Simeone R, Zanon D, et al. MRI-based evaluation of multiorgan iron overload is a predictorof adverse outcomes in pediatric patients undergoing allogeneic hematopoietic stem cell transplantation. Oncotarget. 2017;8 (45):79650-61.
24. Leitch HA, Fibach E, Rachmilewitz E. Toxicity of iron overload and iron overload reduction in the setting of hematopoietic stem cell transplantation for hematologic malignancies. Crit Rev Oncol Hematol. 2017;113:156-70.
25. Knovich MA, Storey JA, Coffman LG, Torti SV, Torti FM. Ferritin for the clinician. Blood Rev 2009;23:95-104.
26. Großekatthöfer M, Güclü ED, Lawitschka A, Matthes-Martin S, Mann G,Minkov M, et al. Ferritin concentrations correlate to outcome of hematopoietic stem cell transplantation but do not serve as biomarker of graft-versus-host disease. Ann Hematol 2013;92:1121-8.
27. Jarisch A, Salzmann-Manrique E, Cario H, Grosse R, Soerensen J, Fischer R, et al. Serum ferritin is not a reliable predictor to determine iron overload in thalassemia major patients post-hematopoietic stem cell transplantation. Eur J Haematol. 2018 Dec;101(6):791-797. DOI: 10.1111/ejh.13169. Epub 2018 Oct 25.
28. Breuer W, Ronson A, Slotki IN, Abramov A, Hershko C, Cabantchik ZI. The
assessment of serum non transferrin-bound iron in chelation therapy and iron supplementation. Blood 2000;95:2975-82.
29. Goto T, Ikuta K, Inamoto Y, Kamoshita S, Yokohata E, Koyama D, et al. Hyperferritinemia after adult allogeneic hematopoietic cell transplantation: quantification of iron burden by determining non-transferrin-bound iron. Int J Hematol.2013;97:125-34.
Recibido: septiembre 17, 2018.
Aceptado: octubre 01, 2018.
MSc. Mariela Forrellat Barrios. Instituto de Hematología e Inmunología. Calle 19 # 960 e/ 8 y 10. Plaza de la Revolución. La Habana, CP 10400, CUBA. Tel (537) 832 0485/ 846 1112.
Correo electrónico : rchematologia@infomed.sld.cu