INTRODUCCIÓN
La leucemia mieloide aguda (LMA) representa el 80 % de las leucemias agudas entre los adultos. En el mundo se diagnostican alrededor de 300 000 casos anualmente, y se plantea que su incidencia global es de aproximadamente 3,7 por 100 000 habitantes, con una edad media de presentación de 67 años y que el índice de mortalidad aumenta progresivamente con la edad. (1
Es el resultado de la malignización de un precursor hematopoyético precoz, que provoca que esta célula de lugar a una progenie que incapaz de diferenciarse pero que continúa proliferando de forma incontrolada, lo que trae como consecuencia la rápida acumulación de células mieloides inmaduras en la médula ósea. (1,2
La LMA puede presentarse como un proceso primario “de novo” o precedida por cuadros biológicos como: mielodisplasia, procesos mieloproliferativos crónicos. 3-5 Con menor frecuencia se presenta como complicación tardía del uso de drogas que integran el arsenal de tratamiento oncohematológico, principalmente del tipo de los agentes alquilantes y epipodofilotoxinas. (4,6
Es una enfermedad heterogénea cuyo pronóstico depende de múltiples factores que incluyen: la edad del paciente al diagnóstico, la existencia de alteraciones citogenética y moleculares, los antecedentes de hemopatías y comorbilidades. (6-10
Los adelantos en el tratamiento de la LMA han dado lugar a tasas de remisión completa sustancialmente mejores. El tratamiento deberá ser lo suficientemente intensivo como para lograr una remisión completa, ya que la remisión parcial no ofrece beneficios importantes de supervivencia. (4,6
Se espera que alrededor de 60 a 70 % de los adultos con LMA logren un estado de remisión completa después de la terapia de inducción apropiada y más del 25 % de estos (cerca de 45 % de los que logran remisión completa) sobrevivan 3 años o más, logrando la posible curación de la enfermedad. (4,7
Las tasas de remisión de LMA en adultos tienen una relación inversa con la edad, con una tasa esperada de remisión de más de 65 % para los pacientes menores de 60 años. El aumento de la morbilidad y mortalidad durante la inducción parece estar directamente relacionado con la edad. (4,7-10
El tratamiento inicial de las LMA se denomina inducción a la remisión que puede ser completa cuando se logran la ausencia de manifestaciones extramedulares de leucemia, valores hematológicos normales en sangre periférica y menos de 5 % de blastos en médula ósea. (1-5
Para mantener la remisión completa (RC) y, además, eliminar elementos celulares malignos residuales no detectables morfológicamente, (7,11,12 se realiza la consolidación, que puede incluir quimioterapia intensiva y el trasplante de progenitores hematopoyéticos (TPH) autólogo o alogénico. (3,13,14
El tratamiento estándar de inducción comenzó a utilizarse a finales de la década de los 60, cuando se comprobó que tanto el arabinósido de citosina (Ara-C) como las antraciclinas provocaban respuestas terapéuticas de forma individual. 4,8-10
Los estudios posteriores recomendaron que el esquema de inducción contemplara una antraciclina como la daunorrubicina a 45-60 mg/m², idarrubicina a 12 mg/m2 o mitoxantrone de 10-12 mg/m2 por 3 días; más el ara-C en infusión endovenosa continua, 100-200 mg/m2 durante 7 días, este esquema se llama “7 + 3”, con el que se debe lograr 60 - 80 % de RC entre los pacientes menores de 60 años. (1-4,15,16
Con excepción de la LMA promielocítica, los resultados terapéuticos alcanzados continúan siendo desalentadores, dos tercios de los adultos jóvenes aún mueren a consecuencia de la enfermedad y ello ha generado constantes esfuerzos por mejorar el tratamiento, especialmente durante el período inicial que representa la inducción. (1,2,17,18
En este contexto han surgido datos que sugieren las altas dosis de daunorrubicina entre 80-100 mg/m2 por 3 días en la inducción, asociado a la dosis estándar de Ara-C, como una posibilidad para lograr mejores resultados, 1,2,4 sobre todo un incremento en los índices de remisiones hematológicas más prolongados, no así en la modificación de la sobrevida global de la enfermedad. (5
En el año 2013, se realizaron estudios en pacientes menores de 60 años donde los desenlaces para quienes recibieron daunorrubicina (90 mg/m2/dosis, dosis total de inducción de 270 mg/m2) fueron superiores a los de aquellos que recibieron dosis más tradicionales (45 mg/m2/dosis; dosis total = 135 mg/m2). (4 La tasa de RC fue de 71 vs 57 % (p < 0.001) y la mediana de supervivencia fue de 24 vs 16 meses (p = 0.003). (4
Las altas dosis de antraciclinas han sido utilizadas en Cuba como parte de los protocolos de tratamiento de la LMA no promielocítica en el adulto menor de 60 años de edad, en centros como es el Hospital Clínico Quirúrgico “Hermanos Ameijeiras”; pero en la institución no se utilizaban estas dosis de antraciclinas, por lo que esta investigación permitió incorporarlas y valorar la repercusión cardiovascular con el uso de medios diagnósticos como la ecocardiografía en los pacientes estudiados.
El objetivo fue incorporar las altas dosis de antraciclina, específicamente de daunorrubicina, al tratamiento de inducción de la LMA no promielocítica en pacientes adultos menores de 60 años. Y de manera específica se pudieron determinar las variables demográficas en los pacientes estudiados; realizar el diagnóstico de la enfermedad según los criterios morfológicos, inmunológicos, citogenéticos y moleculares; relacionar la cardiotoxocidad por antraciclinas con la morbililidad y mortalidad de los casos y determinar la remisión morfológica después de la inducción.
MÉTODOS
Se realizó un estudio cuasiexperimental, en el que se incluyeron los pacientes diagnosticados con LMA no promielocítica tratados en la inducción con altas dosis de antraciclinas, atendidos en el servicio de Adultos del Instituto de Hematología e Inmunología. El estudio se llevó a cabo en el período comprendido entre septiembre de 2013 y diciembre de 2016.
El universo estuvo conformado por todos los pacientes adultos diagnosticados con LMA no promielocítica menores de 60 años de edad. De ellos, se seleccionaron 41 pacientes mediante muestreo no aleatorio consecutivo, que cumplieron los criterios de inclusión de tener el diagnóstico de LMA no promielocítica de acuerdo a los criterios definidos por la organización mundial de la salud (OMS) y edades entre 18 y 59 años en el momento del diagnóstico, sin tratamiento de quimioterapia previa y la constancia del consentimiento informado. Y se excluyeron los pacientes que no contaban con la realización de los estudios requeridos para la clasificación y aquellos con daño cardiovascular previo determinado por el ecocardiograma.
El protocolo de investigación fue revisado y discutido por el Consejo Científico y el Comité de Etica de la investigación del centro, previo a su aprobación. Se garantizó la seguridad y confidencialidad de la información. Todos los pacientes incluidos firmaron el documento de consentimiento informado.
Plan de tratamiento de inducción (7+3)
Ara-C: 100 a 200 mg/m2/d por vía endovenosa, días 1 - 7 en infusión continua de 24 horas.
Daunorrubicina: 100 mg/m2/d por vía endovenosa, días 1 - 3, a durar 1 hora, rediluido en 100 mL de Dextrosa 5 %.
Una vez alcanzada la recuperación de los conteos celulares en sangre periférica (Hb> 10 g/dL, plaquetas >100 x 109/L, neutrófilos > 1 x 109/L), se procedió a la alta médica de la unidad de aislamiento y se realizó aspirado de médula ósea en un término de 15 días para evaluar la respuesta al tratamiento.
Ecocardiograma
La ecocardiografía con doppler se realizó en el Hospital General Docente “Enrique Cabrera” al debut de la enfermedad y evolutivamente un año después del uso de las altas dosis de antraciclinas. Se utilizó un equipo SIEMENS con transductores apropiados para pacientes adultos.
Después de un período de reposo de 10 minutos se visualizaron las estructuras cardíacas a través de la ventana paraesternal y se realizaron las mediciones correspondientes mediante los programas incorporados en el equipo.
Las variables que se midieron fueron:
Fracción de eyección del ventrículo izquierdo (FEVI)
Fracción de acortamiento del ventrículo izquierdo (FAcVI)
Al año de terminado el tratamiento de inducción se realizó otro ecocardiograma para evaluar la cardiotoxicidad relacionada con las altas dosis de antraciclinas.
A partir del valor de la FEVI se establecieron tres categorías:
FEVI menor del 30 % - Cardiotoxicidad grave.
FEVI entre 30 - 40 % - Cardiotoxicidad moderada.
FEVI entre 40 - 55 % - Cardiotoxicidad ligera.
A partir del valor de la FAcVI se establecieron tres categorías:
Análisis estadístico
Los datos fueron recogidos de las historias clínicas. La información fue recopilada en una base de datos confeccionada con el programa Microsoft Excel de Office 2007. El procesamiento estadístico se realizó con el programa SPSS versión 12.0.0.
Las variables cualitativas se resumieron a partir de sus frecuencias absolutas y relativas. Para determinar asociación entre variables se utilizó la prueba Chi Cuadrado de independencia o asociación. Se consideraron significativos los valores de p≤0.05.
RESULTADOS
Se evaluaron 41 pacientes adultos con diagnóstico de LMA no promielocítica en el Instituto de Hematología e Inmunología.
En la tabla 1 se observa la distribución por edad y sexo donde fue mayor en el grupo de 46 a 52 años representado por el 26,8 % de los casos y predominó el sexo masculino (60,9 %).
Tabla 1 Distribución por sexo y grupo de edad de los pacientes atendidos
| Grupo edad (años) | Masculino | Femenino | Total | |||
|---|---|---|---|---|---|---|
| Nº | % | Nº | % | Nº | % | |
| 18-24 | 4 | 9,8 | 2 | 4,9 | 6 | 14,6 |
| 25-31 | 3 | 7,3 | 4 | 9,8 | 7 | 17,1 |
| 32-38 | 0 | 0 | 2 | 4,9 | 2 | 4,9 |
| 39-45 | 1 | 2,4 | 5 | 12,2 | 6 | 14,6 |
| 46-52 | 9 | 22 | 2 | 4,9 | 11 | 26,8 |
| 53-59 | 8 | 19,5 | 1 | 2,4 | 9 | 22 |
| Total | 25 | 60,9 | 16 | 39,1 | 41 | 100 |
Fuente: Historias clínicas
En el 85 % de los casos la enfermedad apareció de novo, y solo en el 15 % la LMA fue de causa secundaria, mayormente crisis blásticas mieloides de pacientes con leucemia mieloide crónica y síndromes mielodisplásticos transformados en LMA.
Según los criterios morfológicos de la clasificación FAB el 31,7 % correspondió a la variante M1, en estrecha relación con las determinaciones de la citometría de flujo donde en el 43,9 % estuvieron presentes los marcadores característicos de esta variedad, siendo la variante morfológica M1 la más frecuente.
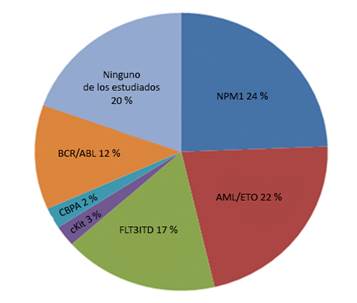
Se representa en la figura 1 que los genes más comúnmente involucrados fueron el NPM1 y el AML/ETO, 24 % y 22 %, respectivamente.
En la tabla 2 se evidencia que el 56,1 % de los pacientes alcanzó la remisión hematológica con un solo ciclo de tratamiento y el 29,3 % fallecieron durante este primer ciclo, el 14,6 % necesitó realizar un segundo esquema de inducción para lograr la remisión hematológica.
Tabla 2 Respuesta al tratamiento con esquema “3+7” en los pacientes atendidos.
| Respuesta al tratamiento “3+7” | No | % |
|---|---|---|
| Remisión hematológica con 1er ciclo de inducción | 23 | 56,1 |
| Inducción 2do ciclo | 6 | 14,6 |
| Fallecidos durante el 1er ciclo de inducción | 12 | 29,3 |
| Total | 41 | 100 |
Fuente: Historias clínicas
En el estudio no se reportaron eventos de cardiotoxicidad por antraciclina en los 17 pacientes vivos (41,5 %) evaluados al año de culminado el tratamiento.
DISCUSIÓN
La distribución por edad en este estudio, corresponde con lo reportado internacionalmente donde la LMA en el adulto es más frecuente en la 4ta y 5ta década de la vida. (2-4 En un estudio realizado por Lee y colaboradores, la edad media de presentación fue de 48 años; a pesar de no tener predilección por sexo alguno, en el trabajo el sexo masculino fue el más representativo. En un estudio de meta-análisis realizado por Gong y colaboradores también el sexo masculino fue el más representativo. (1
En la mayoría de los casos la enfermedad apareció de novo, resultado que está acorde con lo reportado en relación a la forma de presentación de la enfermedad según estudios revidados por Burnett y colaboradores. (19 En la casuística los casos de LMA secundarias fueron mayormente crisis blásticas mieloides de pacientes con leucemia mieloide crónica; en el estudio realizado por Fernández y colaboradores las causas secundarias de LMA estuvieron relacionadas con síndromes mieloproliferativos crónicos y mielodisplásticos transformados datos que se asemejan a los encontrados en el presente trabajo. (4)
Según los criterios morfológicos de la clasificación FAB, el mayor porciente correspondió a la variante M1, en estrecha relación con las determinaciones de la citometría de flujo donde en el 43,9 % estuvieron presentes los marcadores característicos de esta variedad. En la investigación no se encontró relación con otros estudios revisados en la literatura como el de Kronke y colaboradores donde la variante morfológica M2 según la clasificación FAB fue la más frecuente. (7
Los genes más comúnmente involucrados fueron el NPM1 y el AML/ETO; estos resultados están en correspondencia con lo revisado en la literatura internacional donde el gen NPM1 se presenta en el 27-35 % de los adultos con LMA y en el 45-64 % de los adultos con LMA y cariotipo normal.7,8,11,12 Debe destacarse que la existencia del FLT3ITD en relación a la LMA aparece en el 15-35 % los casos como expresión de mutaciones génicas de peor pronóstico, (19-23 siendo una de las más comunes en la hemopatías malignas de manera general, datos que coinciden con los encontrados en la investigación.
Más de la mitad de los pacientes alcanzó la remisión hematológica con un solo ciclo de tratamiento y el 29,3 % de los casos fallecieron durante esta. En los estudios realizados por Wang y por Luskin y colaboradores, el porciento de remisión con el primer ciclo de inducción fueron superiores al 60 % de los casos estudiados. (5,8) Este resultado está en correspondencia con un trabajo realizado por los investigadores del grupo Eastern Cooperative Oncology Group (ECOG) que también reportan resultados positivos en un estudio de 657 pacientes entre 17 y 60 años, comparando 45 y 90 mg/m2 de daunorrubicina, consiguen mejores tasas de RC ( 57 % vs. 70 %).4
En la literatura se describe que entre el 25-50 % de los casos fallece en la inducción por múltiples complicaciones que no solo están relacionadas con el proceso de enfermedad sino con las toxicidades del tratamiento; el 29,3 % de los casos en el estudio fallecieron durante la inducción, a causa de infecciones severas en el período de aplasia postquimioterapia y enfermedad hemorrágica cerebral; el presente estudio está en relación con lo planteado por diferentes autores. (6,9,15) No se presentaron complicaciones cardiovasculares en los pacientes fallecidos.
El 14,6 % de los pacientes necesitó realizar un segundo esquema de inducción para lograr la remisión hematológica.
El riesgo del empleo de altas dosis de antraciclinas, es la aparición de la cardiotoxicidad, que se relaciona, fundamentalmente, con los picos agudos del citostático en sangre y con la exposición a la dosis total indicada. (3,16,24-27 En la investigación no se reportaron eventos de cardiotoxocidad por antraciclina durante el tratamiento, ni al año de culminado este.
El grupo europeo Dutch-Belgium Hemato-Oncology Cooperative Group/Swiss Group for Clinical Cancer Research (HOVON/SAKK) dio a conocer, en el año 2009, sus resultados con el uso de la daunorrubicina a 90 mg/m² sin que se registraran efectos adversos significativos, y con mejoría de los porcentajes de respuesta completa. (4,27
La determinación ecocardiográfica de la FEVI y la FAVI es un método sencillo y no invasivo para detectar alteraciones en los pacientes estudiados y el seguimiento ecocardiográfico permitió mejorar la calidad de vida de los pacientes que han estado expuestos a las altas dosis de antraciclinas. No se reportaron eventos de cardiotoxicidad durante el tratamiento, ni al año de culminado el mismo.
Se continúa trabajando en comparar los resultados con el uso de las altas dosis de antraciclinas y con las dosis estándar de 60 mg/m2 en relación a la aparición de cardiotoxicidad y a la sobrevida lograda.