INTRODUCCIÓN
La hemoglobinuria paroxística nocturna (HPN) es una enfermedad clonal, adquirida, no maligna, que se origina a partir de una mutación somática en la célula madre hematopoyética. Dicha mutación ocurre en el gen PIG-A que se encuentra en el cromosoma X, al final del brazo corto (Xp22.1). 1 Este gen codifica una proteína involucrada en la síntesis del glicosilfosfatidilinositol (GPI), un glucolípido cuya función biológica es el anclaje de proteínas a la superficie de la membrana celular.2 Como resultado de este desorden genético se originan clones de células que carecen total o parcialmente de la expresión de proteínas que se encuentran normalmente unidas a la superficie de la membrana celular a través del GPI.3 Entre dichas proteínas se encuentran el CD55 y CD59, implicadas directamente en la fisiopatología de la HPN. Estas dos moléculas constituyen defensas celulares contra componentes del complemento. La pérdida total o parcial de la expresión de estas proteínas hace de los eritrocitos células susceptibles a la lisis mediada por complemento. (4,5 Como resultado, se evidencia la hemólisis de los hematíes y una activación de los granulocitos, monocitos y las plaquetas. (6
La HPN se caracteriza por la presencia de anemia hemolítica crónica intravascular, hemoglobinuria y frecuentemente se asocia con pancitopenia. Además, esta enfermedad se caracteriza por la ocurrencia de episodios tromboembólicos recurrentes y de localización atípica (abdominal, visceral, cerebral y cutánea), que ocurren en casi la mitad de los pacientes y son la causa fundamental de morbimortalidad de la enfermedad.7 Otras manifestaciones clínicas características de la HPN son: fatiga crónica, dolor abdominal moderado y grave, disfagia, disfunción eréctil e insuficiencia renal.8,9 Entre el 5 y el 9 % de los pacientes con HPN pueden presentar síndrome mielodisplásico (SMD) y anemia aplásica;10) algunos enfermos, pueden evolucionar a leucemia aguda. 11,12 Aunque la incidencia real de la HPN no es bien conocida, se estima la ocurrencia de 1,5-2,0 casos por millón de habitantes, por año en la población mundial, con una prevalencia de 15,9 casos por millón, similar a la incidencia de la anemia aplásica. 13) La media de supervivencia con los tratamientos convencionales es de aproximadamente 10 años, pero se acorta si los pacientes presentan trombosis, deficiencia renal, fallo medular o mielodisplasia. La tasa de supervivencia a los 5 años es de 65 %. 14
El diagnóstico clásico de la HPN se ha basado en pruebas que demuestran el incremento de la sensibilidad de los hematíes a la lisis mediada por complemento. La prueba de Ham fue el primer método diagnóstico que se desarrolló para el estudio de la HPN. (15) Posteriormente, surgieron otros como: la prueba de sacarosa o sucrosa 16 y l prueba de sensibilidad a la lisis mediada por el complemento. (17 Sin embargo, estas técnicas no presentan una sensibilidad y especificidad adecuadas, ya que no permiten detectar clones de células HPN inferiores a 5 %, ni estudiar las poblaciones leucocitarias. (18,19
La citometría de flujo multiparamétrica (CFM) es el método de elección para la identificación de las células deficitarias de GPI, así como para el diagnóstico, la clasificación y monitoreo de los pacientes con diferentes formas clínicas de HPN. (20
El criterio diagnóstico que se tiene en cuenta en la actualidad para la confirmación de HPN por CFM, es que se demuestre el déficit de dos o más proteínas dependientes de anclaje a la membrana por el GPI en al menos dos líneas celulares diferentes. 5,21
El objetivo fue establecer el diagnóstico de la HPN por CFM a partir de una estrategia de análisis propuesta.
MÉTODOS
La muestra se obtuvo a partir de una extracción de sangre periférica (SP) en un tubo con EDTA de un paciente con sospecha clínica de HPN. La identificación y evaluación de los clones HPN se desarrolló por la técnica de CFM, con el empleo de anticuerpos monoclonales (AcMo) dirigidos contra antígenos que se encuentran normalmente anclados a la membrana celular por el GPI. La muestra fue procesada y analizada en el laboratorio de Inmunología del Instituto de Hematología e Inmunología. El resto de los reactivos utilizados fueron preparados en el propio laboratorio de Inmunología. Los AcMo utilizados fueron:
| Anticuerpos monoclonales | Fluorocromos |
|---|---|
| Anti- CD14 | PC5*** |
| Anti- CD15 | FITC* |
| Anti- CD16 | R-PE* |
| Anti- CD24 | APC** |
| Anti- CD45 | PerCP*/APC** |
| Anti- CD55 | R-PE* |
| Anti- CD59 | FITC* |
| Anti- CD64 | R-PE* |
| Anti- CD235a | R-PE* |
(FITC: isotiocianato de fluoresceína, R-PE: R-ficoeritrina, APC: aloficocianina, PC5: R-ficoeritrina Cy5. *: DAKO. **: Miltenyi Biotec ***: abcam)
Técnicas y procedimientos de laboratorio
Se realizó el marcaje directo y múltiple con AcMo en las poblaciones de granulocitos-neutrófilos, monocitos y hematíes con la técnica establecida internacionalmente con algunas modificaciones. (22
En el caso de las muestras a las que se le añadirían los AcMo para el marcaje de los granulocitos y los monocitos se adicionron primeramente 100 µL de sangre total y posteriormente se realizó el lisado de los hematíes con cloruro de amonio durante 10 min, a temperatura ambiente. Luego de un lavado con cloruro de sodio a 0,9 % y centrifugadas durante 10 min a 1500 rpm, las muestras se incubaron con los AcMo durante 20 a 30 min, protegidas de la luz y a temperatura ambiente. Posteriormente, las células fueron lavadas dos veces con cloruro de sodio a 0,9 % y centrifugadas durante 10 min a 1500 rpm. Para el marcaje de los eritrocitos se utilizó sangre total diluida al 3 % en PBS. La muestra se incubó 30 min protegida de la luz y a temperatura ambiente. Posteriormente fueron lavadas dos veces con cloruro de sodio a 0,9 % y centrifugadas durante 10 min a 1500 rpm.
Las células se fijaron con 300 μL de formaldehído al 1 % para conservar su viabilidad y luego fueron guardadas a 4oC hasta ser leídas en un citómetro GALLIOS, BeckmanCoulter.
Los datos obtenidos se analizaron con el empleo del programa informático Kaluza, versión 1.2.
Para el diagnóstico de la HPN por CMF se siguió el siguiente flujo de trabajo:
Separación de las diferentes poblaciones de leucocitos
Identificación de las proteínas deficientes en los neutrófilos-granulocitos con un ensayo multiparamétrico de 4 colores.
Control negativo (muestra no marcada)
CD15 FITC/CD16 PE/CD24 APC/CD45 PerCP
La población de neutrófilos-granulocitos se identificó mediante un “gate” o ventana, a partir de la utilización del CD15 vs SSC
CD16 PE/CD24 APC
CD59 FITC/CD55 PE/CD24 APC/CD45 PerCP
Combinaciones utilizadas para la identificación y cuantificación de los clones HPN doble negativos en los granulocitos.
Identificación de las proteínas deficientes en los monocitos con un ensayo multiparamétrico de 4 colores.
CD14 PC5/CD64 PE/CD59/CD45 APC
La población de monocitos se identificó mediante un “gate” o ventana, a partir de la utilización del antígeno CD64 PE vs SSC o en su defecto, con el uso de CD45 PerCP vs SSC
CD59 FITC/CD14 PC5
Combinación utilizada para la identificación y cuantificación de los clones HPN doble negativos en los monocitos.
Identificación de las proteínas deficientes en los hematíes
La expresión de CD59 sobre la población de eritrocitos se cuantificó y analizó mediante la utilización de las diferentes herramientas que provee el software de análisis Kaluza. Con ellas, se determinó la intensidad de fluorescencia media (IFM) del antígeno CD59. Los eritrocitos se clasificaron posteriormente como: tipo I (elevada IFM del CD59, expresión normal del antígeno sobre células normales), tipo II (moderada IFM del CD59, células con deficiencia parcial en los niveles de expresión del antígeno) y de tipo III (baja IFM del CD59, deficiencia completa en la expresión del antígeno).
RESULTADOS
A partir del algoritmo de análisis propuesto por los investigadores en este trabajo se identificaron y cuantificaron los clones HPN de la muestra de SP.
En el momento de adquirir las células en el citómetro (105 células), se realizó una calibración previa con la muestra no marcada (control negativo). De esta forma, se obtuvo una adecuada distribución de las células según su tamaño y complejidad interna, las cuales dependieron del grado y de la magnitud de la dispersión de la luz del láser, al interactuar con los componentes celulares que se obtuvieron a través del análisis.
Cuando la luz difractada incidió en el mismo eje de la luz incidente, se evaluó el tamaño celular, a través del “Forward Side Scatter” (FW-SC). Por otro lado, cuando la luz difractada y reflejada se detectó a 90º de la dirección del láser, se evaluó la complejidad interna celular o granulosidad, a través del SSC (Fig. 1A).

Fig. 1- Distribución de las células totales provenientes de sangre periférica de un paciente con HPN, según su tamaño y complejidad interna (A). Separación de las diferentes poblaciones celulares de interés mediante la utilización de CD45 vs SSC (B).
Las células totales adquiridas se separaron en las diferentes subpoblaciones celulares de acuerdo con los parámetros físicos mencionados, mediante la utilización del antígeno leucocitario CD45 vs SSC. Estas poblaciones a su vez se separaron del debris celular. Como se observa en la Figura 1B, se realizó un ¨gate¨ o ventana en las poblaciones de granulocitos-neutrófilos y monocitos para el análisis posterior.
Para la identificación de los clones HPN en la población de granulocitos se realizó un ensayo de 4 colores. Se utilizó el antígeno CD15 como marcador inequívoco de la población de interés (Fig. 2A). A partir de la ventana de células granulocíticas CD15 positivas (+), se evaluaron 4 proteínas diferentes: CD16, CD24, CD55 y CD59, que son dependientes de GPI para su anclaje a la membrana citoplasmática. En la figura 2B se observa el gráfico de puntos donde se evaluó la deficiencia simultánea en la expresión de CD16 y CD24. Se pudo determinar la presencia de un clon HPN que constituyó 90,69 % del total de los granulocitos. Así mismo, se pudo apreciar la deficiencia en la expresión de CD55 y CD59 con un tamaño de clon HPN de 90,81 % y 90,40 %, respectivamente (Fig. 2C y 2D).
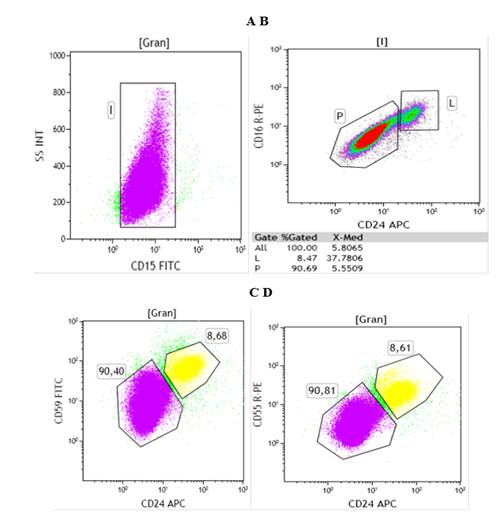
Fig. 2- Estrategia de análisis para la identificación y cuantificación de clones HPN en la población de granulocitos-neutrófilos de un paciente con la enfermedad.
Adicionalmente, se evaluó la expresión de los antígenos CD14 y CD59 en la población de monocitos. Primeramente, se separaron las células mononucleares (Fig. 3A) de la población de granulocitos y del debris celular mediante el CD45 vs SSC (Fig. 3B). Con la utilización del CD64 se separó y se identificó de manera evidente la población de monocitos para la posterior cuantificación de los posibles clones HPN presentes en esta población. En la figura 3C se muestra un clon HPN doble negativo para la expresión de CD14 y CD59, ambas proteínas dependientes de anclaje a la membrana celular por el GPI. El tamaño del clon observado fue de 59,77 % del total de monocitos. Se identificó además un segundo clon HPN con un tamaño clonal de 19,45 % del total de las células evaluadas, que expresó el antígeno CD59 pero no así el CD14. En la figura 3D se muestra el grado de expresividad total del antígeno CD14 y se determinó una deficiencia del 79,06 % en la expresión de la proteína en los monocitos.

Fig. 3- Estrategia de análisis para la identificación y cuantificación de clones HPN en la población de monocitos.
Se estableció una comparación de los parámetros evaluados entre una muestra control sano y la muestra problema. En la figura 4 se observa que en la muestra control, la totalidad de la población de eritrocitos CD235a+ expresó el antígeno CD59 y que la expresividad de la proteína sobre la membrana celular fue de 100 %, lo que se correspondió con una elevada IFM y se traduce como la expresión normal del antígeno sobre células normales o de tipo I.

Fig. 4- Representación en un gráfico dot plot e histograma, de la expresión de CD59 por la población de eritrocitos CD235a+ y de la intensidad de fluorescencia media del antígeno, respectivamente, en una muestra control negativo.
Una vez que se demostró la presencia y el tamaño de los clones HPN en los leucocitos, se procedió a evaluar la expresión de la proteína CD59 en los hematíes para determinar el grado de afectación de estas células. De esta manera se pudo determinar la susceptibilidad de los eritrocitos a la lisis mediada por el sistema del complemento. Los hematíes se identificaron a partir del antígeno específico de linaje eritrocitario CD235a (Fig. 5B).
Cuando se analizó la muestra proveniente de un paciente con sospecha de HPN, se observó un clon HPN CD235a+CD59- con un tamaño clonal de 19,98 % (Fig. 5C). Se determinó finalmente el grado de afectación de los eritrocitos en cuanto a la expresividad en la membrana del antígeno CD59.
Como se observa en la figura 5D, el histograma mostró tres señales diferentes. La primera señal representó una expresividad de 80,47 % en los eritrocitos de la molécula CD59, que se corresponde con el fenotipo de células normales o de tipo I. La señal con una IFM intermedia representó 19,33 % de expresividad, que se corresponde con el fenotipo de células parcialmente deficientes o de tipo II y la tercera señal detectada, correspondiente con células que son totalmente deficientes en la expresión de antígenos dependientes de GPI, presentó 0,19 % de expresividad de CD59 en la membrana celular. El clon HPN determinado como de tipo III, se corresponde con eritrocitos deficientes totalmente en la expresión de GPI y por ende, no expresan en la membrana celular las proteínas reguladoras de la lisis mediada por el sistema del complemento, solo pudo ser identificado por la técnica de CFM.
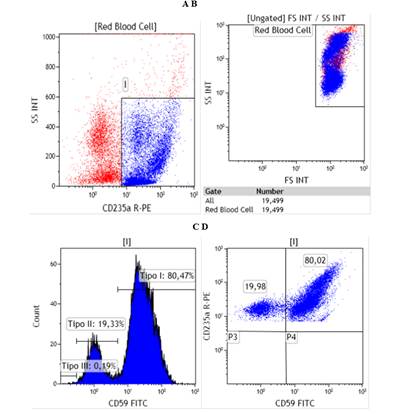
Fig. 5- (A)Gráfico que representa la dispersión celular de las poblaciones de eritrocitos y plaquetas. (B) Separación de los hematíes con la utilización de CD235a vs SSC. (C) Identificación y cuantificación de un clon HPN CD59- en la población de eritrocitos CD235a+ (D) El histograma muestra la intensidad de fluorescencia media de la proteína CD59 en la población de eritrocitos. Se observan tres señales correspondientes a los tipos I (elevada y eritrocitos normales), II (intermedia-baja y eritrocitos parcialmente deficientes en la expresión de GPI) y III (baja y eritrocitos totalmente deficientes en la expresión de GPI en la membrana citoplasmática), respectivamente.
DISCUSIÓN
El diseño y establecimiento de una estrategia o algoritmo de trabajo para aumentar la sensibilidad y especificidad en la detección de clones HPN por CFM, ha sido un objetivo perseguido por muchos investigadores a partir de la última década del pasado siglo. 18
Históricamente, el diagnóstico de la HPN se efectuó mediante la evidencia de una mayor sensibilidad de los eritrocitos, respecto a controles normales, a la lisis por el sistema del complemento activado, ya sea por acidificación del plasma (prueba de Ham) o por aumento de su osmolaridad (prueba de sacarosa). Sin embargo, estas pruebas presentan una baja sensibilidad, no permiten la evaluación de la expresión de proteínas en los leucocitos y pueden brindar falsos negativos si los pacientes están transfundidos. 23
Actualmente, la CFM es el método por excelencia para el diagnóstico de la HPN. Varios grupos de investigadores han realizado el diagnóstico de esta enfermedad mediante el ensayo de dos colores con los marcadores CD55 y CD59. (24, 25) A pesar de que los ensayos de este tipo son informativos, se utilizan principalmente para el análisis masivo de muestras. Una de las desventajas fundamentales es que el CD55 generalmente presenta una señal de baja intensidad y en los eritrocitos no es posible detectar las células deficitarias de tipo II. De forma general este ensayo no presenta una alta sensibilidad ya que no es posible detectar clones HPN < 1 % en enfermedades como la anemia aplásica y el SMD. 14
La introducción y estandarización de nuevos marcadores y el refinamiento en las estrategias de análisis para el diagnóstico de la HPN ha incrementado la especificidad y sensibilidad de la técnica para la detección de alta resolución de clones de pequeño tamaño en otras enfermedades medulares asociadas a la HPN. 26
En este trabajo se diseñó un algoritmo de análisis basado en un ensayo de 4 colores, para la identificación correcta de las poblaciones celulares de interés y la detección y cuantificación de clones HPN < 1 %. Estos resultados están en concordancia con los obtenidos por otros investigadores. 27-29
Para realizar el diagnóstico de la HPN por esta técnica, es necesario demostrar la deficiencia de al menos dos proteínas dependientes de anclaje a GPI en dos líneas celulares diferentes, para excluir que el proceso clínico sea una consecuencia de una deficiencia hereditaria y aislada de una sola proteína dependiente de anclaje a GPI. 22 De acuerdo con lo planteado por estos investigadores, en el presente estudio se demostró la deficiencia de cinco proteínas diferentes (CD14, CD16, CD24, CD55, CD59) que son dependientes de anclaje a la membrana por el GPI en las tres líneas celulares evaluadas. La estrategia basada en el ensayo de 4 colores propuesta por los autores de esta investigación, fue efectiva y precisa en el diagnóstico de la HPN.
En los últimos cinco años se han desarrollado mejoras en la técnica y en las estrategias de análisis, con la incorporación de marcadores novedosos para incrementar la sensibilidad con un límite de detección de 0,001 %, ya que se conoce que pacientes con anemia aplásica o SMD que presentan clones HPN muy pequeños, tienen un mejor pronóstico en la respuesta a los tratamientos con inmunosupresores. 7) Entre los nuevos marcadores introducidos se puede citar la proaerolisina marcada con fluoresceína (FLAER) que reconoce y se une de manera específica al GPI en la membrana citoplasmática de los leucocitos y el CD157, un antígeno que se encuentra expresado en las líneas granulocíticas y monocíticas. Con estos marcadores se han diseñado ensayos de 6 y de 8 colores lo cual aumenta significativamente la especificidad y sensibilidad de la técnica de CFM. 4, 30)
Desde el punto de vista económico, el ensayo multiparámetrico de 4 colores es costoso en cuanto a recursos tecnológicos y de reactivos. Sin embargo, en un estudio realizado en el 2016 se demostró que la utilización de este tipo de ensayo redujo los costos económicos 37,0 % cuando se comparó con un ensayo de 2 colores, mientras que aumentó los costos 10 % solamente, cuando fue comparado con ensayos de 5 o más colores. 29
Con los resultados obtenidos en este trabajo se demostró que el algoritmo diagnóstico propuesto permitió identificar y cuantificar los clones HPN. Se determinó la expresividad de los antígenos dependientes de anclaje a GPI, así como el grado de afectación de los eritrocitos en la expresión de CD59, como medida directa de la susceptibilidad que experimentan a la lisis mediada por el sistema del complemento.














