Introducción
La leucemia linfoide crónica (LLC) es una enfermedad que se enmarca dentro de los síndromes linfoproliferativos crónicos, caracterizada como un trastorno proliferativo maligno de linfocitos de aspecto maduro e incompetentes que se acumulan masivamente en sangre periférica, médula ósea y tejidos linfoides.1,2En el 95 % de los casos, la enfermedad compromete a los linfocitos B, en los cuales ocurre una proliferación clonal.3 El acúmulo de estas células no es secundario a un aumento de su producción, como ocurre en muchas neoplasias, sino a que estos linfocitos atípicos tienen una vida media más larga.2,4
La LLC es la leucemia más frecuente en países de Europa y en los Estados Unidos de América, con una incidencia de 2 a 6 casos por 100 000 habitantes por año.5 La incidencia se incrementa con la edad, más de 70 % de los pacientes al diagnóstico son mayores de 65 año y menos del 2 % son menores de 45 años. La relación hombres/mujeres es de 2:1, respectivamente. Es poco frecuente en latinoamericanos y aún menor, en asiáticos.1,6
En Cuba, durante el año 2018, fallecieron 631 pacientes debido a leucemia, para una tasa de 5.6 por 100 000 habitantes. Los pacientes con LLC presentan una amplia gama de síntomas y signos al momento del diagnóstico; sin embargo, el 70 % de ellos son diagnosticados en forma incidental durante un recuento hematológico de rutina. Las manifestaciones clínicas de la LLC incluyen linfadenopatías pequeñas y simétricas (50 - 90 % de los casos), fundamentalmente cervicales, supraclaviculares y axilares, esplenomegalia (moderada, no dolorosa), hepatomegalia (moderada, no dolorosa), hipogammaglobulinemia, predisposición a las infecciones recurrentes, tales como: neumonía, herpes simple labial y herpes zóster. Estos enfermos presentan además, astenia, fatiga, fiebre, escalofríos, sudores nocturnos, pérdida de peso, anemia hemolítica, trombocitopenia, o ambos, de causa autoinmune.7,8
En Cuba el diagnóstico de la LLC se realizaba inicialmente por morfología de las células leucémicas. Luego, con la introducción de técnicas de inmunofenotipaje celular (IFC)se realizó por inmunofluorescencia indirecta y posteriormente por el ultramicro método inmunocitoquímico (UMICIQ). Actualmente, se utiliza la técnica de citometría de flujo (CMF), método de elección para la identificación y la caracterización inmunofenotípica de las células leucémicas. Se caracteriza por el empleo de anticuerpos munoclonales (AcMo) conjugados a fluorocromos que son detectados y visualizados mediante un sistema informático.9,10,11 Presenta múltiples ventajas frente al uso del microscopio de fluorescencia y técnicas inmunocitoquímicas, lo que la convierte en una poderosa herramienta para la clasificación inmunológica de pacientes con LLC, permite orientar que se emple en tratamientos individualizados que contribuyan a elevar la supervivencia global y calidad de vida de estos pacientes.
El objetivo fue describir la estrategia de diagnóstico del inmunofenotipaje por CMF de un paciente con sospecha clínica y morfológica de leucemia linfoide crónica.
Métodos
Se obtuvo una muestra procedente de médula ósea (MO) en un tubo con etilen-diamino-tetra-acetato de potasio (EDTA) de un paciente con sospecha clínica y morfológica de LLC. La identificación y cuantificación de los antígenos más frecuentemente expresados en la LLC se desarrolló por la técnica de CMF, con el empleo de AcMo dirigidos contra los antígenos de diferenciación linfoides B y T.
En todos los casos, los AcMo fueron previamente titulados y conjugados directamente por el fabricante a los fluorocromos isotiocianato de fluoresceína (FITC), ficoeritrina (PE), aloficocianina (APC) y ficoeritrina cianina 5 (PC5). La muestra fue procesada y analizada en el laboratorio de Inmunología del Instituto de Hematología e Inmunología (IHI). El panel de AcMo que se empleó fue: Anti-CD4FICT/CD8RPE/CD3PC5***; Anti-CD20FICT/CD5RPE/CD19APC*; Anti-CD23 RPE**; Anti-CD25 RPE**; Anti-CD38 FICT**; Anti-CD45 PC5***/APC*; Anti-CD49 FICT**; Anti-kappa APC*; Anti-lambda RPE*; de la firmas DAKO (*), Milteny (**) y Beckman Coulter(***).
Técnicas y procedimientos de laboratorio
Se dispensaron 50 µL de muestra procedente de MO en cada tubo de 15 ml, la cual se incubó con 5µL de las combinaciones correspondientes de AcMo durante30 minutos, a oscuras y a temperatura ambiente. El lisado de los hematíes se realizó con cloruro de amonio, durante 10 min a temperatura ambiente. Posteriormente, las células fueron lavadas en dos ocasiones con cloruro de sodio a 0,9 % y centrifugadas durante 10 min a 1500 rpm. El tubo que contenía la muestra marcada con las cadenas ligeras de inmunoglobulinas (Igs) fue lavado previamente. Las células se fijaron con 300 μL de formaldehido al 1 % y luego, se guardaron a 4 oC hasta ser leídas en un citómetro GALLIOS, Beckman Coulter, ubicado en el laboratorio de Inmunología del IHI.
Para el análisis y posterior diagnóstico de la LLC por CMF se utilizó el siguiente método: En el momento de adquirir las células en el citómetro (104 células), se realizó una previa calibración con la muestra que contenía solamente sangre total (control negativo). Cuando la luz difractada incidió en el mismo eje de la luz incidente, se evaluó el tamaño celular, a través del “forward scatter” (FSC). Por otro lado, cuando la luz difractada y reflejada se detectó a 90º de la dirección del láser, se evaluó la complejidad interna celular o granularidad, a través del “side scatter” (ssc).
Se analizaron los histogramas correspondientes al tubo control, a través de los cuales se establecieron los límites de la emisión de fluorescencia de los fluorocromos utilizados.
Separación de las diferentes poblaciones de leucocitos:
Identificación de los antígenos expresados en la población de linfocitos con un ensayo multiparamétrico de 4 colores:
Se utilizaron gráficos de histogramas de fluorescencia para evaluar a través de la intensidad de fluorescencia media (IFM) la expresión de los antígenos CD3, CD4, CD8, CD5, CD19 y CD20 y gráficos de dot plot para evaluar la coexpresión de los antígenos CD3+/CD4+ y CD3+/CD8+; +/CD20+; CD5+/CD19+; CD19+/CD20+
Los datos obtenidos se analizaron con el empleo del programa informático Kaluza, versión 1.2. Se consideró positivo, si el porcentaje de expresión del antígeno fue igual o mayor que 20 % en los linfocitos leucémicos.
Resultados
La estrategia diagnóstica propuesta por los investigadores para el análisis permitió la identificación y cuantificación de los antígenos expresados en la población de linfocitos procedentes de la MO.
En la Fig.1A se obtuvo la distribución de las células del paciente en estudio atendiendo a su tamaño y complejidad interna. Por su parte, la Fig.1B muestra la ventana de selección (Gate, traducido del inglés) CD45/SSC, donde se discriminó la población de linfocitos, sobre la cual se realizó el análisis.

Fig.1- Distribución total de las células procedentes de la médula ósea de un paciente con LLC, según su tamaño y complejidad interna. A) N: % total de células contadas. Separación de la población de linfocitos maduros mediante la utilización de CD45 vs SSC. Tamaño y complejidad interna, respectivamente. B) BF: % de la población de linfocitos maduros en relación con el % total de células contadas. AcMo conjugado al fluorocromo APC
En la identificación de los antígenos mediante ensayo multiparamétrico de 4 colores, la expresión del CD3 fue 16,99 %; el CD4, 8,99 % y el CD8 8,50 % (Fig 2A, B, C); y la coexpresión de los antígenos CD3+/CD4+ del 8,73 % y del CD3+/CD8+ 7,39 % (Fig. 2D, E), los cuales resultaron negativos en este estudio.
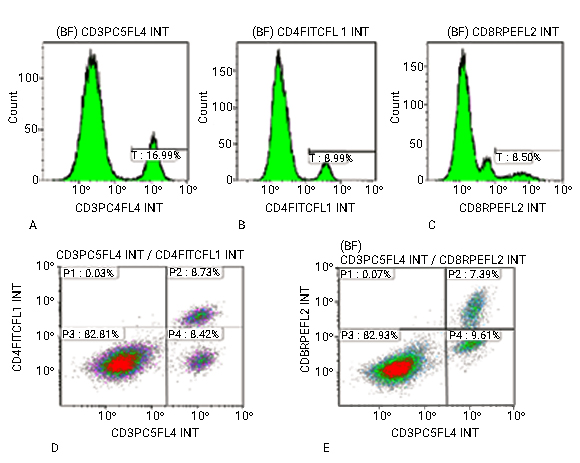
Fig. 2- Histogramas que muestran la intensidad de fluorescencia media (IFM) de la expresión negativa de los antígenos. A) CD3. B) CD4. C) CD8. Gráficos de dotplot que muestran una población doble negativa para los antígenos BF: Población de linfocitos sobre la cual se realizó el análisis. Count: Señal de fluorescencia. CD3PC5, CD4FICT, CD8RPE: AcMo conjugados a los fluorocromos PC5, FICT, RPE respectivamente. D) CD3+/CD4+. E) CD3+/CD8+ respectivamente. P1, P2, P3, P4: % de expresión antigénica sobre la población de linfocitos
La expresión de los antígenos CD5 fue 80,25 %; CD19 99,94 % y CD20 81,56 % (Fig. 3A, B, C) y la coexpresión de los antígenos CD5+/CD20+, 80,56 %; CD5+/CD19+ 96,56 %, CD19+/CD20+ 84,86 % (Fig. 3D, E, F).
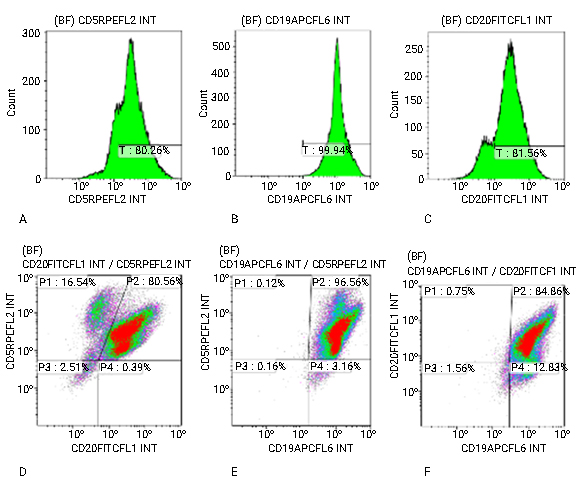
Fig. 3- Histogramas que muestran intensidad de fluorescencia media (IFM) de la expresión positiva de los antígenos CD5. A) CD19. B). CD20. C). Gráficos de dotplot que muestran la coexpresión positiva de los antígenos CD5+/CD20+. BF: Población de linfocitos sobre la cual se realizó el análisis. Count: Señal de fluorescencia. CD5RPE, CD19APC, CD20FICT: AcMo conjugados a los fluorocromos RPE, APC, FICT, respectivamente. D) CD5+/CD19+. E y F). CD19+/CD20+ , respectivamente. P1, P2, P3, P4: % de expresión antigénica sobre la población de linfocitos.
La monoclonalidad de la cadena ligera de Ig к, evaluada a través de la IFM de expresión de la cadena ligera к (44,27 %) y la ausencia en la expresión de la cadena ligera λ (0,16 %), se muestra en la Fig 4.
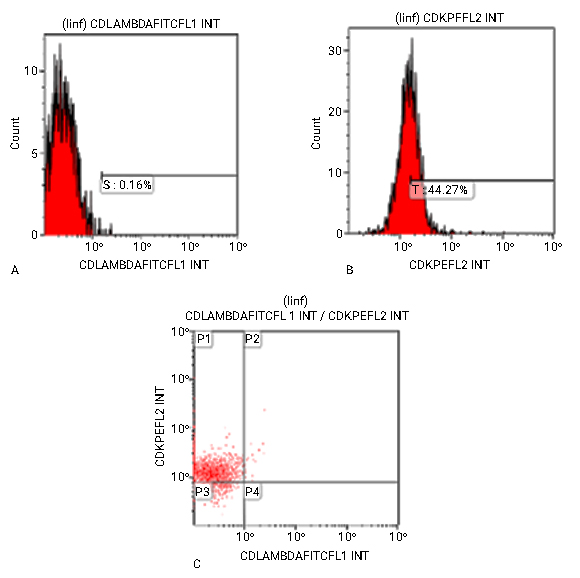
Fig. 4_ Histogramas de fluorescencia que muestran la ausencia en la expresión de la cadena ligera λ. A) expresión de la cadena ligera к. B) Gráfico de dotplot que muestra la expresión de la cadena ligera к y ausencia en la expresión de la cadena ligera λ. linf: Población de linfocitos sobre la cual se realizó el análisis Count: Señal de fluorescencia. Lambda FICT, KRPE: AcMo conjugados a los fluorocromos FICT, RPE, respectivamente. C) indica monoclonalidad de la cadena ligera к. P1, P2, P3, P4: % de expresión antigénica sobre la población de linfocitos
La expresión de los antígenos CD49d (65,18 %), CD23 (62, 65 %) y CD38 (52,17 %) (Fig. 5A, B, D) resultó positiva y la expresión del antígeno CD25 (0,61 %) fue negativa (Fig. 5C)

Fig. 5- Histogramas que muestran la intensidad de fluorescencia media (IFM) de la expresión positiva de los antígenos CD49d. A) CD23. B) CD38. C y D) expresión negativa del antígeno CD25, respectivamente. BF, BG: Población de linfocitos sobre la cual se realizó el análisis. Count: Señal de fluorescencia. D) CD38. CD49dFICT, CD23RPE, CD25RPE, CD38FICT: AcMo conjugados a los fluorocromos FICT, RPE, respectivamente.
Discusión
La inmunofenotipificación a través de la CMF es de gran utilidad en oncohematología para la identificación de las células neoplásicas, la definición de las células leucémicas y la subclasificación de diversas enfermedades en base a la línea celular que les da origen. Por ello, la CMF constituye un criterio objetivo, que integrado con parámetros clínicos, biológicos y morfológicos permite arribar a un diagnóstico final.12Actualmente es la técnica fundamental para el diagnóstico de la LLC.13
El inmunofenotipo es la prueba para confirmar el diagnóstico por la presencia de linfocitos B clonales, que expresan CD5, CD19, CD20, CD23 y ausencia de FMC- 7. Opcionalmente se considera a la expresión de CD79b-/+ tenue, CD43+tenue y CD200++ como una ayuda diagnóstica. La infiltración clonal de la médula ósea (>30 %) es diagnóstico de LLC independientemente del recuento de linfocitos B periféricos. El inmunofenotipo es capaz de excluir otros desórdenes linfoproliferativos B, específicamente linfoma del manto (LM), tricoleucemia (TL), linfoma de la zona marginal y linfoma linfoplasmocítico.14
El estudio de la CMF permitió la caracterización inmunofenotípica de las células leucémicas como linfocitos B maduros que expresaron los antígenos pan-B CD19 y CD20. Estos resultados están en consonancia con los datos de la literatura que seleccionan CD19 como uno de los mejores antígenos para el análisis inmunofenotípico de las neoplasias de células B, incluida la LLC. También, expresaron CD23. En un estudio realizado por Di Raimondo y otros se demostró que la variante de LLC / CD23- era rara, sólo se presentó en 6 % de los pacientes.
Una característica particular de los linfocitos de la LLC-B es la expresión del antígeno CD5, un marcador de células T que se expresa en un sub-grupo de células B. Resultados similares se encontraron en estudios realizados por Panalis y otros, y Deneys y otros, donde la frecuencia de la expresión de CD5 en la LLC fue aproximadamente 98 % de los pacientes en estudio. La identificación de fenotipos aberrantes presentes en casi la totalidad de los síndromes linfoproliferativos crónicos B (SLPC-B) es un signo inequívoco de clonalidad, sin requerir en este caso confirmación molecular.15 Dentro de los fenotipos aberrantes el más frecuente es la expresión anómala de CD5 combinado con la restricción de las cadenas ligeras de Igs. La coexpresión de los antígenos CD5+/CD19+ permitió, en esta investigación, la diferenciación de la LLC y LM (CD5+) de otros SLPC-B, como la leucemia prolinfocítica-B o TC (CD5- o de baja densidad.16
Las proliferaciones neoplásicas de linfocitos B muestran restricción de cadenas ligeras. La clonalidad de las células neoplásicas es la característica más importante para distinguir entre un proceso neoplásico y un proceso reactivo. La clonalidad de las células B puede ser determinada de manera directa por la expresión de las cadenas ligeras de Ig a nivel citoplasmático o en la superficie (k o λ) en la población de células patológicas.17 Por lo tanto, la demostración de cadenas ligeras es un procedimiento muy importante en el diagnóstico de neoplasias de linfocitos B.18 Los linfocitos B producen cantidades pequeñas de Igs, por lo que se requieren técnicas de detección muy sensibles.19) Este estudio demostró por la técnica CMF, la restricción de la cadena ligera k, marcador individual más importante de neoplasia de linfocitos B.
En la actualidad, se describen varios marcadores inmunofenotípicos de pronóstico en la LLC-B. Se recomienda la inclusión de los paneles de AcMo de aquellos dirigidos contra los antígenos CD38, CD49d y ZAP70. Se considera de mal pronóstico cuando el paciente tiene más del 30 % de células leucémicas que expresan CD38, CD49d, o ambos, o más del 20 % de expresión de ZAP70.1
El marcador CD38 es una glicoproteína membrana que se expresa en la superficie de algunas de las células de la LLC que marca la activación y maduración celular, tiene actividad de señalización y ha sido estudiado recientemente en numerosos trabajos. La expresión de CD38 en células de la LLC-B se asocia con un pronóstico global de la enfermedad menos favorable y en los estudios iniciales se consideró como un marcador subrogado para los dos subgrupos importantes de la LLC-B: región variable de la cadena pesada de las inmunoglobulinas (VCPIg) mutado y no mutado.16 Sin embargo, después de la publicación de un buen número de trabajos, se ha podido demostrar claramente que aunque la expresión de CD38 tiene cierto grado de correlación con el estado de mutación de la VCPIg, ambos parámetros se consideran variables pronósticas independientes en la LLC-B.20)
Por su parte, la ZAP-70 es una molécula de señalización clave para linfocitos T y NK y aun cuando no se expresa en linfocitos B normales se asocia con incremento en la señalización intracelular del receptor de Igs en las células de LLC-B. En este sentido, varios estudios han evaluado la relación entre las alteraciones citogenéticas, el estado mutacional de las VCPIg y la expresión del Ag CD38 o ZAP70. Basándose en la combinación de estos marcadores se ha intentado realizar una estratificación de riesgo de progresión de la enfermedad.21 Por otro lado, el grupo de Roth ha reportado recientemente que la longitud de los telómeros de los linfocitos T de pacientes ZAP-70+CD38+ es significativamente menor a la de aquellos pacientes ZAP-70- CD38-, lo que sugiere una mayor expansión clonal de los primeros.22
Por su parte, el CD49d es la cadena α4 de la integrina que se empareja de forma no covalente con CD29 (cadena β1) para formar el antígeno de activación muy tardía 4 (VLA-4) y no solo participa en la adhesión celular a la fibronectina y a la molécula de adhesión celular vascular 1 (VCAM-1), sino también en las interacciones de los leucocitos intercelulares. Se expresa en monocitos, linfocitos, eosinófilos, timocitos y células de Langerhans.23
En el presente estudio, la expresión de los antígenos CD38 y CD49d resultó en más del 30 %, lo que se relaciona con un mal pronóstico de la enfermedad.
Como principal aporte científico cabe resaltar el algoritmo de trabajo que se propone para el diagnóstico por citometría de flujo de la LLC.
Consideramos que constituye una limitación de este estudio el no haber podido cuantificar la expresión del antígeno intracitoplasmático ZAP-70, evaluación a tener presente en próximas investigaciones.
Los resultados de este trabajo demostraron que el flujograma propuesto por los investigadores, permitió identificar el porcentaje de positividad de los antígenos más frecuentemente expresados en pacientes con LLC. Se determinó su coexpresión y monoclonalidad de la cadena ligera k, marcadores celulares que permiten realizar el diagnóstico inmunofenotípico de la leucemia linfoide crónica por citometría de flujo.















