Introducción
La trombosis se puede definir como un trastorno vascular que se presenta cuando se forma un trombo que bloquea de forma total o parcial el interior de un vaso sanguíneo, ya sea una vena o una arteria.1 El término trombofilia se refiere a una alteración de la hemostasia que predispone al desarrollo de trombosis y representa uno de los componentes de la triada de Virchow, descrita en 1856, junto con las condiciones del flujo sanguíneo y las alteraciones de la pared vascular.2 Sin embargo, la presencia de una trombofilia no implica necesariamente la aparición de un evento trombótico.
La enfermedad trombótica surge como resultado de la conjunción de varios factores: genéticos, ambientales o condiciones adquiridas que determinan la expresión fenotípica o clínica individual de la enfermedad.3
Las trombofilias pueden ser hereditarias o adquiridas y constituyen un factor de riesgo para desarrollar trombosis. En la actualidad los principales factores de riesgo hereditarios aceptados como predisponentes al desarrollo de trombosis venosa (no arterial) incluyen las deficiencias de los principales inhibidores fisiológicos de la coagulación: antitrombina (AT), proteína C (PC) y proteína S (PS); así como los polimorfismos genéticos factor V Leiden (FV Leiden), Protrombina G20210A y la metiltetrahidrofolatoreductasa (MTHFR).2,4 Las manifestaciones clínicas son variables y dependen de la región vascular afectada por la ausencia de flujo sanguíneo.
La trombosis venosa es una de las principales manifestaciones clínicas de las trombofilias que tiene un espectro de incidencia anual de 0,7 a 0,14 por 10 000 niños menores de 18 años, de 1 en 100 en la edad geriátrica, y un promedio de 1 en 1 000 en la población general.5,6) Datos actuales sugieren que los eventos trombóticos durante el embarazo están asociados con trombofilias, las que han sido relacionadas con otras complicaciones obstétricas como pérdidas recurrentes de embarazo, muerte fetal intrauterina, preclampsia, y retardo del crecimiento fetal.7
La prevalencia de la mutación de la PC se estima entre el 0,2 - 1,5 % en la población general, es más común entre los descendientes asiáticos y africanos y se encuentra entre 2,5 - 6 % de los pacientes con el primer episodio de tromboembolismo venoso (TEV).8,9,10 El riesgo de TEV primario con deficiencia de PC durante el embarazo se encuentra en el rango 0,1 - 0,8 %.11 Mientras que el riesgo de TEV recurrente varía dentro del rango de 4 - 17 %.12
La deficiencia de la PS es menos común, con una prevalencia de 0,03 - 1,3 % en la población general7,8,9,10 0,03 - 0,13 % entre la población blanca(9, 10,11,12) y 1,1 - 5 % en pacientes con TEV.8)
El TEV se desarrolla en hasta el 20 % de mujeres con deficiencia de PC o deficiencia de PS durante el embarazo y el postparto.8,11)
Con la incorporación de nuevos métodos analíticos, el laboratorio de Hemostasia del Instituto de Hematología e Inmunología, está en capacidad de estudiar diversas condiciones protrombóticas, así como facilitar la individualización de medidas profilácticas y terapéuticas, según el tipo de alteración.
Este trabajo tuvo como objetivo determinar cómo incide la deficiencia de PC y PS en pacientes con historia obstétrica adversa (HOA), eventos de trombosis u otros eventos clínicos (OEC), remitidos al Instituto de Hematología e Inmunología.
Métodos
Se realizó un estudio longitudinal prospectivo en el período comprendido entre los años 2011 al 2018, en pacientes con HOA, eventos de trombosis y OEC, remitidos al Instituto de Hematología e Inmunología. Se incluyeron pacientes pediátricos y adultos hasta 65 años de edad sin tratamiento con anticoagulación. En todos los casos (n=270) fueron respetados los principios éticos relacionados con la investigación en seres humanos.13
La muestra de sangre de cada paciente se obtuvo por punción venosa y se colocó en tubos con citrato de sodio al 3,2 % como anticoagulante; 9 mL de sangre con 1 mL de anticoagulante, se centrifugó a 3 500 rpm durante 10 min y se almacenó el plasma en alícuotas de un 1 mL a -20 oC. La medición de los niveles plasmáticos de PC y PS se realizó por el método cuantitativo en el coagulómetro automático STA Compact Max3 de STAGO con los reactivos de la propia marca y compañía. Las mediciones se hicieron en plasma citratado congelado, pobre en plaquetas, el cual fue descongelado a 37 oC, previa espera de 15 min antes de realizar la prueba.
La medición de la PC se basa en la prolongación de la prueba de tiempo parcial de Tromboplatina Activada (APTT) con el empleo de un activador específico extraído del veneno de Agkistrodon contortrix. El rango normal con este método en casos sanos se estableció entre 70 y 130 %.
La actividad de la PS libre se hizo por la medición del tiempo de coagulación en un sistema que incluye plasma humano liofilizado desprovisto de PS, PC activada humana, factor Va bovino y calcio. En sujetos sanos se considera normal en un rango entre 55 y 140 %.
Para el análisis estadístico se utilizó una base de datos confeccionada en Microsoft Office Excel 2010 y el paquete estadístico SPSS versión 15.0 para Windows. Se determinaron las frecuencias absolutas y relativas de las variables: edad, sexo, eventos trombóticos y obstétricos. Para evaluar la asociación entre las deficiencias de proteínas y los eventos trombóticos y obstétricos se realizó la prueba de (2. Se consideraron significativos los valores de p( 0,05.
Resultados
Durante el período se estudiaron 270 pacientes con antecedentes de algún evento de trombosis venosa o arterial, HOA u otros eventos relacionados. El rango de edad estuvo comprendido entre 15 meses y 65 años. El 17,4 % eran niños (entre 15 meses y 18 años) y el 74,8 %, adultos (entre 19 y 65 años). En el 7,8 % restante no fue registrada la edad.
En 133 pacientes (52,17 %) se detectó deficiencia de PC (n=50), PS (n=66) o ambas (n=17).
La HOA y los eventos trombóticos fueron las principales causas que motivaron la realización de estos estudios. Le siguieron en orden de frecuencia, otros tipos de eventos (ICTUS, pérdida de conciencia, policitemia vera, isquemias transitorias); el síndrome de plaquetas pegajosas (SPP) y el síndrome antifosfolipídico (SAF) (Fig. 1).
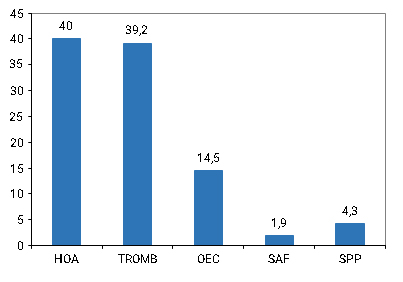 Leyenda: HOA: historia obstétrica adversa, TROMB: trombosis, OEC: otros eventos clínicos, SAF: síndrome antifosfolípidos, SPP: síndrome de plaquetas pegajosa
Leyenda: HOA: historia obstétrica adversa, TROMB: trombosis, OEC: otros eventos clínicos, SAF: síndrome antifosfolípidos, SPP: síndrome de plaquetas pegajosaFig. 1 - Distribución de pacientes por evento clínico
La deficiencia de PS fue la de mayor incidencia en todos los tipos de eventos, aunque se encontró predominio de deficiencia de PC y PS en la HOA y los eventos trombóticos (Fig. 2).
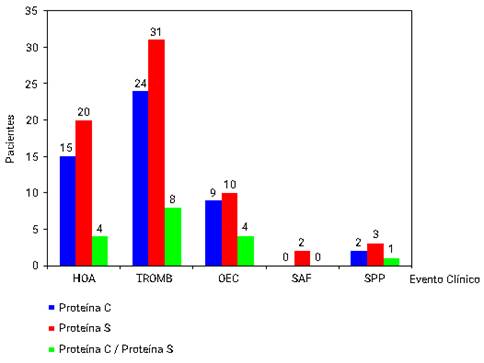 Leyenda: HOA: historia obstétrica adversa, TROMB: trombosis, OEC: otros eventos clínicos, SAF: síndrome antifosfolípidos, SPP: síndrome de plaquetas pegajosa.
Leyenda: HOA: historia obstétrica adversa, TROMB: trombosis, OEC: otros eventos clínicos, SAF: síndrome antifosfolípidos, SPP: síndrome de plaquetas pegajosa.Fig. 2 - Total de pacientes con deficiencia de proteína C y S distribuido por evento clínico
No se encontraron diferencias significativas entre la deficiencia de PC, PS y PC/PS con los eventos clínicos estudiados. PC (p=0,33), PS (p=0,40), PC/PS (p=0,55).
Discusión
La trombosis venosa profunda (TVP) es una entidad frecuente, con una incidencia anual de 1 por 1 000 en la población general. Por lo menos el 80 % de los pacientes con trombosis tiene una causa definida. De estos la mitad tiene una condición clínica que lleva a trombosis y el resto tiene un defecto proteico adquirido o hereditario que causa trombosis.14
Aunque las deficiencias hereditarias de PC y PS son poco frecuentes; y pueden ser identificadas dentro de familias seleccionadas con una fuerte historia de trombosis; están presentes en menos del 0,5 % de la población general, pero se asocian con una tendencia trombofílica grave que puede verse potenciada al aparecer interacciones entre estas deficiencias.15,16 Las implicaciones clínicas dependen del riesgo absoluto de padecer el primer episodio o un episodio recurrente de trombosis venosa en personas con un solo defecto o en aquellas con defectos combinados.17
Se encontró una prevalencia del sexo femenino que determinó que la HOA fuera la principal causa de estudio. Por su parte la distribución por edades fue similar a lo comunicado en la literatura.15
La ausencia de asociación significativa entre las deficiencias de proteínas C y S y los eventos estudiados, contrasta con lo planteado en la literatura, donde se plantea una relación entre la deficiencia de estas proteínas con las trombosis, a consecuencia de su carácter hereditario.2,18,19
Algunos autores plantean que la deficiencia de PS es menos frecuente,8 sin embargo otros estudios reportan que esta deficiencia proteica es predominante en todos los tipos de eventos,20) como ocurrió en el presente estudio.
La deficiencia de las proteínas C y S constituye una causa importante de predisposición en la aparición de eventos tromboembólicos. Clínicamente es imposible distinguir entre la deficiencia de estas moléculas u otras causas de trastornos hipercoagulables primarios; por lo que es indispensable tener en cuenta estas entidades como posibles causas, con el fin de realizar un tratamiento oportuno y mejorar la calidad de vida de estos pacientes.














