Introducción
Las quimiocinas constituyen una gran familia de péptidos que se caracterizan por un grado relativamente alto de similitud en sus secuencias de aminoácidos, pequeños pesos moleculares y presencia de cisteínas en posiciones conservadas que dan como resultado una estructura tridimensional característica. Una función común para esta familia de proteínas surgió en 1987 cuando se descubrió que la interleucina-8 (IL-8), más tarde llamada CXCL8, mostraba una potente actividad quimiotáctica para los neutrófilos, lo que conllevó al descubrimiento revolucionario de que la mayoría de los miembros de esta familia de moléculas promueven la migración direccional. En 1992, considerando el alto número de estos ligandos que podían atraer leucocitos, se les llamó oficialmente quimiocinas, una combinación de las palabras "quimiotáctica" y "citocina", es decir, citocinas que promueven la quimiotaxis.1
Los estudios sobre la IL-8 demostraron que las quimiocinas pueden regular varias funciones en los leucocitos además de la quimiotaxis, el estallido respiratorio, los cambios en la forma de las células y la exocitosis. Sin embargo, pronto el campo de investigación se centró en la quimiotaxis, función que es crucial para el control de la posición de los leucocitos durante la respuesta inmune. En este sentido, la mayoría del trabajo realizado sobre los receptores de quimiocinas se ha centrado en su capacidad para controlar la quimiotaxis.1
Podría ser que el nombre de quimiocina, que describe muy bien una función clave de estos ligandos, podría tener la consecuencia involuntaria de sugerir a los no especialistas en el campo de las quimiocinas que, estas moléculas controlan exclusivamente la quimioatracción en los leucocitos. En esta revisión se presentan evidencias que indican que las quimiocinas regulan múltiples funciones, lo que implica que la quimioatracción es solo una de las varias funciones controladas por estas moléculas en los leucocitos. También se ha realizado una clasificación funcional de las quimiocinas basada en el análisis de las funciones específicas que controlan en los leucocitos.2
Se considera que una función leucocitaria es inflamatoria cuando está asociada intrínsecamente con la respuesta inflamatoria, lo que implica que está activa solo durante esta respuesta y que permanece apagada durante las condiciones normales. Una función leucocitaria se considera homeostática cuando se requiere en condiciones fisiológicas normales. Las funciones homeostáticas no se cierran necesariamente durante la inflamación porque pueden controlar los procesos celulares básicos.
Las funciones inflamatorias incluyen estallido respiratorio, formación de NET (trampa neutrofílica extracelular), fagocitosis (de patógenos), degranulación y exocitosis. Se considera que la exocitosis es inflamatoria u homeostática, según el resultado funcional de la secreción.
La secreción de los siguientes componentes proinflamatorios puede considerarse inflamatoria:
las aminas vasoactivas, como la histamina y los eicosanoides, como el leucotrieno C4, remodelan la vasculatura local en sitios inflamatorios;
las citoquinas inflamatorias IL-1, IL-6, IL-17, TNF-a y las quimiocinas (CXCL8, CCL2 y CCL3) estimulan los leucocitos durante la inflamación y
las proteasas microbicidas como gelatinasa, elastasa y granzima A, contribuyen a la eliminación de patógenos.3
La diferenciación puede considerarse como inflamatoria cuando ocurre solo durante la inflamación y el leucocito diferenciado promueve respuestas inflamatorias en los sitios de inflamación. Por ejemplo, las células dendríticas promueven la diferenciación de células T CD4 vírgenes en células T efectoras tipo 1 (Th1) o células T CD4 Th17 que migran a sitios inflamatorios donde secretan citoquinas proinflamatorias. Por lo tanto, la diferenciación de Th1 y Th17 de las células T CD4 puede considerarse un proceso inflamatorio.4
Las funciones homeostáticas incluyen la supervivencia celular, la proliferación y la endocitosis, múltiples procesos asociados con la migración de leucocitos, incluida la polimerización de actina y el remodelado de citoesqueleto, que resultan en la integración de integrina en adherencia a la matriz extracelular (detención) o a otras células (unión célula-célula), quimiotaxis, haptotaxis, quimiocinesis, migración transendotelial, quimiorrepulsión y haptorrepulsión.5
La secreción de proteínas que regulan las funciones homeostáticas o que no promueven directamente o incluso inhiben la inflamación puede considerarse homeostática. Por ejemplo, la secreción de CCL19, que induce la proliferación en las células T, es homeostática. La liberación de IL-10 antiinflamatoria por los monocitos tras la estimulación con CCL19 también puede considerarse homeostática.6
La diferenciación puede considerarse homeostática cuando se lleva a cabo en condiciones homeostáticas normales y el leucocito diferenciado no promueve directamente la inflamación en los sitios inflamatorios. Por ejemplo, la diferenciación de monocitos, macrófagos y células precursoras de Langerhans inducida por CXCL12 y CXCL14, respectivamente, puede considerarse homeostática.7
La lista de funciones compiladas y la clasificación presentada proporcionan un marco útil para comprender mejor las funciones cruciales que desempeñan las quimiocinas y sus receptores en la organización y ejecución de las respuestas inmunitarias y su relación con la medicina transfusional. Por ello el objetivo de la revisión fue analizar los conocimientos actuales sobre las quimiocinas y sus receptores, y la significación clínica de estas en la medicina transfusional y el trasplante.
Métodos
Se realizó revisión de la literatura a través del sitio web PubMed y el motor de búsqueda Google académico de artículos publicados en los últimos 10 años, empleando como palabras clave quimiocinas; receptores de quimiocinas; trasplante de progenitores hematopoyéticos; enfermedad de injerto contra huésped; reacción transfusional. De los trabajos seleccionados 78 % fueron artículos originales y de revisión, publicados entre los años 2015-2019 en los idiomas inglés y español; agregando 22 % de bibliografía de años anteriores. Se hizo análisis y resumen de la bibliografía y se escogieron los aspectos más importantes referidos al tema.
Análisis y síntesis de la información
Características generales
Las quimiocinas son proteínas secretadas con tamaño en el rango de 8-10 kDa, con numerosas funciones en la fisiología normal y patológica. El término deriva de las palabras citocinas quimiotácticas, que refleja su importancia en la quimioatracción de leucocitos. Sin embargo, las evidencias muestran que las quimiocinas tienen muchas otras funciones como la comunicación intercelular, activación celular y regulación del ciclo celular.1,2
La transcripción de la mayoría de los genes de quimiocinas son inducibles y se produce en respuesta a estímulos celulares específicos. Estas han sido clasificadas como quimiocinas proinflamatorias por su importante implicación en la regulación inmune y en la respuesta inflamatoria, aunque estos mediadores no solo se producen en la inflamación. Algunas se producen a niveles tónicos fisiológicos, en particular, en el mantenimiento de la médula ósea normal y tejido linfoide y se clasifican como quimiocinas homeostáticas. Esta clasificación no es completamente definida porque en algunas condiciones las quimiocinas homeostáticas son inducibles.8
La mayoría de las quimiocinas fueron nombradas originalmente por su primera actividad biológica identificada como quimioatrayente de monocitos. Esto llevó a que muchas de estas moléculas tuvieran varios sinónimos antes de que se establecieran sus identidades moleculares. Una vez que quedó claro que hay marcadas similitudes estructurales entre las quimiocinas, se estableció una nomenclatura sistemática racional por el Subcomité de Nomenclatura de Quimiocinas del Comité de Nomenclatura de la Unión Internacional de Sociedades de Inmunología y se agruparon de acuerdo con las similitudes estructurales y al contenido de residuos conservados de cisteína.
Las clases más grandes son las quimiocinas CC en las que las primeras dos de las cuatro cisteínas son adyacentes y las quimiocinas CXC que tienen un aminoácido intermedio entre las dos primeras de cuatro cisteínas. Las quimiocinas CXC a su vez se han subdividido según la presencia o ausencia del motivo Glu-Leu-Arg (ELR) cerca del amino terminal, designado como ELR+yELR-, respectivamente. Dos clases menores son C, quimiocinas que retienen solo una cisteína en el extremo amino y quimiocinas CX3C con tres aminoácidos intermedios. Actualmente se han identificado solo dos quimiocinas C y una CX3C (Fig. 1).9,10
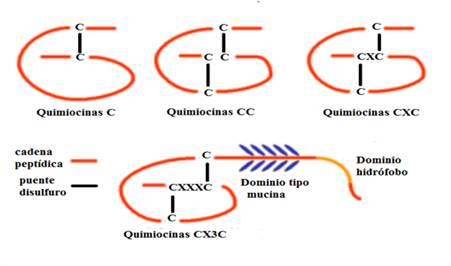
Fuente: Tomado y modificado de: Panda S, et al. Chemokines accentuating protumoral activities in oral cancer microenvironment possess an imperious stratagem for therapeutic resolutions. Oral Oncol. 2016;60:8-17. DOI: 10.1016/j.oraloncology.2016.06.008).10
Fig. 1 Estructura de las diferentes clases de quimiocinas.
En la nomenclatura sistemática cada quimiocina se designa por su clase seguida de la letra L (para ligando) y un número basado en el orden cronológico en el que fue identificado. Los receptores de quimiocinas son denotados de manera similar por la clase a la que se une, la letra R (receptor) y un número. La secuencia de homología entre las quimiocinas da como resultado similitudes en la estructura terciaria. Tanto las quimiocinas CC como las CXC tienen una estructura básica formada por tres láminas β antiparalelas y orientación relativa mantenida por puentes disulfuro (Fig. 2).9,11
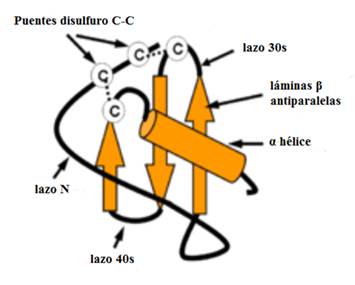
Fuente: Tomado y modificado de: Chew AL, et al. Potential combinatorial effects of recombinant atypical chemokine receptors in breast cancer cell invasion: A research perspective. Biomed Rep. 2013;1(2):185-92.11
Fig. 2 Estructura tridimensional de las quimiocinas.
Las quimiocinas se caracterizan por asociarse espontáneamente en homodímeros y la forma en que estos dímeros se asocian es diferente entre las quimiocinas, a pesar de las similitudes en la estructura terciaria. Por ejemplo, los extremos amino terminal de los dímeros CCL5 están estrechamente asociados y antiparalelos. Por otro lado, los dímeros CXCL8 se asocian entre las primeras hojas β de los monómeros dejando el extremo amino terminal expuesto externamente. También es posible la formación de heterodímeros entre quimiocinas de la misma clase e incluso entre clases diferentes como las demostradas en las combinaciones de CXCL1/CXCL7, CXCL4/CXCL8, CCL2/CCL5, CCL2/CCL8, CXCL4/CCL5, CXCL4/CCL2 y CXCL8/CCL2, aunque la importancia de tales uniones no ha sido dilucidada.12,13
Transducción de señales
Los receptores de quimiocinas pertenecen a la superfamilia de moléculas receptoras acopladas a proteína G que contienen siete dominios transmembrana. Las características estructurales comunes son una porción extracelular que consta de tres bucles peptídicos y un extremo amino y una porción intracelular con tres bucles peptídicos y un extremo carboxilo terminal rico en serina/treonina. Los receptores de quimiocinas transducen señales a través del acoplamiento con proteína G. Estos receptores contienen un motivo Asp-Arg-Tyr (DRY) conservado que es común a prácticamente todos los receptores acoplados a la proteína G.14,15
En el lenguaje de comunicación de quimiocinas, el resultado final sobre la función celular depende del ligando, el receptor y la célula diana. Por lo tanto, hay sinónimos, homónimos, antónimos e incluso palabras sin sentido en este vocabulario. Por ejemplo, CXCL6 y CXCL8 son sinónimo en el sentido de que ambos inducen quimiotaxis de neutrófilos a través de CXCR2, aunque difieren en potencia, lo que da sutiles matices al lenguaje.15
La señalización de CXCL8 a través de CXCR1 en neutrófilos contribuye a la respuesta inflamatoria; mientras que en las células endoteliales la combinación de este receptor/ligando estimula la angiogénesis, por lo que se pueden considerar como homónimos. La CCL7 actúa como un antagonista de la unión de CCL4 y de la señalización a través de CCR5, por lo que estas dos quimiocinas están en un sentido antónimo.15
Receptores sin señalización, como el antígeno Duffy receptor de quimiocinas (DARC), no causa respuesta celular por lo que la unión de ligandos a este receptor puede ser entendida como comunicación sin sentido. El lugar de los heterodímeros en el vocabulario de quimiocinas es incierto, pero se plantea la posibilidad de neologismos complejos.16
Además de los receptores funcionales, existen varios receptores silenciosos no funcionales que unen muchas quimiocinas. Estos receptores facilitan la localización, el transporte y el metabolismo de quimiocinas. Los glucosaminoglicanos (GAG) en la superficie luminal de las células endoteliales se unen a todas las clases de quimiocinas en una orientación que facilita la presentación a receptores de leucocitos. La estructura terciaria común de las quimiocinas permite la unión de estas moléculas a GAGs en una orientación que permite la presentación y unión del receptor de quimiocinas de leucocitos a las quimiocinas circulantes. A medida que los leucocitos ruedan a lo largo de la superficie endotelial, se encuentran con quimiocinas unidas a GAG.17
Esta señalización estimula rápidamente la adhesión mediada por integrina. Estos leucocitos activados pueden luego transmigrar hacia el espacio extravascular. En la matriz intercelular, los GAG también se unen a las quimiocinas, y permite establecer un gradiente de concentración que se mantiene en el tejido. Los leucocitos pueden entonces viajar por este gradiente estabilizado, denominado "haptotaxis". Existen diferencias considerables entre las quimiocinas con respecto a donde residen los dominios de unión de GAG. En CCL5, el motivo de unión se encuentra dentro del bucle 40s entre la segunda y tercera hoja β. En CXCL8, el enlace al dominio GAG se encuentra en el extremo carboxilo terminal.18,19
Receptores atípicos de quimiocinas
Antígenos e interceptores Duffy
Las quimiocinas CC y CXC se unen a los antígenos Duffy (Fy) lo que se conoce como DARC (del inglés Duffy Antigen/Receptor for Chemokines); actualmente nombrado como ACKR1 (del inglés Atipical Chemokines Receptor 1). La proteína Fy carece del motivo DRY, necesario para la señalización de la proteína G. El complejo DARC se expresa en células endoteliales de vénulas poscapilares de piel, riñón, pulmón, bazo y vénulas endoteliales altas de los ganglios linfáticos; esta expresión puede ser inducida por la inflamación en la arteritis de células gigantes, artritis reumatoide, nefritis y rechazo del trasplante renal.16,20,21
Las quimiocinas homeostáticas se unen preferentemente a DARC, pero con baja afinidad. Las angiogénicas ELR+CXCL1, CXCL3, CXCL5, CXCL6 y CXCL8 se unen a DARC mientras que las angiostáticas CXCL9 y CXCL10 no. Aunque DARC no parece ser un receptor de señalización, la unión a este puede dar lugar a pinocitosis y al transporte a través de vesículas internalizadas de células endoteliales hasta la membrana opuesta. Debido a esta actividad, se ha denominado un «interceptor», para internalizar el receptor. Así, DARC puede presentar quimiocinas proinflamatorias para leucocitos circulantes en sitios de inflamación y promover la neoangiogénesis.21
Recientemente se ha propuesto una explicación alternativa de la función DARC. Se plantea que forma constitutivamente oligómeros en la superficie celular y es capaz de formar heteroligómeros con CCR5. Estos receptores híbridos tienen la señalización disminuida pero están internalizados normalmente.21
Se ha sugerido que la ausencia de antígenos Fy en los eritrocitos puede ser un factor que contribuye a la mala supervivencia del aloinjerto renal en individuos Fy negativos, aunque los datos recientes cuestionan esto. Actualmente, no hay evidencia definitiva de que la falta de expresión de antígenos Fy tenga algún efecto fisiológico o patológico significativo.
Interceptor de quimiocinas D6
Se ha observado que D6 es capaz de experimentar internalización constitutiva independiente del ligando y como DARC, no interviene en la señalización mediada por proteína G. Cuando D6 se une a quimiocinas, entra rápidamente a la célula a través de los compartimentos endosomales, se disocia del receptor y la quimiocina internalizada queda atrapada dentro de la célula y marcada para degradación. Simultáneamente, D6 se recicla a la superficie celular para continuar con el secuestro de quimiocinas. Este tráfico no se afecta por la exposición a quimiocina, la señalización inducida por quimiocina no es requerida y el receptor se recicla sin causar reducción en la expresión de D6 en la superficie celular lo cual permite la remoción de gran número de quimiocinas proinflamatorias libres.22
Interceptor de quimiocinas CCX-CKR
El tercer interceptor de quimiocinas es CCX-CKR (también conocido como CCR11 o CCRL1) que como los anteriores, es sin señalización y la exposición continua a la quimiocina, aumenta la actividad de secuestro de CCX-CKR. Sin embargo, a diferencia de DARC y D6, este se une a quimiocinas homeostáticas como CCL19, CCL21, CCL25 y CXCL13 con gran afinidad. Estas quimiocinas participan en la migración de leucocitos y de células cancerígenas a través de su interacción con los receptores CCR7, CCR9 o CXCR5, respectivamente. Los receptores CCR7 y CXCR5 controlan la organogénesis en linfonodos,23 mientras que CCR7 y CCR9 controlan la localización de los timocitos durante el desarrollo de las células T. El CCR7 también regula el reclutamiento de CD, células T naive y algunas subclases de células T de memoria dentro de los compartimentos de los órganos linfoides secundarios y contribuye a la extravasación de las células B.24
hematopoyéticas (CPH)
Las quimiocinas desempeñan una función importante en la movilización de CPH para el trasplante y su localización después de trasplantadas. El CXCR4 se expresa en las CPHCD34+y su ligando CXCL12 se expresa constitutivamente por los osteoblastos y las células endoteliales de la médula ósea.25
El bloqueo de CXCR4 evita el injerto y la repoblación de la médula ósea de humanos y de ratones NOD/SCID. La movilización de CPH por factor estimulador de colonias granulocíticas (FEC-G) da como resultado una expresión superficial reducida de CXCR4, así como otras moléculas de adhesión como VLA-4, probablemente por escisión enzimática. Del mismo modo, la estimulación inducida por FEC-G resulta en la degradación enzimática de CXCL12.26
Con el desarrollo y aprobación del inhibidor competitivo de CXCR4, AMD3100, se ha observado que la movilización de CPH con una dosis única aumenta más de 10 veces la circulación de CPH CD34+ en trasplante autólogo de pacientes con mieloma múltiple y linfoma no Hodgkin y que la combinación FEC-G y AMD3100 aumenta 21 veces en comparación con FEC-G solo; sin fallos tardíos del injerto, ni efectos adversos significativos atribuidos al fármaco.26
Se están realizando ensayos clínicos más amplios con AMD3100, en pacientes que han fallado otros regímenes de movilización. Esta droga parece tener un potencial considerable para mejorar la recolección de CPH; simplifica la colección de donantes autólogos y evita el empleo de agentes citotóxicos. Una preocupación potencial en el entorno de trasplante autólogo es la posible movilización de células malignas, pero hasta la fecha esto no parece ser un problema. Una ventaja adicional potencial para el uso de ADM3100 con FEC-G es el nivel más alto de expresión de CXCR4 en CPH CD34+ recolectadas que pueden facilitar el homing de médula ósea antes del injerto.27
Quimiocinas y enfermedad injerto contra huésped
Las quimiocinas tienen funciones en la fisiopatología de la enfermedad injerto contra huésped (EICH). Hasta la fecha, el conocimiento de las quimiocinas en EICH proviene de modelos experimentales poco después del trasplante de CPH donante.28
Después de varios días de maduración se establece un tráfico de células T de donante injertado a órganos no linfoides, incluidos los objetivos típicos de EICH como la piel, el intestino, el hígado, y los órganos no clásicos, tales como riñón y cerebro. Esta secuencia ordenada es orquestada por quimiocinas, poco después del trasplante:29
En el tejido linfoide se expresan CXCL9, CXCL10 y CXCL11 seguido por CCL2, CCL3, CCL4 y CCL5.
En las células T del donante, la expresión de CCR5 es esencial en la localización en tejido linfoide.
En el hígado se expresan CCL2, CCL3, CCL4, CCL5, CXCL9, CXCL10 y CXCL11, durante la EICH experimental. La eliminación de CCL3 da como resultado una afección hepática reducida.
En la piel, CCL2, CCL6, CCL7, CCL9, CCL11 y CXCL1 se expresan temprano después del trasplante.
Se ha demostrado que CCL17 y CCL27 están involucradas en el reclutamiento de células T de memoria para piel durante EICH, lo que sugiere que estas quimiocinas pueden participar en la migración específica de tejido de células T alorreactivas durante la EICH.29
Las quimiocinas expresadas en pulmón después de un trasplante alogénico incluyen CXCL9, CXCL10, CXCL11, CCL2, CCL3, CCL4, CCL5 y CCL11; además, se ha demostrado que CXCR3 en linfocitos trasplantados es crítico para el reclutamiento de células T en pulmón. La función de estas redes de quimiocinas es dependiente, al menos en parte, del acondicionamiento previo al trasplante. En el modelo no condicionado, la eliminación de CCR5 de las células T trasplantadas produce menos acumulación de células en el hígado y el pulmón. Sin embargo, después del acondicionamiento mieloablativo, las células T CD4 + y CD8 + eliminadas por CCR5 son más abundantes en el hígado y los pulmones y existe una mayor lesión tisular.30
Las CXCL9 y CXCL10 median el reclutamiento de células T de donante para el pulmón en trasplante alogénico y el bloqueo de estas quimiocinas, así como la eliminación de CXCR3 en células T de donantes, reduce significativamente la infiltración celular y la enfermedad en el síndrome pulmonar idiopático.31
Interrelación con las plaquetas
Las moléculas CXCL4 y CXCL7 se identificaron en plaquetas como factor plaquetario 4 (FP4) y péptido activador de neutrófilos (NAP-2), respectivamente; mucho antes del primer derivado leucocitario descrito, IL-8. Posteriormente se descubrió que las plaquetas presentan CCL3, CCL5, CCL7, CCL17, CXCL1, CXCL5 y CXCL8 contenidas dentro de los gránulos α y que se secretan en la activación, siendo las plaquetas una fuente rica de quimiocinas durante la respuesta a una lesión o en la trombosis.32
La quimiocina CXCL4 es una ELR- y carece de actividad quimiotáctica de los neutrófilos. Sin embargo, potencia la desgranulación de neutrófilos cebados por el factor de necrosis tumoral-α (TNF-α) y promueve su adhesión al endotelio con funciones mejor definidas en la coagulación. La unión de CXCL4 a la heparina es inmunogénica y los anticuerpos dirigidos contra este complejo pueden causar trombocitopenia inducida por heparina. La CXCL4 inhibe la inactivación de trombina por antitrombina III dependiente de heparina y potencia la agregación plaquetaria en presencia de concentraciones subóptimas de agonistas. Como es común con otras quimiocinas, CXCL4 se une al GAG endotelial. La inyección intravenosa de heparina produce un aumento inmediato de 15 a 30 veces en las concentraciones plasmáticas de CXCL4 sin afectar a las plaquetas asociadas y también promueve la absorción de lipoproteínas de baja densidad oxidadas por células endoteliales, con importante implicación en la aterosclerosis.33
La CXCL7 se deriva de plaquetas por escisión proteolítica de los 24 aminoácidos amino-terminales. Induce la de granulación de neutrófilos y especies reactivas de oxígeno, aunque es un quimioatrayente de neutrófilos aproximadamente 100 veces menos potente que el CXCL8.34
Las plaquetas también poseen los receptores CCR1, CCR3, CCR4, CXCR1 y CXCR4. En general, parece que las quimiocinas que señalizan a través de estos receptores son débiles agonistas de las plaquetas. Sin embargo, en presencia de niveles bajos de difosfato de adenosina, CXC12, CCL17 y CCL22 inducen una agregación plaquetaria casi máxima.14
Existe la duda de si se producen concentraciones suficientes de quimiocinas en las plaquetas activadas, es probable que tales condiciones puedan existir localmente en sitios de inflamación o trombosis. Por otra parte, CXCR4 es un cofactor para la entrada del virus de inmunodeficiencia humana (VIH) en las células y esto puede contribuir a la trombocitopenia asociada al VIH al facilitar la infección de megacariocitos.(35
Quimiocinas en las enfermedades transmisibles por transfusión
Varios agentes patógenos han desarrollado mecanismos para explotar los receptores de quimiocinas para atacar a las células huésped o para evadir la respuesta inmune. El uso de antígenos Fy por Plasmodium para infestar a los eritrocitos fue descubierto antes de la identificación de la actividad DARC de los antígenos Fy.36,37) El VIH explota los receptores de quimiocinas para infectar las células T después de la unión a gp120 viral a CD4, CCR5 o CXCR4. Esto permite que la subunidad gp41esté firmemente unida a la célula y tenga lugar la fusión entre la cápsula viral y la membrana celular. En individuos que son homocigotos para la deleción de 32 pares de bases dentro de la región codificante del gen CCR5 existe un alto grado de protección contra la infección por VIH.38,39
El genoma del citomegalovirus humano codifica para el receptor de quimiocinas US28, con la estructura característica de poseer siete dominios transmembrana de los receptores de quimiocinas nativas. El US28 se expresa en células infectadas y se une a la mayoría de las quimiocinas CC. Previene el reclutamiento de leucocitos degradando quimiocinas mediante internalización y reciclaje de receptores. El citomegalovirus también codifica el receptor pUL21·5. Esta glucoproteína no comparte similitudes estructurales con los receptores nativos de quimiocinas, pero se une con alta afinidad a CCL5 y no a otras quimiocinas proinflamatorias CC, como CCL2 y CCL3.40
Quimiocinas en las reacciones transfusionales
Las reacciones transfusionales hemolíticas son análogas al síndrome de respuesta inflamatoria sistémica. Los glóbulos rojos recubiertos con inmunoglobulina G (IgG) y complemento estimulan los fagocitos para producir mediadores inflamatorios. En los modelos de incompatibilidad ABO, las quimiocinas CXC y CC se producen en altos niveles. Los eritrocitos recubiertos de IgG y complemento interactúan con receptores en fagocitos mononucleares, estimulan la producción de mediadores incluidas las citoquinas proinflamatorias como TNF-α, IL-1β, CCL2 y CXCL8, que se produce primero. La producción de CCL2 y CXCL8 es parcial por lo que sus niveles son bajos, producto de la inhibición de TNF-α.41
En el marco de una reacción transfusional no hemolítica con fiebre, escalofríos, dolor y disnea asociados a la transfusión de plasma con anticuerpos anti-HLA-DR, están implicadas las quimiocinas CXCL1, CXCL8, TNF-α, IL-1β e IL-6. La producción de quimiocinas se reduce sustancialmente por bloqueo de los receptores de IgG CD16 (FcγRIII) y CD32 (FcγRII), aunque no CD64 (FcγRI). Si bien las funciones de las quimiocinas en tales reacciones no se comprenden completamente, es probable que los ligandos CXC participen en la activación de los neutrófilos, que a su vez contribuye al fenómeno de fuga capilar en la lesión pulmonar aguda relacionada con la transfusión.40
Acumulación de quimiocinas durante el almacenamiento de componentes sanguíneos
Las quimiocinas pueden acumularse en el sobrenadante de componentes de la sangre durante el almacenamiento, ya sea a partir de la desgranulación de las plaquetas o de la activación de los leucocitos. Las quimiocinas derivadas de plaquetas que se encuentran en los componentes sanguíneos incluyen CCL5, CXCL4 y CXCL7. La CXCL8 es la principal quimiocina derivada de leucocitos que se ha identificado en el sobrenadante de componentes de la sangre. La CCL5 también puede ser derivada de leucocitos, pero la contribución de las plaquetas parece mucho mayor que la leucocitaria. La mayoría de los trabajos realizados hasta la fecha, se ha centrado en los concentrados de plaquetas.41
En los componentes plaquetarios no leucodepletados, ya sean preparados a partir de sangre entera, por el método de la capa lustrosa o por aféresis, hay acumulación progresiva de CXCL4, CXCL7, CCL5 y CXCL8. Esta última puede alcanzar niveles particularmente altos en plaquetas no leucorreducidas al final del período de almacenamiento. La reducción de leucocitos antes del almacenamiento puede prevenir la acumulación de CXCL8 derivado de leucocitos, pero no de quimiocinas plaquetarias. El tratamiento fotoquímico de reducción de patógenos o la radiación ultravioleta previene la acumulación de quimiocinas derivadas de leucocitos, pero la radiación gamma no lo hace ya que no impide la liberación de CCL5 derivado de plaquetas.42
Algunos filtros de reducción de leucocitos que tienen una carga neta superficial negativa son capaces de eliminar CXCL8 y CCL5 a partir de componentes sanguíneos. En contraste, Los filtros cargados positivamente no tienen efecto, lo más probable es que estas quimiocinas tengan una carga neta positiva a pH fisiológico.43
Consideraciones finales
Los agonistas y antagonistas de quimiocinas tienen un gran impacto en el trasplante de CPH, similar a la influencia de los factores de crecimiento hematopoyéticos recombinantes; el más inmediato es mejorar la movilización de CPH. Sin embargo, todavía tienen que esclarecerse muchos aspectos sobre las complejidades de las redes de quimiocinas en la EICH. Por otra parte, el desarrollo de fármacos dirigidos específicamente a los receptores de quimiocinas virales podría mejorar la respuesta inmune contra estas infecciones. Alternativamente, los receptores de señuelos virales recombinantes tienen el uso potencial como fármaco para modular las quimiocinas en otras enfermedades como las autoinmunes.
Los esfuerzos para mejorar el almacenamiento de componentes de la sangre para reducir la acumulación de quimiocinas tiene un efecto beneficioso en la prevención de las reacciones transfusionales y en las relacionadas con la modulación inmune de la transfusión. El gran reto será encontrar formas de prevenir la desgranulación de las plaquetas durante almacenamiento, sin afectar negativamente su función hemostática.
Muchas son las oportunidades de futuras investigaciones sobre las quimiocinas en la medicina transfusional. Sin embargo, hay que ser precavidos al interpretar estos estudios por la considerable redundancia y superposición en la función biológica de las quimiocinas individuales y sus receptores, los que son solo una parte de un proceso mucho más grande y complejo dentro de la red de citoquinas y otras moléculas del sistema inmune.















