Introducción
La inmunoterapia alérgeno específica (ITAE) consiste en la administración de alérgeno en dosis crecientes, en intervalos regulares de tiempo, con el objetivo de modular la respuesta inmune Th2 alérgica hacia una inmunidad tolerogénica.1 La ITAE logra reducir los síntomas asociados, disminuir la necesidad de medicación, así como prevenir el desarrollo de nuevas enfermedades y el asma.2
Constituye un problema actual desarrollar vacunas terapéuticas para la ITAE con mayor eficacia y seguridad. Las estrategias basadas en la promoción de las respuestas Th1 o Treg hacia los alérgenos son beneficiosas en humanos alérgicos y en modelos animales de enfermedades alérgicas,3,4 en particular; los adyuvantes basados en agonistas de los receptores de reconocimiento de patrones (RRP), incluidos los receptores tipo Toll (TLR del inglés Toll like receptors), son prometedores. Su actividad inmunoestimuladora puede mejorar si se combinan con sistemas de administración adecuados.4,5,6
La combinación de alúmina con agonistas de TLR puede mejorar la eficacia de las vacunas.4,5,6 El gel de hidróxido de aluminio (GHA) es un conocido adyuvante inductor de anticuerpos bloqueadores de la IgE y ampliamente empleado en vacunas antialérgicas, principalmente por el efecto de depósito, que provee la liberación lenta del alérgeno, lo que reduce así el riesgo de reacciones anafilácticas inmediatas. Recientes trabajos indican que su acción se basa en la activación del inflamasoma NALP4 y así influye en el entorno de la inmunidad innata. Sin embargo, pudiera conducir a la formación de nódulos subcutáneos en el sitio de la inyección como efecto indeseable.7,8 La adsorción de las proteínas alergénicas en GHA es importante para la seguridad y efectividad de las vacunas, esta puede ser afectada por los iones fosfato presentes en el tampón fosfato salino (PBS).9
El proteoliposoma (PL) de membrana externa de Neisseria meningitidis B es un potente adyuvante pro Th1 que contiene ligandos de TLR4/TLR2, y ha demostrado un efecto antialérgico cuando se administra de conjunto con GHA y alérgenos de ácaros, además de su capacidad de maduración de las células dendríticas.10,11,12)
La nueva vacuna antialérgica denominada PROLINEM-DS tiene como componentes: alérgenos purificados del ácaro D. siboney en calidad de ingrediente activo; PL de N. meningitidis B como adyuvante inmunomodulador y GHA como adyuvante de depósito y sistema de entrega. Estudios preliminares demostraron su inmunogenicidad y seguridad en modelos animales, así como su baja toxicidad y la tolerancia local.10,13,14
La ICH (del inglés International Conference on Harmonisation) introdujo el concepto “espacio de diseño” en lo referente a la interacción de las variables de proceso en la formulación y su influencia en los atributos de calidad del producto.15 La reducción del contenido de iones fosfatos y GHA y la eliminación del tiomersal pudieran mejorar el producto en términos de calidad, eficacia y seguridad. En este estudio se evaluó la inmunogenicidad y capacidad protectora de cuatro variantes de formulación obtenidas dentro del espacio de diseño de la vacuna PROLINEM DS.
Métodos
Variantes de formulación
El estudio incluyó las 4 variantes de formulación descritas en el año 2018 por Samalea y otros, las cuales se encuentran dentro del espacio de diseño de PROLINEM DS.16,17)
La variante A contiene 8 µg/mL de Der s1 purificado a partir del extracto del ácaro D. siboney (VALERGEN-DS, BIOCEN, Cuba), 100 μg/mL de PL (Instituto Finlay de Vacuna, Cuba), 2 mg/mL de GHA (Brenntag Biosector A/S) y 0,01 mol/L de PBS como excipiente (9 g/L; fosfato monosódico 0,32 g/L y fosfato disódico 1,09 g/L) y 0,025 mg/mL de tiomersal.
La variante B presenta una reducción del contenido de PBS a la mitad (0,005 mol/L).
La variante C carece de PBS, empleando solamente NaCl.
La variante D contiene reducción a ½ PBS y a ½ GHA (1 mg/mL).
Se incluyó además un control de respuesta inmune Th2, a la cual no se le adiciona el PL y un control negativo con PBS. Solo la variante A se formuló con tiomersal.
Empleo de animales
Se utilizaron ratones Balb/c de 6 a 8 semanas de edad, clínicamente sanos y libres de patógenos (CENPALAB, Habana, Cuba).
Los animales se mantuvieron bajo condiciones ambientales controladas: 21 ± 3 °C, 40-70 % de humedad relativa y ciclo de 12 horas de luz/oscuridad.
Se administró agua y alimentos ad libitum.
El Comité de Ética en Cuidado Animal del Centro Nacional de Biopreparados aprobó todos los protocolos empleados en el estudio.
Diseño experimental
Los ratones Balb/c se distribuyeron en 6 grupos, 8 ratones por grupo, de igual número de machos y hembras nulíparas no embarazadas.
Se administraron 3 dosis de 0,25mL de la formulación correspondiente (vacuna o control) cada 7 días vía subcutánea en la región dorsal.
Una semana después de la última dosis, los animales se sometieron a reto alergénico por aerosol durante 30 min durante 6 días consecutivos. Para ello, se empleó una cámara translúcida de cuerpo entero con un nebulizador de aerosol (Braintree Scientific, EE. UU.). La solución de alérgeno empleada en la nebulización fue de 500 μg/ml (calculados a partir de un sistema ELISA (acrónimo del inglés Enzyme-Linked ImmunoSorbent Assay )Indoor Biotechnologies, Reino Unido).
Se colectaron muestras de sangre por el plexo retro orbital en los días: 0; 21 (2 semanas después de la tercera dosis) y 28 (después del reto alergénico). Pasadas las 48 horas del último reto alergénico, los ratones se sacrificaron por dislocación cervical.
Medición de anticuerpos alérgeno específicos
Los niveles de anticuerpos alérgeno-específico en el suero IgE, IgG1 e IgG2a se cuantificaron mediante un ELISA indirecto. Las placas de microtitulación (Maxisorp Nunc, Dinamarca) se bloquearon a 4 oC durante toda la noche con 2000 UB/mL de extracto alergénico de D. siboney (VALERGEN, BioCEN, Cuba) en tampón carbonato a pH 9,6.
Las uniones no específicas se bloquearon con 1 % PBS-T (PBS+ 0,05 % Tween 20) y albúmina de suero bovino 10 mg/mL, durante 1h a 37 oC.
Las muestras de suero diluidos 1:20 para IgE e IgG2a y 1:100 para IgG e IgG1 se incubaron 2 h a 37 oC.
Se emplearon los conjugados biotinilados anti-IgG, IgG1 o IgG2a de ratón (1:1 000) o el conjugado anti-IgE-peroxidasa (Sigma, EE. UU.) (1:1 000) durante 1h a 37 oC en solución de bloqueo, seguido de la incubación con Streptavidina-peroxidasa (Boehringer Mannhein, Alemania) 1:2 000 para los conjugados con biotina durante 1h a 37 °C. Finalmente se añadieron 100 µL de 3,3´,5,5´- tetrametil bencidina (TMB) y se midió la densidad óptica (DO) a 450 nm en un espectrofotómetro (SUMA, Habana, Cuba). Todos los resultados se expresaron en valores de DO.
Determinación de citoquinas
En cultivo de linfocitos
Los linfonodos se extrajeron de forma aséptica 48 h después del reto alérgenico y se ubicaron en placas estériles con medio RPMI 1640 (Sigma, EE. UU.). La suspensión celular se preparó presionando los ganglios contra un colador de células, de nylon (BD Biosciences, EE. UU.) de 40 μm de diámetro.
Se cultivaron 4x106 células/pozo en medio RPMI-1640 suplementado con 25 mmol/L de HEPES, 2 mmol/L de glutamina, 50 µg/mL de sulfato de gentamicina y 0,5 % de suero de ratón (todos los reactivos pertenecen a Sigma, EE. UU.) en atmósfera de 5 % de CO2 y 37 oC. Se estimuló el cultivo con 10 µg/mL del alérgeno Der s1. Se cuantificaron las citoquinas IL-10, IL-13 e IFN-γ en el sobrenadante por un kit de ELISA tipo sándwich según las instrucciones del fabricante (Bender MedSystems, EE.UU.).
En lavado broncoalveolar (BAL)
Los ratones fueron anestesiados por inyección vía intraperitoneal de Diazepam y Ketamina (Labsynth, Brasil). La tráquea fue canalizada y los pulmones lavados suavemente dos veces con un volumen final de 1,0 mL de PBS frío. El BAL fue inmediatamente centrifugado a 2 000 rpm por 5 min., y el sobrenadante colectado fue almacenado a -70 oC.
Los niveles de las citoquinas IL-5, IL-10 e IFN-γ en BAL fueron cuantificados a partir de un ELISA sándwich comercial (Bender, MedSystems, EE. UU.). El ensayo se realizó según las instrucciones del fabricante. Los valores se cuantificaron a partir de una curva estándar expresada en pg/mL.
Examen histológico
El tejido pulmonar de 5 ratones/grupo se removió fijó en formalina tamponada neutra y embebió en parafina. Se cortaron en secciones de 4 µm y se tiñó con hematoxilina-eosina (H&E). Las secciones teñidas fueron analizadas en el microscopio. Para evaluar la tolerancia local se evaluó la piel y los tejidos subcutáneos por el mismo procedimiento.
Análisis estadístico
Las comparaciones entre grupos se realizaron mediante ANOVA de 1 vía complementado con la prueba de Tukey o ANOVA de 2 vías complementado con una prueba de Bonferroni al comparar entre grupos y fechas. Todas las evaluaciones se llevaron a cabo utilizando el software Prism v.5,0 (GraphPad Inc., EE. UU.).
Resultados
Respuesta humoral alérgeno-específica
Todos los grupos vacunados provocaron un aumento significativo de los anticuerpos IgG alérgeno-específicos, con una respuesta mixta de las subclases IgG1 e IgG2a. Además de la respuesta primaria tras la vacuna, también se midió la respuesta secundaria tras exponer los ratones a reto alergénico.
El grupo C (vacuna sin PBS) fue el de mayor respuesta de IgG1, con diferencias significativas respecto al resto de los grupos (ANOVA, Prueba de Bonferroni p < 0,001) (fig.1A y B), con valores similares a los del grupo de control Th2, sin PL. En contraste, la respuesta de anticuerpos IgG2a en todos los grupos con las diferentes variantes de la vacuna fue significativamente superior a la variante sin PL (control Th2) (p < 0,001, ANOVA de 2 vías, prueba de Bonferroni). Este resultado respalda la dependencia de PL para obtener la subclase IgG2a, que a su vez es un indicador de respuesta Th1. A pesar de que las variantes C (sin PBS) y D (1/2 GHA) mostraron diferencias significativas (p < 0,001) con respecto a los grupos A y B luego de la tercera dosis, esta diferencia no se mantuvo luego del reto alergénico (p ˃ 0,05) (fig. 1C).
Todos los grupos vacunados indujeron una respuesta IgE significativamente menor (p < 0,001, ANOVA de 2 vías, prueba de Bonferroni) que el grupo control Th2 (sin PL). Después de la administración de la vacuna, la variante D (1/2 PBS + ½ GHA) no mostró diferencias significativas (p > 0,05) con respecto a la variante A; mientras que fue significativamente menor con respecto a las variantes B y C (p < 0,01). Sin embargo, después del reto, la variante A presentó la menor respuesta de IgE (p < 0,001) (fig. 1D).
La relación IgG/IgE combina en una sola variable los efectos potencialmente protectores y perjudiciales de la respuesta inmunitaria. Después del tratamiento la variante D (1/2 PBS + ½ GHA) presentó el mayor cociente IgG1/IgE, con diferencias significativas con respecto al resto de los grupos (p < 0,001), sin embargo, después del reto el grupo A mostró el mayor cociente, estadísticamente significativo respecto a los grupos B (p < 0,01), C y D (p < 0,05) (fig. 1E).
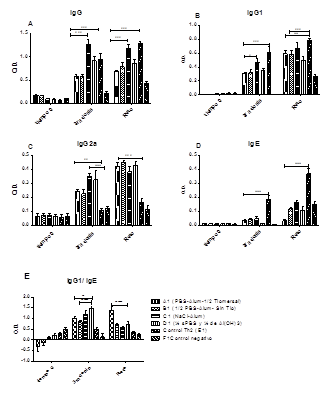
Fig. 1 - Evaluación de la respuesta inmune humoral alérgeno-específica mediante ELISA. Las barras representan el promedio con la desviación estándar de 8 ratones/grupo al inicio del experimento (día 0), después de la vacunación (día 21) y después del reto alergénico (día 33). A. IgG B. IgG1 C. IgG2a. D. IgE. E. Cociente IgG1/IgE. (**p < 0,01;***p < 0,001 ANOVA de 2 vías complementado con la prueba de Bonferroni).
Respuesta celular
A nivel local, en el BAL de los grupos vacunados con las cuatro variantes, no hubo diferencias significativas en los niveles de IL-5 (p > 0,05), mientras que fueron significativamente menores (p < 0,001) en comparación con el control Th2 (sin PL). Por otra parte, para IFN-γ, tampoco hubo diferencias significativas (p > 0,05) entre las variantes que fueron estadísticamente superiores (p < 0,001) a los controles. En contraste, no se apreciaron diferencias significativas (p > 0,05) en cuanto a la IL-10 e IL-13 (fig. 2A).
Por otra parte, a nivel sistémico el sobrenadante de cultivo de linfocitos estimulados presentó valores de IL-13 estadísticamente inferiores al control Th2 en todas las variantes (p < 0,001), el grupo D presentó una respuesta significativamente menor a las demás variantes (p < 0,001). Los grupos con las cuatro variantes presentaron valores de IFN-γ e IL-10 estadísticamente superiores (p < 0,001) al grupo E (control Th2), siendo los grupos B y D los de mayor respuesta (p < 0,001). El grupo D presentó un mayor valor de IL-10, con diferencias estadísticamente significativas (p < 0,001) con respecto al resto de los grupos inmunizados (A, B y C) además del control Th2. Mientras que el grupo C presentó un menor valor, con diferencias significativas respecto las demás variantes (fig. 2B).

Fig. 2 - Cuantificación de citoquinas IL-5, IL-10, IFN-γ e IL-13 en BAL (A) y en sobrenadante de cultivo de linfocitos (B) mediante ELISA posterior al reto alergénico (día 33). Las barras muestran el promedio ± SD de n = 3 ratones/grupo. (*p < 0,05; ***p < 0,001; ANOVA complementado con prueba de Bonferroni).
Análisis histológico
En la histología de los bronquios se apreció una respuesta alérgica característica en el control Th2 (sin PL) con engrosamiento del epitelio bronquial, abundante material proteínaceo en la luz del bronquio e infiltrado perivascular y peribronquial con polimorfonucleares eosinófilos. En contraste, todos los grupos vacunados con las variantes de PROLINEM-DS presentaron una respuesta inflamatoria alérgica disminuida similar a la del control negativo, con solo una reacción inflamatoria discreta con escasos eosinófilos (fig. 3/I).
En el sitio de la inyección, los animales después del reto alergénico correspondientes a los grupos A, B, C y E presentaron, en su mayoría, procesos granulomatosos de tipo macrofágico en el tejido celular subcutáneo. Sin embargo, el grupo D (variante con 1/2 GHA) de un total de seis sitios de inoculación examinados presentó un solo proceso granulomatoso. Como se esperaba el control Negativo no presentó granuloma (fig. 3/II).

Fig. 3 Microfotografías representativas del análisis histológico del tejido pulmonar (I) y el tejido subcutáneo en el sitio de la inyección (II). (A/G) Vacuna Variante A. (B/H) Variante B. (C/I) Variante C. (D/J) Variante D (E/K) Control positivo, respuesta alérgica Th2, sin PL. (F/L) Control Negativo.
Discusión
Este estudio evaluó un modelo murino profiláctico de respuesta alérgica, que emplea reto alergénico, variantes de la vacuna PROLINEM DS obtenidas dentro del concepto de espacio de diseño.
La formulación de la vacuna contiene alérgenos del ácaro del polvo doméstico D. siboney y un adyuvante de combinación con PL de N. meningitides (un ligando de TLR2/4) y GHA, mientras que las variantes contienen reducción de PBS, GHA y eliminación del tiomersal.
La administración de tres dosis de todas las variantes indujo un claro efecto protector antialérgico.
La inducción de anticuerpos IgG bloqueadores de IgE forma parte de los mecanismos de la IT con alérgenos.17 Sin embargo, los alérgenos adsorbidos en el GHA inducen también niveles elevados de IgE como un efecto no deseado.6,18 El cociente IgG1/IgE combina el efecto bloqueador y efector en una misma variable. El uso de los cocientes IgG/IgE o IgG1/IgE mostró en este estudio una diferencia significativa entre las composiciones de vacunas que contenían PL+GHA y solo GHA, a favor de las primeras, tanto antes como después del reto alergénico, reflejando así, no solo el efecto en cuanto a aumento de IgG, sino también en relación a la prevención del incremento de IgE.
Una mayor adsorción de alérgenos en GHA debiera favorecer una vía de presentación antigénica más eficaz y, por lo tanto, mayores niveles de IgG e incremento del bloqueo de respuesta de IgE. Sin embargo, los resultados, particularmente en respuesta al reto alergénico parecen no respaldar del todo esa hipótesis, puesto que el grupo con mayor adsorción (C) no presentó diferencias significativas con el resto en cuanto a respuesta IgG e IgG1. Tampoco el análisis histológico de los animales retados arrojó diferencias entre grupos vacunados, evidenciando en todos los casos prevención de la respuesta inflamatoria Th2.
La subclase IgG1 es equivalente a IgG4 en humanos. Un incremento de la IgG4 está relacionado con la tolerancia inmunológica en la ITAE, a través de mecanismos bien descritos que reducen la activación de los linfocitos B IgE+ de memoria por los alérgenos y disminuye la producción de IgE.19 En concordancia con lo descrito en la literatura, en este estudio los niveles de IgE disminuyeron con respecto al control Th2, lo cual corrobora la efectividad de la misma en cuadros alérgicos como el asma.20
La subclase IgG2a es equivalente a la IgG1 o IgG3 en humanos y el incremento de estos anticuerpos sugiere una inducción de un fenotipo Th1. Este patrón antagoniza la respuesta Th2 alérgica y está relacionada con la efectividad de la inmunoterapia alérgeno específica.21) El incremento de los niveles de IgG1 e IgG2a del estudio se corresponde con lo obtenido por otros grupos de investigación que han empleado adyuvantes de combinación en la ITAE.22
La vacuna antialérgica Pollinex-Quatro (AllergyTherapeutics, UK), combina los adyuvantes Tirosina (adyuvante de depósito) y MPL® [monofosforil-lípido A detoxificado de Salmonella]. Este producto, que ha llegado a ensayos clínicos fase III, se conoce como inductor potente de respuesta Th1 y también conduce altos títulos de IgG,23 demostrando eficacia contra la rinitis polínica con el empleo de sólo 4 inyecciones preestacionales.
Se evidenció la protección sistémica (menor IgE e IL-13), así como de la respuesta inflamatoria local Th2 en el órgano de choque (menor IL5 y menor inflamación pulmonar). El patrón de citoquinas concordó con los resultados de la histología pulmonar de los animales sometidos a reto alergénico, que mostraron una notable disminución de la respuesta inflamatoria alérgica en los animales vacunados en comparación con los ratones control Th2. Estos últimos mostraron una reacción inflamatoria grave caracterizada por infiltración de eosinófilos e hiperplasia de las células caliciformes como rasgos típicos de la patología del asma.24,25
La disminución de los eosinófilos del tejido pulmonar en vacunados puede estar relacionada con la disminución de la IL-5 local. Se ha descrito la relevancia de la IL-5 en la modulación del infiltrado inflamatorio eosinofílico.26 Así mismo, la inducción de una respuesta de IFN-γ moderada junto con la inducción de la subclase IgG2a, apuntan hacia una modulación pro Th1. Varios autores reportan consistentemente este efecto cuando se emplean adyuvantes o estrategias pro Th1.27
Otros grupos de investigación que han empleado adyuvantes de combinación han reportado la inhibición de la respuesta alérgica Th2 asociada con el incremento de IL-10 pero no de IFN-γ.21 En contraste con estos resultados, el presente trabajo observó un incremento del IFN-γ en el lavado broncoalveolar, así como un incremento del IFN-γ e IL-10, en el sobrenadante de cultivo de los linfocitos. Esto coincide con lo reportado en estudios previos con la variante original y pudiera estar relacionado con una respuesta celular Th1/Treg, o posiblemente, de una población celular que induzca ambos marcadores.28
La presencia de formaciones granulomatosas a nivel del punto de inoculación producto de la administración de preparados vacunales donde se utiliza el GHA como adyuvante ha sido estudiada con otros productos y su recuperación.7,8 La tolerancia local en el lugar de la inyección mostró una reducción de los granulomas en los sujetos vacunados con menos GHA. Esta reducción no afectó la inmunogenicidad, ni la protección ante reto como previamente se analizó.
Por otra parte, el tiomersal es un derivado del etilmercurio que ha sido usado ampliamente como preservo en vacunas. En los últimos años se trabaja en reducir, eliminar o sustituir el tiomersal en las vacunas, tanto en presentaciones de dosis única como múltiples por su toxicidad, así como por su acumulación del mismo en el medio ambiente. La eliminación del tiomersal no evidenció ninguna influencia en la formulación, lo que permite su eliminación aumentando la seguridad.29
La respuesta humoral y celular observada en las cuatro variantes de formulación de la vacuna PROLINEM-DS obtenidas dentro del concepto de “espacio de diseño”, demostraron su efecto antialérgico. En general, la reducción del contenido de fosfato, GHA y tiomersal, constituyen mejoras farmacéuticas de la vacuna antialérgica experimental PROLINEM DS, las cuales serían atractivas para la etapa clínica de esta vacuna.














