Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.16 n.2 Ciudad de la Habana jul.-dic. 1997
Temas de Actualización
Instituto Superior de Ciencias Médicas de La HabanaEstudio de los factores endoteliales antitrombóticos
Dr. Andrés O. Pérez Ruíz, Dr. José A. Castillo Herrera, Dr. Pablo Santos Rodríguez, Dra. Deysi Martínez Alvarado y Dr. Pedro J. Argudín MartínezEl principal componente relacionado con la hemostasia es la capa endotelial que reviste la íntima del vaso, a través de la cual se ponen en contacto sangre y vaso. Actualmente se ha empezado a conocer más profundamente el papel del endotelio en la función hemostática, hoy se considera que las células endoteliales no representan una simple capa de revestimiento vascular inerte, sino que son células con capacidades metabólicas muy activas, capaces de sintetizar proteínas y de compleja bioquímica.
Es la íntima, a pesar de que representa un escaso 5 % de la estructura de la pared, la más importante desde el punto de vista de la función hemostática, pues en ella se sintetizan y liberan activadores de la coagulación sanguínea propiamente dicha, de la agregación plaquetaria y del sistema fibrinolítico y en ella se desarrollan gran parte de los mecanismos hasta ahora conocidos del sistema hemostático y de su patología de exceso: la trombosis y la aterosclerosis, procesos que por su importancia han adquirido un papel estelar en nuestra sociedad y reciben en la actualidad una especial atención.
La acción anticoagulante del endotelio vascular se lleva a cabo por la acción conjunta de varios de sus componentes, que actúan inhibiendo el sistema intrínseco (anticoagulantes vasculares); el extrínseco (inhibidores de vía extrínseca); o ambos sistemas de manera conjunta (trombomodulina y proteína S) o sencillamente potencializando la acción inhibidora de algunos anticoagulantes (glicosa-minoglicanos).
No escapan a su actividad las plaquetas, ya que desarrollan una acción antiplaquetaria por su capacidad de síntesis y liberación de sustancias provenientes del metabolismo del ácido araquidónico (prostaglandinas y prostaciclinas), además del óxido nítrico y un derivado del metabolismo de los triglicéridos por la vía de las lipooxigenasas, el ácido 13-hidroxioctadecadienoico.
ACTIVIDAD ANTICOAGULANTE DEL ENDOTELIO VASCULAR
- Anticoagulante vascular
- Anticoagulante del sistema extrínseco
- Trombomodulina
- Proteína S
- Glicosaminoglicanos
Es una proteína recientemente extraída del endotelio vascular con una potente acción anticoagulante, cuya estructura proteica revela una cierta homología con la familia de las lipocortinas, que son inhibidoras de la fosfolipasa A2.
Actúan inhibiendo competitivamente la unión del factor Xa a los fosfolípidos cargados negativamente dificultando de esta manera la formación del complejo de la protrombinasa y por tanto inhibiendo la activación de la protrombina.
Este anticoagulante solamente se libera cuando la célula endotelial se activa, participando de esta manera en la modulación de la hemostasia en estas circunstancias.
ANTICOAGULANTE DEL SISTEMA EXTRÍNSECO
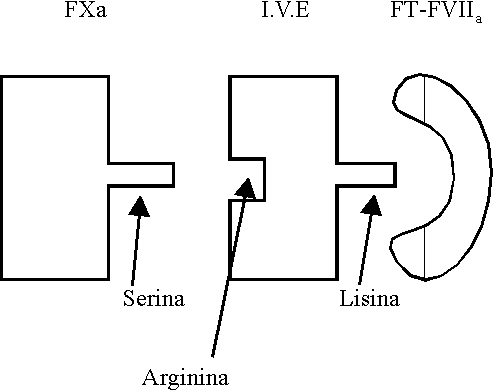
El inhibidor de la vía extrínseca de la coagulación (IVE) (figura 1) es una lipoproteína que circula en el plasma producida por el endotelio y es secretada hacia la pared del vaso. Se encuentra en el plasma fundamentalmente asociado y regulado por las lipoproteínas de baja densidad (LDL), pero no con las de alta densidad. También se halla presente en las plaquetas, producto de la síntesis en el megacariocito y sería el responsable de la liberación en el sitio de lesión.
El tratamiento con inhibores de la HMG-CoA reductasa disminuye la concentración plasmática de la LDL y también del IVE.
La actividad inhibitoria ocurre en 2 pasos:
- FXa se une al IVE (por su unión arg.) en una reacción independiente de calcio.
- El complejo IVE-FXa se une al complejo FT-FVIIa en una reacción dependiente de calcio en el sitio de unión Lys perteneciente al IVE.
La TM es el principal receptor de la trombina en la superficie de la célula endotelial y se manifiesta sin la activación endotelial, por lo que es un modulador de la actividad de la trombina en condiciones fisiológicas.
La TM en la superficie endotelial forma un complejo equimolar en una reacción dependiente de calcio y fosfolípidos, el cual es un potente activador de la proteína C.
El complejo TM-trombina provoca alteración en la conformación de la trombina y modifica sus funciones biológicas, de modo que la trombina se transforma de una poderosa enzima coagulante en anticoagulante, es decir, la TM inhibe la capacidad de la trombina de coagular al fibrinógeno y activar a los cofactores V y VIII y la adhesión y agregación plaquetaria, a la vez que aumenta unas 20 000 veces la velocidad de interacción de la trombina en activar a la proteína C e inhibir la degradación proteolítica de la proteína S. Las acciones anteriormente mencionadas son reversibles por disociación del complejo trombina-TM.
Por otra parte la TM puede formar complejo con el factor Xa, inhibiendo su acción en la activación de la a2 globulina presente en el plasma (protrombina).
En lo que a su distribución se refiere dentro del sistema vascular, son los tejidos pulmonares y placentarios los que muestran una mayor concentración, en cambio está ausente en el cerebro.
PROTEÍNA S
Es el cofactor de la proteína C activada. Tiene un peso molecular de 70 000 daltons. La proteína S se une a la superficie negativa de los fosfolípidos empleando el calcio como puente. Una vez sobre la superficie actúa como receptor de la proteína C activada y forma un complejo estequiométrico 1:1 que se potencia en presencia de calcio. De esta manera el complejo proteína S/proteína Ca degrada proteolíticamente a los factores Va y VIIIa de la coagulación.
La proteína S además de ser sintetizada por el endotelio vascular también puede serlo por el hígado, los megacariocitos y las células intersticiales de Leyding. Su vida media es de aproximadamente 50 h y circula en el plasma en 2 formas: una libre que es la funcionalmente activa y otra unida al C4BP (proteína de unión a la fracción C4p del complemento).
La C4BP aumenta en las infecciones y cuando esto ocurre aumenta la proteína S unida y disminuye la forma libre, lo que puede predisponer a fenómenos trombóticos.
GLICOSAMINOGLICANOS
Los proteoglicanos son glicoproteínas de alto PM, formados por una cadena de polímeros de carbohidratos (glicosaminoglicanos) covalentemente unidos a una proteína.
Entre los glicosaminoglicanos se encuentran los condroitín sulfatos, ácido hialurónico, queratán sulfatos, heparán y dermatán sulfatos, pero solamente los 2 últimos muestran acción anticoagulante.
Funcionalmente son moduladores de la hemostasia por su acción anticoagulante. Esta acción la desarrollan por su capacidad de unión a la trombina y la antitrombina III. El heparán sulfato, un glicosaminoglicano de la pared vascular, actúa de forma muy parecida a la heparina, ya que potencia la inactividad de la trombina del factor Xa y del factor XIa por la antitrombina III. Además de la mencionada acción el heparán sulfato, al igual que la TM, puede actuar como receptor endotelial de la trombina, lo que favorece su inactivación a través de la formación de complejos inactivos.
El dermatán sulfato activa únicamente al cofactor II de la heparina y sólo actúa sobre la trombina y no sobre los factores Xa y XIa.
ACTIVIDAD ANTIPLAQUETARIA DEL ENDOTELIO VASCULAR
- Prostaciclina
- Ácido 15 Hidroxieicosatetraenoico (15 HETE)
- Ácido 13 Hidroxioctadecadienoico (13 HODE)
- Óxido nítrico
En general, las prostaglandinas son un grupo de ácidos grasos de 20 carbonos, poliinsaturados, oxigenados, que contienen un anillo ciclopentano.
La prostaciclina se diferencia de las otras prostaglandinas en que posee un segundo anillo ciclopentano. Fue descubierta en 1976 por Moncada y colaboradores y representa la sustancia más importante derivada del ácido araquidónico en el tejido vascular.
La biosíntesis de PGI2 (figura 2) se inicia por una doble vía: mediante la transferencia, a través de la membrana de endoperóxidos proveniente de las plaquetas, o mediante la generación intracelular de ácido araquidónico liberado de los fosfolípidos endoteliales de membrana por la acción de la enzima fosfolipasa A2.
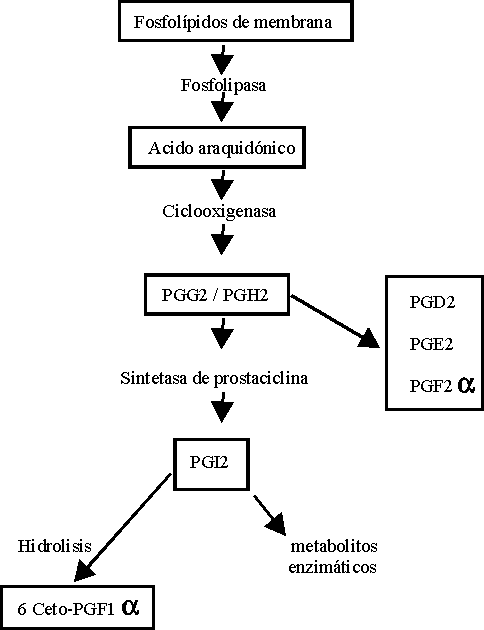
Una vez liberado, el ácido araquidónico es rápidamente oxigenado por la ciclooxigenasa dando los endoperóxidos cíclicos PGG2 y PGH2. También pueden formarse pequeñas cantidades de prostaglandinas estables sin intervención enzimática. La conversión de PGG2/ PGH2 en PGI2 por la sintetasa de prostaciclina es la vía principal. La PGI2 es hidrolizada en forma no enzimática dando 6 ceto PGF1a estable pero inactivo, o bien enzimáticamente dando cierto número de otros productos.
La PGI2 es una sustancia vasodilatadora potente e inhibidora de la agregación plaquetaria. Sus acciones vienen mediadas por la estimulación de la adenilatociclasa, enzima que produce un aumento de los niveles de adenosín-monofosfato cíclico (AMPc) en las plaquetas y en la musculatura lisa vascular.
El incremento de AMPc favorece la proliferación, permeabilidad y contractilidad de las células endoteliales. La PGI2 también promueve la citoprotección, aumenta la fibrinólisis y estimula el metabolismo del colesterol.
La PGI2 inhibe la movilización de los sitios de unión de fibrinógenos en plaquetas, acción que puede limitar la extensión de las interacciones entre el fibrinógeno y las plaquetas. Además la PGI2 aumenta la actividad fibrinolítica, proceso que puede ayudar en la terapia de enfermedades circulatorias obstructivas crónicas.
Un estado fisiopatológico en que se encuentra alterado el equilibrio entre prostaciclina y tromboxano A2 es la hipertensión inducida en la denominada toxemia gravídica. Los niveles de PGI2 que suelen aumentar durante la gestación, están marcadamente disminuidos en sangre y orina de pacientes toxémicas y también su producción vascular y por el contrario aparece una mayor síntesis de tromboxano A2 en relación con lo observado en las grávidas normales. Esta enfermedad se caracteriza por vasoespasmo, hipertensión y disminuida resistencia al efecto presor de la angiotensina II; el desequilibrio mencionado anteriormente explicaría los síntomas clínicos.
15 HETE
El ácido araquidónico liberado de los fosfolípidos de la célula endotelial tras su estimulación es metabolizado a 2 metabolitos principales: la PGI2 generada por vía de las ciclooxigenasas de la membrana celular y el 15 HETE sintetizado en el citoplasma por la vía de las lipooxigenasas (figura 3).
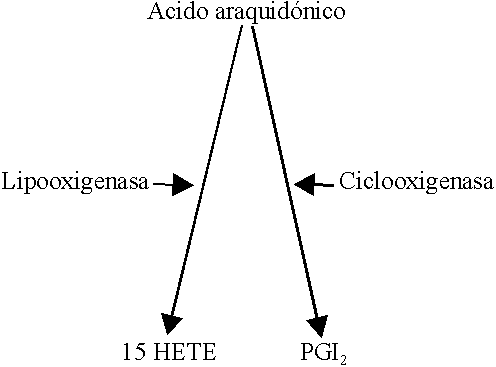
El 15 HETE es quimiotactivo para leucocitos y tiene un pequeño efecto inhibidor de la adhesividad plaquetaria al endotelio vascular activado, aunque en realidad su función biológica no está bien definida.
13 HODE
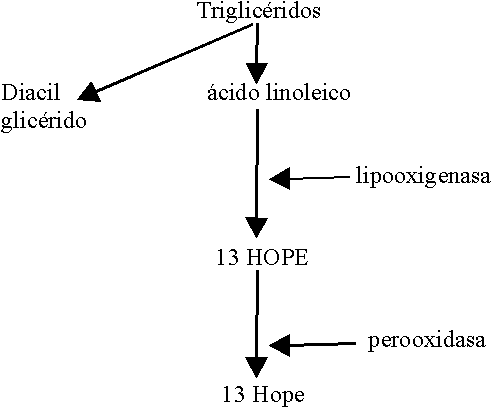
El 13 HODE (figura 4) es un ácido graso poliinsaturado, derivado del ácido linoleico procedente de triglicéridos endoteliales. Se genera en la célula endotelial no estimulada y disminuye drásticamente su liberación tras estimularla; es pues un protector endotelial en condiciones basales y no muestra efecto si se añade exógenamente, por lo que su acción antiadhesiva se ejerce desde el interior de la célula endotelial.
ÓXIDO NÍTRICO (N0)
Fue denominado inicialmente factor relajante derivado del endotelio (FRDE), pero a mediados de 1986 se propuso que el FRDE era óxido nítrico o un compuesto similar. Moncada y colaboradores compararon las propiedades farmacológicas de ambos compuestos y concluyeron que el FRDE es NO y que se libera de las células endoteliales en forma de NO, el cual no halla dificultad en cruzar las membranas celulares, ya que no necesita de ningún transportador para su liberación o acción.
El mecanismo fisiológico de la liberación de NO y su regulación del tono vascular se explica a continuación (figura 5).
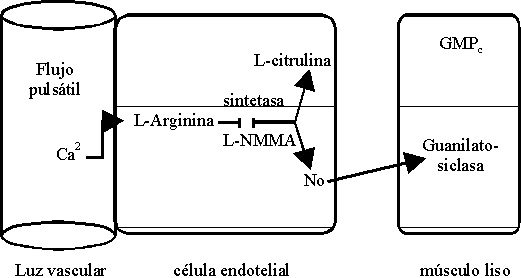
Las plaquetas son estructuras que también liberan NO y se ha demostrado que éste inhibe la agregación plaquetaria, así como que se opone a la adhesión de plaquetas a fibras de colágeno y otras proteínas adhesivas.
El importante aumento de la presión arterial que se obtiene después de inhibir a la sintetasa de NO con monometil L-arginina (L-NMMA) confirma la tesis de que esta sustancia es el nitrovasodilatador endógeno y sugiere que la reducción en la síntesis de NO puede contribuir al mecanismo fisiopatológico de la hipertensión, de modo que la liberación basal de NO desempeña un papel fundamental en la regulación de la presión arterial.
Tanto NO como la PGI2 presentan características citoprotectoras y posiblemente como en la agregación plaquetaria actúan de forma sinérgica.
REFERENCIAS BIBLIOGRÁFICAS
- Borrasca A, López Fernández A. La hemostasia. Generalidades. Su relación con otros sistemas defensivos. En: López Borrasca A, ed. Enciclopedia Iberoamericana de hematología. 1 ed. Salamanca: Ediciones Universidad de Salamanca, 1992; vol 3:3-17.
- Lasierra J, Estelles A. Estructura de la pared vascular. En: López Borrasca A, ed. Enciclopedia Iberoamericana de hematología. 1 ed. Salamanca: Ediciones Universidad de Salamanca, 1992;vol 3:30-4.
- Aznar J, Estelles A. Célula endotelial y hemostasia. En: López Borrasca A, ed. Enciclopedia Iberoamericana de hematología. 1 ed. Salamanca: Ediciones Universidad de Salamanca, 1992;vol 3:35-47.
- Moncada S, López Jaramillo P. Función de la pared vascular. El endotelio vascular: prostaciclina y ácido nítrico. En: López Borrasca A, ed. Enciclopedia Iberoamericana de hematología 1 ed. Salamanca: Ediciones Universidad de Salamanca, 1992;vol 3:48-57.
- Scazziota A, Altman R. El mecanismo de la hemostasia normal. Rev Iberoam Tromb Hemost 1994;7:95- -109.
- Altman R, Scazziota A, Rauvier J. El mecanismo de la trombosis. Rev Iberoam Tromb Hemost 1994;7:110--7.
- Valles J, Santos MT, Marcus AJ. Down regulation of human platelet reactivity by neutrophils participation of lipoxygenase derivatives and adhesive proteins. J Clin Invest 1993;92:1357-65.
- Lopezfarre A, Caramelo C, Esteban A. Effects of aspirin on platelet-neutrophil interactions: role of nitric and endothelin-1. Circulation 1995;91:2080-8.
- Moncada S, Vane JR. An endogenous roles of prostaglandin endoperoxides, tromboxane A2 and prostacyclin. Pharmacol Rev 1979;30:293-331.
Dr. Andrés O. Pérez Ruíz. Instituto Superior de Ciencias Médicas de La Habana. Calle 146 No. 3102 esquina 31, reparto Cubanacán, municipio Playa, Ciudad de La Habana, Cuba. CP 11600.












