Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.17 n.3 Ciudad de la Habana sep.-dic. 1998
Trabajo de Revisión
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"Enzimas generadoras de especies reactivas del oxígeno: mieloperoxidasa
Lic. Onel H. García Morales, Dra. Nayade Pereira Roche y Dra. Rosa M. Flores SánchezRESUMEN
La defensa del organismo está mediada por las células del llamado sistema retículo endotelial, de las cuales los polimorfonucleares neutrófilos constituyen la primera línea de defensa inespecífica. La mieloperoxidasa es la proteína más abundante en los neutrófilos y es la única peroxidasa que cataliza la conversión del peróxido de hidrógeno y cloruro a ácido hipocloroso. Este es un potente agente oxidante que contribuye al mecanismo de defensa contra los agentes infecciosos; sin embargo, puede ser capaz de actuar sobre las células del hospedero en caso de activación incontrolable o excesiva e inactivar factores humorales. Dado el amplio espectro de reactividad, el ácido hipocloroso es un mediador de daño hístico en numerosos procesos inflamatorios. Se presentan algunas características físico-químicas, el mecanismo de reacción, la biosíntesis y la relación de la enzima mieloperoxidasa con diferentes procesos patológicos.Descriptores DeCS: PEROXIDASA/metabolismo; PEROXIDASA/química; NEUTROFILOS/enzimología; ESPECIES DE OXIGENO REACTIVO.
La mieloperoxidasa (MPO, peróxido de hidrógeno oxidorreductasa, EC 1.11.1.7.) es una enzima ampliamente distribuida en el organismo y sus fuentes fundamentales las constituyen los leucocitos (neutrófilos y monocitos) y los macrófagos a pesar de que ha sido aislada a partir de diferentes fluidos biológicos (saliva, líquido sinovial y semen, entre otros)1-3 y también de diferentes tejidos (corazón, riñón, piel, hígado y placenta).4-8 No obstante las fuentes más empleadas son los neutrófilos, donde la enzima se encuentra localizada a nivel lisosomal, en los gránulos azurófilos. Constituye del 2-5 % de las proteínas del neutrófilo,9 con una concentración en sangre humana normal de alrededor del 1 nM.10
Esta enzima fue aislada por primera vez por Agner en 1941, denominándola verdoperoxidasa.11 Posteriormente en 1958, el propio Agner la purificó en forma cristalina y en 1977 Harrison tuvo igual resultado.12
CARACTERÍSTICAS FÍSICO-QUÍMICAS
La MPO es una glicoproteína tetramérica, constituida por 4 subunidades formando 2 homodímeros. Cada uno de ellos contiene una subunidad a (pesada) de aproximadamente 59 kDa y una subunidad ß (ligera) de aproximadamente 14 kDa. El peso molecular de la enzima se estima entre 130-150 kDa.13 Las subunidades pesadas se unen a través de un enlace bisulfuro simple y a cada una de ellas se le une covalentemente un grupo prostético hemo.13,14 Estas subunidades son las únicas glicosiladas y contienen entre 2-4 % de carbohidratos.13Se reporta que esta proteína es fuertemente catiónica con un punto isoeléctrico mayor de 10 y su pH óptimo es de 5.5,11,13
El contenido de aminoácidos se caracteriza por presentar aproximadamente 1 150 residuos, que se corresponden con 573 aminoácidos cada homodímero. De ellos 466 forman la subunidad pesada y 107 la subunidad ligera.15
El patrón espectrofotométrico muestra un máximo de absorbancia a 430 nm, con otros picos a 375, 575, 620 y 690 nm.16 Se reporta una relación de absorbancia 430/280 nm entre 0,80 y 0,87 para una solución de esta enzima pura.15,17,18
MECANISMO DE REACCIÓN
Los neutrófilos contienen 4 formas de MPO, las cuales se denominan compuesto I, compuesto II, compuesto III y MPO nativa o férrica, con una similitud en su composición aminoacídica y actividad, así como en sus propiedades ópticas. No obstante se han observado diferencias en relación con la intensidad de absorción a 430 nm y 620 nm.17 El sistema MPO-peróxido de hidrógeno (H2O2) - haluro ha sido un sistema bien estudiado (fig. 1).19-21 La MPO reacciona con el H2O2 proveniente de las células fagocitarias activadas por contacto con partículas extrañas, formando un complejo enzima-sustrato con una fuerte capacidad oxidativa (reacción 1). Este complejo se combina con el haluro, generalmente cloruro, que se oxida para formar el ácido hipocloroso (HOCl) (reacción 2). El compuesto I puede ser reducido a compuesto II por un exceso de H2O2. Por ejemplo, concentraciones mayores a 20 m M lo transforma parcialmente y mayores de 200 m M completamente, o por la presencia de un agente reductor (AH2 ) como por ejemplo el ditiotreitol, cisteína, glutatión y cisteamina (reacción 3). Este compuesto II, a pesar de ser bastante estable puede reducirse a MPO férrica en presencia de un agente reductor o el radical superóxido (O2 ) (reacción 4) o también puede oxidarse a compuesto III bajo concentraciones elevadas de H2O2 (2-3 mM) (reacción 5). Por otra parte la MPO nativa puede ser oxidada por el O2 a oximieloperoxidasa (compuesto III) (reacción 6).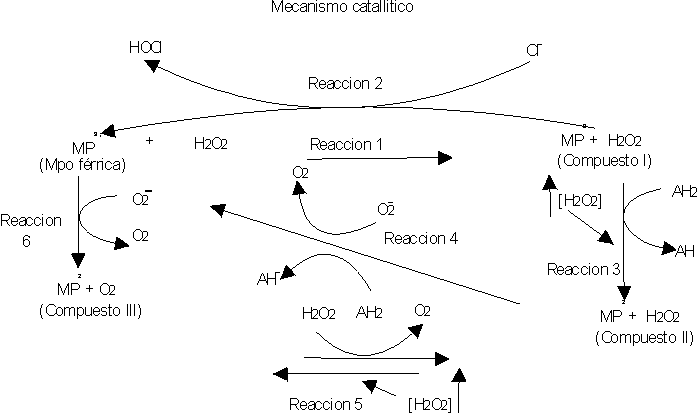
Además puede funcionar como genuina oxidasa (fig. 2), de tal forma que va a depender del oxígeno y no del H2O2 como cosustrato para la oxidación de compuestos.18
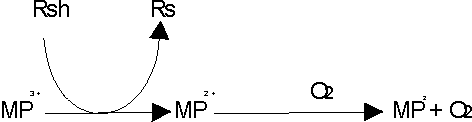
En presencia de un agente reductor (RSH), la enzima se reduce a la forma ferro, que se oxida en presencia de O2 para dar lugar al compuesto III que tiene capacidad oxidante.
El ácido hipocloroso (reacción 2) es un potente agente oxidante que si bien contribuye al mecanismo de defensa contra los agentes infecciosos, puede actuar sobre las células del hospedero lo que provocaría inactivación de a a-antiproteinasa, entrecruzamientos de proteínas y reacción con ácidos grasos insaturados para formar clorohidrinas, las cuales pueden desestabilizar las membranas celulares. De aquí que el HOCl es un candidato a causar mucho del daño mediado por neutrófilos en enfermedades inflamatorias.19 El HOCl puede reaccionar con otra molécula de H2O2 y dar lugar al oxígeno singlete (reacción 7) o reaccionar con aminas para formar las N-cloraminas que son altamente reactivas y presentan un largo tiempo de vida media (reacción 8).22
HOCl + R-NH2 ® R-NHCl + H2O (reacción 8)
INHIBIDORES
Se han reportado diferentes drogas como: la dapsone, benzocaína, primaquina y famotidina, las cuales inhiben a la MPO secuestrando a la enzima en forma de compuesto II;23-25 por otro lado los antihipertensivos como la hidralacina, además de la indometacina y los salicilatos.26,27 El cianuro y la azida de sodio también han sido reconocidos como inhibidores de la MPO, si bien no se conoce el mecanismo por el cual la inhiben.BIOSÍNTESIS
La biosíntesis de la MPO es un proceso complejo que incluye la formación de una proenzima a partir de una pre-proenzima. La enzima activa se obtiene a partir de la maduración de la proenzima,28 que tiene lugar en los lisosomas, en la fase promielocítica de la diferenciación del neutrófilo.20William y otros propusieron un modelo para explicar el proceso de biosíntesis de esta enzima (fig. 3).28 El producto primario de la traducción del mRNA de la MPO es un péptido simple de 80 kDa que sufre ruptura cotraduccional del péptido señal y glicosilación en 5 sitios (residuos de Asparagina), resultando en una especie de 92 kDa, que es rápidamente fragmentada por glucosidasa I para generar la apoproteína de 89 kDa. Esta especie es localizada en el retículo endoplásmico y es extremadamente estable. Estos autores especulan que el próximo evento es la inserción del grupo hemo en la apopro-MPO, que ha indicado ser un evento del retículo endoplásmico (RE) según tinción específica para peroxidasas. Posteriormente la pro-MPO es fosforilada, más probable después de salir del RE porque los residuos fosfomanosil son generados en un compartimiento pos-RE, pre Golgi. La pro-MPO fosforilada tiene un tiempo de vida media muy corto y es proteolíticamente procesado a MPO madura en un compartimiento prelisosomal, liberándose el propéptido de la pro-MPO intracelular.
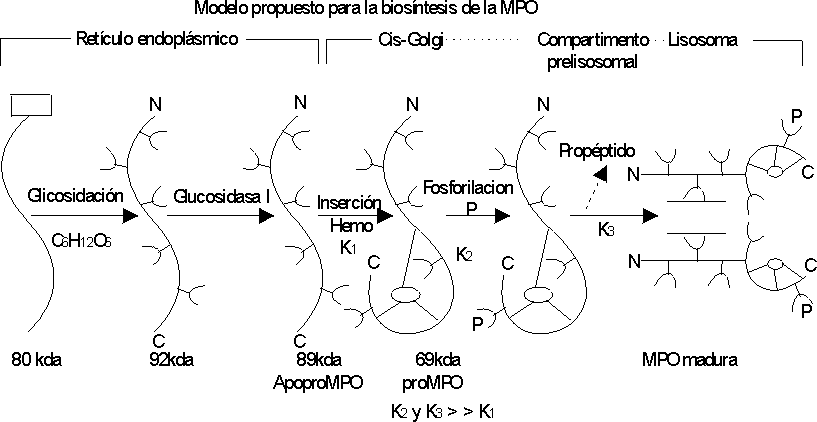
ACTIVIDAD Y ENFERMEDAD
El incremento de la actividad de la MPO se ha reportado en varios procesos patológicos y está asociada con un aumento del riesgo al estrés oxidativo, como en el caso de las enfermedades infecciosas (generales o locales), las enfermedades inflamatorias (artritis reumatoidea) y la isquemia/reperfusión.En estos casos se reporta un aumento significativo de la actividad de MPO, en proporción directa al número de neutrófilos infiltrados en el tejido, por lo que se puede utilizar su actividad como índice de migración leucocitaria y por lo tanto de estrés oxidativo.7,29-35
Enfermedades del sistema respiratorio
En la fibrosis quística, la actividad MPO está aumentada proporcionalmente al grado de obstrucción de las vías respiratorias que presentan estos pacientes. La enzima por la vía de inactivación de la a -1 antiproteasa contribuye a incrementar la actividad de la elastasa de los neutrófilos sobre la elastina pulmonar, la cual desempeña una importante función en la fisiopatología de la enfermedad.36,37Con respecto al daño pulmonar en pacientes fumadores se reporta que en fumadores inveterados hay un incremento de ácidos grasos saturados libres que afectan el metabolismo oxidativo de los polimorfonucleares. Se produce un aumento de la actividad MPO y la producción de HOCl, con lo que se amplifica el daño oxidativo mediado por esta enzima en los pulmones.38
Enfermedades del sistema circulatorio
La MPO es capaz de generar especies reactivas que dañan lípidos y proteínas,39,40 y parece contribuir a la aterogénesis a través de las reacciones oxidativas que ésta cataliza. El sistema MPO-H2O2 al tener como sustrato la L-tirosina produce el radical tirosilo, que es capaz de estimular la peroxidación lipídica. Esta peroxidación es vital para la transformación de las LDL en partículas aterogénicas.39Enfermedades del sistema digestivo
Estudios en pacientes con cirrosis hepática y hepatitis crónica muestran niveles aumentados de MPO. Cuando se acompañan de esplenomegalia este ascenso es mayor. El incremento es siempre más evidente en la primera entidad. Lo anterior sugiere la función de la MPO en la fisiopatología del hiperesplenismo relacionado con estas enfermedades.41Enfermedades del sistema hemolinfopoyético
La MPO se utiliza como índice de diferenciación entre las leucemias linfoblásticas y mieloblásticas, por el aumento de la enzima en estas últimas.42En los pacientes sicklémicos se reportan aumentos significativos de MPO, con una correlación inversa a la concentración de hemoglobina, lo que sugiere que los polimorfonucleares y el sistema de complemento participan en los mecanismos fisiopatológicos de la enfermedad.43
Se ha encontrado que el sistema MPO-H2O2 -Cl es capaz de inactivar las células infectadas por el HIV tipo 1.44 En este mecanismo se utiliza el H2O2 elaborado por las propias células infectadas sin necesidad de H2O2 exógeno. En estudios in vitro se demostró que la actividad antiviral se logra a concentraciones bajas de MPO, concentraciones mayores resultan citotóxicas.
Otras enfermedades
La función de la MPO en la patogénesis de la catarata se demostró al evaluar el efecto de la MPO sobre el cristalino de animales viejos, en los cuales se produjo opacidad del lente.45Los niveles de lipoperóxidos (LPO) y MPO en el vítreo de pacientes vitrectomizados con retinopatía diabética proliferativa se encuentran aumentados, lo cual sugiere que la producción de especies reactivas del oxígeno (ERO) y los mecanismos inflamatorios participan en la patogénesis de la enfermedad.46 Estos niveles se encuentran elevados en la retina de pacientes con melanoma coroidal, lo que evidencia su relación con la retinopatía asociada al tumor.47
En los pacientes con trisomía 21 se encuentran bajos niveles de superóxido y una actividad reducida de MPO, por lo que se produce un desbalance en la producción de ERO en los neutrófilos de esos niños y hace que aumente el daño oxidativo en estos pacientes.48
SUMMARY
Organism´s defence is mediated by cells of the so-called reticuloendothelial system, of which, nautrophils polymorphonuclear, are the first line of nonspecific defense. Myeloperoxidase is the more abundant protein in neutrophils, and is the sole peroxidase catalising hydrogen peroxide and chloride donversion to hypochlorous acid. This es a powerful oxidative agent leading to defense mechanism against infectious agents; however, is able to act on host cells in case of uncontrollable or excessive activation, and in the humoral factors inactivation. In view of the ample spectrum of reactivity, hypochlorous acid is a mediator of tissue damage in many inflammatory process. Authors present some physico-chemical features, mechanism of action, biosynthesis, and relation of myeloperoxidase with different pathologic process.Subject headings: PEROXIDASE/ metabolism; PEROXIDASE/ chemistry; NEUTROPHIS/ ensymology; REACTIVE OXIGEN SPECIES.
REFERENCIAS BIBLIOGRÁFICAS
- Van Den Abbeele A, Pourtois M, Courtois P. Fluoride inhibition of SCN and Cl peroxidase activities in whole saliva and of recombinant myeloperoxidase. Influence of pH and hydrogen peroxide concentration. J Biol Buccale 1992;20:219-24.
- Edwards SW, Hughes V, Barlow J, Bucknall R. Inmunological detection of MPO in synovial fluid from patients with rheumatoid arthritis. Biochem J 1988;250(1):81-5.
- Wolff H, Panhans A, Zebhauser M, Meurer M. Comparison of three methods to detect white blood cells in semen leukocyte esterase dipstick test granulocyte elastase enzymoimmunoassay, and peroxidase cytochemistry. Fertil Steril 1992;58(6):1260-2.
- Karger S, Campo GM, Squadrito F, Ioculano M, Altavilla D, Zingarelli B, et al. Protective effects of IRFI-016, a new antioxidant agent in myocardial damage, following coronary artery occlusion and reperfusion in the rat. Pharmacology 1994;48:157-66.
- Johnson R, Couser WG, Chi EY, Adler S, Klebanoff SJ. New mechanism for glomerular injury. J Clin Invest 1987;79(5):1379-87.
- Bradley PP, Priebat PA, Christensen RD, Rothstein GR. Measurement of cutaneous inflammation: estimation of neutrophil content with an enzyme marker. J Invest Dermatol 1982;78:206-9.
- Komatsu H, Koo A, Ghadishah E, Zeng H, Kuhlenkamp JF, Inova M. Neutrophil accumulation in ischemic reperfused rat liver evidence for a role of superoxide free radicals. Am J Physiol 1992;262(4 Pt 1):6669-76.
- Joseph P, Srinivasan NS, Kulkarni AP. Placental peroxidase further purification of the enzyme and oxidation of thiobenzamide. Placenta 1993;14(3):309-19.
- Márquez LA, Dunford HB, Wart HV. Kinetic studies on the reaction of compound II of myeloperoxidase with ascorbic acid. Role of ascorbic acid in myeloperoxidase function. J Biol Chem 1990;265(10):5666-70.
- Svensson BE, Linduall S. Myeloperoxidase-oxidase oxidation of cysteamine. Biochem J 1988;249(2):521-30.
- Agner K. Verdoperoxidase. A ferment isolated from leukocytes. Acta Physiol Scand 1941;2(Suppl 8):1-62.
- Harrison JE. The subunit structure of crystalline canine myeloperoxidase. Biochim Biophys Acta 1977;493:247-59.
- Nausefl WM. Myeloperoxidase biosyntesis by a human promielocytic leukemia cell line: insight into myeloperoxidase deficiency. Blood 1986;67(4):865-72.
- Morishita Y, Morishima Y, Ogura M, Nagai Y, Ohno P. Biochemical characterization of human myeloperoxidase using three specific monoclonal antibodies. Br J Haematol 1986;63(3):435-44.
- Iwamoto H, Morita Y, Kobayashi T, Hasegawa E. Subunit structures of three human myeloperoxidases. J Biochem 1988;103:688-92.
- Deseer RK, Himmelhoch SR, Evans WH, Januska M, Mage M, Shelton E. Guinea pig heterophil and eosinophil peroxidase. Arch Biochem Biophys 1972;148(2):452-65.
- Svensson BE, Dome K, Linduall S, Rydell G. Peroxidase and peroxidase-oxidase activities of isolated human myeloperoxidases. J Biochem 1987;242:673-80.
- Svensson BE. Myeloperoxidase oxidation states involved in myeloperoxidase-oxidase oxidation of thiols. J Biochem 1988;256:751-5.
- Kettle AJ, Winterbourn CC. Assays for the chlorination activity of myeloperoxidase. Methods in Enzymology 1994;233:502-12.
- . Superoxide modulates the activity of myeloperoxidase and optimizes the production of hypochlorous acid. J Biochem 1988;252:529-36.
- Kettle AJ, Robertson IGG, Palmer BD, Anderson RF, Patel KB, Winterbourn CC. Oxidative metabolism of Amsacrine by the neutrophyl enzyme myeloperoxidase. Biochem Pharmacol 1992;44(9):1731-8.
- Domigan NM, Charlton TS, Duncan MW, Winterbourn CC, Kettle AJ. Chlorination of tyrosil residues in peptides by myeloperoxidase and human neutrophils. J Biol Chem 1995;270(28):1-7.
- Kettle AJ, Gedye CA, Winterbourn CC. Superoxide is an antagonist of antiinflammatory drugs that inhibit hypochlorous acid production by myeloperoxidase. Biochem Pharmacol 1993;45(10):2003-10.
- Van Zyl JM. Mechanism by which clofazimine and dapsone inhibit the MPO system. A possible correlation with their antiinflammatory properties. Biochem Pharmacol 1991;42(3):599-608.
- Zyl JM van, Kriegler A, Walt BJ van der. Anti-oxidant properties of H2-receptor antagonists effects on myeloperoxidase catalysed reactions and hydroxyl radical generation in a ferrous hydrogen peroxide system. Biochem Pharmacol 1993;45(12):2389-97.
- Kettle AJ. Mechanism of inhibition of myeloperoxidase by antiinflammatory drugs. Biochem Pharmacol 1991;41(10):1485-92.
- Nassberger L. The antihipertensive compounds hidralazine, dihydralazine and cadralazine and their metabolites inhibit MPO activity as measured by chemiluminescense. Biochem Pharmacol 1991;42(9):1844-7.
- Nauseef WM, Mc Cormick S, Yi H. Roles of hemo insertion the manose-6-phosphate receptor in processing of the human myeloid lysosomal enzyme, myeloperoxidase. Blood 1992;80(10):2622-33.
- Simpson PJ, Fantone JC. Identification of a time window for therapy to reduce experimental canine myocardial injury. Circulation Res 1988;63(6):1070-9.
- Nalini S, Mathan MM, Balasubramanian KA. Oxygen free radical induced damage during intestinal ischemia/reperfusion in normal and Xanthine oxidase deficient rats. Mol Cell Biochem 1993;124(1):59-66.
- Wilson IC, Gardner TJ, Dinatale JM, Gillinov AM, Curtis WE, Cameron DE. Temporary leukocyte depletion reduces ventricular dysfunction during prolonged postischemic reperfusion. J Thorac Cardiovasc Surg 1993;106(5):805-10.
- Peralta JG, Llesuy S, Evelson P, Carreras MC, Flecha BG, Poderoso JJ. Oxidative stress in skeletal muscle during sepsis in rats. Circ Shock 1993;39(2):153-9.
- Junger WG, Cardoza TA, Liu FC, Hoyt DB, Goodwin R. Improved rapid photometric assay for qualitative measurement of PMN migration. J Immunol Methods 1993;160:73-9.
- Over C, Yamalik N, Yavuzyilmaz E, Ersoy F, Eratalay K. Mieloperoxidase activity in peripheral blood, neutrophil crevicular fluid and whole saliva of patients with periodontal disease. J Nihon Univ Sch Dent 1993;35(4):235-40.
- Venge P. Eosinophil activity in bronchial asthma. Allergy Proc 1994;15(3):139-41.
- Meyer KC, Zimmerman J. Neutrophil mediators. Pseudomonas and pulmonary dysfunction in cystic fibrosis. J Lab Clin Med 1993;121(5):654-61.
- Koller DY, Gotz M, Eichler I, Urbanek R. Eosinophil activation in cystic fibrosis. Thorax 1994;49(5):496-9.
- Quian M, Eaton JW. Free fatty acids enhance hypochlorous acid production by activated neutrophils. J Lab Clin Med 1994;124(1):86-95.
- Savenkowa ML, Mueller DM, Heinecke JW. Tyrosyl radical generated by myeloperoxidase is a physiological catalyst for the iniciation of lipid peroxidation in low density lipoprotein. J Biol Chem 1994;269(32):20394-400.
- Heinicke JW, Li W, Fracis GA, Goldstein JA. Tyrosyl radical generated by myeloperoxidase catalyzes the oxidative cross-linking of proteins. J Clin Invest 1993;91(6):2866-72.
- Nakamuta M, Ohashi M, Tanabe Y, Hiroshige K. Nawata H. High plasma concentration of myeloperoxidase in cirrhosis: a possible marker of hypersplenism. Hepatology 1993;18(6):1377-83.
- Schlaifer D, Cooper MR, Attal M, Sartor AO, Trepel JB, Laurent G, et al. MPO: an enzyme envolved in intrinsic vincristine resistance in human myeloblastic leukemia. Blood 1993;81(2):482-9.
- Mohamed AO, Hashim MS, Nilsson UR, Venge P. Increased in vivo activation of neutrophils and complement in sickle cell disease. Am J Trop Med Hyg 1993;49(6):799-803.
- Chochola J, Yamaguchi Y, Moquilevsky N, Bollen A, Strosberg AD, Stanislawski M. Virocidal effect of myeloperoxidase in an human immunodeficiency type 1-infected T cells. Antimicrob Agent Chemother 1994;38(5):969-72.
- Iugai MT, Formaziuk VE, Sergienko VI, Riabtseva AA, Romashova MP. The role of Myeloperoxidase, a product of the polymorphonuclear leukocytes, in the pathogenesis of cataract. Biull Eksp Biol Med 1992;114(10):364-6.
- Augustin AJ, Boker J, Breipohl W. Increased lipid peroxide levels and myeloperoxidase activity in the vitreous of patients suffering from proliferative diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol 1993;231(11):647-50.
- . Increased lipid peroxidase and inflammatory parameters in the retina adjacent to choroidal melanoma. Br J Ophthalmol 1994;78(2):130-2.
- Gabianelli R, Kantar A, Oggiano N, Fiorini R, Falcioni G, Giorgi PL. Oxidative metabolism in polymorphonuclear granulocytes of children with trisomy 21. Minerva Pediatr 1993;45(12):493-7.
Lic. Onel H. García Morales. Instituto Superior de Ciencias Básicas y Preclínicas "Victoria de Girón". Ave 146 y 31 No. 3102, Playa, La Habana 16, CP 11600, Cuba.














