Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.18 n.2 Ciudad de la Habana may.-ago. 1999
Trabajos de Actualización
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"Telómeros y telomerasas
Dr. Rolando A. Hernández FernándezRESUMEN
Los telómeros son estructuras cromatínicas especializadas que se encuentran localizadas en los extremos de los cromosomas eucariontes. Tanto el ADN como las proteínas que los constituyen presentan características singulares que los diferencian del resto de los cromosomas. Parecen estar implicados en numerosas funciones celulares, especialmente las relacionadas con el control de la duración de la vida de diferentes estirpes celulares. Estas estructuras se replican durante el ciclo celular gracias a la acción de enzimas denominadas telomerasas que están formadas por proteínas y ARN y presentan un mecanismo peculiar. Recientemente se ha estudiado el comportamiento de las telomerasas en las células cancerosas y sus posibles aplicaciones diagnósticas y terapéuticas. En este trabajo se presenta un resumen de los principales hallazgos más recientes sobre la estructura y funciones de los telómeros y la acción de las telomerasas.Descriptores DeCS: TELOMERASA/fisiología; TELOMERO/fisiología; CICLO CELULAR.
Los telómeros constituyen estructuras especializadas que forman los extremos de los cromosomas eucariontes que participan en funciones celulares tan importantes como la mitosis, la estabilidad cromosómica y el tiempo de vida de las estirpes celulares. Recientemente se ha demostrado su relación con algunas enfermedades, especialmente con el cáncer. Durante las últimas 2 décadas mucho se ha avanzado en el conocimiento de su estructura y dinámica. En este trabajo se resumen los hallazgos recientes más importantes.
Estructura de los telómeros
Los telómeros fueron identificados por H.J. Muller durante la década de los años 30. Desde entonces, se ha profundizado extraordinariamente en el conocimiento de estas estructuras, gracias a la introducción de la moderna tecnología de la Genética Molecular. Un resumen de los principales trabajos realizados en los primeros años de aplicación de estas técnicas fue publicado en 1984 por Blackburn y Szostack.1Los estudios se han realizado principalmente en ciliados, cuyos macronúcleos pueden contener de 40 000 a 1 000 000 de telómeros según la especie, por lo que constituyen una excelente fuente de componentes teloméricos y de las enzimas que participan en su replicación. Posteriormente, se ha comprobado que los aspectos descritos en ciliados están presentes en otros organismos. En los ciliados y en S. cerevisiae los telómeros se encuentran en una forma de estructura cromatínica particular no nucleosómica que ha sido denominada telosoma. Los nucleosomas adyacentes presentan histonas hipoacetiladas características de la cromatina que no se transcribe activamente. En mamíferos, donde son mucho más largos, se presentan formados por nucleosomas pero hacia la zona más extrema aparecen como telosomas. Esto evidencia que al menos en parte hay conservación estructural de los telómeros. También muestran diferencias interespecies algo sorprendentes.
El adn telomérico
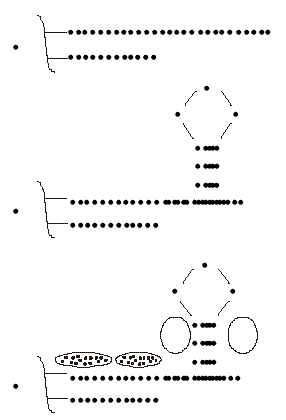
En casi todos los eucariontes estudiados, el ADN telomérico (ADNt) consiste en repeticiones en tanden de pequeñas secuencias nucleotídicas con una distribución asimétrica de los pares G:C, pues las G se acumulan en una de las hebras (hebra G) y se encuentran agrupadas. La hebra G está orientada de 5' a 3' hacia el extremo del telómero y forma el extremo 3'del ADN cromosómico. En la zona más extrema no está apareada formando un segmento final monofibrilar con una longitud que varía según la especie. Las principales características estructurales de los telómeros se resumen en la figura 1. La longitud del telómero es variable. En Oxytricha y Euplotes es apenas de 38 pb mientras en ratones alcanza 150 kb. Cada organismo posee una longitud media característica. La cantidad de ADNt por cromosoma también fluctúa. En algunos organismos la longitud promedio de los telómeros responde a cambios genéticos o nutricionales.Fig. 1. Representación esquemática de la estructura de los telómeros. (A) El ADN telomérico consta de pequeñas secuencias repetidas ricas en bases de guanina con un extremo monofibrilar. (B) El extremo monofibrilar puede formar estructuras de tipo secundario por apareamiento de las bases de guanina. (C) Estas repeticiones sirven para la unión a proteínas tanto en la doble hebra como en la zona monofibrilar.
Las secuencias de ADNt mejor caracterizadas se muestran en la tabla 1 confeccionada a partir de la excelente revisión de V.A. Zakian.2 La mayoría de las secuencias son cortas y precisas, como en Tetrahymena que es de 6 pb (TTGGGG). Sin embargo, en S. cerevisiae es heterogénea, y muy larga en K. lactis donde presenta 25 pb. Especies muy distantes pueden presentar la misma secuencia, como los vertebrados, y especies muy cercanas como Tetrahymena y Oxytricha ser diferentes aunque muy relacionadas.
| Organismo | |
| Tetrahymena | |
| Oxytricha | |
| Giardia | |
| Physarum | |
| Kluyveromyces | |
| Neurospora | |
| Caenorphabditis | |
| Vertebrados | |
Mientras más secuencias teloméricas se conocen, más difícil resulta encontrar una secuencia consenso. La existencia de múltiples secuencias teloméricas sugiere que las funciones de los telómeros no requieren de una secuencia única. El hallazgo de secuencias teloméricas en sitios internos de los cromosomas demuestra que ellas por sí mismas no hacen los telómeros. In vitro, las hebras G pueden aparearse de formas diversas. Una de ellas es la de hélices tetrafibrilares o cuartetos G, que se mantienen por múltiples pares G:G. Si estas estructuras son importantes para la función de los telómeros se explicaría el agrupamiento de las G que se observa en las secuencias.
Dos excepciones notables aparecen entre los telómeros. En Parascaris no se observa la distribución asimétrica de las G, éstas ni siquiera están agrupadas pues su secuencia es TTGCA. En Drosophila presentan una estructura totalmente diferente representada por repeticiones de elementos de transposición.
Las proteínas teloméricas
Las proteínas teloméricas (PT) pueden presentarse asociadas al extremo monofibrilar o a la zona adyacente de doble hebra. Entre las primeras se ha identificado una proteína de Oxytricha que no está relacionada estructuralmente con ninguna otra proteína. In vitro, esta proteína facilita la formación de cuartetos G, lo cual sugiere la existencia de estas estructuras in vivo. No se le ha detectado unión a zonas internas del cromosoma.Una proteína de unión a la hebra G monofibrilar en levaduras es el producto del gen EST1. La unión de EST1p es específica para las repeticiones (TG1!3)n de una sola hebra y requiere de un extremo 3' libre.3
La principal PT de unión a la zona de doble hebra en S. cerevisiae es el producto del gen RAP1. Su unión a las repeticiones (TG1!3)n de hebra simple se realiza con menos afinidad que a las de doble hebra. Se ha demostrado que RAP1p contiene 2 motivos estructurales de unión al ADN que son homólogos a los del oncogen myb.
A partir de células HeLa se purificó una proteína de 60 kDa que se une a los telómeros humanos y se le denominó hTRF. La proteína tiene 439 aminoácidos para una masa molecular de 50 341 dalton y su expresión in vitro da lugar a una proteína de tamaño similar a la identificada en los extractos nucleares de células HeLa.4 Alrededor de la posición 350 hTRF contiene 2 secuencias de localización nuclear, la zona N terminal es rica en aspártico y glutámico y en la zona C terminal presenta fuerte homología con la región de unión al ADN del oncogen myb. Ver la referencia5 para una comparación con otros TRF de mamíferos. A partir del hTRF se pudo localizar una proteína telomérica con motivos del oncogen myb en Schizosaccharomyces pombe.6
Es de esperar que en los próximos años se puedan identificar otras proteínas implicadas en la estructura y función de los telómeros.
Las telomerasas
El descubrimiento de las telomerasas resolvió en principio el problema de la replicación de los estremos de moléculas lineales de ADN. La actividad de telomerasa fue detectada por primera vez en Tetrahymena y después en otros eucariontes. En la referencia7 aparece una revisión de los principales trabajos sobre esta enzima. La enzima es una ribonucleoproteína y para su actividad son esenciales tanto el componente proteínico como el ARN.En Tetrahymena el ARN telomerásico (ARNtl) tiene una longitud de 159 nucleótidos (nt) y contiene 9 repeticiones del molde 5' CAACCCCAA3'. Esta característica que se observa también en todos los otros ARNtl identificados, permite el apareamiento del telómero en crecimiento con el ARNtl y que aún quede una región que pueda servir de molde.
Las telomerasas difieren de todas las polimerasas en que utilizan un molde interno en vez de uno externo, lo cual impone limitaciones estéricas específicas para la elongación del iniciador y la catálisis. La telomerasa alarga el ADN iniciador por la adición uno a uno de los desoxinucleósidos trifosfatados y así genera las repeticiones en tanden de los telómeros. La de Tetrehymena puede alargar ADN iniciadores Oxytricha, humanos, plantas y levaduras. Esto sugiere que la enzima tiene afinidad general por las secuencias ricas en G más que por un motivo específico como sucede con otras proteínas de unión al ADN. Pero en todos los casos, la secuencia añadida se corresponde con el molde de ARN de la enzima.
Actualmente, se propone la existencia de 2 sitios enzimáticos independientes de interacción con el ADN iniciador. Uno contiene el molde de ARN y alínea el extremo 3' del iniciador para su elongación en el centro catalítico. El otro se une al ADN iniciador hacia el lado 5'del molde y proporciona una vía de salida para la hebra en crecimiento. Este modelo explica la adición de varias repeticiones sin que la enzima se disocie del ADN iniciador. Este sitio catalítico único debe moverse en relación con el ARN molde. Experimentos en Euplotes apoyan este modelo de los 2 sitios.8 La enzima posee también actividad endonucleolítica que pudiera estar relacionada con una función de corrección (fig. 2).
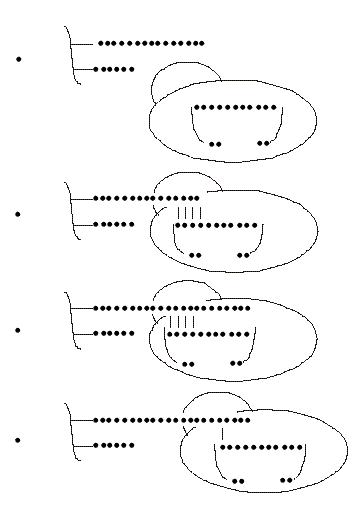
Fig. 2. Mecanismo de acción de la telomerasa. (1) La enzima contiene el ARN telomerásico con un sector complementario a la secuencia de los telómeros. (2) La unión del ADN telomérico con el ARN telomerásico se produce por apareamiento de bases complementarias. (3) La enzima alarga el telómero usando como molde el ARN. (4) Al completar un alargamiento la enzima se desplaza y comienza un nuevo ciclo de alargamiento y así sucesivamente.
El arn telomerásico
El ARNtl ha sido aislado de numerosas especies. La longitud de éste varía desde 160 a 190 nt en los ciliados hasta 1 300 en levaduras y cada uno de ellos contiene una secuencia molde apropiada para la síntesis de las repeticiones teloméricas. Los ARNtl presentan poca homología de secuencia, sin embargo, al menos en ciliados, la estructura secundaria está muy conservada. En Tetrahymena solamente 159 nt son suficientes para un funcionamiento adecuado. Se ignora por qué en otras especies es mucho más largo. Algunas características de estos ARN se recogen en la tabla 2.
| Organismo | | |
| Tetrahymena | | |
| Euplotes | | |
| Oxytricha | | |
| Humanos | | |
| Ratón | | |
| S. cerevisiae | | |
| K. lactis | | |
Los estudios con mutantes de ARNtl en Tetrahymena han mostrado que cambios en algunos de los 6 nt del extremo 5' (CAACCCCAA) producen secuencias repetidas alteradas, sin embargo los 3 últimos no son utilizados como molde y más bien parecen participar en alinear el iniciador. En el mutante (AAACCCCAA) se produce una disociación prematura de la enzima antes de arribar al nucleótido cambiado, tal vez por efectos estéricos de los nucleótidos alterados en el molde o porque el ARN desempeñe algún papel en la catálisis u otra función.9
Proteínas telomerásicas
La telomerasa de Tetrahymena consta de 2 polipéptidos, p80 y p95, el menor se une al ARNtl y el mayor al ADN iniciador. La enzima contiene una copia de cada una de las proteínas y una del ARNtl para una masa molecular aparente de 250 kDa. Las secuencias de p80 y p95 no guardan una extensa homología con otras proteínas, lo que indica que se trata de proteínas nuevas. No obstante, se ha encontrado una homología limitada entre p95 y las ARN polimerasas dependientes de ARN (transcriptasas inversas, T1) así como con motivos estructurales de algunas ADN polimerasas. Este motivo de T1 también se encuentra en la p123 de E. aediculatus y en el producto del gen EST2 de S. cerevisiae cuya deleción produce defectos teloméricos. Los cambios de un aminoácido por otro en el motivo de T1 de EST2p produce acortamiento de los telómeros y senescencia en levaduras, lo que indica su importancia para el alargamiento de los telómeros in vivo.10También se han identificado en mamíferos 2 proteínas con homología secuencial con p80. Una de ellas designada TP1 interactúa con el ADNt.11 La otra obtenida de ratas se ha denominado TLP1 y su ADNc codifica una proteína de 2 629 aminoácidos para una masa molecular deducida de 240 kDa (p240).12 Esta p240 es modificada in vivo y convertida en p230, tal vez como un mecanismo postraduccional de regulación de la actividad de la telomerasa.
Genética de la telomerasa
Al introducir cambios en la secuencia molde del ARNtl en Tetrahymena las células se hacen muy grandes con problemas en la división nuclear y pierden viabilidad después de varias generaciones. Existe una alteración en los mecanismos que regulan la longitud de los telómeros, tal vez porque se inhibe la unión de las PT al cambiar la secuencia. En S. cerevisiae la deleción de EST1 produce un acortamiento progresivo de los telómeros y al cabo de unas 50 generaciones las células se hacen muy grandes y muchas de ellas mueren. La deleción del gen TLC1, que codifica el ARNtl y de EST2, EST3 y EST4 produce fenotipos similares que no se agravan en los dobles mutantes, lo que sugiere que estos genes están en epistasis.13Replicación de los telómeros
En la estructura de los telómeros predomina la zona de repeticiones en la doble hebra y solamente el extremo terminal presenta la estructura monofibrilar. Aunque la telomerasa es necesaria para mantener la longitud de los telómeros, esta enzima sólo alarga la hebra G. La replicación de la hebra C debe hacerse por el sistema convencional de las polimerasas. En levaduras mutantes para la polimerasa a y la proteína replicativa C (RFC) tienen alteraciones en la síntesis de los telómeros. Tanto en levaduras, en humanos, como en otros organismos los telómeros se replican al final de la fase S.14La replicación de los telómeros es sólo necesaria para compensar la pequeña y lenta pérdida de ADN que resulta de la replicación incompleta, por lo tanto debe ser considerada como una función de reparación. En este proceso, el ADN telomérico no tiene exactamente la función de molde. In vitro la telomerasa de Tetrahymena puede añadir hasta 500 nt antes de separarse del ADN. La síntesis de la hebra C por el sistema convencional de las polimerasas generaría una larga molécula bifibrilar con un extremo monofibrilar de 8 a 12 nucleótidos, que es un buen sustrato para la telomerasa.
El estado dinámico de los telómeros depende de varios factores, entre ellos, la procesividad de las telomerasas, la frecuencia de su acción sobre cada telómero particular y la velocidad de degradación del ADNt.15 Las PT como el hTRF1 también pueden regular su longitud.16
Se ha visto que en levaduras, un mutante (TEL1) deficiente en la regulación de los telómeros es homólogo de 2 genes implicados en la regulación del ciclo celular: el MEC1 en levaduras y el de la ataxia telangiectásica (ATM) en humanos, lo cual apunta a un vínculo entre la replicación de los telómeros y el ciclo celular.
Funciones de los telómeros
Los telómeros representan estructuras esenciales para las células, pues evitan la fusión cromosómica, desempeñan un importante papel en mantener la estabilidad cromosómica17 y participan tanto en la meiosis como en la mitosis.18Sin embargo, su función más notoria es la de servir como un reloj mitótico que mide y regula el número de las divisiones celulares.19 Los telómeros se acortan con cada división celular y el número de divisiones que la célula puede experimentar se correlaciona con la longitud de los telómeros.20 Este acortamiento pudiera eliminar genes indispensables para la vida o silenciar genes cercanos por el efecto de posición del telómero. Una longitud crítica pudiera ser la señal para la entrada en la senescencia celular. Sin embargo, vale tener presente que no está relacionada con la edad del organismo.
La actividad de la telomerasa varía en diferentes etapas de la vida. Se ha detectado en ovarios y testículos en fetos, recién nacidos y adultos, pero no en óvulos ni espermatozoides maduros. El blastocisto y la mayoría de los tejidos somáticos de 16 a 20 semanas de desarrollo exhiben un alto nivel de telomerasa que desaparece después del nacimiento.21 También es alta en tejidos adultos con una intensa proliferación celular como en las células endoteliales22 y el endometrio.23 En otras células puede ser inducida en determinadas etapas de la vida como ocurre con la activación de los linfocitos T24 y los B.25
Esta función de los telómeros los relaciona de inmediato con la transformación cancerosa. En uno de los primeros trabajos sobre el tema se encontró que en células cultivadas de 18 diferentes tejidos humanos 98 de cada 100 inmortales y ninguna de 22 mortales mostraban actividad de telomerasa. Asimismo 90 de 101 biopsias de 12 tipos de tumores y ninguna de 50 de tejidos somáticos normales poseían actividad de la enzima.26
Estudios posteriores han confirmado una actividad incrementada de telomerasa en cáncer de mama,27 próstata,28 astrocitomas29 y otros. Estos hallazgos pudieran tener importantes implicaciones clínicas. La determinación de la actividad de telomerasa pudiera ser utilizada para el diagnóstico precoz del cáncer en pruebas no invasivas30 y los inhibidores de la enzima pudieran ser usados como agentes antitumorales con un alto grado de selectividad para las células transformadas.
Perspectivas
El descubrimiento de la singular estructura nucleoproteínica de los telómeros y su conservación filogenética estructural y funcional demuestran el carácter esencial de esas estructuras para la vida de la célula. La existencia de las telomerasas soluciona el viejo problema sobre la replicación de los extremos de moléculas lineales de ADN. Sin embargo, estos hallazgos plantean nuevos problemas. Entre ellos está determinar la función del ARNtl en la zona que no funciona como molde y su posible participación en la catálisis enzimática. Los factores que regulan la actividad de la enzima por una parte y la longitud de los telómeros por otra. Dilucidar los mecanismos moleculares que vinculan los telómeros con la regulación de la proliferación celular. También será interesante y trascendental la posible aplicación de estos conocimientos para el diagnóstico y tratamiento de enfermedades proliferativas, especialmente el cáncer. Para dar respuesta a estos y otros problemas deben encaminarse las futuras investigaciones.SUMMARY
Telomeres are specialized chromatin structures located in the extremes of eukaryotic chromosomes. Both their DNA and proteins present singular characteristics that differentiate them from the rest of chromosomes. They seem to be involved in a member of cell functions, especially those related to the control of life span of different cell species. These structures replicate in the cell cycle thanks to the activity of telomerases. which are enzimes composed by proteins and RNA with a peculiar mechanism. Recent research works have studied the behaviour of telomerases in cancer cells and their possible diagnostic and therapeutical uses. This paper shows a summary of the main and most recent findings on the structure and functions of telomeres and the action by telomerases.Subject headings: TELOMERASE/physiology; TELOMERE/physiology; CELL CYCLE.
REFERENCIAS BIBLIOGRÁFICAS
- Blackburn EH, Szostak JW. Molecular structure of centromeres and telomeres. Ann Rev Biochem 1984;53:163-94.
- Zakian VA. Telomeres beginning to understand the end. Science 1995;270:1601-7.
- Viria Peariman V, Morris DK, Lundblad V. Est 1 has the properties of a single-stranded telomere end-binding protein. Genes Dev 1996;10:3094-104.
- Chong L, Stensel B van, Broccoli D, Erdjument-Bromage H, Hanish J, Tempst P, et al. A human telomeric protein. Science 1995;270:1663-7.
- Smith S, Lange T de. TRF1, a mammalian telomeric protein. Trends Genet 1997;13:21-6.
- Cooper JP, Nimmo ER, Alishire RC, Cech TR. Regulation of telomeric lenght and function by a myb-domain protein in fission yeast Nature 1997;385:744-7.
- Collins K. Structure and function of telomerase. Curr Opin Cell Biol 1996;8:374-80.
- Hammond PW, Live TN, Cech TR. The anchor site of telomerase from Euplotes aediculatus revealed by photo-cross-linling to single- and double-stranded DNA primers. Mol Cell Biol 1997;17:296-308.
- Battachay A, Blackburn EH. A functional telomerase RNA swap in vivo reveals the importance of nontemplate RNA domains. Proc Natl Acad Sci USA 1997;94:2823-7.
- Lingner J, Hughes TR, Shevchenko A, Mann M, Lundblad V, Cecch TR. Reverse transcriptase motifs in the catalytic subunit of telomerase. Science 1997;276:561-7.
- Harrington L, McPhail T, Mar V, Zhou W, Oulton R, Bass MB, et al. A mammalian telomerase-associated protein. Science 1997;275:973-7.
- Nakayama J, Saito M, Nakamura H, Matsuura A, Ishikawa F. TLP1: a gene encoding a protein component of mammalian telomerase is a novel member of WD repeats family. Cell 1997;88:875-84.
- Lendva TS, Morris DK, Sah J, Balasubramanian B, Lundblad V. Senescence mutants of Saccharomyces cerevisiae with a defect in telomere replication identify three additional EST genes. Genetics 1996;144:1399-412.
- Shimada Y, Nakano M, Kanda N, Murakami-Murofushi K, Kim JK, Ide T, et al. Cycle-dependent activation of telomerase in naturally synchronized culture of a true slime mold, Physarum polycephalum. Biochem Biophys Res Commun 1997;232:4921-6.
- Greider C. Telomere length regulation. Ann Rev Biochem 1996;65:337-5.
- Steensel B van, Lange T de. Control of telomere length by the human telomeric protein. Nature 1997; 385:740-3.
- Pommier JP, Lebeau J, Ducray C, Sabatier L. Chromosomal instability and alteration of telomere repeat sequence. Biochimie 1995;77:817-25.
- Kirk KE, Harmon BP, Reichardt IK, Sedat JW, Blackburn EH. Block in znaphase chromosome separation caused by telomerase template mutation. Science 1997;275:1478-81.
- Chiu CP, Harley CB. Replicative senescence and cell inmortality: the role of telomeres and telomerase. Proc Soc Exp Biol Med 1997;214:99-106.
- Counter CM. The roles of telomeres and telomerase in cell life span. Mutat Res 1996;366:45-63.
- Wright WE, Piatyszeck MA, Rainey WE, Byrd W, Shay JW. Telomerase activity in human germline and embryonic tissues and cells. Dev Genet 1996;18:173-9.
- Hsiao R, Sharma HW, Ramakrishnan S, Keith E, Narayanan R. Telomerase activity in normal human endothelial cells. Anticancer Res 1997;17:827-32.
- Saito T, Scheneider A, Martel N, Mizumoto H, Bulgay-Moeschel M, Kudo R, et al. Proliferation-associated regulation of telomerase activity in human endometrium and its potencial implication in early cancer diagnosis. Biochem Biophys Res Commun 1997;321:610-4.
- Weng N, Levine BL, June CH, Hodes RJ. Regulation of telomerase RNA template expression in human T lumphocyute development and activation. J immunol 1997;158:3215-20.
- Igarashi H, Sakagushi N. Telomerase activity is induced in human peripheral B lumphocytes by the stimulation to antigen receptor. Blood 1997;89:1299-307.
- King NW, Piatyszeck MA, Prowse KR, Harley CB, West MD, Ho PLC et al. Specific assoiation of human telomerase activity with inmortal cells and cancer. Science 1994;266:2911-5.
- Nawaz S, Hashizumi TL, Markkhan NE, Shroyer AL, Shroyer KR. Telomerase expression in human breast cancer with and without lumph node metastases. Am J Clin Pathol 1997;107:542-7.
- Lin Y, Uemura H, Fujinami K, Hosaka M, Harada M, Kubota Y. Telomerase activity in primary prostate cancer. J Urol 1997;157:1161-5.
- Sallinen P, Miettinen H, Sallinen SL, Haapasalo H, Helin H, Kononen J. Increased expression of telomerase RNA component is associated with increased cell proliferation in human astrocytomas. Am J Pathol 1997;150:1159-64.
- Shay JW, Gazdar AF. Telomerase in the early detection of cancer. J Clin Pathol 1997;50:106-9.
Recibido: 29 de septiembre de 1998. Aprobado: 19 de julio de 1999.
Dr. Rolando A. Hernández Fernández. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón", Calle 146 y Ave. 31, Playa, Ciudad de La Habana, Cuba.