Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.19 n.1 Ciudad de la Habana ene.-abr. 2000
Centro de Ingeniería Genética y Biotecnología de La Habana
Durabilidad de la respuesta inmune antihepatitis B en trabajadores de la salud peruanos con 6 años de vacunados
Dr. Antonio González Griego, Dra. Victoria Ramírez Albajés, Dr. Ricardo Almeida Varela, Dr. Eduardo Zumaeta, Dr. Jorge Ferrandiz, Dr. A. Villanueva, Dr. Víctor Soto, Dra. Alina Alerm González, Dr. René Díaz y Lic. Manuel Antón LoloRESUMEN
Partiendo de la importancia que la Organización Mundial de la Salud y el Centro para el Control de las Enfermedades le atribuyen a la protección de los trabajadores de la salud contra la hepattis viral tipo B (VHB), en 1993 el Instituto Peruano del Seguro Social (hoy ESSALUD), orientó la vacunación del personal de riesgo en los 4 hospitales nacionales, mediante la vacuna cubana Heberbiovac HB (20 mg, esquema 0-1-2 meses). El propósito fue evaluar la persistencia de los anticuerpos en los vacunados después de 6 años de la inmunización y la posible existencia de marcadores de infección por el virus B. Se estudiaron los sueros de 144 trabajadores de la salud, para una cobertura de 70,24 % en relación con los seroprotegidos en el estudio inicial. Para la detección de los marcadores en el suero se emplearon métodos inmunoenzimáticos comerciales. El AgsHB y el anti-AgcHB fueron negativos en todas las muestras serológicas, por lo que se afirmó que en ninguno de los vacunados hubo evidencias de infección por este virus. El anti-AgsHB fue positivo, todos presentaban seroconversión, con seroprotección e hiperrespuesta de 91,6 y 43,7 %, respectivamente. El tiempo de vida media del anti-AgsHB (t ½) es de 3 años, se pronosticó que los niveles de anticuerpos serían superiores a 10 UI/L hasta después de 15 años de finalizado el esquema. Los menores de 40 años tuvieron niveles de seroprotección e hiperrespuesta significativamente mayores; las mujeres se mantuvieron en categorías de respuesta superiores. Se recomendó evaluar la memoria pos-refuerzo en los casos de seroconversión, no seroprotegidos, y extender el trabajo con ESSALUD a otros hospitales del país.Descriptores DeCS: VACUNAS CONTRA HEPATITIS B; PERSONAL DE SALUD; CAMPAÑAS DE VACUNACIÓN; ANTI-CUERPOS DE LA HEPATITIS B/sangre; ANTIGENOS DE LA HEPATITIS B/sangre; PERU.
La hepatitis viral tipo B se mantiene como un problema de salud en el nivel mundial1,2 y las intervenciones para su eliminación y erradicación todavía distan de ser idóneas, pues son múltiples los factores que están presentes en torno a sus formas clínicas y patrones de trasmisión; además de que las acciones terapéuticas para la eliminación de los reservorios están en fase experimental y, aunque auguran mejorías, muestran que los beneficios de las terapias contemporáneas serán solamente para un pequeño porcentaje.
Para la eliminación, es decir, la no aparición de nuevos reservorios, existen posibilidades más eficientes; sin embargo, ocurre que las poblaciones más expuestas son en ocasiones las más difíciles de controlar. Una de ellas, cada vez más reconocida, es la de los trabajadores de la salud, en especial, los que tienen contacto con enfermos o con fluidos biológicos provenientes de ellos y que a través de accidentes laborales, o de malas prácticas asistenciales, poseen un riesgo mucho mayor de puesta en contacto con el virus productor de la hepatitis B (VHB).3-7 En 1960, el CDC (Center for Disease Control [Centro para el control de las enfermedades]) estimó que existían 8 700 pacientes de hepatitis B entre los trabajadores de la salud de América Latina, con 800 casos de hepatitis crónica y 200 fallecidos por año.8 En Perú la prevalencia en general es intermedia (3,8 %),9,10 pero se caracteriza por su heterogeneidad en dependencia del área geográfica, e inclusive de las condiciones socioeconómicas predominantes.11,12 Existen en el país regiones de alta endemicidad, por lo que, las acciones de salud llevadas a cabo allí por este personal, incrementan el riesgo y los exponen aún más.
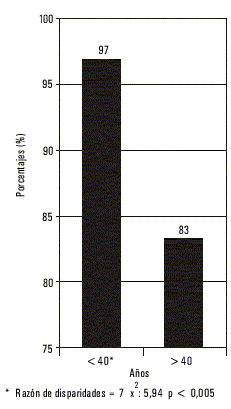
En 1993, el Instituto Peruano de Seguridad Social (hoy ESSALUD), orientó la vacunación de los trabajadores de la salud de 4 hospitales nacionales. Para ello se empleó la vacuna cubana Heberbiovac HB. Se realizó un estudio de inmunogenicidad previo análisis de marcadores del VHB, con la aplicación de la vacuna a los susceptibles. Se obtuvo 97 % de seroprotección después de transcurridos sólo 75 d de haber iniciado el esquema14 de vacunación, que fue de 0-1-2 meses. Teniendo en cuenta los resultados se recomendó esta intervención como parte del Programa de Control de la hepatitis viral tipo B en el Perú. Este esquema se utilizó de acuerdo con su simetría, corta latencia y al grado de protección obtenido en otros estudios realizados antes.13
Entre los aspectos que se toman en consideración para evaluar la eficacia, están la durabilidad de la respuesta inmune pos-vacuna,15 mediante el estudio de la persistencia de anticuerpos; así como de la presencia o ausencia de marcadores de infección por el VHB. En este trabajo se han evaluado los niveles de protección en esta cohorte después de transcurridos 6 años de la vacunación.
MÉTODOS
Previo consentimiento informado, se incluyeron en el estudio 144 trabajadores de salud que cumplieron los criterios de haber resultado con seroprotección en la vacunación de 1993 y que no habían recibido dosis de refuerzo durante estos 6 años. Ellos procedían de los hospitales nacionales E. Rebagliaty; G. Almenara de Lima; Hospital Nacional del Sur de Arequipa y Hospital Nacional A. Aguinaga de Chiclayo.En las muestras serológicas obtenidas, se estudiaron los marcadores del VHB siguientes: AgsHB, anti-AgcHB y anti-AgsHB; la cuantificación de este último se realizó para informar los resultados en categorías de seroconversión (< 10 UI/L), seroprotección (³ 10) e hiperrespuesta (³ 100). Para la detección del AgsHB, anti-AgsHB y anti-AgcHB se utilizaron métodos inmu-noenzimáticos de la Organon Teknika.
Se analizó la cobertura a partir de los individuos originalmente vacunados y los que pudieron ser incluidos en este estudio. Los cambios de categoría se evaluaron para cada individuo y se comparó la clasificación pos-vacunal y transcurridos 6 años, se tuvo en cuenta el género y la edad.
Se estimó la media geométrica de anti-AgsHB y se realizó un pronóstico de la durabilidad de la seroprotección, a partir de los valores de las medias de los anticuerpos pos-vacunales y los obtenidos en este estudio. Para el cálculo del tiempo de vida media y la durabilidad de los anticuerpos se utilizó la expresión t - = Ln 2/n, donde n es la velocidad con la que el anticuerpo disminuye su concentración a la mitad del valor anterior en un tiempo T, y t - es el tiempo requerido para que ocurra ese cambio en la concentración. Una transformación logarítmica de la curva exponencial [C (t) = Ce-nt ] se empleó para el ajuste de la ecuación lineal.
Las variables cualitativas fueron analizadas por chi cuadrado (X2), y se consideraron significativos valores de p < 0,05. Cuando hubo significación se estimaron a razones de disparidades.
RESULTADOS
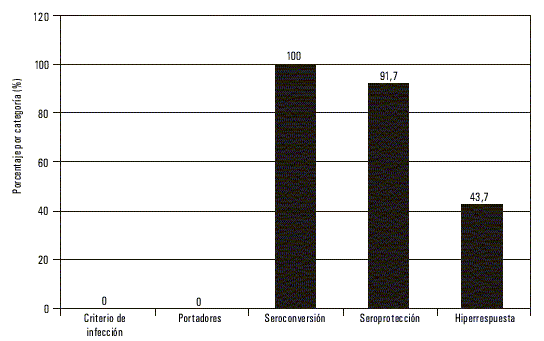
El seguimiento a los 6 años de vacunados se pudo realizar en 144 de los 205 trabajadores que recibieron la vacuna en el año 1993, para una cobertura de 70,24 %.No se detectó la presencia de anti-AgcHB ni de AgsHB en los sueros estudiados. La seroconversión fue de 100 % (144/144), la seroprotección de 91,7 % (132/144) y de 43,7 % (63/144) la hiperrespuesta (tabla 1) (fig. 1). El valor de la media geométrica en la muestra estudiada fue de 97 UI/L (tabla 2).
| | |||||
| Categorí | Rebagliati n (%) | Almenara n (%) | Arequipa n (%) | Chiclayoo n (%) | Totales n (%) |
| Criterio de infección | 0 | 0 | 0 | 0 | 0 |
| Portadores | |||||
| AgsHB | 0 | 0 | 0 | 0 | 0 |
| Seroconversión | 47/47 (100) | 22/22 (100) | 56/56 (100) | 19/19 (100) | 144/144 (100) |
| Seroprotección | 42/47 (89,4) | 20/22 (90,9) | 52/56 (92,9) | 18/19 (94,7) | 132/144 (91,7) |
| Hiperrespuesta | 24/47 (51,0) | 7/22 (31,8) | 21,56 (37,5) | 11/19 (57,9) | 63/144 (43,7) |
| | |||
| Hospitales | | | |
| Rebagliati | | | |
| Almenara | | | |
| Arequipa | | | |
| Chiclayo | | | |
| General | | | |
| n=144 | | | |
| | ||
| Categoría | | |
| Criterio de infección (PI) | | |
| Portadores | | |
| Seroconversión | | |
| Seroprotección | | |
| Hiperrespuesta | | |
| | ||
| Categoría | | |
| Igual categoría n (%) | | |
| | | |
| Caída a categoría inferior | | |
| de seroprotección n (%) | | |
| Caída a seroconvertidos n (%) | | |
| | | |
| | ||
El tiempo de vida media calculado para el anti-AgsHB a partir de la media geométrica pos-vacunal (428 UI/L) y el encontrado en este estudio (97 UI/L) fue de aproximadamente 3 años, y el pronóstico para la duración del anti-AgsHB con cifras superiores a 10 UI/L fue de 15 años.
DISCUSIÓN
Este fue el primer trabajo que se realizó para evaluar una cohorte individual después de la inmunización con la vacuna cubana antihepatitis B y la mayor estimación de durabilidad realizada para esta vacuna hasta el momento, con el empleo de un esquema único donde se puede mostrar su inmunogenicidad.Teniendo en cuenta el carácter longi-tudinal y multicéntrico de este trabajo, el tiempo transcurrido desde la culminación del esquema de vacunación hasta la evaluación actual (6 años), así como las dificultades que implica la ejecución de un estudio de este tipo en trabajadores de la salud, se considera en este estudio que la cobertura alcanzada fue muy buena, esto es un indicador de la adecuada colaboración del personal que voluntariamente tomó parte en él, así como de la dedicación de los médicos y paramédicos que participaron en la evaluación.
La ausencia de anti-AgcHB y AgsHB en las muestras serológicas analizadas puso de manifiesto la inexistencia de infección por el VHB durante los 6 años que mediaron entre la vacunación y la evaluación del grupo, que tenía un alto riesgo de exposición ocupacional, por lo tanto, la eficacia de la vacuna pudo estimarse en 100 %.
De igual forma, la persistencia de seroconversión y los altos niveles de seroprotección e hiperrespuesta encontrados, son indicadores de la elevada inmunogenicidad de la vacuna, que ya ha sido documentada en otros estudios en los que se empleó en trabajadores de salud13,14,16-20 (Ibarra E, Borges R, Taibo ME, Flores J. Evaluación de la seroconversión de dos vacunas contra la hepatitis B, elaboradas por el método ADN recombinante. Barquisimeto, Estado Lara, Venezuela, 1993-1994 [Informe del Ministerio de Sanidad y Asistencia Social, Instituto Nacional de Higiene "Rafael Rangel", Universidad Centro-Occidental "Lisandro Alvarado". Dirección de Salud y Fundasalud del Estado Lara, 1994)].
A la durabilidad, una de las categorías fundamentales de la respuesta inmune, se le ha concedido gran importancia cuando se trata de evaluar un producto vacunal, por lo que en múltiples estudios se le señala como una variable a medir para estimar el impacto de la vacunación. En este trabajo el impacto se ha analizado como la transformación de susceptibles en inmunes pos-vacunación en el año 1993 y la persistencia del estado de seroprotección en el tiempo, que en este caso fue de 6 años.
Tomando en consideración el tiempo de vida media para los anticuerpos y el pronóstico de durabilidad de las cifras protectoras de anti-AgsHB, se puede considerar en primer lugar que los vacunados se mantendrán protegidos al menos hasta el año 2008 y que no serán necesarias dosis de refuerzo al menos durante este tiempo. Este aspecto resulta en estos momentos polémico pues, si bien la presencia de cifras de anti-AgsHB superiores a 10 UI/L ha sido aceptado tradicionalmente como criterio de protección,21 trabajos más recientes han rebatido lo establecido de que la presencia o ausencia de anticuerpos circulantes después de la vacunación están asociadas al criterio de inmunidad ante la infección por el virus de la hepatitis B22,23 y para otros hepatotrópicos.24 Se ha encontrado en otros trabajos realizados con esta misma vacuna que, en ausencia de niveles protectores de anticuerpos en individuos pertenecientes a otras poblaciones, la administración de un refuerzo incrementó la seroprotección y la hiperrespuesta en 87 % - 4,7 y 76,5 % - 9,5, respectivamente por lo que, si se considera la corta latencia de esta respuesta pos-refuerzo, se está sin dudas frente a una clara expresión de memoria inmunológica, la cual, a juicio del colectivo de autores de este trabajo, es la categoría más importante en la dinámica de la respuesta inmune, pues el tiempo de incubación de este virus es superior al tiempo de latencia medido en esos estudios.
Los resultados obtenidos en cuanto a edad y género, corroboran que las personas menores de 40 años en general, y en particular las mujeres, tienen respuestas superiores frente a esta vacuna, así como en términos de eficiencia inmunológica en general.
De particular importancia es el dato que informa sobre la permanencia de las mujeres en categorías de respuesta superiores en relación con los hombres, pues estos resultados se obtuvieron a partir de las diferencias individuales entre lo hallado en este estudio y los valores obtenidos en el año 1993, donde se evidenciaron respuestas superiores pos-vacunación en menores de 40 años en general y en mujeres en particular.14 Estas variables hubiesen pasado inadvertidas de no haberse analizado este aspecto con las características con que se hizo en este trabajo. Por lo tanto, las mujeres no sólo respondieron mejor a la vacunación, sino que mantuvieron los niveles de anticuerpos más elevados en el tiempo; esto se ajusta a lo esperado de acuerdo con el comportamiento predictivo de la caída de los anticuerpos que describen una curva exponencial, con un tiempo de semivida de 3 años; donde la reducción de la concentración de anti-AgsHB a la mitad se produciría en ese tiempo estimado.
Estos resultados además, ponen de manifiesto la importancia de realizar estudios de seguimiento de cohortes, hacer comparaciones no sólo grupales, sino individuales, a pesar de que tienen como desventaja las dificultades de llevarlos a la práctica y su elevado costo.
Se concluye que la persistencia de los anticuerpos después de transcurridos 6 años de terminado el esquema y la ausencia de marcadores de infección por el virus B permiten evaluar la eficacia de la vacunación como excelente. El estudio de los cambios individuales en las categorías de protección realizado por primera vez en una cohorte de vacunados, así como la estimación del tiempo de vida media de los anticuerpos y la predicción de la durabilidad a partir de la transformación de una curva exponencial, abren nuevas perspectivas para la evaluación de las vacunas y los esquemas vacunales.
Teniendo en cuenta la importancia que este trabajo tiene desde el punto de vista científico se recomienda extender esta metodología de estudio a otros grupos poblacionales de alto riesgo potencial como son estudiantes de Medicina y Odontología.
AGRADECIMIENTOS
A la gerencia general de ESSALUD, que autorizó la realización de este trabajo. A la disciplina de los trabajadores de la salud que voluntariamente participaron, a la entusiasta colaboración del personal médico coordinador de cada hospital, así como al personal de enfermería y laboratorio de los 4 hospitales que ayudaron en la obtención de las muestras serológicas.SUMMARY
On the basis of the importance given by the Health World Organization and the Disease Control Center to the protection of health workers against viral hepatitis B(HBV), the Peruvian Institute of Social Security(presently ESSALUD) instructed in 1993 the vaccination of health personnel at risk in 4 national hospitals by using the Cuban vaccine called Herberbiovac HB(20 mg, 0,1,and 2 month schedule). The purpose was to evaluate the persistence of antibodies in the immunized workers six years after the immunization program and the possible presence of HB virus infection markers. Sera from 144 health workers were studied covering 70.24% of seroprotected subjects in comparison with seroprotected subjects in the initial study. Conventional immunoenzymatic methods were used to detect markers in the serum, HbsAg and antibodies to HbcAg were negative in all the serological samples, an outcome that showed that any of the vaccinated persons had traces of HB virus infection. The anti-HbsAg was positive, seroconversion was 100% whereas seroprotection and hyperesponse amounted to 91.6 and 43.7% respectively. The mean lifetime of anti-HbsAg is 3 years but it was predicted that the levels of antibodies would reach over 10 UI/L after 15 years of the vaccination schedule completion. Subjects aged under 40 years had significantly higher levels of seroprotection and hyperesponse, being females those in the higher response categories. The evaluation of the post-vaccination reinforcement immunological response in seroconverted non-seroprotected cases and the extension of the work with ESSALUD to other hospitals in the country were recommended.Subject headings: HEPATITIS B VACCINES; HEALTH PERSONNEL; MASS VACCINATION, HEPATITIS B ANTIBODIES/blood; HEPATITIS B ANTIGENS/blood; PERU.
REFERENCIAS BIBLIOGRÁFICAS
- World Health Organization. Towards the elimination of hepatitis B: A guide to the implementation of national immunization programs in developing world. Final Report: October 7-9, 1991.
- Kane M. Global programme for control of hepatitis B infection. Vaccine 1995;13 (Suppl 1): S47-S49.
- Mulley AG, Silverstein MD, Dienstag JL. Indication for use of hepatitis B vaccine, based on cost-effective annalysis. N Engl J Med 1982;307:644-52.
- Hadler SC. Hepatitis B. Virus infection and health care workers. Vaccine 1990;8:S24.
- Centers for Disease Control. Protection against viral hepatitis. MMWR 1990;39(S/2):15.
- -----. Recommendations of the Immunization Practices Advisory Committee (ACIP). MMWR 1991;40 (RR-13):10.
- Canada Communicable Disease Report. Proceedings of the Consensus Conference on Infected Health Care Workers: Risk for Trasmission of Bloodborne Pathogens. Final Report 1998;15 (Suppl):1-13.
- Gotuzzo E. Hepatitis crónica y ribavirina. Rev Panam Infectol 1998;2(1):4-5.
- Vildosola H, Farfan G, Colán E, Delgado L, Mendoza R, Pineda O, et al. Prevalencia del antígeno de superficie del virus de la hepatitis B en población general de costa, sierra y selva del Perú. Reporte preliminar. Rev Gastroenterol Perú 1990;10:96-100.
- Comisión para el control de la hepatitis viral B. Epidemiología de la hepatitis viral B (HVB) y Delta (HVD) en el Perú. Boletín Epidemiológico 1995: 4-8.
- Fay OH, the Latin American Regional Study Group of Hepatitis B in Latin America. Epidemiological patterns and eradication strategy. Vaccine 1990;8:S100-S106.
- Instituto Nacional de Salud, Asociación de Desarrollo de la Selva Peruana. Prevalencia de marcadores serológicos para la hepatitis viral B y Delta en pueblos indígenas de la amazonia peruana. Lima: AIDESEP, 1997:1-44.
- Juliao O, González Griego A, Ramírez V, Rojas MC, Boschell J, Hernández LS, et al. Estudio de inmunogenicidad para dos vacunas recombinantes contra hepatitis B comparando dos esquemas. Biomédica 1991;11:(1,2,3,4):71-83.
- Zumaeta E, González Griego A, Ramírez V, Figueroa R. Inmunogenicidad de la vacuna recombinante cubana contra la hepatitis B en trabajadores de la salud del Instituto Peruano de Seguridad Social. Rev Méd IPSS 1994;3(1):31-5.
- Espinal C, Noguera M, Olaya P, Ramírez M, Torres D, González GA, et al. Análisis de los estudios sobre la inmunogenicidad, efectividad y evaluación del impacto de la vacunación contra la hepatitis B con la vacuna cubana ADN recombinante. Rev Panam Infectol 1998; 2(2):76-90.
- Díaz J, Ospina S, Zapata LD, Arroyane A, Mayo G. Respuesta a una vacuna contra hepatitis B en trabajadores de la salud, Antioquía 1994. Bol Epidemiol Ant 1994;19:342-8.
- Torres J, Lecuna V, González A. Immunogenicity of the Cuban anti-HBV recombinant vaccine administered by intramuscular or intradermal (ID) routes. Biotecnol Aplicada 1993;10(2):97-9.
- Torres J, Márquez M, González A, Ramírez V. Eficacia comparativa de las vías intradérmica e intramuscular en la inmunización activa contra la hepatitis B con una vacuna recombinante. Resultados preliminares. Gen 1993;47(3):145-9.
- Hoyos A, Ramírez V, González A, Trujillo C, Juliao O, Prieto P et al. Hepatitis B, inmunogenicidad de la vacuna recombinante cubana anti-HBV en trabajadores de la salud vacunados sin seroprotección. Biomédica 1991;11(1, 2, 3, 4):61-4.
- Cuevas H, Fajardo H, Mejía G, Neira M. Respuesta a la vacunación contra hepatitis B en trabajadores de la salud del Hospital San Juan de Dios de Santa Fé de Bogotá. Acta Méd Colombia 1997;22(2):61-6.
- Couroucé-Pauty AM. Prevention of viral hepatitis in haemodialysis units by means of anti-HBs immunoglobulins. Transplant Clin Immunol 1978;3:77.
- Dienstag JL. Prevention of hepatitis B. En: Viral hepatitis A to F: an update. American Association for the Study of Liver Diseases. Post-Graduate Course Text Book. Chicago: 1994.
- Resti A. Anti HBs and immunological memory to HBV vaccine, implication for booster timing. Vaccine 1993,11:1079.
- Maiwald H, Jily W, Bock HL, Loscher T, Sonnenburg. Long-term persistence of anti-HAV antibodies following active immunization with hepatitis A vaccine. Vaccine 1997;15(4):346-8.
Dr. Antonio González Griego. Instituto Superior de Ciencias Básicas y Preclínicas "Victoria de Girón". Avenida 146 No. 3102 esquina a 31, reparto Cubanacán, municipio Playa, Ciudad de La Habana, Cuba. CP 11600.














