Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.19 n.1 Ciudad de la Habana ene.-abr. 2000
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"
Evaluación y control de un brote epidémico de hepatitis viral en escolares guineanos. Eficacia de heberbiovac HB
Dr. Antonio González Griego, Dra. Alina Alerm González, Dra. Graciela Delgado, Dra. Irma Vega García, Lic. Manuel Antón Lolo, Dra. Teresa Rodríguez Fernández y Dra. Victoria Ramírez AlbajésRESUMEN
Se estudiaron 448 muestras serológicas con el propósito de conocer la etiología de un brote de hepatitis aguda entre jóvenes guineanos que estudiaban en Cuba. Se determinaron los anticuerpos de clase IgM contra el virus de la hepatitis A (anti-VHA IgM), los anticuerpos contra la proteína central del virus de la hepatitis C (anti-VHC), el antígeno de superficie del virus de la hepatitis B (AgsHB) y su anticuerpo (anti-AgsHB) y los anticuerpos dirigidos contra el virus de la hepatitis Delta (anti-VHD). Se encontró positividad para el AgsHB en 124 sueros (27,67 %). A 86 sueros AgsHB positivos se les determinó la presencia del antígeno asociado con la replicación viral en la infección por virus B (AgsHB) y la detección de los anticuerpos totales (IgG e IgM) contra la proteína central del virus de la hepatitis B (anti-AgcHB total) se hizo en 50 de esas muestras. Los estudiantes que no tuvieron marcadores de infección por el virus B se vacunaron con la vacuna cubana antihepatitis B, con el empleo de 3 dosis de 20 mg mediante un esquema de 30 d interdosis. No se encontraron positivos el anti-VHA IgM ni el anti-VHC. La cuantificación del AgsHB permitió clasificar como agudos con buen pronóstico a 3 de los 14 jóvenes que presentaron síntomas de hepatitis y como crónicos a los 121 restantes. De los sueros de 3 fallecidos con un cuadro de hepatitis fulminante, 2 fueron AgsHB positivos y 1 anti-AgsHB positivo, y el tiempo de vida media estimado para el antígeno fue de 48 h, a diferencia del obtenido para los agudos con buena evolución, que resultó de 7 d aproximadamente; mientras que en los crónicos fue como promedio de 60 d. En los reservorios crónicos se detectó una elevada antigenemia (59 % con cifras de AgsHB entre 10 y 100 mg/mL) en asociación con la presencia del AgeHB, que fue positivo en 31 % de los sueros B. Se encontraron anticuerpos anti-VHD en 15 % de los sueros AgsHB positivos analizados, con 66 % en los fallecidos. La cuantificación del AgsHB permitió establecer criterios de clasificación pronóstica en los infectados. La asociación de la presencia del AgeHB en los reservorios crónicos con altas cifras de AgsHB puso de manifiesto el valor de la cuantificación del antígeno de superficie como indicador indirecto de infecciosidad. La circulación del virus Delta se consideró un factor contribuyente para la aparición del brote y la mortalidad. Después de la vacunación masiva de los susceptibles no aparecieron nuevos casos clínicos, se obtuvo seroprotección en 98 % de los inmunizados, con medias geométricas de 1 398 UI/L.Descriptores DeCS: BROTES DE ENFERMEDADES/prevención & control; HEPATITIS VIRAL HUMANA/epidemiología; HEPATITIS VIRAL HUMANA/sangre; VACUNAS CONTRA HEPATITIS B; BECAS; GUINEA.
A partir de la aparición de varios casos con un cuadro sintomático de hepatitis viral aguda y fulminante entre jóvenes guineanos que estudiaban en Cuba en el municipio Isla de la Juventud, el Viceministerio de Higiene y Epidemiología del Ministerio de Salud Pública solicitó asesoría al Departamento de Inmunología del Instituto Superior de Ciencias Médicas de La Habana, para realizar una evaluación etiológica del brote mediante la búsqueda de marcadores de algunos de los virus que infectan el hígado y tomar medidas para su control epidemiológico.
El propósito consistió entonces en realizar el estudio de marcadores de los virus A, B, C y D en los pacientes con hepatitis aguda y fulminante, y buscar marcadores de aquéllos que producen enfermedad crónica del hígado en el suero del resto de los estudiantes, pues estaban en una institución cerrada.
MÉTODOS
Se estudiaron 448 muestras serológicas en total, 17 provenientes de jóvenes con cuadros clínicos de hepatitis y el resto procedentes de aquellos estudiantes sin manifestaciones clínicas de hepatopatía, pero pertenecientes a la población escolar del internado. De los agudos, 3 presentaron síntomas y signos de hepatonecrosis fulminante, 2 de los cuales fallecieron en el transcurso del estudio.A los casos agudos se les determinó la presencia de anti-VHA IgM (Organon Teknika), anti-VHC (Heber Biotec, CIGB), AgsHB (ELISA-AgsHB, Girón), AgeHB (Organon Teknika), anti-AgcHB total (Organon Teknika), anti-AgsHB (anti-AgsHB, Girón), anti-VHD (Organon Teknika), así como la concentración del AgsHB mediante un procedimiento diseñado en el laboratorio de inmunología.1 Una vez establecida la presencia de marcadores del virus B entre los casos con enfermedad aguda, se procedió a estudiar el resto de las muestras en busca de indicadores de infección por este virus (AgsHB) o de puesta en contacto previamente con él (anti-AgsHB o anti-AgcHB), en las que resultaron AgsHB negativas. Del total de sueros positivos para el AgsHB, se determinó la presencia del AgeHB en 86 y del anti-AgcHB total en 50, por limitaciones en la disponibilidad de reactivos.
Se evaluaron la coinfección o superinfección por virus Delta (anti-VHD Organon Teknika) en los sueros de 15 enfermos clasificados clínicamente como agudos, 2 de ellos que en el transcurso del estudio fallecieron con un cuadro de hepatitis fulminante, 12 con formas en apariencia autolimitadas pero que sólo 3 evolucionaron a la recuperación en un período de 6 meses, 7 que sin haber presentado síntomas de la enfermedad tuvieron antecedentes de elevación de la alaninaminotransferasa (ALAT) y 28 reservorios asintomáticos procedentes de los dormitorios escolares de los casos reportados como agudos.
Se determinó el tiempo de vida media del AgsHB en todos los infectados, mediante la expresión t ½ Ln 2/l, donde l es la velocidad con la cual el antígeno disminuye su concentración a la mitad del valor anterior en un tiempo T, y t ½ es el tiempo requerido para que ocurra ese cambio en la concentración. Una transformación logarítmica de la curva exponencial [C(t) = Ce -lT] se utilizó para el ajuste de la ecuación lineal (López A, Alerm A, González Griego A. Usefulness of the longitudinal study of the markers of the hepatitis B virus (HbsAg) in cases affected by the same [Thesis for the obtention of the degree of Specialist in Internal Medicine]. Institute of Medical Sciences. Havana, Cuba, 1994). Para lograr la estimación del tiempo de semivida del AgsHB se realizaron extracciones diarias durante 1 semana, después 1 por semana durante 2 meses y 1 mensual hasta el sexto mes a los casos clasificados como agudos, con la excepción de los fallecidos. A los reservorios asintomáticos se les efectuó una extracción mensual a lo largo de 1 año.
Los jóvenes cuyos sueros fueron AgsHB negativos y que no tuvieron positivos ni el anti-AgsHB ni el anti-AgcHB total fueron vacunados con la vacuna cubana antihepatitis B (Heberbiovac HB) con el empleo de 3 dosis de 20 mg cada una, espaciadas por 1 mes y administradas por vía intramuscular. Después de 1 mes de administrada la tercera dosis se evaluó la concentración de anti-AgsHB.2
RESULTADOS
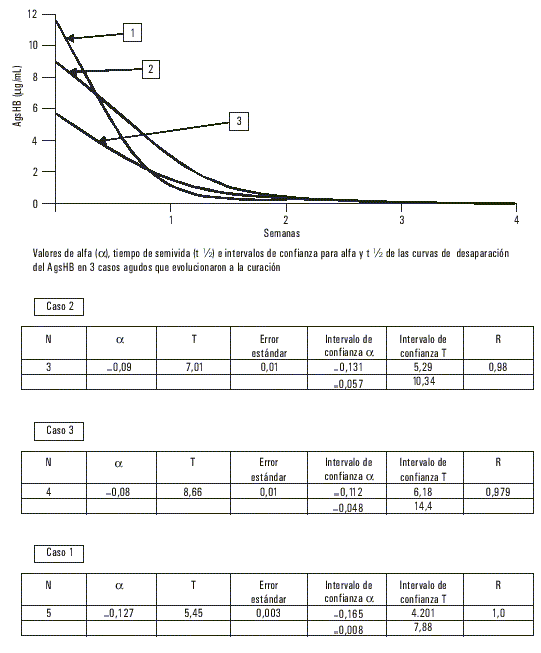
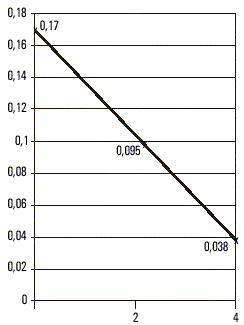
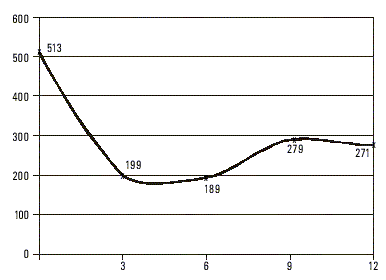
De las 448 muestras analizadas, incluidas las 17 provenientes de enfermos, ninguna tuvo marcadores de infección positivos presentes por virus A (anti-VHA IgM) ni virus C, mientras que 124 fueron AgsHB positivas para un 27,67 % de prevalencia de infección por virus B y una razón de disparidades (odds ratio) de 38 con respecto de la población cubana.En 3 de los casos diagnosticados clínicamente como agudos, la cuantificación evolutiva del AgsHB mostró un tiempo de semivida para este antígeno de casi 7 d (fig. 1), mientras que en 11 clasificados también como portadores de formas autolimitadas se prolongó hasta más de 35 d. En 2 de los que presentaron un cuadro fulminante el t - fue de 48 h (fig. 2), mientras que en los reservorios crónicos fue de 60 d como promedio (fig. 3). Uno de los fallecidos no tuvo positivo el AgsHB, pero sí el anti-AgsHB con una concentración de 238 UI/L. Entre los enfermos agudos, sólo los 3 que mostraron tiempos de semivida del AgsHB de 7 d evolucionaron a la recuperación total con posterior seroconversión al anti-AgsHB antes del sexto mes; pero aquéllos donde ese tiempo se prolongó por más de 35 d, mantuvieron el AgsHB positivo durante los 6 meses en que fueron estudiados. Los pacientes diagnosticados como crónicos mostraron fluctuaciones de la concentración del AgsHB, con tendencia a la disminución en determinados períodos, seguido de incrementos también transitorios; pero sin que se hiciera negativo en ningún momento durante el año en que se realizó el seguimiento.
La cuantificación del AgsHB permitió clasificar las muestras en 4 grupos de acuerdo con los rangos de concentración y evidenció que 59 % tuvo cifras entre 10 y 100 mg/mL. Le siguieron aquéllas con concentraciones entre 1 y 10 mg/mL y el menos representado fue el de concentraciones inferiores a 1 mg/mL (tabla 1).
TABLA 1. Distribución de las muestras de acuerdo con la concentración del antígeno de superficie de la hepatitis B (AgsHB)
| Grupos de concentración del AgsHB | | |
| Menos de 1 µg/mL | | |
| Entre 1-9 µg/mL | | |
| Entre 10-100 µg/mL | | |
| Más de 100 µg/mL | | |
| Total | | |
No se encontró diferencia significativa al analizar la prevalencia total por sexos (24 % en las mujeres y 29 % en los hombres) y los casos sintomáticos se comportaron de forma similar, con 4,14 % en los hombres y 3,08 % en las mujeres, resultó destacable que todos los fallecidos pertenecían al sexo masculino. Por otra parte, en lo que respecta a la recuperación y la seroconversión al anti-AgsHB, no se observó tendencia en cuanto al sexo. Sin embargo, al desglosar los grupos de concentración del AgsHB por sexos, se encontró que en los de mayores concentraciones predominaron los hombres, mientras que en los de menores lo hicieron las mujeres (tabla 2).
TABLA 2. Distribución de las muestras de acuerdo con la concentración del antígeno de superficie de la hepatitis B (AgsHB) y por sexo
| Grupo de concentración AgsHB | | | | ||
| | | | | ||
| Menos de 1 µg/mL | | | | | |
| Entre 1-9 µg/mL | | | | | |
| Entre 10-100 µg/mL | | | | | |
| Más de 100 µg/mL | | | | | |
| Total | | | | | |
TABLA 3. Relación entre la concentración del antígeno de superficie de la hepatitis B (AgsHb) y la presencia del antígeno e (AgeHb)
| Grupos de concentración AgsHB | | | |
| Menos de 1 µg/mL | | | |
| Entre 1-9 µg/mL | | | |
| Entre 10-100 µg/mL | | | |
| Más de 100 µg/mL | | | |
De las 50 muestras AgsHB positivas que fueron estudiadas para determinar la presencia del anti-AgcHB total, 2 resultaron negativas para este marcador y correspondieron a reservorios asintomáticos con cifras superiores a 100 mg/mL.
La prevalencia global de virus Delta fue de 15,2 %, se distribuyó fundamentalmente entre los que tuvieron formas fulminantes que los llevaron a la muerte; así como en los que durante el brote tuvieron manifestaciones fenomenológicas de la enfermedad (con clasificación clínica de agudos), pero que se mantuvieron infectados a lo largo del período que duró la evaluación (tabla 4).
| Clasificación | | | |
| Fallecidos | | | |
| Enfermos agudos | | | |
| Enfermos clínicos | | | |
| Asintomáticos con ALAT elevada | | | |
| Asintomáticos | | | |
DISCUSIÓN
La aparición de un brote epidémico de hepatitis B en una población cerrada no había sido descrita antes en Cuba, por lo que el hallazgo de marcadores de este virus en el suero de 17 jóvenes con un cuadro sintomático de esta enfermedad constituyó un dato epidemiológico importante; sobre todo porque se trataba de un grupo de estudiantes que provenía de una región con alta prevalencia de infección crónica por el agente causal de la hepatitis B.3,4 La prevalencia de AgsHB encontrada en la población que se estudió confirmó este hecho, al ser 38 veces superior a la reportada en Cuba, y quedó dentro del rango reportado en algunos países considerados de prevalencia elevada.La cuantificación evolutiva del AgsHB en los casos con cuadros agudos corroboró los resultados obtenidos por este colectivo de autores en trabajos anteriores, pues los que tuvieron tiempos de semivida del antígeno entre 5 y 7 d evolucionaron hacia la curación con sero-conversión para el anti-AgsHB. El comportamiento de la desaparición del AgsHB con una curva de primer orden y un tiempo de semivida de casi 7 d en 3 de los 14 casos con cuadros sintomáticos de hepatitis viral permitió pronosticar una evolución favorable, pues en las formas autolimitadas de hepatitis B la respuesta inmune frena la replicación viral y lleva a la erradicación de la infección. Este comportamiento se ha asociado con la activación de células Th1 que segregan citocinas relacionadas con los mecanismos que contribuyen a una respuesta inmune apropiada, incremento de la actividad antiviral de los macrófagos mediante la producción de óxido nítrico, inducción de resistencia a la infección en las células vecinas, incremento de la expresión de moléculas HLA en las membranas de las células infectadas y expansión de clonos de linfocitos T citotóxicos específicos.5
Los que tuvieron tiempos muy superiores a 7 d mantuvieron indicadores de infección crónica, al ser positivos para el AgsHB durante el año que duró el seguimiento. En los enfermos donde esta variable estuvo en un rango de horas, se interpretó el rápido aclaramiento viral como manifestación de respuesta inmune facilitada, neutralización incrementada del antígeno y posible destrucción masiva del parénquima hepático; con la consiguiente limitación de los sitios de replicación para el virus.6,7 Estudios recientes vinculan el desarrollo de formas fulminantes de hepatitis B con mutantes del virus en la región pre-core (pre-c) y plantean que los niveles elevados de sobrexpresión del AgcHB en las células hepáticas podría desencadenar una vigorosa respuesta inmune celular, la cual, si no es citopática per se, resultaría sensibilizadora de los hepatocitos infectados a mediadores solubles capaces de destruirlos.8-10 Considerando que 68,6 % de los reservorios crónicos fueron AgeHB negativos podría inferirse la probabilidad de que en la población estuviesen circulando esas mutantes capaces de provocar hepatitis fulminante,10 evento que no pudo demostrarse ante la imposibilidad de estudiar la presencia o ausencia de AgeHb, anti-AgeHB o anti-AgcHB en el suero de los fallecidos. De hecho, la cuantificación del AgsHB con carácter prospectivo permitirá predecir la aparición de un cuadro de hepatonecrosis aguda masiva y realizar intervenciones con el propósito de reducir la mortalidad por esta forma de hepatopatía.
Teniendo en cuenta el elevado porcentaje (59 %) de estudiantes AgsHB positivos con antigenemias superiores a 10 mg/mL se puede suponer que existió en la población una elevada circulación viral, de acuerdo con resultados recientes obtenidos por el colectivo de este trabajo donde se observaron que cifras de AgsHB superiores a 10 mg/mL correspondían a más de 7 000 x 106 Eq/mL de material genético viral. En términos moleculares, cada microgramo de AgsHB corresponde a 2,2 x 1013 moléculas (PM 27 x 103, número de avogadro) y cada partícula está constituida casi por 100 moléculas de AgsHB (2,2 x 1011 partículas). Si 1 de cada 1 000 constituye un virión completo, 2,2 x 108 sería el número de partículas infectantes por cada microgramo de AgsHB detectado en el suero.11
La tendencia en los estudiantes del sexo masculino a presentar cifras más elevadas de antigenemia con respecto de las del sexo femenino, podría interpretarse como que en las mujeres la respuesta inmune es superior, si se tiene en cuenta que la magnitud de la masa antigénica circulante está en parte relacionada con el control que esta respuesta ejerce sobre la replicación viral y la circulación del virus en la periferia.6
La asociación encontrada entre la presencia del AgeHB y elevadas cifras de AgsHB pone en evidencia el valor de la cuantificación del AgsHB como criterio indirecto de infecciosidad, tal y como se ha reportado antes,1 pues los enfermos AgeHB positivos tienen en general más de 106 viriones/mL y trasmiten el VHB con más frecuencia que los AgeHB negativos.12 Se ha reportado que en infectados crónicos con mutaciones en la región pre-c que no expresan el AgeHB, la detección del ADN viral coincide con altos niveles del AgeHB durante los períodos de exacerbación de la enfermedad hepática.13 Si tenemos en cuenta además, el criterio de que los reservorios crónicos del virus pueden clasificarse en infectados por virus salvaje con AgeHB presente en el suero, o por mutantes pre-c con ausencia del AgeHB,13,14 la cuantificación del AgsHB permitiría asociar las cifras de este antígeno con la pertenencia a uno u otro grupo, y orientar los procederes terapéuticos de acuerdo con los reportes que afirman que los infectados donde predominan las mutantes pre-c responden de manera diferente al interferón, comparados con aquellos provocados por virus salvaje.15
La ausencia de positividad del anti-AgcHB total en el suero de 2 de los enfermos hace pensar en la posibilidad de que estuviesen circulando formas defectivas del virus reportadas en África, capaces de modificar el patrón serológico de la enfermedad y su desarrollo;16 a pesar de que actualmente se interpreta la ausencia del anti-AgcHB como la incapacidad de algunos individuos para producir el anticuerpo y no como consecuencia de un serotipo diferente del VHB.14
Con respecto al VHD, la distribución encontrada está en relación con lo reportado sobre factores de riesgo para la trasmisión parenteral inaparente del virus, donde se afirma que el más importante es el contacto próximo o íntimo con individuos infectados por este virus.17,18 Por otra parte, el comportamiento evolutivo de los fallecidos con un cuadro de hepatonecrosis se corresponde con algunos resultados que demuestran que la replicación persistente del VHB en casos crónicamente infectados por el VHD, se asocia con una peor evolución y mayor gravedad de la enfermedad hepática, comparado con infectados por el VHD pero sin replicación activa del VHB. Se sugiere que esta replicación favorece la patogénesis del virus Delta, y lleva a un fallo hepático agudo con necrosis hepática masiva.19 Durante la evolución fulminante en pacientes con injertos primarios, fueron detectados inmunohistoquímicamente, abundantes AgsHB, AgcHB y Ag-VHD; resultaron positivas las serologías para el ADN del VHB con títulos elevados del ARN del VHD. Esto confirmaría la hipótesis de que la replicación viral activa del VHB durante las recurrencias puede asociarse con la evolución hacia formas fatales.20
Sin embargo, en otros estudios se encontró que la superinfección por el VHD con recuperación de la infección aguda por este virus, provocó la desaparición del AgsHB y regresión del daño hepático crónico; quizás por un incremento del aclaramiento de las células infectadas durante la fase replicativa de la infección crónica por VHB, como consecuencia de la activación de mecanismos inmunológicos relacionados con la citotoxicidad.21 Quedaría por demostrar si la evolución hacia el aclaramiento con patrones autolimitados o hacia formas letales se relaciona con elementos dependientes del huésped, del hospedero o de ambos, pues en estos estudios no se señala la existencia de mutantes virales o de fenotipos HLA que pudiesen explicar la dicotomía en el comportamiento clínico.
Los niveles de anti-AgsHB alcanzados en los individuos vacunados tuvieron un comportamiento similar al observado en otros grupos estudiados durante las fases de evaluación de la vacuna,22,23 se pudo considerar como elevado el porcentaje con seroprotección, lo cual reafirmó la inmunogenicidad del producto vacunal con la novedad de ser la primera vez que esta vacuna es utilizada en africanos. Por la homogeneidad de la muestra en cuanto a edades no se consideró esta variable al analizar los resultados de la inmunización. La ausencia de nuevos casos una vez culminada la intervención, es indicador de que se logró frenar el brote epidémico mediante el uso de esta vacuna.
Se concluye que la presencia del AgsHB en 27,67 % de la población estudiada hizo que pudiera catalogarse como de prevalencia elevada y se evidenció un riesgo relativo de 27 veces con respecto de la población cubana. La cuantificación del AgsHB demostró su utilidad en la clasificación y el pronóstico de los reservorios del virus, y resultó destacable la corta vida media de este marcador en los fallecidos por hepato-necrosis masiva. Las elevadas cifras de antigenemia encontradas en un alto porcentaje de los reservorios crónicos, así como su asociación con la presencia del AgeHB, puso de manifiesto el nivel de infecciosidad que prevaleció en este brote y el valor de la cuantificación del AgsHB como método indirecto para predecirla. La circulación del virus Delta posiblemente influyó en el comportamiento clínico de la enfermedad, y estuvo relacionada la evolución a la hepatonecrosis con una coinfección o superinfección por este virus defectivo. La vacunación de los no reservorios frenó la aparición de nuevos casos clínicos y confirió seroprotección a un elevado porcentaje de estudiantes.
SUMMARY
Four hundred and forty eight serological samples were analyzed to find out the etiology of an acute hepatitis ourbreak among Guinean students who studied in Cuba. IgM antibodies to hepatitis A(anti-HAV IgM), antibodies to main protein of hepatitis C virus (antiHCV), hepatitis B surface antigen (HbsAg) and its antibody (anti-HbsAg) and antibodies to hepatitis Delta (anti-HDV) were all determined. One hundred and twenty four sera (27.67%) were found to be positive to HbsAg. The presence of antigen linked to viral replication in virus B infection (HbsAg) was determined in 86 HbsAg positive sera whereas total antibodies (IgG and IgM) to central hepatitis B virus protein (total anti HbcAG) was detected in 50 of these samples. Those students who did not have virus B infection markers were immunized with Cuban anti-hepatitis B vaccine using three 20mg doses through a schedule of 30 d interdosage. There was positivity neither to anti-HAV IgM nor tp anti-HCV. The quantification of HbsAg allows to classify 3 of the 14 students showing hepatitis symptoms as acute hepatic patients with good prognosis and the remaining 121 young people as chronic patients. Of the sera of 3 deceased peoplle from fulminant hepatitis, 2 were HbsAg positive and 1 anti-HbsAg positive and the average lifetime estimated for the antigen was 48h in these cases whereas the average antigen lifetime for those acute patients with good evolution was nearly 7d and that of the chronic was 60 days. In chronic hosts, high antigenemia was detected (59%, with HbsAg from 10 to 100 mg/mL) associated with HbcAg positive in 31% of sera B. Anti-HDV antibodies were found in 15% of HbsAg positive sera and in 66% of the dead people. The quantification of HbsAg allowed to establish predictive classification criteria of the infested people. The relationship of the presence of HbsAg in chronic hosts with hih levels of HbsAg showed the value of the quantification of surface antigen as an indirect indicator of infectivity. The circulation of Delta virus was deemed to be a contibuting factor to the emergence of the hepatitis outbreak and mortality. After mass vaccination of sensitive students, no new clinical case occured, seroprotection reached 98% of the immunized people; with geometric means of 1 398UI/L.Subject headings: DISEASE OUTBREAKS/prevention and control; HEPATITIS, VIRAL, HUMAN/epidemiology; HEPATITIS, VIRAL, HUMAN/blood; HEPATITIS B VACCINES; FELLOWSHIPS AND SCHOLARSHIPS; GUINEA.
REFERENCIAS BIBLIOGRÁFICAS
- González Griego A, Alerm A, Vega I, Ramírez V. Quantification of the surface antigen of HBV (HbsAg) in biological samples for health care and preparative purposes. Biotecnol Aplicada 1993;10:17.7.
- Ramírez V, González Griego A, Alerm A, Izquierdo M, Vega I, Herrera L. Immunoenzimatic method for the quantification of anti-HBs. Biotecnol Aplicada 1993;10:17.6.
- World Health Organization. Report of the Third Meeting of the WHO Technical Advisory Group in Viral Hepatitis. Final Report. Geneva, 2-5 November, 1987.
- World Health Organization. International Conference of the Control of Hepatitis B in the Developing World. XIV Internacional Congress of Hepatitis. Cameroon 7-9 October, 1991.
- Penna A, Del Prette G, Cavalli A, Bertollet A. Predominant T-helper 1 cytokine profile of hepatitis B virus nucleocapsid-specific T cells in acute self-limited hepatitis B. Hepatology 1997; 25:1022-7.
- Sherlock S. Hepatitis B: the disease. Vaccine 1990;8 (Suppl):s 6-s 9.
- Chisari FV, Ferrari C. Hepatitis B immunopathogenesis. Ann Rev Immunol 1995;13:29-60.
- Faray C, Gigou M, Samuel D, Reynes M. Hepatitis B virus DNA in serum and liver of patients with fulminant hepatitis. Gastroenterology 1992;103:548-55.
- Feitelson MA. Biology of hepatitis B virus variants. Lab Invest 1994;71:324-49.
- Moradfour D, Wands JR. Understanding hepatitis B virus infection. N Eng J Med 1995;332:1292-9.
- Ganem D, Varmus HE. The molecular biology of the hepatitis B virus. Ann Rev Biochem 1987;56:651-6.
- Coppola R, Rizzetto M, Bradley DW, Crivelli O. Viral hepatitis Handbook. Italy: Ed. Saluggia. Sorin Biomedica Diagnostics 1996.
- Raymond G, Stemler M, Smedile V, Rodino G, Will H. A new hepatitis B virus variant in a chronic carrier with multiple episodes of viral reactivation and acute hepatitis. Virology 1990;179:64-8.
- Okamoto H, Yotsumoto S, Akahane Y, Yamanaka M. Hepatitis B viruses with precore region defects prevail in persistently infected host along with seroconversion to the antibody against e antigen. J Virol 1995;64:1298-1303.
- Brunetto MR, Giarin M, Saracco G, Oliveri F. Hepatitis B unable to secrete e antigen and response to interferon in chronic hepatitis B. Gastroenterology 1993;105:845-50.
- Coursaget P, Yvonnet B, Bourdil G, Buisson Y. Hepatitis B surface antigen reactivity in man due to a new variant of hepatitis B virus. Vaccine 1990;8(Suppl): s15- s17.
- Rizzetto M, Ponzetto A, Forzani I. Hepatitis Delta virus as a global health problem. Vaccine 1990;8 (Suppl):s10-s14.
- Torres JR, Mandolfi A. Protected outbreak of severe Delta hepatitis. Experience in a isolated Amerindians population of the Upper Orinoco Bassin. Rev Infect Dis 1990;13:52-5.
- Lozano JL, Crespo J, Cruz F de la, Casafont F. Correlation between hepatitis B viremia and the clinical and histological activity of chronic Delta hepatitis. Med Microbiol Immunol 1994;183:159-67.
- Marsman WA, Wiesner RH, Batts KP, Poterucha JJ. Fulminant hepatitis B virus: recurrence after liver transplantation in two patients also infected with hepatitis Delta virus. Hepatology 1997;25:434-8.
- Pastore G, Monno T, Santantonio G, Angarano M. Hepatitis B virus clearance from serum and liver after acute hepatitis Delta virus superinfection in chronic HbsAg carriers. J Med Virol 1990;31:284-90.
- Juliao O, González A, Ramírez V. Estudio de inmunogenicidad para dos vacunas recombinantes contra la hepatitis B comparando dos esquemas. Bioméd Colombia 1991;11:71-3.
- Juliao O, González-Griego A, Ramírez V, Rojas MC. Resultados al primer año de aplicada la vacuna recombinante cubana anti HBV en esquemas 0-1-2 y 0-1-6 meses. Biomédica 1993;13(3-13):164.
Dr. Antonio González Griego. Instituto Superior de Ciencias Básicas y Preclínicas "Victoria de Girón". Avenida 146 No. 3102 esquina a 31, reparto Cubanacán, municipio Playa, Ciudad de La Habana, CP 11600.














