Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.20 n.2 Ciudad de la Habana abr.-jun. 2001
Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón"
Hospital General Docente "Julio Trigo"
Peroxidación lipídica y otros indicadores de estrés oxidativo en pacientes diabéticos
Ing. Sonia Clapés, Dra. Omaida Torres, Lic. Mirtha Companioni, Dr. Ulises Villariño, Dr. Félix Broche y Dra. Ela M. Céspedes
Resumen
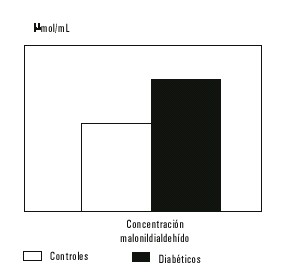
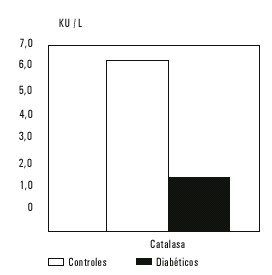
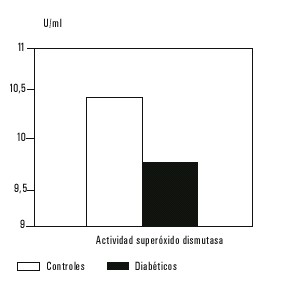
Se demostró una importante relación entre los niveles de peroxidación lipídica y el desarrollo de complicaciones, en la enfermedad de origen endocrino diabetes mellitus. En este tra-bajo se encontraron variaciones en la concentración de productos de peroxidación lipídica (malonildialdehído), con valores de 8,33 ± 2,90 en pacientes diabéticos contra 4,51 ± 1,40 en las personas sanas. Los niveles de glutatión reducido, un antioxidante endógeno medido en suero de pacientes diabéticos demostró valores más bajos, 4,75 ± 2,31 y 8,30 ± 1,52 nmol/mL en suero de donantes de sangre. Se encontró una disminución significativa de la enzima catalasa, con valores de 16,21 ± 18,25 contra 65,78 ± 24,78 U/mL. No resultó significativa la disminución en la actividad de la enzima superóxido dismutasa.
DeCS: PEROXIDACION DE LIPIDO; DIABETES MELLITUS/complicaciones; DIABETES MELLITUS/enzimología; MALONILDIALDEHIDO; ESTRES OXIDATIVO; ANTIOXIDANTES/uso terapéutico.
La hiperglicemia constituye la principal manifestación de la diabetes mellitus y está implicada en la aparición de las complicaciones que se presentan asociadas con la enfermedad. Estas consisten en un heterogéneo grupo de disfunciones clínicas que afectan el sistema nervioso, el sistema vascular, el riñón, la retina, el nervio periférico, el lente y la piel.1-5
Los individuos diabéticos tienen 25 veces mayor probabilidad de contraer ceguera, 20 veces más riesgo de amputaciones y de 6 a 10 veces más riesgo de padecer de enfermedades coronarias.2 Esta situación de desequilibrio comienza en una etapa temprana de la enfermedad, como se ha demostrado en varios estudios. La susceptibilidad de los diferentes tejidos a la exposición de radicales libres en diabetes espontánea y experimental es muy variada y se modifica además en el desarrollo de la enfermedad.4
En el estudio de las causas implicadas en la aparición de esta patología se ha demostrado que altos valores de glicemia conducen a un estrés oxidativo. Esto se debe a que la glucosa se autoxida y da lugar a la formación de alfacetoaldehídos, peróxido de hidrógeno (H2O2) y radical superóxido (O2), entre otras especies reactivas del oxígeno (ERO).5,6 También se plantea que el descontrol de la glicemia conduce al incremento de la velocidad de los procesos de glicosilación y oxidación de lípidos y proteínas de membrana, lo que provoca cambios conformacionales de estas macromoléculas y por lo tanto el deterioro de sus funciones.1,7,8 Los productos que se forman se conocen como AGE (advanced glicosilation endproducts [productos finales de la glicosilación avanzada]). Un número de estas sustancias que se forman de modo irreversible son capaces de hacer enlaces covalentes con otras proteínas para potenciar así el daño.
En el caso de las complicaciones vasculares se conoce que su fisiopatología está caracterizada por una anormal unión de proteínas de la circulación y una progresiva constricción del área luminal en grandes y pequeños vasos.9
En la retina existen varios mecanismos de defensa para minimizar el efecto del estrés oxidativo. Entre ellos se encuentran sustancias de bajo peso molecular como alfatocoferoles, glutatión y ácido ascórbico y enzimas como la superóxido dismutasa (SOD), catalasa (CAT) y glutatión peroxidasa (GPx). Pero el sistema antioxidante no logra eliminar la explosión de oxidantes que se produce en los eventos de hiperglicemia sostenidos, por lo que la producción de EROS excede las posibilidades de eliminación.4
Las teorías que vinculan el estrés oxidativo con la diabetes plantean que la hiperglicemia per se es esencial en el desarrollo de la neuropatía diabética. Entre estas teorías se proponen: alteraciones en la vía del poliol, insuficiencia vascular, síntesis alterada de óxido nítrico, transporte axonal desajustado y glicosilación de lípidos y proteínas y las vinculadas con el estrés oxidativo.9
El estrés oxidativo puede ser una vía común que relacione mecanismos en apariencia diversos, pero que convergen en el papel que desempeñan el incremento de las ERO, los AGE y los productos de peroxidación lipídica (PL) en la explicación de la fisiopatología de estas enfermedades que frecuentemente padece el paciente diabético.5
Métodos
Las muestras de suero se obtuvieron de extracciones realizadas a 30 pacientes ingresados en la Clínica del Diabético del Hospital "Julio Trigo" (grupo 1). Los sueros utilizados como control se obtuvieron de donantes voluntarios del banco de sangre de Marianao (grupo 2).
Los pacientes estudiados tenían un tiempo de evolución de la enfermedad mayor que 8 años. Los datos utilizados correspondían a la media de las determinaciones realizadas a las muestras de sangre pertenecientes al grupo de los pacientes diabéticos. Estas personas se encontraban ingresadas en una clínica de atención al diabético con régimen ambulatorio para logar un adecuado control glicémico, y la extracción se realizó el cuarto día del tratamiento.
Procesamiento de las muestras
Se procedió a separar de cada muestra la cantidad necesaria para la determinación de malonildialdehído (MDA) y colesterol y el resto se sometió al proceso de deslipidación con una mezcla de metanol - cloroformo 2:1.
Análisis realizados
A las muestras se les determinó el contenido de LDL (lipoproteína de baja densidad), colesterol, actividad de las enzimas SOD, CAT, concentración de glutatión reducido (GSH) y MDA; este último como medida de la peroxidación lipídica.
Técnicas analíticas utilizadas
Concentración de GSH: La determinación de este antioxidante no enzimático se realizó por el método de Beutler.10 El GSH reacciona con el colorante DTNB y rinde un compuesto coloreado que se lee a una longitud de onda de 412 nm. La concentración se calcula por una curva patrón de GSH. La unidad en que se expresa es nmol/mL.
Actividad de SOD: Se utilizó el método de Marklund.11 Las muestras deslipidadas se ponen a reaccionar con pirogalol, este se autoxida y da como producto final pirogalina, un compuesto amarillo y radical superóxido que autocataliza la oxidación del pirogalol. La cinética de aparición del producto de la autoxidación del compuesto se registra durante 1 min. Se calcula el porcentaje de inhibición de la autoxidación y se considera que una unidad de actividad enzimática logra una inhibición de 50 %. La unidad en que se expresa la actividad es unidades internacionales (UI)/mL.
Actividad de catalasa: Al suero se le aplicó el procedimiento descrito por Aebi,12 y se le adiciona una solución de H2O2 0,010 mol en PBS (tampón fosfato salino) 0,050 mol a pH 7. Se registra en un espectrofotómetro el cambio de absorbancia a 240 nm. La actividad se expresa en KU/L.
Peroxidación lipídica: Se determina por medio de los niveles de MDA, con el uso de la técnica de Kikugawa.4 El suero fue añadido a una mezcla de TCA 20 %, ácido perclórico 10 % y TBA. Luego de tratamieno con calor fue determinada la densidad óptica a 530 nm y el contenido de MDA expresado en nmol/mL.
Resultados
A los valores de los análisis realizados a las muestras de pacientes diabéticos se les calculó el valor promedio y se comparó con la media obtenida para las muestras de suero normal (n = 20). La prueba estadística utilizada fue la t de Student (tabla).
Tabla. Valores promedio de los análisis realizados al grupo de pacientes diabéticos y de los controles, así como las correspondientes desviaciones estándar
| Actividad de CAT | Actividad de SOD | GSH | MDA | |
| (U/mL) | (U/mL) | (nmol/mL) | (mmol/mL) | |
| Controles | 65,78 ± 14,78 | 10,46 ± 6,51 | 8,30 ± 1,42 | 4,51 ± 0,86 |
| Diabéticos | 16,21 ± 13,25 | 9,77 ± 10,25 | 4,75 ± 2,31 | 8,33 ± 2,91 |
| Valor máximo | 92,30 | 29,30 | 9,48 | 15,71 |
| Valor mínimo | 0,00 | 0,00 | 0,00 | 2,42 |
CAT: catalasa, SOD: superóxido dismutasa, GSH: glutatión reducido, MDA: malonildialdehído. El valor de p < 0,05, excepto para la actividad de SOD con p = 0,3025 y t = -0,35.
Un considerable incremento en el proceso de peroxidación lipídica se avala por los altos valores de MDA obtenidos en las muestras de suero de los pacientes diabéticos, que al ser comparada con los normales resultó significativamente superior (fig. 1). El valor medio de la actividad de la enzima antioxidante catalasa resultó ser significativamente inferior en los pacientes diabéticos, comparado con los pacientes normales (fig. 2). También se observó una disminución en los niveles de glutatión reducido, un antioxidante endógeno de gran importancia por su participación en los procesos de destoxificación de los compuestos dicarbonilos (fig. 3). La concentración de GSH en los pacientes diabéticos disminuyó significativamente, resultó 57 % del valor promedio obtenido en el grupo control. La actividad de SOD disminuyó en el grupo diabético en relación con el control, pero la disminución no fue significativa (fig. 4). No se encontró correlación entre los valores de las determinaciones realizadas y el tiempo de evolución de la enfermedad. Se encontró una débil correlación entre los valores de GSH y MDA con valor de r = - 0,4286.
Fig. 1. Valores promedio de la concentración de malonildialdehído en los 2 grupos estudiados
Fig. 2. Actividad de la enzima catalasa en los 2 grupos estudiados.
Fig. 3. Valores promedio de la concentración de glutatión reducido en los 2 grupos estudiados.
Fig. 4. Actividad de la enzima superóxido dismutasa en los 2 grupos estudiados.
Discusión
La disminución en la actividad de las enzimas de defensa antioxidantes pudo haber sido causada por el incremento de las especies reactivas del oxígeno, pues numerosos reportes sobre el tema señalan que cuando estas especies se acumulan contribuyen a la reducción de la actividad enzimática antioxidante. La superóxido dismutasa se inhibe cuando se expone a altas concentraciones de H2O2; sin embargo, la disminución encontrada en la muestra no resultó significativa. Se observó disminución de la concentración de GSH en plasma de pacientes diabéticos comparados con los controles, resultado que concuerda con el reportado por Muramaki y otros.13
Los valores de glicemia, determinados en la misma muestra usada en este estudio no guardaron relación estadística con el desbalance encontrado en el estado antioxidante en el grupo de los pacientes hospitalizados. En estudios posteriores deben determinarse los niveles de glicosilación de la hemoglobina con vistas a obtener un indicador de control metabólico a largo plazo, pues los niveles de glicemia se pueden normalizar en 1 ó 2 d, pero el cambio en los niveles antioxidantes en el nivel sistémico requiere de un tiempo mayor para su vuelta a la normalidad.
En la búsqueda de las concentraciones en suero de productos o sustancias reactivas del ácido tiobarbitúrico se determinó la concentración de MDA, cuyos valores mostraron niveles significativamente superiores en pacientes diabéticos al compararlos con los sanos. Estos resultados mostraron una vez más que los pacientes diabéticos están sometidos a estrés oxidativo. Una explicación puede estar dada por el hecho de que la hipoinsulinemia incrementa la actividad de la enzima acil CoA grasa oxidasa, la cual inicia la beta oxidación de los ácidos grasos con mayor producción de H2O2. La disminución en la actividad de la SOD provoca que se acumulen sustancias como el radical O2, y queda disponible para reaccionar con el Fe+3, y lo reduce al ion ferroso. De esta manera se inicia la reacción de Fenton, al combinarse el Fe+2 con el H2O2 y así contribuir a incrementar el daño al formar especies más dañinas como el radical ion hidroxilo (OH), con el consiguiente daño a proteínas, lípidos y ADN.3
Estos estudios realizados en el nivel sistémico pueden explicar por qué casi 70 % de las personas que componen la muestra han desarrollado hipertensión arterial, neuropatías y otras complicaciones que habitualmente acompañan al descontrol metabólico. En estas disfunciones se incluye la que sufre el sistema endotelial, este es uno de los más dañados cuando se produce un incremento en las especies reactivas del oxígeno en el organismo diabético, como el confirmado en la muestra.6,14,15
El tratamiento con sustancias antioxidantes puede proveer al organismo enfermo de las defensas que necesita y que ha perdido para contrarrestar el incremento de las ERO y así restablecer el equilibrio entre generación y eliminación de sustancias oxidantes.16
Summary
An important relationship between the levels of lipid peroxidation and the development of complications was observed in diabetes mellitus, a disease of endocrine origin. Variations were found in the concentration of products of lipid peroxidation (malondialdehyde) with values of 8.33 ± 2.90 in diabetic patients versus 4.51 ± 1.40 in sound individuals. The levels of reduced gluthatione, an endogenous antioxidant measured in serum of diabetic patients showed lower levels, 4.75 ± 2.31 and 8.30 ± 1.52 nmol/mL in serum of blood donors. It was found a significant reduction of catalase with values of 16.21 ± 18.25 versus 65.78 ± 24.78 U/mL. The decrease in the activity of superoxide dismutase was not remarkable.
Subject headings: LIPID PEROXIDATION; DIABETES MELLITUS/complications; DIABETES MELLITUS//enzymology; MALONDIALDEHYDE; OXIDATIVE STRESS; ANTIOXIDANTS/therapeutic use.
Referencias bibliográficas
- Baynes JW. Role of oxidative stress in development of complications in diabetes. Diabetes 1991;40:405-12.
- Brownlee M, Cerami A. The biochemistry of the complications of diabetes mellitus. Ann Rev Biochem 1991;50:385-432.
- Gary WW. The radical view. Free Radic Biol Med 1986;548:19-37.
- Kakkar R, Kalra J, Mantha SV. Lipid peroxidation and activity of antioxidant enzymes in diabetic rats. Mol Cell Biochem 1995;151:113-9.
- Van Dam PS, Bravenboer B, Asbeck BS van. Effects of insulin treatment on endoneural and systemic oxidative stress. Eur J Clin Invest 1996;26:1143-9.
- Galen M, Pieper P, Siebeneich W. Chronic treatment in vivo with dimethylthiourea, a hydroxyl radical scavenger, prevents diabetes-induced endothelial dysfunction. J Cardiovasc Pharmacol 1996;28:741-5.
- Bucala R, Makita Z, Konschinsky T. Lipid advanced glycosylations; pathway for lipid oxidations in vivo. Proc Natl Acad Sci USA 1993;90:6434-8.
- Stevens J, Feldman EL, Greene DA. Clinical management of diabetic neuropathy. Diabetic Med 1995;12:566-79.
- Brownlee M, Cerami A, Vlassala H. Advanced glycosylation endproducts in tissue and the biochemical basis of diabetic complications. En: Flier JS, ed. Seminar in medicine of the Beth Israel Hospital. Boston. 1998;318(20):1315-21.
- Beutler W. A manual of biochemical methods. En: Beutler E, ed. Red cell metabolism. 3 ed. Philadelphia: Grune and Stratton, 1984:72-136.
- Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pryrogallol and a convenient ssay for superoxide dismutase. J Biochem 1974;47:469-74.
- Aebi H. Catalase in vitro. Methods Enzymol 1984;105:121-6.
- Murakami K, Kondo T, Ohtsuka Y, Fujiwara Y, Shimada M, Kawakami Y. Impairment of glutathione metabolism in erythrocytes from patients with diabetes mellitus. Metabolism 1989;38:753-8.
- Kowluru RA, Kern TS. Abnormalities of retinal metabolism in diabetes or experimental galactosemia. Free Radic Biol Med 1997;22:587-92.
- Thornaley P. Advanced glycation on the development of diabetic complications. Endocrinol Metabol 1996;3:149-66.
- Wolff SP: The potential role of oxidative stress in diabetes and its complications. Diabetes Complications (London) 1987;167-221.
Recibido: 24 de junio de 1999. Aprobado: 12 de enero del 2000.
Ing. Sonia Clapés. Instituto de Ciencias Básicas y Preclínicas "Victoria de Girón". Avenida 146 No. 3102, municipio Playa, Ciudad de La Habana, CP 11600, Cuba
Correo electrónico: sclapes@vgiron.giron.sld.cu