Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.21 n.1 Ciudad de la Habana ene.-mar. 2002
Universidad del Quindío
Inmunización intranasal de ratones con la proteína SAG2 de Toxoplasma gondii asociada con la toxina colérica
Jhon Carlos Castaño Osorio y Dr. Jorge Sarracent Pérez
Resumen
Se estudió la capacidad como inmunógeno de la proteína SAG2 nativa del taquizoíto de T. gondii administrada por vía intranasal asociada con toxina colérica en ratones. El grupo de animales inmunizados con la proteína SAG2 sin adyuvante, presentó una menor carga de quistes cerebrales después del reto por vía oral con quistes de la cepa 76K de T. gondii. Se demostró la presencia de anticuerpos específicos contra esta proteína tanto en el nivel serológico (IgG), como en saliva (IgA), en todos los animales que recibieron la SAG2 en el esquema de inmunización.
DeCS: INMUNOENSAYO; ANTICUERPOS PROTOZOARIOS; ADMINISTRACION INTRANASAL; RATONES.
Toxoplasma gondii es un parásito intracelular obligado, que presenta una alta distribución en la naturaleza. La enfermedad humana producida por Toxoplasma gondii es una causa importante de morbilidad y mortalidad en neonatos y pacientes inmunodeprimidos. En el caso de una primoinfección durante el embarazo, la infección puede llevar al aborto. En los pacientes inmunosuprimidos, la toxoplasmosis cerebral (TC) es la causa más frecuente de lesiones cerebrales focales.1-4
La inmunidad protectora estimulada por una infección natural por T. gondii sugiere que el desarrollo de una vacuna efectiva es un objetivo alcanzable.5
La superficie del taquizoíto de T.gondii está dominada por 5 proteínas mayoritarias, las cuales han sido implicadas como ligandos mediante los cuales se realiza el reconocimiento celular y la adhesión. De ellas la P30 (SAG1) y la P22 (SAG2) son las más abundantes.6 Varios autores han tratado de dilucidar el potencial inmunoprotector de la proteína SAG1 y la SAG2 con resultados contradictorios.7-9 Se han utilizado varias estrategias en el desarrollo de vacunas contra este parásito, para tratar de producir una respuesta inmune protectora a largo plazo. Se han realizado inmunizaciones con componentes del parásito como homogenizados crudos, SAG1, rSAG1, SAG2, rSAG2, SAG3, ESA (componentes secretorios-excretorios), p24, GRA, plásmidos que codifican la SAG1 (p1tPASAG1), así como la SAG1 asociada con toxina colérica; y se logró protección parcial o completa y aun resultados contradictorios, como sucedió con un esquema de SAG1 con coadyuvante de Freund, donde aumentó la mortalidad en los ratones inmunizados con esta preparación.7-12
La proteína de membrana SAG2 es la segunda en abundancia en la superficie del parásito y al igual que la SAG1, solo está presente en el estadio de taquizoíto. Es reconocida por los sueros de animales y humanos infectados aguda y crónicamente, y muestra una respuesta más fuerte en los individuos en fase aguda. Se cree puede estar involucrada en los procesos de invasión celular, específicamente en la reorientación apical del parásito.6
Los ensayos de protección con el uso de esta proteína en animales se han realizado con la utilización de SAG2 sola o asociada con la glutation-S-transferasa (GST) e ISCOM como adyuvante; en unos han encontrado un débil efecto protector y en otros se le ha atribuido propiedades inmunosupresoras a la proteína, en dependencia de la cepa de T. gondii y el estadio del parásito utilizado en el reto. Es de resaltar que en dichos ensayos la vía de inoculación ha sido la intramuscular o subcutánea.11,12 Después de estos resultados, no se ha avanzado en el estudio de esta proteína de superficie con fines de inmunoprotección, y el interés se ha centrado en su utilidad como un marcador de virulencia de las cepas aisladas en humanos y animales, mediante un análisis rápido de los locus del gen de la SAG2 por Nested-PCR seguido de la digestión con enzimas de restricción (Hhal y Sau3AI) de los productos de la amplificación, que permite la clasificación en los diferentes linajes clonales.13
Considerando que la vía natural de infección de T. gondii es por la ruta oral por medio de la ingestión de ooquistes o quistes tisulares del parásito, se decidió estudiar la hipótesis de que la inmunización por vía intranasal con la proteína SAG2 era capaz de estimular la inmunidad de mucosas y sistémica de manera suficiente para brindar protección. Para comprobar esta hipótesis se plantearon los objetivos siguientes: 1. Determinar la capacidad inmunogénica de la proteína de superficie SAG2 de T. gondii por vía intranasal; y 2) determinar el potencial protector en un esquema de inmunización por vía intranasal con la proteína SAG2 en un modelo murino ante un reto por vía oral con quistes tisulares.
Métodos
Parásitos
Cepa RH de Toxoplasma gondii mantenida en el Instituto de Medicina Tropical Pedro Kourí (IPK). Se utilizaron los taquizoítos de la cepa RH para la obtención de antígenos para los esquemas de inmunización, ensayos inmunoenzimáticos, electroforesis e immunotransferencia. Los taquizoítos fueron mantenidos por pases intraperitoneales en ratones OF1.
La cepa 76K de T. gondii, fue donada gentilmente por la doctora Marie-Noëlle Mevelec (Nouzilly, francia). Esta cepa cuando se inocula en ratones, regularmente causa toxoplasmosis latente, con producción de una gran cantidad de quistes cerebrales.10 Se utilizó para el reto oral. Los quistes se obtuvieron mediante purificación por gradiente de centrifugación con Dextrán 6 000 de los cerebros de ratones OF1 inoculados intragástricamente 30 d antes.
Antígenos
El extracto total de antígenos solubles enriquecidos en proteínas de membrana se obtuvo por sonicación en frío a 10 000 Hz, 5 cilos de 30 s cada uno, de una suspensión en solución salina tamponada con fosfato (SSTF) de 3 ´ 109 taquizoítos frescos de la cepa RH, obtenidos a partir de cultivo en células Vero y purificados por filtración a través de un filtro de policarbonato de 3 mm de tamaño de poro (Nucleopore.Inc, Cambridge, USA). El sonicado, se centrifugó a 10 000 rpm ´ 30 min a 4 °C y se recuperó el sobrenadante. Para enriquecer esta preparación en proteínas de membrana se agregó al precipitado, Triton ´ 100 (Sigma, USA) 0,1 %. Se adicionó una mezcla de inhibidores de proteasas (PMSF 5 mM, Pestatin A 1 mM, EDTA 1 mM), se filtró por membrana de 0,2 mm y se determinó la concentración de proteínas por el método de Smith.14
Animales
Ratones OF1 (Centro Nacional para la Producción de Animales de Laboratorio-CENPALAB, La Habana), se utilizaron para el mantenimiento de los taquizoítos de la cepa RH de T. gondii, por pase intraperitoneal cada 4 d.
Ratones C57BL/6 (CENPALAB, Cuba), se utilizaron en los ensayos de inmunización y reto con la cepa 76 K de T. gondii por ser altamente susceptibles al desarrollo de quistes cerebrales en la fase crónica de la infección por T. gondii.
Purificación de la proteína SAG2 de T. gondii
La proteína SAG2 se obtuvo a partir de electroforesis preparativa en gel de poliacrilamida SDS(SDS-PAGE) 12 % en condiciones no reductoras de 500 mL del extracto total de antígenos solubles enriquecido en proteínas de membrana de T. gondii con una concentración de 1 mg/mL. Siguiendo la técnica para recuperación de proteínas descrita por Santana,15 la proteína correspondiente a la banda de peso molecular de 22 kD, fue visualizada mediante tinción inversa con imidazol 0,2 M –SDS 0,1 % y sulfato de zinc 0,2 M. La elución de la proteína de la banda se realizó previa renaturalización del gel en SSTF-Triton ´ 100 al 0,1 % y lavado en SSTF. La proteína fue eluida pasivamente por fragmentación de gel y resuspendida en SSTF. La suspensión se sometió a agitación vigorosa, se incubó por 16 h a 4 °C en esta solución y después se centrifugó por 60 min a 15 000 rpm/4 °C. El sobrenadante que se concentró se recuperó mediante ultrafiltración por membrana YM3 (MilliporeÒ) y se le determinó la concentración de proteínas mediante la técnica de Smith.14 La presencia de la proteína se verificó por inmunotransferencia con un anticuerpo monoclonal de ratón anti SAG- 2.
Electroforesis en gel de SDS-PAGE
Las proteínas se separaron mediante electroforesis en geles 12,5 % de poliacrilamida-SDS de 1,5 mm. Las electroforesis se corrieron en un sistema discontinuo de tampones, bajo condiciones no desnaturalizantes en mini-cámaras (BioRAD) a razón de 15 mA/gel. Los geles se tiñeron mediante la solución de tinción: 450 mL de metanol, 450 mL de agua destilada, 100 mL de ácido acético glacial y 1 g de azul Coomassie brillant Blue R-250. Posteriormente se realizó la decoloración en una solución con igual composición que la anterior (excepto que no contenía colorante), hasta obtener una buena resolución.
InmunotransferenciA (Western Blot)
Las proteínas presentes en los geles de PAGE sin colorear, se transfirieron a membrana de nitrocelulosa por 40 min, a razón de 5 mA por cm2 (semi-dry-transfer, BioRAD) con un voltaje máximo de 25 V y la utilización de un tampón de Tris 0,05 mM, glicina 0,4 M, SDS 0,1 M, metanol 20 % en SSTF. La eficiencia de la transferencia se evidenció tiñendo la membrana de nitrocelulosa con una solución de rojo ponceau 0,5 % y ácido acético 1 %. Posteriormente las membranas se bloquearon 4 h a 4 °C con una solución de leche descremada 5 % en SSTF, después se lavaron con SSTF y se incubó 16 h a 4 °C con el AcM a una concentración de 100 mg/mL en SSTF-T, o suero humano policlonal anti-toxoplasma a una dilución de 1:200 en SSTF-T. Luego se lavaron las membranas con SSTF-T y se adicionó un conjugado de inmunoglobulinas antiratón o antihumano peroxidasa según el caso, a la dilución recomendada por el productor en SSTF-T y se incubó 2 h a 37 °C. Tras un paso similar de lavado, la membrana se incubó con un sustrato insoluble de la peroxidasa (5 mg de diamino benzidina y 5 mL de H2O2 por cada 10 mL de SSTF pH 7,4), hasta la aparición de las bandas.
Esquemas de inmunización en ratones C57BL/6
Se distribuyeron 25 ratones C57BL/6 hembras de 20 g en 5 grupos de 5 ratones cada uno:
Grupo 1: control, cada ratón recibió 15 mL por vía intranasal de solución de bicarbonato de sodio 0,1 M.
Grupo 2: recibió igual volumen de la solución de bicarbonato de sodio con 2 mg de toxina colérica (Sigma, USA).
Grupo 3: recibió solución de bicarbonato con 5 mg de proteína SAG2 y 2 mg de toxina colérica.
Grupo 4: recibió solución de bicarbonato de sodio con 5 mg de la proteína SAG2.
Grupo 5: recibió un extracto total de antígenos solubles del taquizoíto del parásito (5 mg) en la solución de bicarbonato de sodio y 2 mg de toxina colérica.
Se dieron 4 dosis con intervalo de 7 d entre ellas para lograr una dosis total de 20 mg de la proteína SAG2 a los grupos 3 y 4.
Determinación de anticuerpos séricos y en saliva de ratones inmunizados
Se tomó saliva y suero de los ratones antes del inicio y al final del esquema de inmunización, para la determinación de anticuerpos contra la toxina colérica y contra la proteína SAG2 por ELISA. La saliva se recolectó 5 min posteriores a la inyección intraperitoneal de 0,2 mg de pilocarpina por ratón y la sangre mediante punción retro orbital.
Determinación de la respuesta de anticuerpos
Los anticuerpos IgG séricos e IgA de mucosas contra la proteína SAG2 y la toxina colérica fueron medidos mediante un ensayo inmunoabsorbente asociado con enzimas (ELISA): Se recubrieron los pozos de placas MaxisorpÒ (Nunc, Suiza) con 100 mL de solución de 5 mg/mL de los antígenos a estudio, diluidos en solución tamponada de carbonato y bicarbonato 10 mM, pH 9,6 (STCB) y se incubaron a 37 °C por 2 h, y se lavaron 3 veces con solución salina tamponada de fosfato que contiene 0,05 % de Tween 20 (SSTF-T). Se realizó el bloqueo con 300 mL de solución de STCB-leche descremada 5 %. Se incubaron las placas a 37 °C por 1 h, posteriormente se adicionaron 100 mL de las muestras a una dilución de 1:5 para la saliva y 1: 100 para los sueros en SSTF-T, albúmina 0,1 %. Se incubó en cámara húmeda a 37 °C por 2 h, al cabo de las cuales se realizaron lavados con SSTF-T. Luego se adicionaron 100 mL de solución de conjugado de anti-inmunoglobulinas de ratón en SSTF-T, albúmina 0,1 %. Se incubó a 37 °C por 1 h, luego se realizaron lavados y se adicionó solución tamponada de citrato-fosfato de sodio (STCF) pH 5,5, que contenía 0,014 % de peróxido de hidrógeno y 0,05 % de ortofenilendiamina (OPD). Tras la incubación a temperatura ambiente (TA), la reacción se detuvo a los 15 min con 50 mL de H2SO4 12,5 %. La lectura se realizó a una longitud de onda de 492 nm. Los resultados se expresan como los valores de absorbancia a 492 mn (A492).
Determinación de la presencia de quistes de T. gondii en el cerebro de los ratones C57BL/6 después del reto por vía oral con la cepa 76K
Una semana después que se completó el esquema de inmunización, se realizó el reto por vía oral con 100 quistes hísticos de la cepa 76K de Toxoplasma gondii a cada uno de los ratones de los grupos en estudio. Al cabo de 1 mes se realizó el sacrificio de todos los ratones, se extrajo su cerebro, se maceró en 5 mL de solución salina y se realizó conteo del número de quistes hísticos desarrollados en este tejido mediante visualización microscópica entre lámina y laminilla a 40 ´ de 10 muestras de 10 mL del homogeneizado del cerebro de cada ratón. De esta forma se calculó la media de los quistes cerebrales por cerebro y los resultados se expresan como la media y la desviación estándar para cada grupo.
Resultados
Los experimentos se repitieron 2 veces con resultados muy similares. Se presentan los resultados de uno de los experimentos. El coeficiente de variación entre experimentos fue de 12 %.
Conteo de quistes cerebrales en ratones inmunizados
Para determinar si la inmunización por vía intranasal con los diferentes esquemas de antígenos asociados a la toxina colérica conferían algún grado de protección, los ratones recibieron un reto oral con quistes hísticos de la cepa 76K de T. gondii. Se encontró en el conteo que el grupo inmunizado con la proteína SAG2 sola presentó un menor número de quistes cerebrales con una diferencia respecto a los otros grupos estadísticamente significativa, Kruskal-Wallis: p< 0,01.
En la figura 1 se puede observar el número de quistes cerebrales en los diferentes grupos de ratones inmunizados. El conteo de quistes se realizó 1 mes después de realizado el reto por vía oral con 100 quistes tisulares de la cepa 76K de T. gondii en los ratones previamente inmunizados. Se usó la técnica de conteo por campo bajo microscopio de luz 40x del homogeneizado del cerebro. Los datos presentados son el promedio ± DE de 1 experiencia. Kruskall Wallis: p< 0,01 Mann-Whitney: ratones inmunizados con SAG2 vs. ratones inoculados con CO3HNaO,1M: p< 0,01, ratones inmunizados con SAG2 vs. ratones inmunizados con TC p< 0,01, ratones inmunizados con SAG2 vs. ratones inmunizados con SAG2+TC p< 0,05, ratones inmunizados con SAG2 vs. ratones inmunizados con Ag total p < 0,05.
Fig. 1. Número de quistes cerebrales en los diferentes grupos de ratones inmunizados.
Determinación de anticuerpos contra SAG2 en la saliva de los ratones inmunizados por vía intranasal
Los resultados de ELISA en las muestras de saliva revelaron la presencia de anticuerpos específicos para la proteína SAG2, en los grupos tratados con esta proteína o el antígeno total. Se observó una diferencia significativa entre estos grupos y los grupos tratados con bicarbonato o toxina colérica sola. Kruskal-Wallis p < 0,05.
En la figura 2 se presenta la determinación de anticuerpos contra T. gondii en la saliva de los ratones inmunizados. Se realizó un ELISA con recubrimiento de la fase sólida con 2 mg/mL de proteína SAG2. Se adicionaron 100 mL de saliva a una dilución de 1:5, se utilizó un conjugado anti inmunoglobulina A (IgA) de ratón peroxidasa, la reacción se reveló con OPD. Los datos presentados son el promedio ± DE de quintuplicados de una de las experiencias KW: p < 0,01.
Fig. 2. Determinación de anticuerpos contra Toxoplasma gondii en la saliva de los ratones inmunizados.
Derterminación de anticuerpos séricos contra SAG2 en ratones inmunizados por vía intranasal
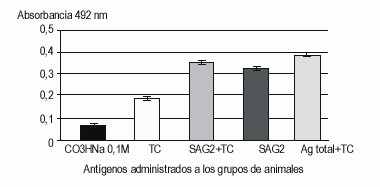
En el sistema de ELISA con la proteína SAG2 como recubrimiento y con la utilización de suero como muestra, se obtuvo una respuesta de anticuerpos séricos totales estadísticamente significativa, en los grupos inmunizados con el antígeno soluble total más toxina colérica, en el grupo inmunizado con la SAG2 más toxina colérica y en el grupo inmunizado con la proteína SAG2 sin adyuvante. Kruskal-Wallis: p < 0,05.
En la figura 3 aparece la determinación de anticuerpos séricos contra SAG2 de T. gondii, en ratones inmunizados. ELISA con recubrimiento de la fase sólida con 2 mg/mL de SAG2. Se adicionaron 100 mL de suero a una dilución de 1: 100, se utilizó un conjugado antiinmuno-globulinas totales de ratón peroxidasa, la reacción se reveló con OPD. Los datos presentados son el promedio ± DE de quintuplicados de 1 de las experiencias KW: p< 0,01.
Fig. 3. Determinación de anticuerpos séricos contra SAG2 de Toxoplasma gondii en ratones inmunizados.
Determinación de anticuerpos séricos contra la toxina colérica en los ratones inmunizados por vía intranasal
La toxina colérica es conocida como uno de los adyuvantes más poderosos por vía nasal u oral para levantar respuesta al nivel de mucosas y sistémicas. Para verificar que los ratones habían sido correctamente inmunizados, se realizó un ELISA buscando anticuerpos contra la toxina colérica (TC). Se pudo evidenciar una respuesta serológica consistente con los esquemas de inmunización en los grupos de ratones tratados. En la figura 4 se puede observar la determinación de anticuerpos contra la toxina colérica en suero de ratones inmunizados. Se realizó un ensayo de ELISA con recubrimiento de la fase sólida con 2 mg/mL de la toxina colérica, se adicionaron 100 mL de suero a una dilución de 1: 100. Se utilizó un conjugado anti inmunoglobulinas totales de ratón peroxidasa. Los datos presentados son el promedio ± DE de quintuplicados de una experiencia. KW: p < 0,01.
Fig. 4. Determinación de anticuerpos contra la toxina colérica en suero de ratones inmunizados.
Discusión
La infección primaria con T. gondii confiere al hospedero una inmunidad protectora contra la reinfección, lo que ha permitido sugerir que la prevención de la toxoplasmosis es una meta alcanzable.4,5
Para el desarrollo de una vacuna contra la toxoplasmosis, debemos considerar en primera instancia que la vía natural de infección, tanto en el hombre como en los animales es la ingestión de quistes u ooquistes del parásito y que estos, después de la digestión peptídica de su pared, liberan los bradizoítos o esporozoítos en la superficie de la mucosa del intestino, iniciándose rápidamente el proceso de invasión y multiplicación en los enterocitos del intestino del hospedero por los taquizoítos del parásito y su posterior diseminación a todos los órganos del individuo.2 De aquí que el desarrollo de una buena inmunidad de mucosas sea de vital importancia para controlar la infección.16 Como se conoce, las formas infectantes por vía oral requieren de una rápida interconversión de las formas de latencia contenidas en ooquistes y quistes hísticos a la forma de replicación rápida (taquizoítos), que permite la colonización de la mucosa intestinal del hospedero así como su posterior diseminación. Si consideramos que las 2 proteínas mayoritarias de la superficie de este parásito, SAG1 y SAG2, solo se expresan en el estadio de taquizoíto, se puede inferir que las proteínas de superficie y en particular la SAG2 también es un blanco importante de la respuesta inmune para evitar la reinfección.
Todos los ensayos de inmunización con la proteína SAG2 previamente reportados han utilizado la vía parenteral para su administración como inmunógenos, sin lograr ningún grado de protección ante un reto,11,12 y por otra parte los reportes donde se ha suministrado la proteína SAG1 asociada con toxina colérica por vía intranasal como adyuvante, han obtenido resultados prometedores al potencializar la respuesta inmune de mucosa, con grados variables de protección.8,10,17-21 Por esta razón se decidió realizar ensayos de inmunización por vía intranasal con la proteína SAG2 nativa purificada, asociada con toxina colérica (el más potente adyuvante de mucosa), para explorar la capacidad de estimular la inmunidad contra esta proteína y evaluar su capacidad protectora ante un reto con quistes hísticos de la cepa 76K de T. gondii, una cepa que produce una gran cantidad de quistes cerebrales en ratones C57BL/6 (altamente susceptibles al desarrollo de quistes).
Se encontró en los ratones inmunizados por vía intranasal, una respuesta de anticuerpos IgG e IgA específicos tanto contra la proteína SAG2 del parásito como contra la toxina colérica en la saliva y en el suero, lo que demuestra que la vía de administración intranasal es efectiva para suscitar una respuesta inmune serológica tanto en la mucosa gastrointestinal, así como sistémica, como ha sido reportado previamente con esquemas de inmunización similares, pero con la utilización de la proteína SAG1.8,21
Cuando se realizó el conteo de quistes cerebrales de la cepa 76 K de T. gondii en los ratones C57BL/6, como indicativo de protección se encontró que el grupo inmunizado con la proteína SAG2 sola, presentó un menor número de quistes cerebrales con una diferencia estadísticamente significativa respecto de los otros grupos; esto puede estar reflejando la importancia de esta proteína en la inmunidad de mucosa contra este parásito. Es conocido que cuando un antígeno se administra junto con toxina colérica por vía intranasal se obtiene una poderosa inmunidad humoral al nivel de mucosas y una respuesta celular limitada.17-19,22 El reconocimiento de los antígenos administrados junto a la toxina colérica ocurre fundamentalmente al nivel de los corpúsculos de Peyer, sin embargo cuando se administra el antígeno solo por vía intranasal las células que desempeñan el papel fundamental son los linfocitos intraepiteliales que en su mayoría son linfocitos T CD8, que son capaces de migrar por todo el sistema linfático a otros órganos y realizar su función protectora y destruir las céluls infectadas.16,23-25
Bourguin y otros encontraron un incremento de la respuesta secretoria de IgA específica al nivel de mucosa cuando administraron la toxina colérica (TC) asociada con un sonicado total de Toxoplasma. Al evaluar la inmunidad contra el desarrollo de quistes cerebrales hallaron una gran protección evidenciada por la disminución de quistes cerebrales, solo en el grupo de animales inmunizados con TC asociada al sonicado del parásito.18 Sin embargo, al utilizar la misma cepa del parásito y ratones, se encontró una mayor protección contra el desarrollo de quistes cerebrales en el grupo que recibió la proteína SAG2 sola, a pesar de utilizar una cepa de ratón del haplotipo H-2b que se conoce son altamente susceptibles al desarrollo de quistes cerebrales.19 Esto podría estar evidenciando capacidad inmunogénica interesante de esta proteína, como ser capaz de presentarse sin necesidad de adyuvante al menos por la vía de mucosas, así como estimular tanto una inmunidad local secretoria de IgA, como IgG sistémica específica, y capacidad para estimular la inmunidad celular al nivel de mucosa que impida la reinfección por esta vía. Es de notar que en la literatura consultada no se encuentra ningún antecedente de inmunización con esta proteína por vía de mucosas y que los antecedentes de vacunación con la SAG1 por ruta intranasal asociada con la TC o a una mutante no tóxica de la enterotoxina termolábil (LTR72, LTR63), han mostrado una disminución en el número de quistes cerebrales después del reto con la cepa 76K, asociado con un patrón de citoquinas en los esplenocitos y células de los nódulos mesentéricos de tipo Th1 y una fuerte respuesta inmune de IgG e IgA, tanto local como sistémica.21 Velge-Roussel y otros encontraron que cuando transfirieron células de los nódulos linfáticos cervicales, mesentéricos y de los linfocitos intraepiteliales de ratones previamente inmunizados a ratones desnudos, estos presentaron una menor cantidad de quistes cerebrales después del reto con la cepa 76K.9 De los resultados de este trabajo se puede inferir que se logró un patrón inmune similar cuando se administró la SAG2 sola por vía intranasal y se considera que se ha descrito actividad de superantígeno asociado con la proteína SAG1, y que cuando se administra la SAG1 sola se polariza la respuesta inmune al patrón Th2 que no brinda ninguna protección contra la reinfección por T. gondii,26 los autores de este trabajo consideran adecuado realizar nuevos estudios con la proteína SAG2.
Los estudios previos de Lundén con esta proteína son contradictorios, porque cuando administró la SAG2 nativa incorporada en complejos inmuno estimulantes (ISCOM) por vía parenteral, obtuvo una fuerte respuesta de anticuerpos, así como un aumento en la sobrevivencia estadísticamente significativo en los ratones inmunizados, ante el reto intra-peritoneal con taquizoítos de la cepa RH, así como al reto por vía oral con ooquistes de T. gondii; sin embargo no obtuvo una diferencia estadísticamente significativa entre los ratones inmunizados y no inmunizados cuando realizó el reto con quistes hísticos por vía oral.11 Posteriormente, cuando realizó la inmunización con la proteína SAG2 recombinante integrada a ISCOM, aunque obtuvo una buena respuesta de anticuerpos séricos específicos contra la SAG2, no observó ningún efecto protector ante el reto con ooquistes de la cepa Me49 o quistes hísticos de la cepa C56 de T. gondii; al contrario, observó una mortalidad de 100 % en los ratones inmunizados con la SAG2 antes que en los grupos controles. Resultados similares en el incremento de la mortalidad se han reportado con la proteína SAG1 cuando se ha administrado junto con adyuvante de Freund o a hidróxido de aluminio por vía parenteral,27,28 en tanto se han logrado niveles significativos de protección cuando se ha administrado asociada con un adyuvante que se sabe polariza la respuesta inmune a un patrón Th1 (SBAS1c), o incorporada a ISCOM por vía parenteral o cuando se ha dado por vía intranasal asociada con la TC.18,19,28-31
Al analizar los resultados alcanzados, se concluye que la administración intranasal de la proteína SAG2 es efectiva para desarrollar una inmunidad protectora contra T. gondii tanto al nivel de mucosas como sistémica y se recomienda continuar los estudios con esta proteína administrada por vía de mucosas.
Agradecimientos
A BID-COLCIENCIAS y a la Universidad del Quindío por la financiación para la realización de este trabajo.
Summary
The capacity of SAG2 native protein from the Toxoplasma gondii tachyzoite as an immunogen administered by intranasal route associated with cholera toxin in mice was studied. The group of animals immunized with SAG2 protein without adjuvant presented a smaller charge of cerebral cysts after the challenge by oral route with T. gondii 76K strain cysts. The presence of specific antibodies against this protein, both at the serological level (IgG) and in saliva (IgA), was proved in all the animals that received SAG2 in the immunisation scheme.
Subjct headings: IMMUNOASSAY; ANTIBODIES, PROTOZOAN; ADMINISTRATION, INTRANASAL; MICE.
Referencias bibliográficas
- Freyre A. Los ciclos de Toxoplasma inducidos por infecciones con carne y con ooquistes. Memorias Segundo Congreso Internacional de Toxoplasmosis; 1998. Junio 4-6; Santa Fe de Bogotá. Universidad de los Andes.
- Dubey JP. Epidemiología de la infección por Toxoplasmas gondii en animales. Memorias Segundo Congreso Internacional de Toxoplasmosis; 1998. Junio 4-6; Santa Fe de Bogotá. Universidad de los Andes.
- Kasper LH, Buzoni-Gatel D. Some oportunistic parasitic infections in AIDS: candidiasis, pneumocystosis, cryptosporidiosis, toxoplasmosis. Parasitol Today 1998;14:150-6.
- Remington JS, Desmonts G. Toxoplasmosis. En J.S. Remington and J.O. Kleing ed, Infectious diseases of the fetus and the newborn infant, 3rd ed. Philadephia, Pa: The W. B. Saumders Co; 1995;140-267.
- Araujo FG. Immunization against Toxoplasma gondii. Parasitol Today 1994;10:358-60.
- Tomavo S. The major surface proteins of Toxoplasma gondii: structures and functions. Curr Top Microbiol Immunol 1996;219:82-9.
- Elsaid MM, Vitor R, Frézard F, Martins MS. Protection against Toxoplasmosis in mice immunized with different antigen of Toxoplasma gondii incorporated into liposomes. Mem Inst Oswaldo Cruz. 1999;94:485-90.
- Debard N, Buzoni-Gatel D, Bout D. Intranasal immunization with SAG1 protein of Toxoplasma gondii in association with cholera toxin dramatically reduces development of cerebral cysts after oral infection. Infect Immun 1996;64:2158-66.
- Vercammen M, Scorza T, Huygen K, De Braekeleer J, Diet R, Jacobs D, Saman E, Verschueren H. DNA vaccination with genes encoding Toxoplasma gondii antigens GRA1, GRA7 and ROP2 induces partially protective immunity against lethal challenge in mice. Infect Immun 2000;68:38-45.
- Chardés T, Bourguin I, Mevelec M, Dubremetz J, Bout D. Antibody responses to Toxoplasma gondii in sera, intestinal secretion and milk from orally infeted mice and characterization of target antigens. Infect Immun 1990;58:1240-6.
- Lundén A, Lovgren K, Uggla A, Araujo FG. Immune responses and resistance to Toxoplasma gondii in mice immunized with antigens of the parasite incorporated into immunostimulating complexes. Infect Immun 1993;61:2639-43.
- Lundén A, Parmely SF, Lövgren Bengtsson K, Araujo FG. Use of a recombinat antigen, SAG2, expressed as glutahion-S-transferase fusion protein to immunize mice against Toxoplasma gondii. Parasitol Res 1997;83:6-9.
- Howe DK, Summers BC, Sibley LD. Acute virulence in mice is associated with markers on chromosome VIII in Toxoplasma gondii. Infect Immun 1996;64:5193-8.
- Smith PK, Krohn RI, Hermanson GT. Measurement of protein using bicinchoninic acid. Anal Biochem 1985;150:76-85.
- Santana HE, Sosa A, Hernández L, Fernández C, Castellanos L. Recovery of biologically active proteins detected with imidazole-sodium dodecyl sulfate-zinc (reverse stain) on sodium dodecyl sulfate gels. Anal Biochem 1996;240:150-2.
- Chardés T, Buzoni-Gatel D, Lepage AC, Bernard F, Bout D. Toxoplasma gondii oral infection induces specific cytotoxic CD8/+ Thy-1+ gut intraepithelial lymphocytes, lytic for parasite-infected enterocytes. J Immunol 1994;153:4596-603.
- Bourguin I, Chardés T, Mevelec M, Woodman JP, Bout D. Amplification of the secretory IgA response to Toxoplasma gondii using cholera toxin. FEMS Microbiol Letters, 1991;81:265-72.
- Bourguin I, Chardés T, Bout D. Oral immunization with Toxoplasma gondii antigens association with cholera toxin induces enhanced protective and cell-mediated immunity in C57BL/6 mice. Infect Immun 1993;61:2082-8.
- Bourguin I, Chardés T, Bout D. Peritoneal macrophages from C57BL/6 mice orally immunized with Toxoplasma gondii antigens in association with cholera toxin possess an enhanced ability to inhibit parasite multiplication. FEMS Immunol Medical Microb 1995;12:121-6.
- Debard N, Buzoni-Gatel D, Bout D. Intranasal immunization with SAG1 protein of Toxoplasma gondii in association with cholera toxin dramatically reduces development of cerebral cysts after oral infection. Infect Immun 1996;64:2158-66.
- Khan IA, Smith KA, Kasper LH. Induction of antigen specific parasiticidal citotoxic T cell splenocytes by a major membrane protein (P30) of Toxoplasma gondii. J Immunol 1988; 141:3600-5.
- Bonenfant C, Dimier-Poisson L, Velge-Roussel F, Buzoni-Gatel D, Del Giudice G, Rappuoli R, Bout D. Intranasal immunization with SAG1 and notoxic mutan heat-labile enterotoxins protects mice against Toxoplasma gondii. Infect Immun 2001;69:1605-12.
- Bergquist C, Johnsson EV, Lagergard T, Holmgren J, Rudin A. Intranasal vaccination of humans with recombinat cholera toxin B subunit induces systemic and local antibody responses in the upper respiratory tract and the vagina. Infect Immun 1997;65:2676-84.
- Buzoni-Gatel D, Debabi D, Moretto M, Dimier-Poisson I, Lepage AC, Bout D, Kasper LH. Intraepithelial lymphocytes traffic to the intestine and enhance resistance to Toxoplasma gondii infection. J Immunol 1999;162:5846-52.
- Marinaro M, Staats HF, Hiroi T, Jackson RJ, Coste M, Boyaka PN, Okahashi N, Yamamoto M, Kiyono H, Bluethmann H. Mucosal adjuvant effect of cholera toxin in mice result from induction of T helper 2 (Th2) cells and IL-4. J Immunol 1995;155:4621-9.
- Lepage A, Buzoni-Gatel D, Bout D, Kasper LH. Gut-derived intraepithelial lymphocytes induces longterm immunity against Toxoplasma gondii. J Immunol 1998;161:4902-8.
- Letscher-Bru V, Villard O, Risse B, Zauke M, Klein JP, Kien TT. Protective effect of vaccination with a combination of recombinant surface antigen 1 and interleukin-12 against toxoplasmosis in mice. Infect Immun 1998;66:4503-6.
- Kasper LH, Currie KM, Bradley MS. An unexpected response to vaccination with a purified major membrane tachyzoite antigen (P30) of Toxoplasma gondii. J Immunol 1985;134:3426-31.
- Biemans R, Grégorie D, Haumont M, Bosseloir A, García L, Jacquet A, Dubeaux C and Bollen A. The conformation of purified Toxoplasma gondii SAG1 antigen, secreted from engineered Pichia pastoris, is adequate for serorecongnition and cell proliferation. J Biocthecnol 1998;66:1337-46.
- Uggla A, Araujo FG, Lunden A, Lovgren K, Remington JS, Morein B. Immunizing effects in mice of tow Toxoplasma gondii iscom preparations. J Vet Medic Series B. 1988;35:311-4.
- Overnes G, Nesse LL, Waldeland H, Lovgren K, Gudding R. Immune response after immunization with an experimental Toxoplasma gondii ISCOM vaccine. Vaccine 1991;9:925-28.
Recibido: 13 de junio de 2001. Aprobado: 12 de septiembre de 2001.
Dr. Jhon Carlos Castaño Osorio. CIMB-Universidad del Quindío. Camera 15 Calle 12 Norte Armenia. Quindío. Colombia S.A. Correo electrónico:yiyuma@yahoo.com