Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.21 n.4 Ciudad de la Habana oct.-dic. 2002
Determinación de variables metabólicas en recién nacidos con presencia de meconio en el líquido amniótico
Dr. Jorge Valdés Moreno, Dra. Lidia Cardellá Rosales, Dra. Ana María Gómez Álvarez y Dra. Genny Rojas Palacios
Resumen
Se estudió en un grupo de recién nacidos con líquido amniótico meconial sin otro signo de sufrimiento fetal, algunas variables bioquímicas que se han encontrado incrementadas en pacientes hipóxicos. Las muestras fueron obtenidas en el bloque ginecoobstétrico del Hospital Julio Trigo; 14 casos en el grupo con líquido meconial y 51 en el grupo control. Las variables estudiadas: hemoglobina total y fetal, proteínas totales, glucosa, lactato, aspartato aminotransferasa, alanina aminotransferasa y láctico deshidrogenasa, fueron determinadas en sangre del cordón umbilical. La concentración sérica de lactato y la actividad de alanina aminotransferasa y láctico deshidrogenasa en el grupo con meconio fue significativamente superior al grupo control, lo que apoya el criterio de que la presencia de meconio en el líquido amniótico es un signo de sufrimiento fetal.
DeCS: MECONIO/metabolismo; LIQUIDO AMNIOTICO/metabolismo; LACTATO DESHIDROGENASA; ALANINA TRANSAMINASA; ANOXIA FETAL; SUFRIMIENTO FETAL; RECIEN NACIDO.
Los trastornos perinatales más frecuentes suelen acompañarse de algún grado de hipoxia, lo cual puede según el momento, la intensidad y duración, afectar el normal desarrollo del recién nacido. Un acontecimiento bioquímico importante en la hipoxia es el paso de la oxidación aerobia de la glucosa a la anaerobia, con la acumulación de lactato y aparición de acidosis metabólica;1,2 se han reportado concentraciones elevadas de lactato en sangre de la arteria umbilical relacionadas con la duración de la hipoxia intraparto.3 La hipoxia perinatal provoca un aumento reversible en la permeabilidad de las membranas celulares que se manifiesta por la liberación de enzimas citoplasmáticas como la láctico deshidrogenasa2,4 (LDH) y las transaminasas glutámico oxalacética2,5 (TGO) y glutámico pirúvica (TGP)5 (Gómez-Álvarez AM. Actividad sérica de las enzimas lactato deshidrogenasa y de las transaminasas glutámico pirúvico y glutámico oxalacético en recién nacidos con signos de sufrimiento fetal. Tesis de terminación de residencia. La Habana, 1988), creatina quinasa y sus isoenzimas.2,3,6,7 La obtención de predictores eficaces de la severidad de la hipoxia ha sido ampliamente explorada, porque el diagnóstico precoz contribuiría a evitar secuelas que puedan condicionar algún tipo de minusvalía. Se sabe que una causa fundamental de hipoxia es la aspiración de meconio.8,9 El propósito del presente trabajo consistió en estudiar algunas variables bioquímicas, en un grupo de recién nacidos que presentaron como único signo de sufrimiento fetal la presencia de líquido amniótico meconial, con el objetivo de determinar si existen condiciones metabólicas diferentes a los recién nacidos normales que puedan requerir una atención diferenciada.
Métodos
La muestra quedó conformada con 65 casos del municipio Arroyo Naranjo, cuyos nacimientos ocurrieron durante 3 d a la semana de mayo a diciembre de 1994. La muestra se separó en 2 grupos: grupo control con 51 casos y 14 casos que conformaron el grupo de recién nacidos que presentaron meconio en el líquido amniótico, con puntaje de apgar mayor que 7 al minuto y de 8 a los 5 min, y ningún otro signo de sufrimiento fetal. Se excluyeron de la muestra los casos pertenecientes a otro municipio o que presentaran cualquier otra afectación perinatal que no fuese presencia de meconio en el líquido amniótico.
Las determinaciones de las variables se realizaron a partir de sangre obtenida del cordón umbilical. Las variables estudiadas fueron proteínas totales por el método de Biuret según Henry,10 hemoglobina total, por el método de la cianohemoglobina según OBrien,11 y fetal, por el método de Beckel;12 glucosa, según el método de Keston;13 lactato, por el método de Noll,14 aspartato aminotransferasa o transaminasa glutámico oxalacética (TGO) [2.6.1.1] y alanina aminotransferasa o transaminasa glutámico pirúvica (TGP) [2.6.1.2], según Bergmeyer15,16 y lactato deshidrogenasa (LDH) [1.1.1.27] según Wroblenwski y Le Due.17
La hemoglobina total y la fetal se determinaron en sangre heparinizada; el lactato en el sobrenadante obtenido después de la precipitación de la sangre heparinizada con perclórico 0,6 M. El resto de las variables se determinaron en suero de sangre no heparinizada.
Los resultados se expresaron en g/dL para la hemoglobina total (Hb total) y las proteínas totales. La hemoglobina fetal se expresa en porcentaje de la hemoglobina total. La glucosa y el lactato en mmol/L. Las actividades de las enzimas transaminasas GPT y GOT en U/L (1 unidad= cantidad de enzimas que convierte 1 mmol de sustrato/min) y la LDH en UI/mL (1 unidad= cantidad de enzimas que convierte 1 mmol de sustrato/min). Los datos de edad gestacional, peso corporal, talla y puntaje de apgar al minuto y a los 5 min fueron obtenidos de las historias clínicas de la madre y el niño.
Análisis estadístico
Los resultados obtenidos en las variables estudiadas se presentaron con los estadígrafos descriptivos. La comparación de las variables estudiadas entre el grupo control y el de meconio en líquido amnió-tico, se realizó, previa la comprobación de la distribución normal, por la prueba t de Student, mediante el Sistema Miscrosta. Se consideró la significación para p< 0,05.
Resultados
Los resultados obtenidos de las variables estudiadas se presentan en la tabla. Como se puede apreciar, en el análisis de comparación de las medias en ambos grupos según la prueba t de Student, solo se encontró significación estadística para la concentración de lactato y la actividad de la GPT y la LDH, que mostraron valores superiores en el grupo con líquido amniótico meconial, aunque el porcentaje de hemoglobina fetal, sin dar significación estadística, fue también superior en este grupo.
En la figura 1 se muestra la comparación de las medias del peso, la talla, la edad gestacional y los valores del apgar al minuto y a los 5 min. La similitud de los valores del peso, la talla, la edad gestacional y los puntajes del apgar, refuerzan los criterios de selección de los grupos, de manera que solo se diferenciarán por la presencia de líquido amniótico meconial.
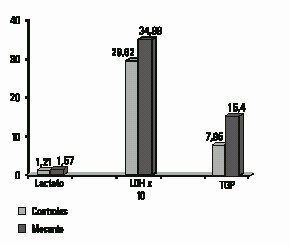
En la figura 2 se muestran las medias en las variables bioquímicas que resultaron estadísticamente significativas al comparar ambos grupos.
Fig. 1. Comparación de los valores de las medias de la edad gestacional, el peso corporal, la talla y el puntaje de apgar al minuto y a los 5 minutos entre el grupo control y el grupo con meconio en el líquido amniótico. Meconio: grupo con líquido amniótico meconial, apgar1= puntaje de apgar al minuto, apgar5= puntaje de apgar a los 5 minutos.
Fig. 2. Comparación de las medias de las variables con significación estadística según la prueba t de Student entre el grupo control y el grupo con meconio en el líquido amniótico. Meconio: grupo con líquido amniótico meconial.
Tabla. Comparación de los resultados de las variables estudiadas en ambos grupos
| Grupo control | Grupo con meconio en el líquido amniótico | Análisis estadístico | |
| Valor de t | |||
| Edad gestacional (semanas) | 39,40 ± 1,28 | 35,62 ± 2,75 | - |
| Peso (g) | 3277,49 ± 441,3 | 3246,43 ± 400,07 | - |
| Talla (cm) | 50,62 ± 3,74 | 51,08 ± 0,97 | 0,2420 |
| Hb total (g/dL) | 15,46 ± 1,46 | 15,40 ± 0,67 | 0,0713 |
| Hb fetal (% total) | 64,46 ±10,81 | 68,5 ± 9,38 | 1,0194 |
| Proteínas totales (g/dL) | 7,28 ± 1,78 | 6,63 ± 1,79 | 0,445 |
| Glucosa (mmol/L) | 5,26 ± 1,21 | 5,17 ± 1,26 | 0,2371 |
| Lactato (mmol/L) | 1,21 ± 0,57 | 1,57 ± 0,62 | 2,0562* |
| TGO (U/L) | 20,54 ± 13,92 | 20,40 ± 4,43 | 0,0240 |
| TGP (U/L) | 7,95 ± 4,4 | 15,40 ± 5,93 | 3,38517*** |
| LDH (UI/L) | 288,24 ± 66,2 | 349,92 ± 50,8 | 2,4989** |
* p< 0,05, ** p< 0,01, ***p< 0,001.
Fuente: Edad gestacional, peso y talla por las historias clínicas de la madre y el recién nacido.
Los valores de las variables bioquímicas son las determinaciones realizadas por los autores.
Discusión
La presencia de meconio en el líquido amniótico aparece en aproximadamente 15 % de todos los embarazos, antes, o durante el trabajo de parto. El paso temprano de meconio al líquido amniótico se ha relacionado con incremento de la morbilidad perinatal.18 Walther19 encontró que en recién nacidos con líquido meconial la saturación de oxígeno en la vena umbilical fue menor que en niños normales. Saling20 considera que la salida de meconio puede deberse a la vasoconstricción en el intestino fetal, con hiperperistalsis y relajación de los esfínteres provocadas por una hipoxia fetal. Hons21 explica la salida de meconio como consecuencia de una compresión de la médula que produzca un estímulo vagal, en tanto que para Miller,22 la salida de meconio es un acontecimiento fisiológico y solo lo relaciona con incremento de la madurez fetal. Sin embargo, otros autores lo consi-deran un signo importante y recomiendan que en su presencia sea obligada la monitorización y gasometría fetal, porque la aspiración de meconio es causa frecuente de cuadros severos de hipoxia.8,9 Es de resaltar cómo los valores de lactato, TGP y LDH fueron significativamente superiores en el grupo con presencia de meconio en el líquido amniótico, al compararlos con el grupo control. El aumento de lactato y de la actividad de LDH han sido ampliamente reportados en casos de hipoxia de diversos grados e incluso se ubican en la escala 2 y 3, respectivamente, de predictores valiosos de hipoxia, únicamente superados por la actividad de isoenzimas de creatina quinasa.23 La aspiración de líquido meconial es para muchos autores la causa principal de hipoxia,8,9 porque inhibe la acción de los surfactantes en el pulmón.24 Por todo esto, los autores de este trabajo consideran importante controlar su presencia y prestar una atención especial, así como valorar la conveniencia de mantener un seguimiento programado a los recién nacidos que presenten como posible único signo de sufrimiento fetal intrauterino, la presencia de meconio en el líquido amniótico.
Summary
Some biochemical variables that have increased in hypoxic patients were studied in a group of newborn infants with meconial amniotic fluid and with no other sign of fetal suffering. The samples were obtained at the gynecoobstetric ward of Julio Trigo Hospital. There were 14 cases in the group with meconial fluid and 51 in the control group. The studied variables: total and fetal haemoglobin, total proteins, glucose, lactate, aspartase aminotransferase and lactic dehydroginase, were determined in blood from the umbilical cord. The serum lactate concentration and the alanine aminotransferase and lactate dehydrogenase activity in the group with meconium was significantly higher than in the control group, which supports the criterium that the presence of meconium in the amniotic fluid is a sign of fetal suffering.
Subject headings: MECONIUM/metabolism; AMNIOTIC FLUID/metabolism; LACTATE DEHYDROGENASE; ALANINE TRANSAMINASE; ANOXIA, FETAL; FETAL DISTRESS; INFANT, NEWBORN.
Referencias bibliográficas
- Stave V, Wolf H. Metabolic effect in hypoxia neonatorum. Science 1980;98:132-8.
- Castro-Gago M, Rodríguez-Núñez A, Novo-Rodríguez MI, Eiris-Puñal J. Biochemical parameters predictive of neuronal damage in childhood. Rev Neurol 2001;32(12):1141-50.
- Fischer JW. Control erytropoyetin production. Biol Med 1983;173:289-90.
- Afonina LG, Tagieva TA. Serum levels of creatin kinase bb and lactate dehydrogenase isoenzymes in diagnosis of CNS perinatal lesiona in newborns. Pediatría 1987;9:33-7.
- Zanardo V.Serum glutamic oxalacetic transminase and glutamic piruvic transaminase activity in premature and full term asphyxiated newborns. Biol Neon 1985;47:61-9.
- Fonseca E, García Alonso A, Zarate A, Ochoa R, Galván RE, Jiménez S. Elevation of activity of creatine phosphokinase (CK) and its isoenzymes in the newborn is associated with fetal asphyxia and risk at birth. Clin Biochem 1995;28(1):91-5.
- Challas A. Red cells phosphate metabolism in full term neonates. Health Pediatr Act 1985;40:39-45.
- Khatura S, Serrao PR, Milano EL. Advances in management of meconium aspiration syndrome. Indian J Pediatr 2000;67(11): 837-41.
- Ohama Y, Ogawa Y. Treatment of meconium aspiration syndrome with surfactant lavage in an experimental rabbit model. Pediatr Pulmonol 1999;28(1):18-23.
- Henry RJ. Biuret method in clinical chemistry. En Harper and Row Publisher, eds, New York:1964:181-4
- OBrien D. Determination of hemoglobin. En Laboratory manual of pediatric microbiochemical technics. Herper and Row Publisher,eds, New York, 1984:167-8.
- Beckel K. Stimation os small porcentages of faetal haemoglobin. Nature 1959;148:1877-80.
- Keston AS. Specific colorimetric enzymatic analytical reagents for glucose. Abstracts of papers, 129th. Meeting ASC Dallas, Texas, 1956.
- Noll F. Enzymatic stimation of lactate, según Bergmeyer UH: Methos of enzymatic analyse. Verlag Chemie, eds, 1974: 1521-5.
- Bergmeyer UH, Holder N. Stimation of GOT activity in serum. Ann Biol Clin 1986;44:497-501.
- Bergmeyer UH, Holder N. Determination of GPT activity in blood. Ann Biol Clin 1986;44:481-9.
- Wroblensky F, Le Due S. Lactic dehydrogenase activity in blood. Proc Soc Exp Biol Med 1955;90:210-5.
- Starks GC. Correlation of meconium-stained amniotic fluid, a early intrapartum fetal pH, and apgar scores as predictors of perinatal outcome. Obst Gynecol 1980;56:604-9.
- Walter B. Diagnostic and pronostic criteria of neonatal poligraphyc after perinatal hypoxia. IV International Berlin Symposium on infant mortality. GDR, 1985.
- Saling E. Vorgehen zur untersuchung des kindes unter Gerbert. Arch Gynaekol 1962;197:108-22.
- Hons EH. The neonatal value of fetal monitoring. An J Obst Gynecol 1988;122:573-80.
- Miller FC. Significance of meconium during labor. An J Obst Gynecol 1975;124:470-3.
- Esqué M. Estudio multicéntrico sobre asfixia neonatal. Ann Esp Pediatr 1985;23:542-50.
- Almaas R, Robertson B, Linderholm B, Lundberg E, Saugstad OD, Moen A. Reversal of meconium inhibition of pulmonary surfactant by ferric chloride, copper chloride and acetic acid. Am J Respir Crit Care Med 2000;162(5):1789-94.
Recibido: 26 de abril de 2002. Aprobado: 8 de octubre de 2002.
Dr. Jorge Valdés Moreno. Jesús Peregrino No. 117 e/ Marqués González y Santiago, municipio Centro Habana. Teléfono: 8794702.