Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.22 n.2 Ciudad de la Habana jun. 2003
Universidad Autónoma Metropolitana de Iztapalapa, México
Universidad Nacional Autónoma de México
Daño al ADN y niveles de radicales libres en fibroblastos de ratones jóvenes y viejos
Dra. Norma López Díaz-Guerrero, Dra. María Concepción Gutiérrez Ruiz, Dra. Edith Cortés Barberena, Dr. Alejandro Zentella Dehesa y Dra. Mina Konigsberg Fainstein.
Resumen
Se evaluó el daño al ADN en cultivos primarios de fibroblastos de pulmón provenientes de ratones jóvenes (2 meses) y viejos (13 meses), en presencia y ausencia de un reto por estrés oxidativo y se correlacionó este daño con los niveles de las especies reactivas del oxígeno, para contribuir a la comprensión de la relación que existe entre los niveles de especies reactivas del oxígeno y el daño al genoma con el envejecimiento celular. Este es un fenómeno complejo que se ha tratado de explicar de diversas maneras, una es la teoría del envejecimiento por radicales libres, la cual propone que este fenómeno se debe a la acumulación del daño provocado por las especies reactivas del oxígeno a lo largo de la vida del organismo. Sin embargo, existen otras teorías diferentes que obvian el estrés oxidativo y tratan de explicar el envejecimiento basándose en cambios programados de la expresión de ciertos genes.
DeCS: ENVEJECIMIENTO CELULAR; DAÑO DEL ADN; ESPECIES DE OXIGENO REACTIVO; RADICALES LIBRES; ESTRÉS OXIDATIVO; FIBROBLASTOS; RATONES.
Los organismos vivos se encuentran constantemente expuestos a especies reactivas de oxígeno (ERO) por causa de agentes del medio ambiente como radiaciones, fármacos o incluso contaminación, así como también a fuentes endógenas del metabolismo celular como es la respiración mitocondrial, entre otras. Se sabe que las ERO son indispensables para mantener la homeostasis celular, para lidiar contra las infecciones1 y en los últimos años se ha evidenciado su papel en respuesta a la estimulación por factores de crecimiento que están involucrados en la regulación proliferativa.2,3 Sin embargo, si los niveles de moléculas oxidantes aumentan más que su contraparte de moléculas y sistemas enzimáticos antioxidantes, la célula se encuentra sometida a lo que se ha denominado estrés oxidativo. Como resultado de este incremento en las ERO pueden ocurrir modificaciones en las proteínas, los lípidos y el ADN. Cuando la concentración de especies oxidantes causa más daños de los que la célula puede reparar, sobreviene la muerte. Aun si existe un balance entre los oxidantes y los antioxidantes, pueden ocurrir daños puntuales que quedan sin reparar, pero que no alteran el metabolismo inmediato de las células. En el caso del ADN esto puede ser de gran relevancia porque los daños pueden acumularse y heredarse a las siguientes generaciones celulares dando lugar a genotipos alterados y células funcionalmente deficientes.4,5
Se ha reportado que, comparadas con las especies menos longevas, las más longevas poseen niveles de estrés oxidativo más bajo, que correlaciona con un menor daño6 Asimismo, existe una gran cantidad de estudios que relacionan la acumulación de mutaciones y deleciones en el ADN causadas por estrés oxidativo con el envejecimiento, el cáncer y la evolución de enfermedades de la tercera edad.4,7,8 De hecho, la teoría de Harman del envejecimiento por radicales libres9 propone que este fenómeno se debe a la acumulación del daño provocado por las ERO a lo largo de la vida del organismo. Sin embargo, existen otras teorías diferentes que obvian el estrés oxidativo y explican el envejecimiento basándose en cambios programados de la expresión de ciertos genes, que también cuentan con una gran cantidad de evidencia experimental que las apoya.10,11 Por lo que es claro que aún perdura la controversia sobre la importancia del daño oxidativo al ADN como elemento determinante para el envejecimiento celular.
De la teoría propuesta por Harman, cabe esperar que las células provenientes de animales viejos posean mayor susceptibilidad a contraer y acumular daño al ADN al ser sometidas a estrés oxidativo, que las células provenientes de animales jóvenes expuestos al mismo estrés. Es por ello que en este trabajo se evaluó el daño al ADN en cultivos primarios de fibroblastos de pulmón provenientes de ratones jóvenes (2 meses) y viejos (13 meses) en presencia y ausencia de un reto por estrés oxidativo y se correlacionó este daño con los niveles de especies reactivas de oxígeno.
Métodos
Cultivo celular
Los cultivos primarios de fibroblastos se han empleado como un buen modelo para estudios de envejecimiento,12 en este caso se decidió extraer fibroblastos de pulmón porque estos órganos se encuentran expuestos de manera constante a altas concentraciones de oxígeno. Para obtener los cultivos se utilizaron ratones hembra de la cepa CD1. Se consideraron jóvenes a los 2 meses de edad y viejos a los 13 meses. Los fibroblastos se obtuvieron siguiendo la metodología de Doyle.13 Los cultivos se mantuvieron en medio Eagle modificado por Dulbecco (DMEM) suplementado con 15 % de suero fetal bovino inactivado (Hyclone), penicilina (100 U/mL), estreptomicina (100 mg/mL) y 1 % de aminoácidos esenciales (Microlab). Las células se incubaron a 37 °C, 5 % de CO2 y 90 % de humedad, y se les cambió el medio cada tercer día. Las determinaciones se realizaron cuando las células se encontraban en fase de crecimiento logarítmico.
Reto de estrés oxidativo
Para generar estrés oxidativo en las células se empleó H2O2 porque es un agente oxidante natural y es precursor de algunos de los radicales más dañinos como el radical hidroxilo (OH·). En el caso de las células que se utilizaron para cuantificar el daño al ADN, se agregó una concentración de 0,3 mM de H2O2 por 30 min a 37 °C tanto a los cultivos provenientes de animales jóvenes como de animales viejos. Mientras que para la evaluación de los niveles de radicales libres por citometría, se agregó la misma concentración de H2O2 pero los niveles de ERO se determinaron 15 y 30 min posteriores a la adición.
Cuantificación del daño al ADN. Electroforesis unicelular alcalina (ensayo cometa)
La electroforesis unicelular alcalina (ensayo cometa) es una técnica que permite cuantificar el daño al genoma de manera independiente en cada célula de una población, mediante la detección de rompimientos de cadenas sencillas de ADN.14 Para este ensayo se sembraron 5 x 104 células/cm2 en cajas multipozo. A las 24 h se despegaron usando tripsina 0,1-EDTA, se centrifugaron y el botón se resuspendió en 40 mL de PBS. Se prepararon microgeles en portaobjetos esmerilados con 3 capas de agarosa: la primera capa fue de agarosa regular 1 %, la segunda y tercera capas fueron de agarosa de bajo punto de fusión 0,5 %. En la capa del medio se encontraban las células. Los geles se despositaron en una solución de lisis (NaCl 2,5 M, EDTA 100 mM, Tris 10 mM, NaOH 0,25 M, Tritón 1 %, DMSO 10 %, pH 10) durante 2 h a 4 °C para precipitar las proteínas. Posteriormente, se sumergieron en la solución de electroforesis alcalina (NaOH 300 mM, Na2EDTA 1 mM, pH 13) en la cual permanecieron por 20 min antes de correr la electroforesis a 300 mV y 25 mA, por 20 min. Una vez terminado el proceso, los geles se enjuagaron con solución de neutralización (Tris 0,4 M, pH 7,4) 3 veces por 5 min, se tiñeron con bromuro de etidio (0,1 g/mL) y se cuantificó el daño al ADN como la longitud de la cola del cometa medida en mm, en un analizador de imágenes Sinoptics.15 Los experimentos se realizaron por triplicado en eventos independientes, de los cuales se cuantificaron 50 cometas de cada condición experimental.
Niveles de ERO por citometría de flujo
El flouróforo DCFH2 (diacetato de diclorodihidroflouresceína) se ha utilizado ampliamente para cuantificar las ERO en cultivos celulares porque al oxidarse se restablece la estructura electrónica de la fluoresceína y fluoresce a 520 nm si se excita a 480 nm. La intensidad de la fluorescencia que se observa en presencia del fluoróforo se puede correlacionar con el contenido celular de radicales libres, incluidas las especies reactivas de oxígeno, en especial las derivadas del H2O2 como el OH·.16 Para detectar los niveles de radicales libres se sembraron 1 x 105 células/cm2 en cajas multipozo, pasadas 24 h se despegaron y se resuspendieron en 1 mL de PBS que contenía 4 mM de DCFH2. Se incubaron a temperatura ambiente y en oscuridad por 15 min para cargar a las células con el fluoróforo. Después se centrifugaron a 1 200 rpm por 5 min para eliminar el DCFH2 no incorporado y se resuspendieron en 1 mL de PBS. Inmediatamente después se cuantificó la flourescencia en un citómetro de flujo FacsCalibur (Beckton Dickinson) excitando a 480 nm y analizando la intensidad de fluorescencia a 520 nm. Los resultados se expresan en histogramas en los cuales el eje de las X representa unidades arbitrarias de fluorescencia (UAF).
Análisis estadístico
Para el análisis estadístico de los resultados obtenidos por el ensayo cometa se utilizó la prueba no paramétrica de Kruskal-Wallis seguida del análisis de varianza de Tamhane. Mientras que la prueba t de Student se usó en los experimentos de citometría. El nivel de significación en todos los casos fue de p<0,05.
Resultados
Daño al ADN. Ensayo cometa
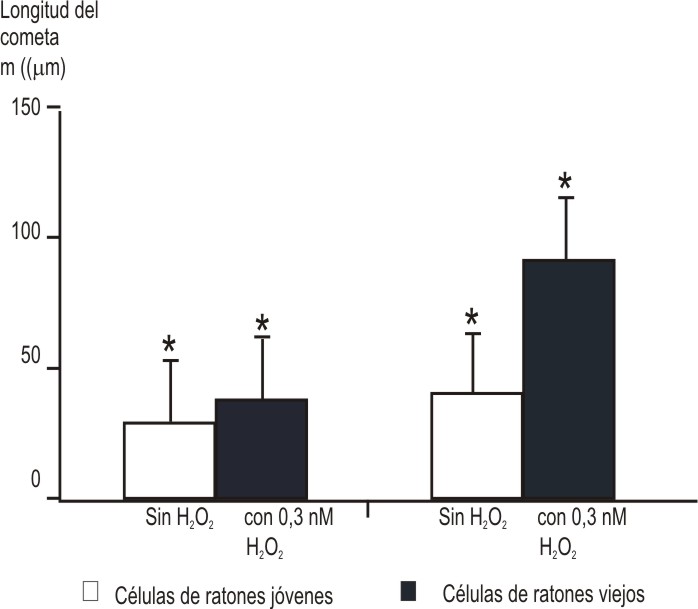
Los resultados de los ensayos cometas realizados a las células provenientes de ratones jóvenes y de ratones viejos sin el tratamiento de H2O2 muestran una diferencia estadísticamente significativa, con 30 % más de daño en las células de ratones viejos. Al tratar a las células con H2O2 se encontró que las células provenientes de animales viejos presentan 80 % más daño que el determinado en las células que provienen de animales jóvenes (fig. 1). Un punto de vista más interesante es comparar de manera independiente el daño que se produce en cada tipo celular. En el caso de las células de animales viejos se observó un incremento de 120 % en el daño causado por el peróxido, mientras que en las células de animales jóvenes el aumento fue solo de 60 %.
Fig. 1. Daño al ADN cuantificado por ensayo cometa. Las células obtenidas de ratones viejos (barras oscuras) y de ratones jóvenes (barras claras) se sometieron a un reto de estrés oxidativo con H2O2 como se indica en la metodología. El daño sobre el ADN se expresa como la longitud de la cola del cometa dado en mm. Cada barra representa el promedio del análisis de 150 células tratadas en 3 experimentos independientes.
Niveles basales de ERO
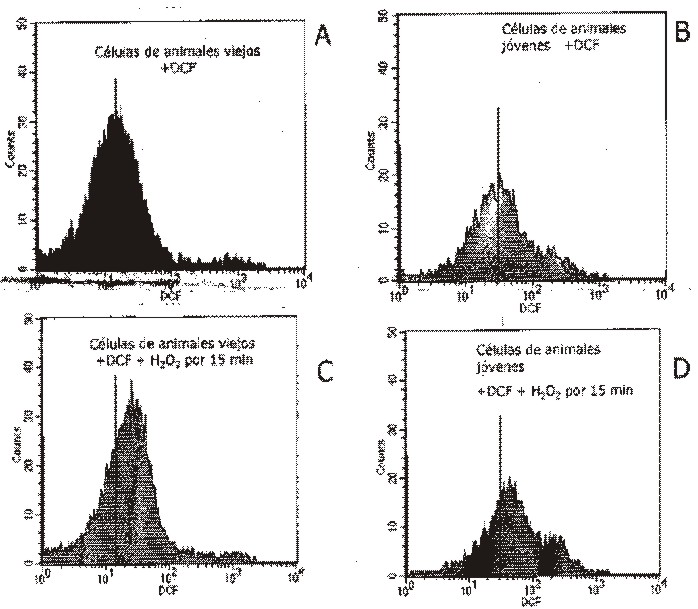
En la figura 2 se muestran los resultados de citometría de flujo. En los paneles A y B, a manera de control, se encuentran las células sin el fluoróforo, por lo que la intensidad de la fluorescencia detectada a 520 nm se debe a la autofluorescencia innata de las células. Los paneles C y D muestran a las células preincubadas únicamente con el DCFH2, sin agregar H2O2, lo que indica los niveles basales de ERO. Se observa que la curva del histograma D (células de ratones jóvenes) está más desplazada hacia la derecha que el histograma C (células de ratones viejos). Por otro lado, es evidente que los eventos en los histogramas no están distribuidos de manera homogénea en los 2 paneles. Esto es consistente en todos los experimentos realizados, donde se observa que la fluorescencia de las células provenientes de ratones jóvenes no se distribuye de igual manera que la fluorescencia de las células de los ratones viejos.
Fig. 2. Estrés oxidativo valorado con DCFH2. Los paneles de la izquierda corresponden a los histogramas obtenidos con las células provenientes de ratones viejos, mientras que los de la derecha corresponden a los histogramas de células de ratones jóvenes. En los histogramas A y B se muestran los histogramas obtenidos únicamente con el fluoróforo DCFH2. En los paneles C y D se observan los histogramas 15 min después de que se agregó el H2O2. Las líneas continuas representan la intensidad de fluorescencia (IF) de los controles sin H2O2 , lo que demuestra como se corrió la IF en las células tratadas. Las condiciones experimentales están descritas en la sección de metodología. El porcentaje de cambio en la intensidad de fluorescencia es el promedio de 4 experimentos realizados de manera independiente.
Niveles de ERO inducidos por H2O2
A los 15 min después de la adición de H2O2, se cuantificó la intensidad de la fluorescencia y se encontró un corrimiento hacia la derecha de las curvas de los histogramas E y F en relación con sus respectivos controles, C y D, debido a la adición de H2O2. El promedio del aumento de la intensidad de fluorescencia de 3 experimentos independientes, en el caso de las células de ratones viejos, corresponde a 37 %, mientras que el incremento correspondiente a las células de ratones jóvenes es de 45 %, lo cual resultó no ser estadísticamente significativo. Se cuantificó la fluorescencia a los 30 min desde la adición del peróxido, y no se encontró diferencia en los histogramas ni en la intensidad de la fluorescencia con respecto a los datos encontrados a los 15 min.
Discusión
La teoría del envejecimiento por radicales libres9 propone que los daños que se generan por acción de las ERO se acumulan a lo largo del tiempo, y que esto da lugar al deterioro conocido como envejecimiento. Los resultados de este trabajo muestran que existe un mayor daño basal en el ADN proveniente de animales viejos que en el ADN de animales jóvenes. Sin embargo, es difícil precisar el tipo específico de daño que se refleja en los ensayos cometas. Por un lado puede ser que sea el resultado de cortes o rompimientos en el ADN, o bien, que se trate de daños estructurales en la cromatina que relajan o "aflojan" la estructura general de esta. La magnitud del daño basal que se observa en las células de animales viejos, lleva a pensar que el daño que se observa pueda ser una alteración en la cromatina. Un cambio de este tipo podría modificar la transcripción del material genético y explicar el deterioro funcional que se percibe en los animales viejos como propone la teoría de Harman. Por otro lado, un daño explicado por rompimientos en la cadena de ADN de 30 %, será demasiado importante como para que una célula pudiera seguir funcionando de manera normal.
Los experimentos de citometría de flujo muestran que aparentemente existe una mayor cantidad de ERO, de manera basal, en las células provenientes de animales jóvenes que de animales viejos. Esto pudiera deberse a una mayor actividad del metabolismo celular y una cadena respiratoria funcionalmente más activa. Cuando se agregó H2O2 a los cultivos primarios, no se encontró una diferencia estadísticamente significativa en los niveles de ERO producidos por el peróxido en las células provenientes de animales y las de animales viejos. Esto sugiere que el mecanismo de destoxificación rápida para este tipo de radicales en ambos tipos celulares sea muy similar. No es posible asegurar de qué manera el estrés oxidativo está afectando al ADN y qué tipo de daño es el que se observa; sin embargo, resulta claro que los animales viejos son más susceptibles al daño por peróxido que los jóvenes. Retomando los resultados de los cometas, estos sugieren que el daño que se acumula en el genoma a lo largo del tiempo no son rompimientos directos en la cadena de ADN sino daños al nivel de la estructura de la cromatina, y se integran con los resultados obtenidos por citometría con respecto a los niveles de ERO; es posible pensar que cuando un organismo envejecido se enfrenta a un reto de estrés oxidativo, el deterioro que se manifiesta no se relaciona de manera directa con el daño preexistente en el ADN, sino con la capacidad que tiene este organismo de manejar el estrés oxidativo al que se enfrenta, y más aún, con los mecanismos de reparación con los que se cuenta para poder resarcir el daño generado por las ERO. Estos resultados coinciden con los de otros investigadores5,17,18 quienes han propuesto que más que la acumulación de daño, el fenómeno del envejecimiento está dado por una pérdida en los sistemas antioxidantes y en la capacidad reparativa de las células.
Agradecimientos
Al MSc. Manuel Castillo por su valiosa ayuda con la parte estadística. Este trabajo es apoyado por el CONACyT con el proyecto No. 400200-5-J34194-M, asimismo el citómetro de flujo forma parte del apoyo No. F282-M-9208 de CONACyT y de FOMES-98-35-28.
Summary
The ADN damage was evaluated in primary cultures of lung fibroblasts from young (2 months) and old (13 months) mice in the presence and absence of a challenge presented by oxidative stress. This damage was correlated with the levels of the reactive oxygen species to contribute to the understanding of the relation existing between the levels of reactive oxygen species and the damage caused by cellular aging to the genoma. This is a complex phenomenon that has been tried to explain by different ways. One of them is the theory of aging caused by free radicals, which proposes that this phenomenon results from the accumulation of the damage caused by the reactive oxygen species during the organism’s life. However, there are other theories that rule out the oxidative stress and try to explain aging on the basis of programmed changes occurring in the expression of certain genes.
Subject headings: CELL AGING; DNA DAMAGE; REACTIVE OXYGEN SPECIES; FREE RADICALS; OXIDATIVE STRESS; FIBROBLASTS; MICE.
Referencias bibliográficas
- Babior BM. Oxygen-dependent microbiol killing by phagocytes. N Engl J Med 1978;298:721-8
- Ryter S, Tyrrel R. Singlet molecular oxygen: A possible effector of eukaryotic gene expression. Free Rad Biol Med 1998;24:1520-34.
- Finkel T. Oxygen radicals and signaling. Curr Opin Cell Biol 1998;10:248-53.
- Bohr V, Anson RM, Mazur S, Dianov G. Oxidative DNA damage processing and changes with aging. Toxicol Lett 1998;102-103:47-52.
- Ames BM, Shigenaga MK, Hagen TM. Oxidants, antioxidants and the degenerative diseases of aging. Proc Natl Acad Sci 1993;90:7915-22.
- Barja G, Cárdenas S, Rojas C, Pérez-Campo R, López-Torrez M. Low mitochondrial free radical production per unit O2 consumption can explain the simultaneous presence of high longevity and high aerobic rate in birds. Free Rad Res 1994;21:317-28.
- Yau-Huei W. Oxidative stress and mitochondrial ADN mutations in human aging. Proc Soc Exp Biol Med 1998;217(1):53-63.
- Wiseman H, Halliwell B. Damage to ADN by reactive oxygen and nitrogen species: role in inflammatory disease and progression to cancer. Biochem J 1996;313:17-29.
- Harman D. Ageing: a theory based on free radical and radiation chemistry. J Gerontol 1956;11:298-300
- Hayflick L. Theories of biological aging. Exp Gerontol 1985;20:145-59.
- Campisi J. Aging and cancer the double-edged sword of replicative senescence. Geriatr Biosci 1997;45(4):482-8.
- Hayflick L, Moorehead PM. The serial cultivation of human diploid strains. Exp Cell Res 1961;25:585-621.
- Doyle A, Griffiths JS, Newwell DG. Cell and tissue culture: laboratory and procedures. New York:John Wiley, 1998;4B:7.
- Collins AR, Dobson VL, Dusinska M, Kennedy G, Stetina R. The comet assay: what can it really tell us?, Mutat Res 1997;375:183-93.
- Tice RR. The single cell gel/comet assay: a microgel electroforetic technique for the detection of ADN damage and repair in individual cells. Mutat Res 1994;271:243-52.
- Cathcart R, Schwiers E, Ames BN. Detection of picomole levels of hydroperoxides using a flouresent dicholorofluorescein assay. Anal Biochem 1983;134:111-6.
- Ku H, Brunk UT, Sohal R. Relationship between mitochondrial superoxide and hydrogen peroxide production and longevity of mammalian species. Free Rad Med Biol 1993;15:621-7.
- Richter C, Park JW, Ames BN. Normal oxidative damage to mitochondrial and nuclear ADN is extensive. Proc Natl Acad Sci USA 1998;85:6465-7.
Recibido: 28 de septiembre de 2001. Aprobado: 15 de diciembre de 2002.
Dra. Norma E López Guerrero. Departamento de Ciencias de la Salud, División de Ciencias Biológicas y de la Salud, UAM-Iztapalapa. A.P. 55-535. C.P 009340, México, D.F. Tel 5804 4732, Fax: 5804 4727.