Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Investigaciones Biomédicas
versão On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.23 n.1 supl.1 Ciudad de la Habana ene.-mar. 2004
Centro de Investigaciones de Energía Solar, Santiago de Cuba
Centro de Estudios de Biotecnología Industrial, Santiago de Cuba
Estudio cualitativo de relación estructura-actividad de aldehídos aromáticos, potenciales agentes antisickling
Lic. Hugo Jorge Cortina Marrero, Dr. Víctor Roberto Ferro Fernández, Lic. Humberto Joaquín Morris Quevedo, Lic. Liliana Hechavarría Difour y Lic. Luis Argel Poveda Calviño
RESUMEN
Se realizó un estudio cualitativo de relación estructura-actividad (SAR) con 27 aldehídos aromáticos de interés como potenciales agentes antisickling. Los datos de actividad: modificación de la HbA intracelular (A1) y efectos sobre la afinidad por el oxígeno (A2), se tomaron de estudios publicados en la literatura. Se emplearon descriptores mecanocuánticos determinados mediante cálculos semiempíricos (MNDO/PM3 y CNDO). Los resultados obtenidos sugieren nuevas consideraciones sobre el papel de diversos parámetros moleculares en la actividad de estos compuestos. La baja polaridad del grupo carbonilo favorece la actividad A1, así como la presencia de sustituyentes electroaceptores, disminuidores de esta polaridad. El papel de los sustituyentes y el anillo no se reduce al de moduladores de la polaridad del carbonilo. Las evidencias encontradas podrían ser útiles en trabajos de síntesis orientados a obtener compuestos con mejores perfiles de actividad antisickling.
DeCS: ANEMIA DE CELULAS FALCIFORMES/ quimioterapia; RELACION ESTRUCTURA-ACTIVIDAD.
La polimerización de la hemoglobina sicklémica (HbS) desoxigenada es la causa directa de la sicklemia o anemia por eritrocitos falciformes.1-4
Cuando se comprenden las características moleculares de los mecanismos fisiológicos y fisiopatológicos es factible imaginar la posibilidad de una estrategia preventiva y el desarrollo de medios de diagnóstico.5
Los conocimientos alcanzados sobre la patogénesis molecular y celular de la sicklemia han permitido establecer 3 aproximaciones terapéuticas:
- Inhibición química de la polimerización de la HbS.
- Reducción de la concentración de hemoglobina intracelular.
- Incremento farmacológico de la producción de hemoglobina fetal (HbF).6
La actividad de un químico sobre un organismo viviente depende de la acción física o química en los tejidos biológicos, y la naturaleza de tal acción está relacionada con la estructura molecular del químico (Tenorio E, Peña A, Pérez A, Aguila E, Sosa R, Marrero O. Desarrollo de un modelo alternativo [QSAR] teórico práctico para predecir relación estructura inmunotoxicidad de una molécula de nueva creación. En: Resúmenes del Primer Taller sobre métodos alternativos a la experimentación animal en América Latina y el Caribe. Santiago de Cuba, 4-5 Diciembre 2001:16). En la búsqueda de inhibidores del proceso de polimerización se han estudiado diversas series de compuestos,7-13 entre estos los aldehídos aromáticos.
En el contexto de estos estudios se han realizado análisis de relación estructura-actividad, que han permitido establecer vínculos entre algunos parámetros estructurales y la actividad biológica de los compuestos. No se ha logrado construir, sin embargo, un sistema completo de requerimientos estructurales que posibilite el diseño de compuestos con perfiles óptimos de actividad antisickling.
En el presente trabajo se realizó un estudio cualitativo de relación estructura-actividad (SAR) en un conjunto de 27 aldehídos aromáticos, con el interés de profundizar en la comprensión del proceso de interacción de los aldehídos con la hemoglobina intracelular, los mecanismos que determinan la actividad de estos compuestos, y el establecimiento de requerimientos estructurales que permitan obtener mejores perfiles de actividad antisickling.
MÉTODOS
Compuestos
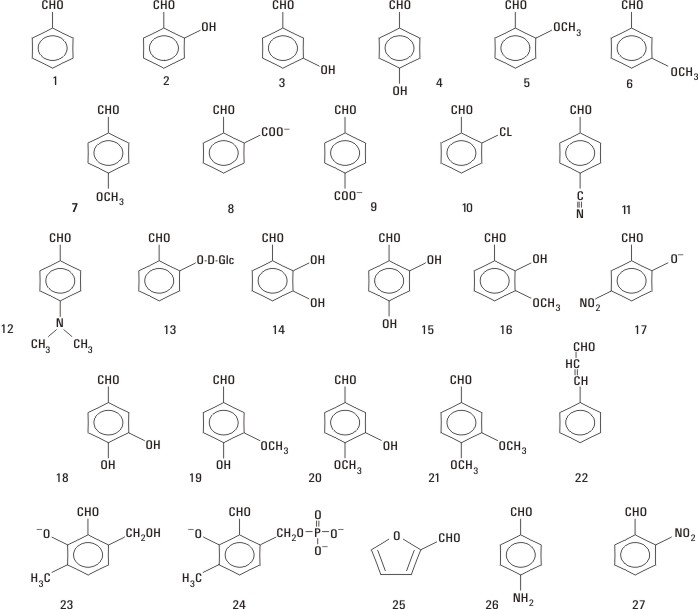
Se emplearon aldehídos aromáticos con sustituyentes de variado carácter (fig.).
Fig. Aldehídos aromáticos estudiados.
Actividad biológica
Los datos de actividad biológica considerados en el presente trabajo fueron tomados de estudios referidos en la literatura (tabla 1).8
Tabla 1. Modificación de la HbA intracelular mediante compuestos carbonílicos (A1) y efectos sobre la afinidad por el oxígeno (A2)
Compuesto | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
A1 | 60 | 45 | 60 | 30 | 55 | 65 | 25 | 15 | 20 | 90 | 90 | 0 | 10 |
| A2 | 5 | 50 | 45 | 20 | 40 | 30 | 10 | 5 | 0 | 35 | 55 | 0 | 15 |
| Compuesto | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
A1 | 40 | 70 | 55 | 0 | 30 | 50 | 30 | 50 | 30 | 20 | 0 | 75 |
| A2 | 75 | 60 | 75 | 55 | 15 | 30 | 35 | 40 | 35 | 60 | 0 | 40 |
Para los compuestos 11, 19, 26 y 27, se estableció el siguiente orden de actividad A1:12
11 > 27 > 19 > 26
La actividad A1 se define como el porcentaje de hemoglobina normal intracelular modificada por el aldehído añadido, determinado mediante focalización isoeléctrica. La actividad A2 es el porcentaje de cambio de la P50 (%DP50), en presencia de una concentración del compuesto de 3 mM.
Parámetros moleculares
Como parámetros moleculares se emplearon descriptores mecanocuánticos, determinados por medio de cálculos semiempíricos.
Se identificaron los átomos de interés siguientes: átomos del grupo carbonilo, e hidrógeno enlazado a este grupo; el átomo más positivo, el más negativo, e hidrógeno más cargado de cada sustituyente; el átomo más positivo y el más negativo del anillo y la molécula; y los átomos que más contribuyen al HOMO (high occupied molecular orbital) y al LUMO (low unoccupied molecular orbital). Como magnitudes de interés se escogieron: la carga sobre cada uno de los átomos de interés; la contribución al HOMO y al LUMO de cada uno de los átomos de interés; la distancia entre los átomos de interés; las energías de los orbitales fronteras y la diferencia entre estas: energía del HOMO (E-Ho), energía del LUMO (E-Lu), y DE = (E-Lu) - (E-Ho); la energía electrónica total (ET); y el calor de formación (DHf).
Se emplearon los formalismos semiempíricos MNDO/PM3 del programa MOPAC (versión 6.0) para la optimización de las geometrías, y determinación del calor de formación y las energías; el CNDO del programa HyperChem (versión 3) para el cálculo de las cargas; y el CNDO/s del programa NDOL (versión 3.00) para la determinación de las contribuciones atómicas.
RESULTADOS
Los resultados de los cálculos de optimización de geometría con el método semiempírico MNDO/PM3 revelaron que la mayoría de los compuestos analizados presentan alta planaridad; solo unos pocos casos presentaron desviaciones, generalmente pequeñas, del grupo carbonilo y/o los sustituyentes respecto al plano del anillo. Lo anterior indica la presencia de importantes efectos de conjugación en dichos compuestos.
Se reproducen en la tabla 2 las cargas calculadas sobre los átomos de carbono y oxígeno del grupo carbonilo, así como la distancia entre ambos átomos, especificando en cada caso el método de cálculo empleado.
Tabla 2. Cargas sobre los átomos de carbono y oxígeno del grupo carbonilo (CNDO), y distancia entre ambos átomos (MNDO/PM3)
| Compuesto | q-C[CO] | q-O[CO] | d-(C-O) | Compuesto | q-C[CO] | q-O[CO] | d-(C-O) |
| 1 | ,234 | -,228 | 1,210 | 15 | ,254 | -,265 | 1,221 |
| 2 | ,249 | -,255 | 1,220 | 16 | ,247 | -,252 | 1,219 |
| 3 | ,231 | -,224 | 1,210 | 17 | ,270 | -,312 | 1,215 |
| 4 | ,239 | -,237 | 1,211 | 18 | ,236 | -,232 | 1,211 |
| 5 | ,245 | -,237 | 1,211 | 19 | ,236 | -,233 | 1,211 |
| 6 | ,231 | -,224 | 1,210 | 20 | ,236 | -,232 | 1,211 |
| 7 | ,238 | -,236 | 1,211 | 21 | ,236 | -,233 | 1,211 |
| 8 | ,337 | -,287 | 1,217 | 22 | ,239 | -,233 | 1,211 |
| 9 | ,243 | -,277 | 1,215 | 23 | ,256 | -,258 | 1,212 |
| 10 | ,238 | -,225 | 1,210 | 25 | ,226 | -,229 | 1,210 |
| 11 | ,233 | -,223 | 1,209 | 26 | ,239 | -,239 | 1,211 |
| 12 | ,238 | -,239 | 1,211 | 27 | ,215 | -,207 | 1,208 |
| 14 | ,246 | -,250 | 1,219 | | | | |
q-C[CO]: carga sobre el átomo de carbono del grupo carbonilo, q-O[CO]: carga sobre el átomo de oxígeno del grupo carbonilo, d-(C-O): distancia entre ambos átomos.
Los coeficientes de correlación de diversos parámetros de las moléculas con las actividades A1 y A2 se muestran en la tabla 3. Aparecen reflejadas las magnitudes cuyos coeficientes de correlación con la actividad son iguales o mayores que 0,400. Los valores de los coeficientes de correlación son apreciables y similares para un amplio conjunto de magnitudes.
Tabla 3. Coeficientes de correlación calculados (se consideran todos los compuestos, excepto 13, 24, 26 y 27)
| Parámetro | A1 | A2 | Parámetro | A1 | A2 |
| q-C[CO] | -,413 | | E-Lu | -,535 | |
| |q-O[CO]| | -,575 | | DE | ,675 | |
| q-H[CO] | -,515 | | d-(C-O) | | ,433 |
| |q-A-[S1]| | -,510 | | d-(C[CO]-AIS1) | | -,599 |
| q-H[S1] | | ,584 | d-(O[CO]-AIS1) | | -,737 |
| |q-A-[S2]| | -,701 | | d-(C[CO]-AIS2) | | -,760 |
| q-A+[S2] | -,773 | | d-(O[CO]-AIS2) | | -,827 |
| q-A++ | | ,466 | d-(A(H)-A(L)) | | -,457 |
| q-A(H) | | -,539 | d-(A(H)-AIS1) | | ,702 |
| q-A+++ | -,536 | | d-(A++-AIS1) | | -,544 |
| |q-A---| | -,535 | | d-(A(H)-A--) | -,490 | |
| c-A+[S1]-Ho | ,478 | ,464 | d-(A(L)-A--) | ,448 | |
| c-A+[S1]-Lu | ,459 | | d-(A(H)-AIS2) | ,562 | |
| c-A-[S2]-Ho | | -,440 | d-(A(L)-AIS2) | | ,750 |
| c-A-[S2]-Lu | -,845 | | d-(A++-AIS2) | | ,603 |
| c-A+[S2]-Lu | -,777 | | d-(A---AIS2) | | ,746 |
| c-A++-Ho | ,454 | | |ET| | -,521 | |
| c-A----Lu | ,427 | | DHf | ,456 | |
| |E-Ho| | ,636 | | | | |
q-C[CO]: carga sobre el carbono del grupo carbonilo; |q-O[CO]|: módulo de la carga sobre el oxígeno del grupo carbonilo; q-H[CO]: carga sobre el hidrógeno enlazado al grupo carbonilo; |q-A-[S1]|: módulo de la carga sobre el átomo más negativo del sustituyente 1 (sustituyente más cercano al grupo carbonilo); q-H[S1]: carga sobre el hidrógeno más cargado del sustituyente 1; |q-A-[S2]|: módulo de la carga sobre el átomo más negativo del sustituyente 2 (sustituyente más alejado del grupo carbonilo); q-A+[S2]: carga sobre el átomo más positivo del sustituyente 2; q-A++: carga sobre el átomo más positivo del anillo; q-A(H): carga sobre el átomo que más contribuye el HOMO; q-A+++: carga sobre el átomo más positivo de la molécula; |q-A---|: módulo de la carga sobre el átomo más negativo de la molécula; c-X-Ho(Lu): contribución del átomo X al HOMO(LUMO); |E-Ho|: módulo de la energía del HOMO; E-Lu: energía del LUMO; DE = (E-Lu) – (E-Ho); d-(X-Y): distancia entre el átomo X y el átomo Y, donde AIS1 y AIS2 son los átomos enlazados al anillo de los sustituyentes 1 y 2, respectivamente.
DISCUSIÓN
En estudios SAR publicados8,11 se han logrado establecer importantes relaciones entre diversos parámetros moleculares y las actividades A1 y A2 de los compuestos aquí considerados. Ha sido planteado que la presencia de sustituyentes voluminosos dificulta por impedimentos estéricos las actividades A1 y A2 de los compuestos. El grado de ionización de las moléculas, así como la presencia de una carga neta también desfavorecen estas actividades, en virtud del efecto disociador del campo eléctrico a que se somete el aducto Hb-compuesto (en la determinación de la actividad A1), y las dificultades del compuesto para atravesar la membrana del eritrocito. Se ha establecido, además, que la polaridad del grupo carbonilo, regulada por el carácter electroaceptor, electrodonor, o neutro de los sustituyentes y el anillo, favorece la actividad A1 de los compuestos. Los anillos y sustituyentes electroaceptores favorecen dicha actividad en virtud de que acentúan la polaridad del grupo carbonilo, mientras que en ciertos casos los sustituyentes electrodonores la desfavorecen debido a su efecto atenuador de la polaridad de este grupo. Lo anterior se debe a que los aldehídos tienden a efectuar reacciones tipo base de Schiff con los grupos aminos terminales de la hemoglobina.
A pesar de constituir un importante paso de avance, los autores de este esquema lo reconocen insuficiente, en virtud de la imposibilidad de explicar a través del mismo el comportamiento de todos los aldehídos aromáticos estudiados. Una importante contribución se ha producido en años recientes debido a la realización de trabajos experimentales que han permitido profundizar en distintos aspectos de la interacción de los aldehídos con la hemoglobina.11-13
De interés resulta el hecho de que algunos de los resultados obtenidos en este trabajo se corresponden con resultados reportados, mientras que otros presentan discrepancias con resultados anteriores.
Los resultados de correlación sugieren un alto grado de complejidad del proceso de interacción de los compuestos estudiados con la hemoglobina intracelular. Esto se corresponde con resultados experimentales obtenidos por otros autores que señalan la variedad de sitios y tipos posibles de enlace, los tipos de interacciones en los distintos ambientes macromoleculares, y la significación de ambos elementos en la actividad de los compuestos, como elementos sustentadores de dicha complejidad.12,13
De forma general, se observa que los parámetros moleculares vinculados a la reactividad química de estos compuestos correlacionan mejor con la actividad A1, mientras que los vinculados a aspectos conformacionales y configuracionales correlacionan mejor con la actividad A2. Estudios experimentales han establecido que las propiedades alostéricas de los compuestos (expresados a través de A2), no dependen exclusivamente del sitio y tipo de enlace entre el compuesto y la hemoglobina, sino de la interacción general que se produzca entre ambos sistemas.12,13
Existe una discrepancia entre resultados obtenidos en el presente trabajo y un criterio reportado en estudios SAR anteriores, el cual se refiere al papel del grupo carbonilo, el anillo y los sustituyentes, en la actividad A1 de los compuestos considerados.
En estudios anteriores8,14 se refiere el aumento de la polaridad del grupo carbonilo como un elemento favorecedor de la modificación de la hemoglobina intracelular (A1). Sin embargo, el signo negativo de los coeficientes de correlación obtenidos para la relación entre la actividad A1 y los valores modulares de las cargas de los átomos de carbono y oxígeno del grupo carbonilo, sugieren una relación inversa entre la polaridad de este grupo y dicha actividad. De este modo, la baja polaridad del grupo carbonilo se presenta como un elemento favorecedor de la modificación de la hemoglobina intracelular.
Una cuestión de interés se refiere a la relación entre el carácter de los sustituyentes y la polaridad del grupo carbonilo. Se ha indicado8,14 que los sustituyentes electroaceptores aumentan la polaridad del grupo carbonilo, mientras que los electrodonores la disminuyen. Los resultados obtenidos en el presente trabajo, sin embargo, sugieren lo contrario. Los cálculos evidencian que los sustituyentes electroaceptores (por ejemplo, compuestos 10, 11 y 27), disminuyen la polaridad del grupo carbonilo, mientras que los electrodonores (por ejemplo, compuestos 2, 12 y 26), la aumentan. Correspondiendo con lo obtenido por otros autores,15 los cálculos semiempíricos realizados en este trabajo muestran un efecto electroaceptor del grupo carbonilo sobre los electrones p del anillo. Como resultado aparece una carga positiva asociada principalmente con las posiciones orto y para, lo cual corresponde con las predicciones de la teoría de resonancia en términos de estructura.
La presencia de un sustituyente electrodonor puede, a través de la entrega de electrones, disminuir la carga positiva del anillo, y así estabilizar las estructuras en las cuales el grupo carbonilo tiene su forma más polar. Un sustituyente electroaceptor provocaría un efecto contrario desestabilizando aún más estas estructuras. De este modo se explica que los sustituyentes electrodonores favorezcan la polaridad del carbonilo, mientras que los electroaceptores la desfavorecen. En correspondencia con lo dicho en párrafos anteriores es de esperar que, a través del efecto modulador de la polaridad del carbonilo, los sustituyentes electroaceptores favorezcan la actividad A1 de los compuestos, mientras que los electrodonores no. Lo anterior se corresponde con lo observado para un amplio conjunto de los compuestos considerados.8
Los resultados obtenidos sugieren que los sustituyentes y el anillo tienen un efecto más amplio que la modulación de la polaridad del grupo carbonilo. Esto puede ilustrarse con los compuestos 18, 19, 20 y 21, cuyos grupos carbonilos tienen similares polaridades, mientras que las actividades de algunos de ellos difieren significativamente. Estas consideraciones se ven apoyadas por evidencias experimentales recientes que muestran el efecto estabilizador de las interacciones de los sustituyentes con la Hb en la formación del aducto Hb-compuesto, así como el importante papel alostérico de estas interacciones.11,13
Aún cuando no agotan el problema abordado, los resultados obtenidos pudieran orientar trabajos de síntesis encaminados hacia la creación de compuestos con mejores perfiles de actividad antisickling.
Los resultados apoyan la idea de que, dentro de ciertos límites, es factible dar un cambio favorable a favor de una farmacología más predictiva con basamento en la estructura molecular de sustancias a evaluar y el cúmulo de información que sobre estructuras relacionadas se posee de forma experimental; sin menoscabar los protocolos estándar de experimentación legislados internacionalmente, pero sí como un factor a tener en cuenta alternativamente en el momento de elaborar una estrategia de evaluación de nuevos fármacos.16
AGRADECIMIENTOS
Los autores quieren reconocer la contribución del ingeniero Manuel Lores y la licenciada Grisel del Toro (Centro de Biofísica Médica) en la realización de este trabajo. También expresan su agradecimiento a la profesora Catalina Soler (Universidad de Oriente) por sus valiosos comentarios sobre el manuscrito.
Summary
A qualitative structure-activity relationship study was conducted with 27 aromatic aldehydes of interest as potential antisickling agents. The activity data: intracellular HbA modification (A1) and effects on the oxygen affinity (A2), were taken from published studies. Mechanoquantum descriptors determined by semiempyric calculations (MNDO/P3 and CNDO) were used. The results obtained suggest new considerations on the role played by diverse molecular parameters in the activity of these compounds. The low polarity of the carbonyl group favors the A1 activity, as well as the presence of substituting electroaceptors that reduce this polarity. The role of the substitutes and of the ring is not only that of modulators of the carbonyl polarity. The evidence found may be useful in synthesis works oriented to obtain compounds with better antisickling activity profiles.
Subject headings: ANEMIA, SICKLE CELL/ drug therapy; STRUCTURE-ACTIVITY RELATIONSHIP
REFERENCIAS BIBLIOGRÁFICAS
- Edelestein SJ. Sickle cell anemia. En:Bailey DM, ed. Annual reports in medical chemistry San Diego: Academic; 1985.p.247.
- Embury SH. The clinical pathophysiology of sickle cell disease. Annu Rev Med 1986;37:361-76.
- Bunn HF, Forget BG. Hemoglobin molecular genetic and clinical aspects. Philadelphia: WB Saunders, 1986.
- Eaton WA, Hofrichter J. Hemoglobin S gelation and sickle cell disease. Blood 1987;70:1245-66.
- Goldstein DJ. Biotecnología, universidad y política. Sin cristalografía de rayos X no hay biotecnología posible. México, DF: siglo xxi; 1 ed. 1989:67-109.
- Goldberg MA, Brugnara C, Dover GJ, Schapira L, Charache S, Bunn HF. Treatment of sickle cell anemia with hydroxyurea and erythropoietin. N Engl J Med 1990;323(6):366-72.
- Beddell CR, Kneen G, White RD. The anti-sickling activity of a series of aromatic aldehydes. Br J Pharmacol 1979;66:70.
- Zaugg RH, Walder JA, Klotz IM. Schiff base adducts of hemoglobin. J Biol Chem 1977;252:8542-8.
- Abraham DJ, Kennedy PE, Mehanna AS, Patwa DC, Willians FL. Design, synthesis and testing of potential antisickling agents .4. Structural-activity relationships of benzyloxy and phenoxy acids. J Med Chem 1984;27(8):967-78.
- Abraham DJ, Mehanna AS, Willians FS, Cragoe EJ Jr, Woltersdorf OW Jr. Design, synthesis and testing of potential antisickling agents .7. Ethacrynic acid analogues. J Med Chem 1989;32(11):2460-7.
- Wireko FC, Abraham DJ. X-ray diffraction study of the binding of the antisickling agent 12 C79 to human hemoglobin. Proc Natl Acad Sci USA 1991;88:2209-11.
- Abraham DJ, Safo MK, Boyiri T, Danso-Danquah RE, Kister J, Poyart C. How allosteric effectors can bind to the same protein residue and produce opposite shifts in the allosteric equilibrium. Biochemistry 1995;34:15006-20.
- Boyiri T, Safo MK, Danso-Danquah RE, Kister J, Poyart C, Abraham DJ. Bisaldehyde allosteric effectors as molecular ratchets and probes. Biochemistry 1995;34:15021-36.
- Abdala JC, Soler C, Fernández A, Álvarez E, Toro G del. Estudio de la interacción de compuestos carbonilo con hemoglobinas in vitro. Valoración de su efecto antisickling. Rev Cubana Quím 1996;8:3-10.
- Hehre WJ, Radom L, Pople JA. Molecular orbital theory of the electronic structure of organic compounds. XII. Conformations, stabilities and charges distributions in monosubstituted benzenes. J Am Chem Soc 1972;94(5):1496-504.
- Carnesoltas D, Freman M, Martínez J, González R. Perspectivas de la utilización de relaciones estructura-actividad para ensayos preclínicos. Una mirada al pasado y al futuro. Rev Cubana Invest Biomed 1999;18(1):10-1.
Recibido: 14 de septiembre de 2002. Aprobado: 15 de febrero de 2003.
Lic. Hugo Jorge Cortina Marrero. Edificio B-44, Apartamento 8, Distrito José Martí. Santiago de Cuba, CP 90 600. Cuba. Teléf: 31 618. Correo electrónico: hcortina@cies.ciges.inf.cu