Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.23 n.4 Ciudad de la Habana sep.-dic. 2004
Centro de Estudios Aplicados al Desarrollo Nuclear
Facultad de Biología, Universidad de La Habana
Efecto de la radiación gamma sobre la supervivencia y la inducción de la respuesta SOS en células de Escherichia coli deficientes en la reparación por escisión de nucleótidos y por recombinación
Lic. Eliseo Almeida, Lic. Jorge L. Fuentes, Lic. Ángel Sánchez, Lic. Sandra Carro y Lic. Enrique Prieto
Resumen
Se estudiaron los daños primarios producidos por la radiación gamma en el ADN de cepas de Escherichia coli portadoras de la fusión génica sulA::lacZ y de mutaciones en diferentes genes de reparación del ADN. Además, se determinó su radiosensibilidad. Las cepas con mutaciones en los genes recN y uvrA fueron más sensibles que la tipo salvaje. Esto concuerda con estudios previos donde se demostró que los genes rec y uvr participaban en la reparación del daño en el ADN producido por los rayos gamma. En las cepas mutantes se encontraron diferencias significativas en los niveles de expresión del gen sulA en relación con el tipo salvaje. Se discute la utilidad de las cepas estudiadas como biosensores de genotoxicidad así como en estudios de radioprotección.
Palabras clave: Radiación gamma, reparación del DNA, respuesta SOS, Escherichia coli.
En bacterias, la respuesta celular a agentes que dañan su cromosoma o bloquean su replicación se conoce como respuesta SOS. En esta respuesta de emergencia celular, son inducidos más de 20 productos génicos cuya expresión es mediada por el circuito RecA/LexA.1,2 La proteína RecA, el regulador positivo del circuito, es activada después de la interacción con las moléculas señales. La proteína LexA, el regulador negativo, es el represor transcripcional de todos los genes SOS, incluido su propio gen y el gen recA.3 Se conoce que este circuito regula y modula importantes funciones bacterianas, entre las que se encuentran: reparación del ADN, activación y modificación de proteínas y el proceso de formación del septo celular. Estas tienen como objetivo restaurar la división celular y con ello garantizar la supervivencia de la célula.4 Adicionalmente, otros fenómenos como la inducción de profagos,5 una parte importante de la mutagénesis inducida en bacteria4,6 y la mutación adaptativa,7 se encuentran bajo el control de la respuesta SOS.
Dado que la respuesta SOS está directamente implicada en los procesos mutagénicos en bacterias, los ensayos que se basan en fusiones transcripcionales en genes involucrados en esta respuesta, han sido muy utilizados como biosensores del daño genético.8-12 Estos ensayos estiman el nivel de daño primario producido en el ADN, midiendo el nivel de expresión de un gen marcador (conocido comúnmente como gen reportero); ya sea una proteína fluorescente o una enzima que en presencia del sustrato desarrolla color o bioluminiscencia. Estos ensayos han probado su utilidad en el análisis de la mutagenicidad de compuestos cromados,13 de agentes oxidantes,10 de partículas diesel en muestras de aire14,15 y de muestras de agua residuales y de consumo humano.16-20 Además, ha sido demostrado que los ensayos basados en fusiones transcripcionales en genes SOS, son excelentes biosensores del daño producido por radiaciones ionizantes.21-23
En trabajos previos (Llagostera, datos no publicados), se introdujo la fusión sulA::LacZ en la cepa AB-1157 y sus líneas mutantes, las cuales tienen defectos en la reparación por escisión de nucleótidos (uvrA-) y en la reparación por recombinación de roturas de doble cadena (recN-). Ambos mecanismos, como se conoce, están implicados en la reparación del daño en el ADN producido por radiaciones gamma.24,25 El presente trabajo tiene como objetivos, estudiar la sensibilidad de estas cepas bacterianas a la radiación gamma así como la influencia de estas mutaciones sobre el nivel de inducción de la respuesta SOS en Escherichia coli.
Métodos
Cepas bacterianas y su cultivo
Para este estudio, fueron utilizadas cepas de Escherichia coli AB-1157 portadoras de la fusión transcripcional sulA::lacZ y de las mutaciones recN y uvrA (tabla 1). El medio de cultivo utilizado fue Luria-Bertani,26 suplementado con 100 mg/mL de ampicilina en el caso de cepas resistentes al antibiótico. Los cultivos se dejaron crecer durante toda la noche a 100 rpm, 37 ºC; posteriormente fueron diluidos en medio fresco (1/25) e incubados a igual temperatura y agitación, hasta una absorbancia A600nm de 0,4.
Tabla 1. Cepas bacterianas utilizadas en el estudio
| Cepa | Características relevantes | Fuente |
| AB1157 | pro-, arg-, his-, leu-, ade+, TetS, AmpS | B. Bachmann |
| UA4865 | AB1157/sulA::lacZ, AmpR | M. Llagostera |
| UA4867 | AB1157/recN262, sulA::lacZ, AmpR | M. Llagostera |
| UA4868 | AB1157/uvrA6, sulA::lacZ, AmpR | M. Llagostera |
Irradiación gamma
La irradiación se realizó en una fuente de 60Co, modelo PX-g-30M. Las células fueron irradiadas a diferentes dosis, a una temperatura de 2 ± 0,5 ºC. El valor de la tasa de dosis fue de 58,42 Gy/min, calculada con el dosímetro Fricke.27
Curvas de supervivencia celular
El cultivo celular crecido hasta una A600nm de 0,4 fue centrifugado a 4 000 rpm, suspendido en buffer fosfato (0,2 M Na2HPO4 x 2H2O/NaH2PO4) a una concentración de 2 x 108 células/mL y posteriormente distribuido en viales de irradiación. Las dosis aplicadas estuvieron en un rango entre 100-800 Gy. Las suspensiones irradiadas fueron diluidas en suero fisiológico (0,85 % NaCl), en rangos que fueron ajustados experimentalmente para cada dosis. Por último, 0,1 mL de las diluciones fueron sembrados en medio Luria-Bertani para ser contadas, a las 48 h, las unidades formadoras de colonias por dosis de radiación.
Ensayo SOS
El procedimiento empleado fue una modificación de los propuestos por Miller28 y Quillardet y otros.8 El cultivo celular crecido hasta una A600nm de 0,4, fue diluido (1/20), distribuido en viales estériles e irradiados a diferentes dosis. De las suspensiones irradiadas y posteriormente cultivadas durante 120 min a 37 ºC se separaron muestras para conocer su absorbancia A600nm. El test colorimétrico se desarrolló distribuyendo 0,15 mL del cultivo bacteriano en tubos que contenían 1,3 mL de buffer Z (60 mM Na2HPO4, 40 mM NaH2PO4, 10 mM KCl, 1 mM Mg2SO4, 0,1 % de SDS y 40 mM b-mercaptoetanol, pH 7), las muestras se incubaron durante 20 min a 30 ºC, posteriormente se añadieron 0,3 mL de ONPG (Orto-nitrofenil-b-D-galactopiranósido) a una concentración de 4 mg/mL en buffer T (1M TRIS-HCl, pH 8), y se incubó 40 min a 25 ºC. La reacción se detuvo con 0,65 mL de una solución 1 M de Na2CO3. Las lecturas de A420, A550 y A600nm se realizaron en un espectrofotómetro ULTROS PEC II (LKB). La actividad específica b-galactosidasa (AE), fue calculada según la fórmula de Miller.28
Análisis estadístico
Fueron calculados los valores medios de porcentaje de supervivencia y de AE y sus desviaciones estándar para cada tratamiento (dosis de radiación), mediante una prueba de Kolmogorov-Smirnov y posteriormente se comprobó la homogeneidad de varianza de los datos por medio de una prueba de F máxima. Para cada cepa, los valores medios obtenidos fueron comparados, respecto al control (UA4865), utilizando una prueba t de Student (Sigarroa A., 1987 Programa TONYSTAT. Facultad de Biología, Universidad de la Habana, Cuba).29
Resultados
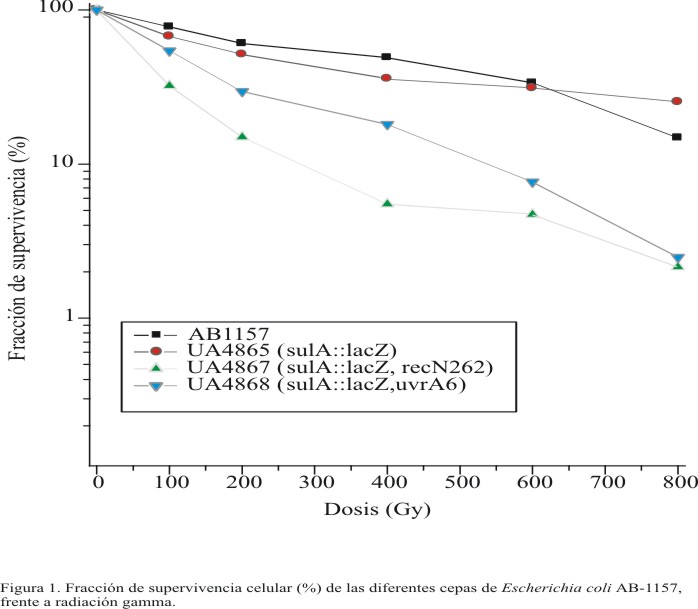
En el presente estudio, la fracción de supervivencia celular fue utilizada como una medida de la toxicidad de la radiación gamma sobre Escherichia coli. En la figura se muestran las curvas de radiosensibilidad de las 4 cepas estudiadas. Los valores de DL50 para las cepas AB-1157, UA-4865, UA-4867 y UA-4868 fueron de 400, 200, 80 y 125 Gy. Este estimador demostró que la cepa UA-4867, deficiente en la reparación de roturas de doble cadena, es la más sensible. En general, se pudo constatar que la sensibilidad a la radiación gamma de las cepas defectivas en mecanismos de reparación del ADN resultó mayor que la obtenida en las cepas AB-1157 y UA-4865. Adicionalmente, la cepa UA-4865 mostró mayor sensibilidad a este tipo de mutágeno que la cepa salvaje AB-1157.
Fig. Fracción de supervivencia celular (%) de las diferentes cepas de Escherichia coli AB-1157, frente a radiación gamma.
Las diferencias en los valores de fracción de supervivencia, encontradas para la cepa UA-4867 respecto a la cepa UA-4865, fueron significativas para todas las dosis de radiación gamma aplicadas. Por el contrario, para la cepa UA-4868 solo fueron significativas a partir de 200 Gy.
En el presente estudio además se midió la inducción de respuesta SOS en las diferentes cepas de Escherichia coli derivadas de AB-1157 (tabla 2). El nivel de inducción de la fusión sulA::lacZ en la cepa UA-4865 (cepa control), tanto espontáneo como el ocasionado por el tratamiento con radiación gamma, resultó inferior a aquellos obtenidos en las cepas UA-4867 y UA-4868. Las diferencias en el nivel de inducción espontáneo fueron significativas solamente en la cepa UA-4868. Esto sugiere, que en cepas deficientes en la reparación por escisión de nucleótidos, está sobre-expresado el gen sulA.
| Cepas | Dosis (Gy) | |||||||||||||
| 0 | 100 | 150 | 200 | 400 | 600 | |||||||||
| UA-4865 | 335 ± 101(24) | 433 ± 170 (24) | 528 ± 302 (24) | 496 ± 205 (24) | 646 ± 249 (24) | 657 ± 83 (9) | ||||||||
| UA-4867 | 393 ± 161 (9) ns | 645 ± 141 (9) ** | 677 ± 257 (9) ns | 619 ± 225 (9) ns | 882 ± 140 (9) ** | 969 ± 296 (9) * | ||||||||
| UA-4868 | 498 ± 93 (9) *** | 655 ± 83 (9) *** | 765 ± 136 (9) ** | 791 ± 200 (9) ** | 898 ± 153 (9) ** | 897 ± 189 (9) ** | ||||||||
Los valores dentro del paréntesis son el número de réplicas utilizadas. (*, **, ***) significativo, respecto a la cepa control (UA-4865), para 95, 99 y 99,9 % de confidencia, respectivamente.
Adicionalmente, el nivel inducido de sulA producto de la radiación gamma fue superior en la cepa UA-4868. Este fue significativo para todas las dosis estudiadas, lo que no ocurrió en la cepa UA-4867.
Discusión
Los cambios genéticos operados en las cepas empleadas modifican su sensibilidad a las radiaciones gamma; idea sostenida por evidencias adicionales encontradas en otros estudios donde se utilizan cepas de Escherichia coli con diferente base genética a la aquí empleada (Fuentes y otros, en imprenta).
Las roturas de doble cadena en la hélice producidas por la radiación gamma son determinantes en la muerte celular.30,31 Se ha encontrado (Moreno y otros, en imprenta), que la radiación gamma induce preferentemente lesiones potencialmente recombinogénicas en Saccharomyces serevisiae, siendo los resultados aquí presentados una evidencia adicional de la importancia de la reparación de este tipo de daño en el ADN para la viabilidad celular.
Diferentes trabajos han demostrado que tanto los mecanismos de escisión de bases y de nucleótidos como los de recombinación, están involucrados en la reparación del daño producido por radiación gamma.24,25,32-34 A juzgar por los resultados del presente trabajo (específicamente los obtenidos con UA4867), la reparación de roturas de doble cadena, en términos de supervivencia, es la más importante en Escherichia coli.
Si se considera que las células con deficiencias en un mecanismo de reparación general, como es la escisión de nucleótidos, requieren de determinados niveles de inducción de mecanismos alternativos que le permitan suplir esa deficiencia, es lógico esperar un nivel de inducción SOS como el obtenido con la cepa UA4868. Por esta razón se debe expresar un mayor nivel de la proteína SulA, para evitar que la célula sea dividida sin que se haya reparado su ADN. Este mismo fenómeno (menos marcado) se distingue también en la inducción del mutante recN (cepa UA-4867).
La utilización de cepas con deficiencias en mecanismos de reparación para el desarrollo de diferentes ensayos bacterianos de evaluación mutagénica, ha sido una práctica común.35 Además, estos ensayos pueden ser de especial utilidad para definir el carácter desmutagénico o bioantimutagénico de protectores del ADN (Fuentes y otros, en preparación). Los resultados aquí obtenidos evidencian que los ensayos de genotoxicidad basados en fusiones transcripcionales de genes SOS, en cepas deficientes en mecanismos de reparación, pueden resultar biosensores del daño en el ADN muy sensibles. Tanto la cepa UA-4867 como la UA-4868 detectaron niveles superiores de daño en el ADN inducido por radiación gamma; aunque estos no fueron significativos para todas las dosis en el caso de UA-4867. Serán necesarios estudios futuros para demostrar la utilidad de estas cepas en la búsqueda de antimutágenos.
A modo de conclusión se puede plantear lo siguiente:
Agradecimientos
A la doctora M. Llagostera por suministrar las cepas bacterianas utilizadas en este trabajo. Esta investigación fue financiada por la Agencia Nuclear del Ministerio de Ciencia, Tecnología y Medio Ambiente de Cuba, mediante el proyecto PNA/8/CEADEN.
Summary
The primary damages produced by the gamma radiation in the DNA of Escherichia coli strains carriers of the sulA::lacZ genic fusion and of mutations in different DNA repair genes were studied. Its radiosensititvity was also determined. The strains with mutations in the recN and uvrA genes were more sensitive than the wild type. This agrees with previous studies where it was proved that the rec and uvr genes take part in the repair of the DNA damage produced by the gamma rays. In the mutant strains, there were found significant differences at the level of expression of the sulA gene in relation to the wild type. The usefulness of the strains studied as genotoxicity biosensors and in radioprotection studies was discussed.
Key words: Gamma radiation; DNA repair; SOS response; Escherichia coli.
Referencias bibliográficas
- Little JW, Mount DW. The SOS regulatory system of Escherichia coli. Cell 1982;29:11-22.
- Lewis LK, Jenkins ME, Mount DW. Isolation of DNA damage-inducible promoters in Escherichia coli: regulation of polB (dinA), dinG, and dinH by lexA represor. J Bacteriol 1992;174:3377-85.
- Aksenov SV, Krasavin EA, Litvin AA. Mathematical model of the SOS response regulation of an excision repair deficient mutant of Escherichia coli after ultraviolet light irradiation. J Theor Biol 1997;186:251-60.
- Echols H, Goodman MF. Mutation induced by DNA damage: a many protein affair. Mutat Res 1990;236:301-11.
- Little JW. Auto-digestion of LexA and phage T7 repressors. Proc Natl Acad Sci USA 1984;81:1375-9.
- Urios A, Herrera G, Blanco M. Detection of oxidative mutagens in strains of Escherichia coli deficient in the OxyR or Mut Y functions: dependence on SOS mutagenesis. Mutat Res 1995;332:9-15.
- McKenzie GJ, Harris RS, Lee PL., Rosenberg SM. The SOS response regulates adaptive mutation. Proc Natl Acad Sci USA. 2000;97:6646-51.
- Quillardet P, Huisman O, D'Ari R, Hofnung M. SOS Chromotest, a direct assay of induction of an SOS funtion in Escherichia coli K-12 to measure genotoxicity. Proc Natl Acad Sci USA 1982;79:5971-5.
- Oda Y, Nakamura S, Oki I, Kato T, Shinagawa H. Evaluation of the new system (umu-test) for the detection of environmental mutagens and carcinogens. Mutat Res 1985;147:219-29.
- Nunoshiba T, Nishioka H. Rec-lac test for detecting SOS-inducing activity of environmental genotoxic substances. Mutat Res 1991;254:71-7.
- Vollmer AC, Belkin S, Smulski DR, Van Dyk TK, LaRossa RA. Detection of DNA damage by use of Escherichia coli carrying recA::lux, uvrA::lux, or alkA::lux reporter plasmids. Applied Environm Microbiol 1997;63:2566-71.
- Gu MB, Min J, La Rossa RA. Bacterial bioluminescent emission from recombinant Escherichia coli harboring a recA::luxCDABE fusión. J Biochem Biophys Methods 2000;45:45-56.
- Llagostera M, Garrido S, Guerrero R, Barbé J. Inducction of SOS genes of Escherichia coli by chromium compounds. Environmental Mutagenesis 1986;8:571-7.
- Claxton LD, Douglas G, Krewski D, Lewtas J, Matsachita H, Rosenkranz H. Overview, conclusions and recommendations of the IPCS collaborative study on complex mixtures. Mutat Res 1992;276:61-80.
- Nylund L, Hakala E, Sorsa M. Application of a semi-automated SOS chromotest for measuring genotoxicities of complex environmental mixtures containing polycyclic aromatic hydrocarbons. Mutat Res 1992;276:125-32.
- Llagostera M, Garrido S, Gibert I, Guerrero R, Barbé J, Rivera J, Espadaler I, Caixach J, Ventura F. Identification of organic pollutants in the Llobregat river and determination of genotoxicity. Rev Toxicol 1989;6:201-8.
- Le Curiex F, Giller S, Gauthier L, Erb F, Marzin D. Study of the genotoxic activity of six halogenated acetonitriles, using the SOS chromotest, The Ames-fluctuation test and the newt micronucleus test. Mutat Res 1995a;341:289-302.
- Le Curieux F, Gauthre L, Erb F, Marzin D. Use the SOS chromotest, the Ames-fluctuation test and the newt micronucleus test to study the genotoxicity of 4-trihalometanos. Mutagenesis 1995b;10:333-41.
- Le Curieux F, Marzin D, Erb F. Study of the genotoxic activity of five chlorinated propanones using the SOS chromotest, the Ames-fluctuation test and the newt micronucleus test. Mutat Res 1994;341:1-15.
- White PA, Rasmussen JB. The genotoxic hazards of domestic wastes in surface waters. Mutat Res 1998;410:223-36.
- Kozubek S, Ogievetskaya MM, Krasavin EA, Drasil V, Soska J. Investigation of the SOS response of Escherichia coli after g-irradiation by means of the SOS Chromotest. Mutat Res 1990;230:1-7.
- Fuentes JL, Ferrer M, Almeida E, Prieto E, Llagostera M. Inducción de los genes recA, umuC y sulA de Escherichia coli por irradiación gamma. Rev Toxicol 1998;15:114-6.
- Fuentes JL, Padrón E, Del Sol R, Almeida E, Prieto E, Pérez N, Martín G, Llagostera M. Induction of SOS response in Escherichia coli cells with gamma rays. Nucleus 1996;21:11-6.
- Picksley SM, Attfield PV, Lloyd RG. Repair of DNA double-strand breaks in Escherichia coli K12 requires a funtional recN product. Mol Gen Genet 1984;195:267-74.
- Nabben FJ, Lafleur MVM Sikkers JCM, Loman AC, Retel J, Loman H. Repair of damage in duble-stranded FX174 (RF) DNA due to radiation-induced water radicals. Int J Radiat Biol 1984;45:379-88.
- Maniatis T, Fritsch EF, Sambrook J. Molecular cloning. New York:Cold Spring Harbor Laboratory. 1982.
- Prieto E, Cañet F. Aspectos a considerar en el dosímetro Fricke. Tecnología Química . Año XI. No 2. 1990; p 19.
- Miller J. Experiments in molecular genetics. New York:Cold Spring Harbor Laboratory. 1972.
- Sigarroa A. Biometría y Diseño Experimental. La Habana:Editorial Pueblo y Educación. 1985.
- Demple B, Harrison L. Repair of oxidative damage to DNA: enzymology and biology. Annu Rev Biochem 1994;63:915-48.
- Daralhon M, Nohturfft A, Meniel V, Averbeck D. Repair of DNA double-strand breaks in Saccharomyces cerevisiae using g-ray doses-rates: a pulsed-field gel electrophoresis analysis. Int J Radiat Biol 1994;65:307-14.
- Wallace SS. DNA damage processed by base excision repair:biological consequences. Int J Radiat 1994;66:587-9.
- Jaruga P, Dizdaroglu M. Repair of productos of oxidative DNA base damage in human cells. Nucleic Acid Research 1996;24:1389-94.
- Braun EFJ, Handayani WA, Westmijze JE, Wientjes MN, Wijker AC, Lafleur MMV, et al. Influence of nucleotide excision repair of Escherichia coli on radiation-induced mutagenesis of double-stranded M13 DNA. Mut Res 1997;384:45-53.
- Josephy PD, Gruz P, Nohmi T. Recent advances in the construction of bacterial genotoxicity assays. Mutat Res 1997;386:1-23.
Recibido: 22 de octubre de 2004. Aprobado: 19 de julio de 2004.
Lic. Eliseo Almeida. Centro de Estudios Aplicados al Desarrollo Nuclear. AP 6122. Calle 30 No.502, esq. 5ta Ave, Playa, C. Habana, Cuba. Correo electrónico: fuentes@ceaden.edu.cu Fax: (53-7) 241188