Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.24 n.2 Ciudad de la Habana abr.-jun. 2005
Instituto Superior de Ciencias Médicas Carlos J. Finlay
Centro de Inmunología y Productos Biológicos
Plasma equino como sustituto del plasma humano en la identificación del Staphylococcus aureus en los laboratorios de microbiología
Dr. Oscar Hernández Betancourt, Dr. Douglas del Río Méndez, Dra. Blanca R. Santana Guerra, Dra. Yadira Falcón Almeida, Dra. Imilla Casado Hernández y Dra. María del Carmen Galdós
Resumen
Se evaluaron varios plasmas de diferentes especies y se trabajó un total de 106 cepas, por los problemas éticos que impone este plasma, así como la baja sensibilidad en la identificación de cepas de Staphylococcus aureus. Esta se realiza en los laboratorios microbiológicos de la red hospitalaria nacional con plasma de origen humano. Se estudió el efecto de la dilución, del tiempo de incubación, así como la influencia del sexo en la identificación de las cepas positivas (índice de positividad). Se determinaron las condiciones óptimas de trabajo, las cuales no difirieron significativamente de los resultados obtenidos con el plasma de conejo. El plasma humano mostró ser poco efectivo en la identificación de cepas positivas (57,5 %), revelando diferencias significativas con el plasma de conejo y del equino (95,3 y 94,3 %, respectivamente). Los resultados aquí obtenidos sugieren la sustitución del plasma humano por el plasma equino en los laboratorios microbiológicos para la identificación de este microorganismo patógeno. Este plasma mostró ser estable a - 20 ºC por un período de 12 meses.
Palabras clave: Staphylococcus aureus, plasma, coagulasa.
El género Staphylococcus perteneciente a la familia Micrococceae está formado por alrededor de 30 especies, muchas de las cuales son patógenas para el hombre.1,2 Entre las más importantes se encuentran S. aureus, S. epidermidis y S. saprophyticus. Estos microorganismos pueden causar enfermedades tanto por su capacidad de multiplicación y extensión en los tejidos, como por la producción de sustancias extracelulares que interaccionan con receptores específicos que se encuentran en la superficie celular.3,4
La propiedad de coagular el plasma descalcificado se conoce como reacción coagulasa positiva5,6 y es típica del Staphylococcus aureus, debido a la producción de una enzima denominada coagulasa libre (estafilocoagulasa), la mayoría de las demás especies del género no tienen la capacidad de producirla y son conocidas como coagulasa negativa,3,6,7 por lo que usualmente no son patógenas para los animales y el hombre. Se ha determinado que existe una correlación positiva entre la virulencia en el humano y la producción de la estafilocoagulasa.8
Recién se han identificado factores que intervienen en los mecanismos de la coagulación como son la proteína A de unión a la fibronectina (fnbA), factor de unión a la proteína A clumping factor (clfA), y el factor de unión al fibrinógeno extracelular (Efb), todos asociados a la patogenicidad de este.9-11
La prueba más importante que se realiza para su identificación lo constituye la prueba de la coagulasa, la cual es muy práctica y sencilla de realizar en los laboratorios microbiológicos. El diagnóstico de este microorganismo ha evolucionado marcadamente y varios son los métodos que pueden realizarse para tales fines como son: el ensayo de la coagulasa en tubo, ensayo en lámina, el ensayo de la nucleasa termoestable, el empleo de látex, y por último, el desarrollo de sistemas inmunoenzimáticos (ELISA).3,9,11-16
En los laboratorios microbiológicos de las entidades de salud cubana se utiliza de forma rutinaria el plasma humano para realizar esta técnica, a pesar de las limitaciones éticas que este producto presenta, así como el desvío del producto destinado a las transfusiones de pacientes necesitados. La literatura revisada indica que el plasma de conejo brinda los mejores índices en la detección del patógeno cuando se compara con otros plasmas animales. Dada las limitaciones en la obtención de grandes volúmenes, necesarios para suplir las demandas de los laboratorios de la región centro oriental de Cuba con plasma de esta especie, así como la discrepancia encontrada en la literatura sobre la efectividad del plasma equino, los autores de este estudio se propusieron definir mediante un estudio estadístico la existencia de diferencias significativas entre el plasma equino y de conejo en la identificación de cepas de S. aureus, empleando la técnica de la coagulasa en tubo. Los resultados de la comparación de los plasmas obtenidos de diversas especies evidenciaron la calidad del plasma equino. Se determinaron las condiciones óptimas de trabajo para este plasma, las cuales no difieren significativamente (p< 0,05) en relación con los resultados obtenidos en el plasma de conejo. El plasma humano mostró ser poco sensible en la identificación de cepas positivas, difiriendo significativamente del plasma de conejo y del equino. Los resultados aquí obtenidos permiten proponer el plasma equino como sustituto del plasma humano usualmente utilizado en los laboratorios microbiológicos.
Métodos
Obtención del plasma
Los plasmas de las diferentes especies animales se obtuvieron bajo condiciones experimentales en la Unidad de Producción de Biológicos (única de su tipo en el sector de la salud en el país) perteneciente al Centro de Inmunología y Biológicos (CENIPBI) del Instituto Superior de Ciencias Médicas (ISCM) de Camagüey.
Las especies estudiadas fueron el ovino, el bovino y el equino, las cuales fueron comparadas con el plasma humano por ser el más empleado en los laboratorios de microbiología. Se comparó además con el plasma de conejo, por ser la especie recomendada en la literatura. La sangre extraída se colectó en frascos estériles de cristal de 200 mL. Se dejaron en reposo por 24 h a 4 ºC, el plasma se obtuvo por sedimentación y fue traspasado a frascos estériles para su conservación a - 20 ºC hasta la realización de la prueba.
Cepas utilizadas
Se trabajó con un total de 106 muestras de cepas positivas aisladas de pacientes adultos y niños hospitalizados y de consultas externas. Se utilizó como control la cepa de referencia del Staphylococcus aureus ATCC 25923, donada por el Centro de Ingeniería Genética y Biotecnología (CIGB) de Camagüey, así como controles negativos y positivos donados por el Hospital Provincial "Manuel Ascunce Domenech".
Prueba de la coagulasa
El medio de cultivo empleado para la prueba de la coagulasa en tubo fue el caldo corazón. El agar nutriente se utilizó para el traslado y mantenimiento de las cepas. La prueba de la coagulasa se realizó inoculando y homogeneizando bien una asada del cultivo en el tubo que contenía el medio.17 Una vez inoculados todos los tubos se agregó el plasma a las diluciones en estudio y se incubaron a 37 ºC. El ensayo es positivo si se forma un coágulo compacto que comprometa 3/4 del volumen de plasma que contiene el tubo o más.18
Tiempo de reacción y diluciones de trabajo
Las lecturas se llevaron a cabo a las 2, 4, y 24 h. Se realizaron inclinando el tubo de ensayo ligeramente para observar la presencia o no del coágulo. Se plantearon 4 diluciones, 1:2, 1:4, 1:8, 1:10. Se utilizó como diluente la solución salina a 0,9 %.
Estudio de la influencia del sexo sobre el índice de positividad
Se empleó el ensayo de la coagulasa en tubo descrito con anterioridad para este estudio. El número de muestras fue de n= 30 y para la selección de los casos positivos se siguió el criterio de clasificación del coágulo, antes mencionado. El plasma animal seleccionado para este ensayo fue el equino, y se trabajó con la dilución 1/4.
Estabilidad del plasma
Las pruebas de estabilidad se realizaron por el método conocido como ensayo a tiempo real. La variable seleccionada para el estudio fue la coagulación del plasma medida mediante el ensayo en tubo. La actividad biológica se midió por la capacidad de los factores plasmáticos de permitir la coagulación mediada por la estafilocoagulasa, a 2 temperaturas mencionadas anteriormente. Se utilizaron la cepa de referencia (ATCC 25923) y los respectivos controles negativos y positivos de Staphylococcus aureus (4 cepas de cada uno). La dilución ensayada en este estudio fue 1/4. Las pruebas se llevaron a cabo a 4 ºC y a - 20 ºC y fueron realizadas a 3 lotes del plasma equino. Los ensayos se llevaron a cabo en los meses 0, 1, 2, 3, 6, 9 y 12 según la literatura consultada. 19,20
Análisis estadístico
Se utilizó el paquete estadístico Systat versión 5.0 del 92.
La estadística no paramétrica fue empleada en el estudio, dada la falta de supuestos para la conformación de una prueba paramétrica. La tabla de contingencia de 2 x 2 y la prueba de X2 fue empleada para el procesamiento de los datos, según Sigarroa.21
Resultados
Comparación de los diferentes plasmas de origen animal
Con el objetivo de evaluar el efecto de cada plasma animal sobre el índice de casos positivos, se comparó un total de 5 plasmas de especies diferentes, tomando como referencia el de conejo, dado lo planteado en la literatura revisada, donde se recomienda su uso por su rápida formación de un coágulo firme en el plasma en relación con otros.
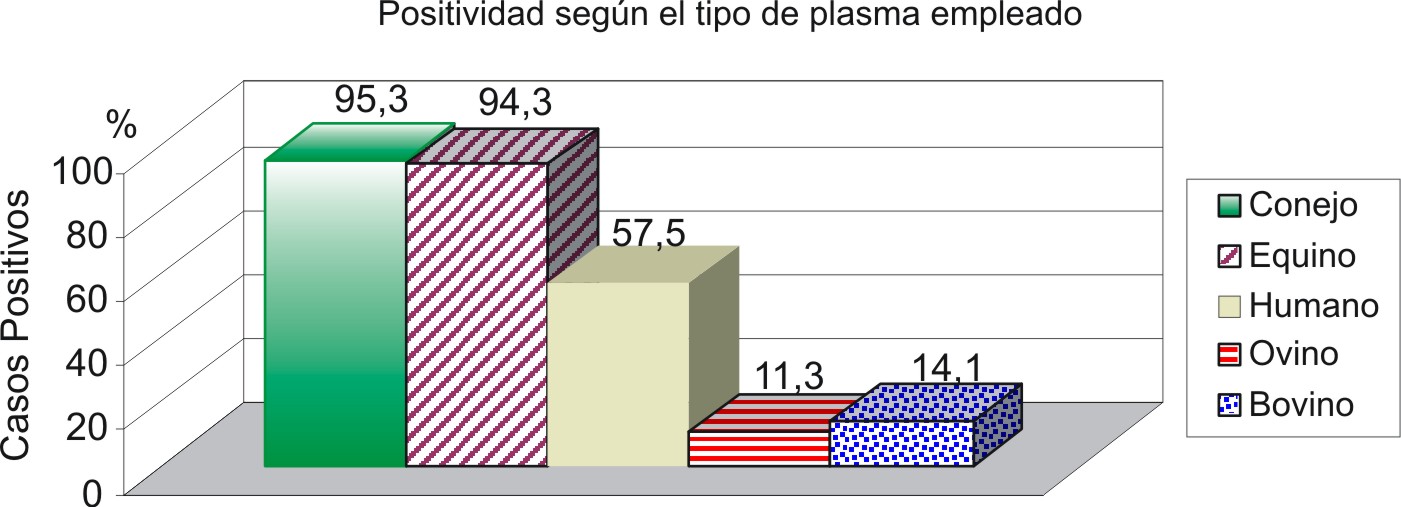
En la figura 1 se muestra una comparación entre todos los plasmas utilizados en el ensayo basada en la identificación de los casos positivos (n= 106) a las 24 h, tomando como dilución 1/4. Como se observa, los plasmas con mejores resultados en la identificación de casos de S. aureus coagulasa positivo fueron el de conejo y el equino (95,3 y 94,3 %, respectivamente), no existiendo diferencias significativas para p< 0,05. Por el contrario existieron diferencias significativas entre estos 2 plasmas y el plasma humano (p= 1,09*10-9) donde se identificaron solo 61 casos positivos para 57,5 %.
Fig. 1. Comparación del índice de positividad obtenido mediante el uso de plasmas de origen animal a las 24 h y con la dilución ¼. El dato sobre la barra esta expresado en porcentaje.
Relación del sexo con el índice de positividad
Fue de interés conocer si el sexo influye sobre el índice de positividad en la identificación de cepas positivas de S. aureus, para lo cual se diseñó un experimento donde se compararon los plasmas obtenidos de los 2 sexos equinos. El estudio realizado con 30 cepas procedentes del hospital provincial, no reveló diferencias significativas entre ambos plasmas (p= 1) para una p< 0,05.
Evaluación del efecto de la dilución en la identificación de cepas positivas
Existen diferentes criterios sobre la dilución óptima del plasma empleada para el ensayo en tubo, donde las sugerencias van desde el uso del plasma puro, hasta la utilización de una dilución de 1/10. Los resultados obtenidos muestran que esta variable afecta el índice de positividad en mayor o menor grado, en dependencia de las especies. (figs. 2 A y B).
Fig. 2. Efecto de la dilución sobre el índice de positividad de cada plasma en estudio a las 4 h (A) y a las 24 h (B).
La dilución afectó notablemente la cuantificación de los casos positivos, disminuyendo este índice en la medida que aumentó esta.
Efecto del tiempo de incubación
Objetivo de este trabajo fue evaluar el efecto del tiempo de incubación sobre la identificación de casos positivos, con el fin de proponer un instructivo o prospecto de trabajo en los laboratorios microbiológicos. Para todos los plasmas ensayados existió una correlación positiva del tiempo de incubación con los casos positivos identificados (fig. 3).
Fig. 3. Efecto del tiempo de incubación sobre el índice de positividad de los plasmas humano, equino y de conejo. Sobre la barra se muestra el porcentaje de casos positivos identificados.
Estabilidad
Los ensayos realizados a la temperatura de 4 ºC fueron suspendidos en el mes 1, dada la inestabilidad mostrada por el producto desde el inicio (mes 0), observándose patrones de coagulación incongruentes entre las cepas seleccionadas. En cambio, el producto almacenado a - 20 ºC, se mantuvo estable, no afectándose el índice de positividad (tabla). Las cepas positivas y de referencia reaccionaron formando un coágulo en el plasma en 100 % de los casos, durante los 12 meses analizados. Lo contrario ocurrió con las 4 cepas negativas empleadas, donde no se observó el efecto de la estafilocoagulasa.
Tabla. Ensayo de estabilidad a tiempo real realizada al plasma equino en una dilución de 1/4. Estudio de 12 meses. Se muestran los porcentajes de reacciones coagulasas positivos en cada mes
| 0 | 1 | 2 | 3 | 6 | 9 | 12 | |
| Cepas negativas | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cepas positivas | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| Cepa de referencia | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
Se demostró la esterilidad del plasma equino para todos los meses estudiados, al resultar negativa la prueba del tioglicolato. De igual forma el cultivo en medio BHI no mostró autocoagulación del plasma, lo cual evidenció que este producto se mantuvo en óptimas condiciones de esterilidad durante el tiempo de estudio.
Discusión
Comparación entre los índices de positividad obtenidos para los diferentes plasmas estudiados
Los resultados aquí obtenidos confirmaron las limitaciones que presenta el uso del plasma humano en esta técnica, donde un gran número de falsos negativos (43,5 %) son informados con la repercusión en el tratamiento del paciente por parte del especialista. Este resultado es importante, si se tiene en cuenta que el plasma humano es utilizado en la gran mayoría de los laboratorios microbiológicos de la red nacional de salud. Este estudio se contrapone al realizado por algunos autores quienes recomiendan el plasma humano en sustitución del plasma de conejo debido a su mayor disponibilidad.22-24 El plasma humano además de las limitaciones éticas ya conocidas, presenta otros inconvenientes para la realización de esta prueba, entre los que se encuentran, la pérdida de actividad biológica de la estafilocoagulasa por la presencia de anticuerpos humanos presentes en este plasma, o de medicamentos como los antibióticos por su conocida acción inhibitoria,25 lo que sin dudas constituyen limitaciones para su utilización.
Los resultados obtenidos con los plasmas bovino y ovino fueron los esperados, según lo conocido por la literatura revisada y concuerdan con los datos publicados por Conway y Steel.12 Una causa probable de estos bajos índices de casos positivos identificados, puede deberse a la falta de factores bioquímicos involucrados en esta reacción en ambas especies. Se ha planteado que estas diferencias entre especies están relacionadas con la presencia del factor reactivo de la coagulasa (FRC) y su concentración en el plasma animal. Los trabajos descritos por Orth y otros,24 en estudios llevados a cabo con plasmas de diferentes especies animales, plantearon que la concentración de este factor (FRC) es máxima en el plasma humano, seguida del cerdo, conejo y equino, donde las cifras más bajas estuvieron en el bovino, pollo y ovino. Este informe es contradictorio, si se tiene en cuenta la poca efectividad (57,5 %) mostrada por el plasma humano, en los experimentos aquí realizados. En la actualidad no se encontró en la literatura consultada, las causas reales de estas diferencias interespecíficas. Experimentos que las identifiquen deberán ser diseñados. El resultado más relevante se obtuvo con el plasma equino. En la literatura consultada se encontraron pocos trabajos que emplearon este plasma y en algunas los resultados no fueron tan eficientes como los altos índices aquí mostrados, comparable con los índices obtenidos con el plasma de conejo (94,3 y 95,3 %, respectivamente).
Sexo y positividad: no existe reporte alguno de la influencia que puede tener el sexo del animal del cual es extraído el plasma sobre la prueba de la coagulasa en tubo, si se tiene en cuenta que las hormonas sexuales pueden interferir con esta reacción in vitro. Los resultados aquí obtenidos no mostraron diferencias significativas (p= 1) entre los 2 sexos y sugieren el uso del plasma equino por parte de los laboratorios microbiológicos independientemente del sexo, siendo este el primer reporte que asocia el ensayo a esta variable.
Efecto de la dilución: es notable el efecto negativo que causa esta variable sobre el ensayo en tubo de la coagulasa, el efecto menos marcado se observó en la especie cunícula, donde no existieron diferencias significativas (p= 0,6) entre los puntos estudiados, lo que sugiere su uso en cualquiera de estas diluciones. Los restantes plasmas se vieron afectados por esta variable. No obstante el plasma equino mostró resultados superiores al humano, bovino y ovino. Llamó la atención el efecto que causó la dilución del plasma humano, si se tiene en cuenta que este es el plasma que con mayor frecuencia se utiliza en los laboratorios microbiológicos, donde usualmente se trabaja a una dilución de 1/5. Cuando la incubación se llevó a cabo durante 24 h, este plasma mostró diferencias significativas entre 1/2 y 1/4 (p= 0,0035) y entre 1/4 y 1/8 (p= 0,00013), dejándose de identificar 40 casos en la primera dilución y más de 60 casos positivos en la segunda; lo que influye negativamente en el diagnóstico efectivo del microorganismo. Contrapuesto a este resultado fueron los datos obtenidos con el plasma equino, que permitió identificar 40 cepas coagulasa positiva en la dilución 1/4 no logradas con el plasma humano, lo cual tiene sin dudas una importancia práctica.
Según Harper y Conway,14 al aumentar la dilución del plasma, la concentración de los factores involucrados en la reacción disminuye, viéndose afectadas aquellas entidades con baja actividad biológica de su enzima estafilocoagulasa.
Efecto del tiempo de incubación
En la figura 3, solo se muestran los resultados obtenidos con los 3 plasmas de mayor interés en el estudio, utilizando como dilución 1/4 para todos los casos, por ser esta la dilución de trabajo óptima para el uso del plasma equino. No obstante, el efecto del tiempo de incubación sobre el índice de positividad fue observado en todas las diluciones ensayadas. Dado los bajos valores determinados con los plasmas ovino y bovino, no se reflejaron sus resultados en la figura.
Como muestra la lectura a las 2 h de incubación, el número de casos identificados para cada uno de los sueros es mínimo (humano 0 % y equino 12,3 %) excepto para el conejo, donde se identificó 63,2 % de los casos, lo cual indica que la evaluación del coágulo en este tiempo es inefectiva y por consiguiente no recomendada.
Los resultados obtenidos en este trabajo confirman estadísticamente, la factibilidad que tiene el empleo del plasma equino para realizar la prueba de la coagulasa en tubo por parte de los laboratorios microbiológicos. El empleo del producto propuesto (PlasmEq) eleva el índice de positividad en relación con el plasma humano utilizado con frecuencia en estos laboratorios, y elimina los riesgos biológicos a los que está expuesto el personal técnico, así como las limitaciones éticas que el suero humano impone. En conclusión este plasma no difiere del plasma de conejo (tradicionalmente recomendado en la literatura), en las condiciones que aquí se proponen para su empleo (dilución 1/4 y 24 h de incubación) y permite como fuente animal, la obtención de grandes volúmenes para su distribución a los laboratorios microbiológicos de la red de la provincia de Camagüey, al mostrar ser muy estable a - 20 ºC, cumpliendo las normativas establecidas por el CECMED para los diagnosticadotes.19
Equine plasma as a substitute of human plasma in the identification of Staphylococcus aureus in microbiology laboratories
Summary
Various plasmas from different species were evaluated and work was done on a total of 106 strains, due to the ethical problems posed by this plasma, as well as to the low sensitivity in the identification of Staphylococcus aureus strains that is carried out in the microbiological laboratories of the national hospital network with plasma of human origin. The dilution effect, the incubation time, and the influence of sex on the identification of positive strains (positivity index) were studied. The optimal working conditions, which were not significantly different from the results obtained with rabbit plasma, were determined. Human plasma proved to be little effective in the identification of positive strains (57,5 %), showing marked differences from the rabbit and equine plasma (95,3 y 94,3 %, respectively). The results obtained suggest the substitution of human plasma for equine plasma in the microbiological laboratories for identifying this pathogenic microorganism. This plasma demonstrated to be steady at - 20 °C for 12 months.
Key words: Staphylococcus aureus, plasma, coagulase.
Referencias bibliográficas
1. Gaillot O, Wetsh M, Fortineau N, Berche P. Evaluation of CHRO-Magar Staphylococcus aureus, a new medium, for isolation and presuntive identification of Stapylococcus aureus from human clinical specimens. J Clin Microbiol 2000;38:1587-91.
2. Lowe A, Bealtie D, Deresewiccs R. Identification of novel staphylococcal virulence genes by in vivo expression technology. Mol Microbiol 1998;27:967-76.
3. Llop A, Valdez-Dapena M, Zuazo J. Microbiología y parasitología médica. 1ra ed. Ciudad de La Habana: Editorial Ciencias Médicas; 2001.
4. Mac Devitt D, Francois P, Vaudaux P, Foster J. Molecular characterization of the clumping factor (fibrinogen receptor) of Stapylococcus aureus. Mol Microbiol 1994;11:237-48.
5. Akatov A, Samsonova T, Khatenever M, Shiriaeva V. Classification and biological characteristics of coagulase positive Staphylococci isolated from animals. Microbiol Epidemiol Immunobiol 1983;1:29-33.
6. Murray P, Kobayashi G, Pfaller M, Rossenthal K. Microbiología Médica. 2da ed. España: Harcourt Brace España; 1999.
7. Eiff C, Proctor R, Peters G. Phathogens have major role in nosocomial infections. Postgrad Med 2001;10:63-76.
8. Ayres l. Inventors. Device and procedure for identifying pathogenic microorganisms. US patent 5,380,652.1995.
9. Colque-Navarro P, Palma M, Soderquist B, Flock JI, Mollby R. Antibody response in patientswith staphylococcal septicemia against two Staphylococcus aureus fibrinogen binding proteins: clumping factor and an extracellular fibrinogen binding protein. Clin Diag Lab Immunolgy 2000;7(1):14-20.
10. Que A, Haefliger J, Franciolli P, Moreillon P. Expression of Stapylococcus aureus Clumping Factor in Lactocccus lactis subsp cremoris using a new shutle vector. Infect Immun 2000;68:3516-22.
11. Que Y, Haefliger J, Franciolli P, Moreillon P. Reassening the role of Stapylococcus aureus clumping factor and fibronectin-binding protein by expression in Lactocccus lactis. Infect Immun 2001;69:6296-302.
12. Cowan ST, Steel KJ. Manual for the identification of medical Bacteria. 1st ed. Cambridge: Cambridge University Press;1966.
13. Gillespie EH. The routine use of coagulase test for Staphylococci. Mon Bull Emerg Public Health Lab Serv 1943;2:19.
14. Harper EM, Conway NS. Clotting of human citrated plasma by gram negative organisms. J Pathol Bact 1948;60:247.
15. Madison BM, Baselski VS. Rapid identification of Staphylococcus aureus in blood cultures by thermonuclease testing. J Clin Microbiol 1983;18:722-4.
16. Guzman C, Guardati M, Fengolio D, Coratza G, Pruzzo C, Sata G. A novel inmunoenzimatic assay for the identification of Stapylococcus aureus strains negative for coagulase and protein A J Clin Microbiol 1992;30:1194-7.
17. Mac Faddin J. Pruebas bioquímicas para la identificación de bacterias de importancia clínica 1980. Ed Médica Panamericana. Eds Lorenzo I y Giardiano.7: p. 50-8.
18. BIOSCHILE. Ensayo para coagulasa [ on line] enero 2004. Disponible en: URL: http://www.bioschile.cl/2c_5a.html.
19. Regulación No. 20-2000. Buenas prácticas para la producción de los diagnosticadores. CECMED 2000. p.37
20. Regulación No. 25-2000. Requerimientos de los estudios de estabilidad para el registro de productos biológicos/biotecnológicos. CECMED 2000. p.14
21. Sigarroa A. Biometría y diseño experimental. 1ra ed. La Habana:Editorial Pueblo y Educación. SNLC:CU01.26651.9. 1985.
22. Morton H, Cohn J. Coagulase and deoxiribonuclease activities of staphylococci isolated from clinical sources. Appl Microbiol 1972;23:725
23. Martínez N, Laborda S, Anunciao A, Almeida M, Roch G, Pinheiro M, et al. Caracterização de Staphylococcus sp. Isolados de processos infecciosos de caninos utilizando plasmas de diferentes espécies animais. Rev Bras Saúde Prod An 2001;1:5344-8.
24. Orth DS, Chung LR, Anderson AW. Comparison of animal sera for suitability in coagulase testing. Microbiol 1971;21:320-3.
25. Bayliss BG, Hall ER. Plasma coagulation by organisms other than Staphylococcus aureus. J Bacteriol 1965;89:101-4.
Recibido: 16 de marzo de 2005. Aprobado: 12 de mayo de 2005.
Dr. Oscar Hernández Betancourt. Centro de Inmunología y Productos Biológicos (CENIPBI). AP 150. Camagüey CP 70100. Cuba. Teléf: 293321. Correo electrónico: oscar@finlay.cmw.sld.cu