My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
Print version ISSN 0864-0300On-line version ISSN 1561-3011
Rev Cubana Invest Bioméd vol.25 no.2 Ciudad de la Habana Apr.-June 2006
Trabajos originales
Instituto de Ciencias Básicas y Preclínicas Victoria de Girón
Hospital Pediátrico de Centro Habana
Hospital del Internado Celia Sánchez Manduley de Tarará
Escuela Latinoamericana de Ciencias Médicas
Disminución de la capacidad antioxidante en niños y adolescentes diabéticos
Dra. Sonia Clapés Hernández, Dra. Daisy Armas Castillo, Dra. Anay Marquetty Hernández, Dra. Maritza Lemani Pérez, Dra. Ileana Márquez, Dr. Dariel Díaz Arce y Dra. Mirta Companioni Gázquez
Resumen
Se propuso demostrar que la diabetes en niños y adolescentes evoluciona con incremento de especies reactivas, las cuales circulan al nivel sistémico y pueden dañar las biomoléculas. Se evidenció que los niños diabéticos tienen disminuidas las defensas antioxidantes, presumiblemente por causa de su mayor utilización. A pesar de observarse una tendencia a su incremento, no resultó significativa la diferencia en los niveles de daño a proteínas, aunque sí el daño a lípidos entre los pacientes diabéticos y el grupo de niños control. El análisis de los valores obtenidos permitirá la elaboración de una estrategia terapéutica, que comprenda la indicación de antioxidantes específicos en los pacientes que así lo requieran.
Palabras clave: Estrés oxidativo, diabetes mellitus, glutatión reducido, proteínas oxidadas, enzimas antioxidantes, malonildialdehído.
La diabetes mellitus es un síndrome crónico no transmisible que afecta alrededor de 150 000 000 de personas en el mundo. De los diabéticos, 80 % son adultos diabéticos tipo 2. La prevalencia de la diabetes en la infancia en América Latina es de 3 por cada 100 000 niños, en su mayoría diabéticos tipo 1. En Cuba la prevalencia es de 2,3/10 000 sujetos, en ese grupo de edades.
La aparición de la diabetes mellitus en los primeros años de la vida representa un grave problema, por lo difícil que resulta lograr un adecuado control metabólico en este tipo de pacientes. La diabetes tipo 1 en la infancia (la que más frecuentemente afecta a los niños y adolescentes) está caracterizada por la presencia de autoinmunidad con un progresivo deterioro de las células beta que produce pérdida de la capacidad de segregar insulina. Antecede a la aparición de los signos clínicos más significativos, los altos títulos en anticuerpos anti-islotes pancreáticos (ICA), anticuerpos contra insulina (AAI), anticuerpos contra la descarboxilasa del ácido glutámico (AGAD) y anticuerpos contra la porción intracelular de la proteína tirosina fosfatasa (AIA2). La presencia de varios tipos de estos anticuerpos indica mayor riesgo a desarrollar la enfermedad que altos títulos de uno solo.1 La constante generación de especies reactivas del oxígeno (ERO) puede conducir a daño de las biomoléculas, apoptosis, cambios en la actividad metabólica y en eventos de señalización molecular.
Numerosos estudios han relacionado la diabetes con el estado conocido como estrés oxidativo, en el cual las defensas antioxidantes celulares son superadas por la producción de especies reactivas.2 La elevación sostenida de la glucosa en sangre conduce al incremento en la actividad de varias reacciones involucradas en procesos metabólicos donde se generan metabolitos intermediarios que tienen acción pro-oxidante. La glicosilación no enzimática de proteínas es uno de los eventos que parecen tener mayor peso en el daño, el que trasciende de las células a órganos y sistemas (Robert SB, Shino N, Toren F. Mitochondria, Oxidants, and Aging Cell, Vol. 120, 483–495, February 25, 2005). La elevación de especies reactivas circulantes provoca que las moléculas más importantes para la vida sean blanco de reacciones oxidativas. Por esta vía se elevan las concentraciones de lípidos peroxidados, grupos carbonilo y bases nitrogenadas dañadas.3
La defensa contra el estrés oxidativo es asegurada por sustancias antioxidantes y enzimas que responden rápidamente a los cambios. Entre los más notables antioxidantes se encuentran las enzimas superóxido dismutasa, catalasa, glutatión peroxidasa, glutatión reductasa y otras. Gran importancia dentro de los antioxidantes se le confiere a los de bajo peso molecular como ácido úrico, vitaminas como la E, C y A y otros componentes del plasma.4
El número de estudios que relacionan el estrés oxidativo y la diabetes en la infancia no es muy abundante en el mundo, tampoco lo es en Cuba. El objetivo que se pretendió con este estudio es evaluar los niveles que alcanzan indicadores de daño a biomoléculas y niveles de antioxidantes que se encuentran en la circulación sistémica en una muestra de niños y adolescentes diabéticos. Esta investigación forma parte de un proyecto más abarcador que pretende contribuir a evaluar la conveniencia de aplicar una terapia antioxidante a niños y adolescentes con diabetes que así lo requieran.
Métodos
Se estudiaron 30 niños diabéticos en edades comprendidas entre 7 y 15 años procedentes de los hospitales pediátricos de la capital y el centro interno de Tarará. Un total de 36 niños sin enfermedad alguna diagnosticada participaron como controles.
Se estudiaron los niveles de 3 antioxidantes y el daño a 2 biomoléculas. De los antioxidantes, 2 corresponden a las enzimas antioxidantes superóxido dismutasa,5 (SOD) y catalasa6 (CAT) y el otro antioxidante estudiado fue el glutatión reducido(GSH) (GSH Beutler E. Improved assay of the enzymes of glutathions syntesis. Clin MDA ). Las determinaciones de daño a biomoléculas se realizaron en lípidos y proteínas mediante las técnicas del malonildialdehído7 (MDA) y determinación de la concentración de grupos carbonilo8 (Prot. Oxid.), respectivamente. Todas estas determinaciones se efectuaron en plasma.
Resultados
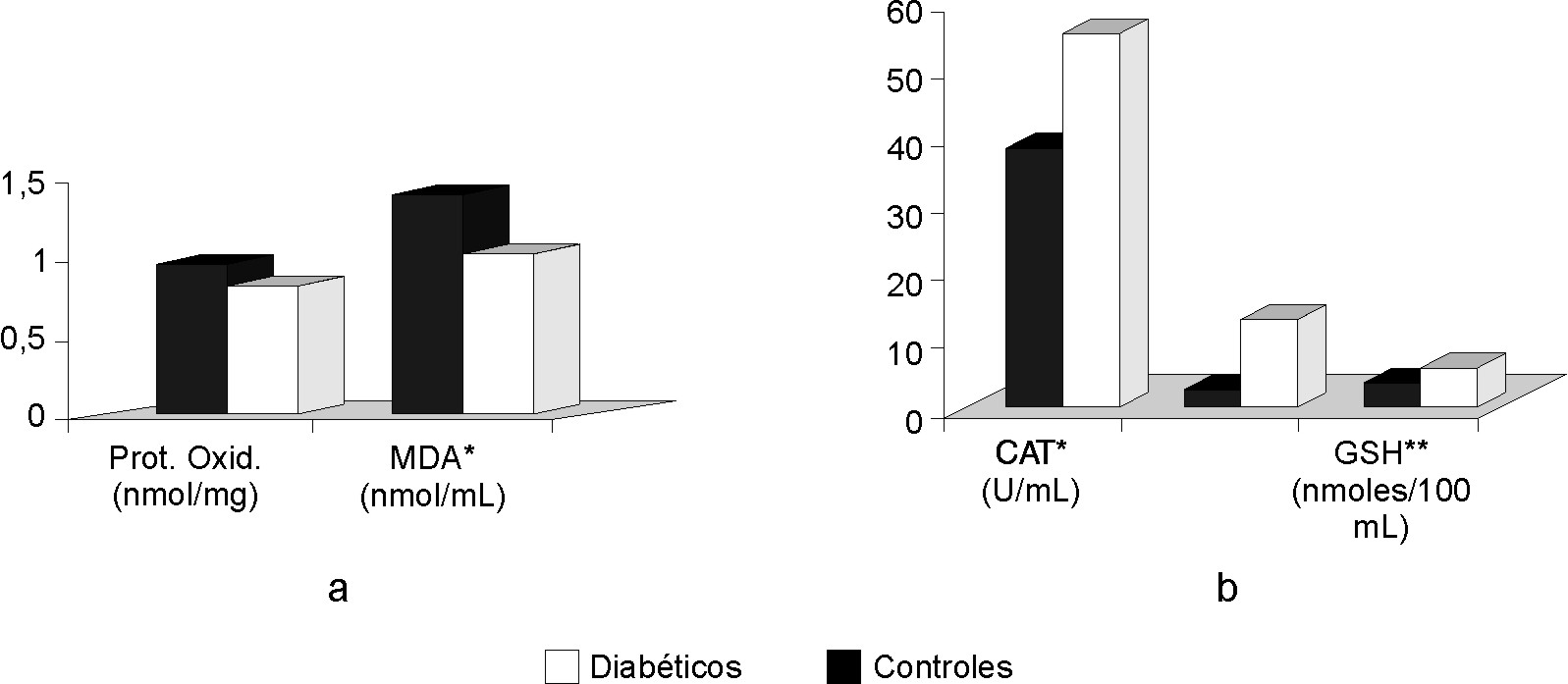
En la tabla se exponen los valores promedio de las variables estudiadas. En la figura (a y b) se muestran las diferencias entre los antioxidantes y el daño a biomoléculas, respectivamente. Resultó significativa (p< 0,005) la diferencia numérica de los valores que muestran la actividad de las enzimas catalasa y SOD entre los grupos control y diabéticos. También fue de significación la diferencia de los valores obtenidos en la determinación de glutatión reducido entre ambos grupos, con p< 0,05 en este caso (fig. [a]). El valor promedio de MDA es también superior en el grupo de diabéticos (p< 0,05) los valores de concentración de grupos carbonilos aunque muestran una tendencia al aumento no son estadísticamente diferentes (fig. [b]).
Tabla. Resultados de los indicadores bioquímicos estudiados
| Indicadores | Diabéticos | Controles |
| CAT* (U/mL) | 38,26 ± 10,14 | 55,00 ± 47,6 |
| SOD* (U/mL) | 2,21 ± 3,58 | 12,89 ± 10,8 |
| GSH** (nmoles/100 mL) | 3,19 ± 1,55 | 5,31 ± 3,07 |
| Prot. Oxid. (nmol/mg) | 0,97 ± 0,65 | 0,82 ± 0,61 |
| MDA* (nmol/mL) | 1,41 ± 1,44 | 1,02 ± 1,31 |
* p< 0,005 , **p < 0,05
Fig. Diferencias entre los antioxidantes y el daño a biomoléculas.
Una correlación negativa y de valor apreciable se observa entre los valores de MDA y GSH en ambos grupos (- 0,53 para los diabéticos y - 0,45 para los controles). Es interesante que exista también una correlación negativa en el comportamiento de los niveles de actividad de la enzima SOD con respecto a la concentración de grupos carbonilo, donde al aumentar la actividad de la SOD disminuyen los valores de las proteínas oxidadas en la muestra de niños diabéticos estudiada (r= - 0,37).
Discusión
El grupo de niños diabéticos posee más bajos niveles de los 3 indicadores asociados con el estado de los antioxidantes al compararlo con el grupo control. Los niveles de GSH muestran valores marginales, lo cual puede ser una evidencia de la necesidad de la utilización de este antioxidante o de la disminución en su síntesis o su regeneración, que se realiza por enzimas diferentes. El GSH es sintetizado por la enzima g glutamilcisteína sintetasa, pero cuando es utilizado como antioxidante se regenera por la acción de la glutatión reductasa. Esta última enzima utiliza NADPH como cofactor, por lo que en situaciones de incremento de la actividad de la aldosa reductasa y otras vías que se activan por la hiperglucemia, la disponibilidad de este cofactor disminuye por competencia entre varias vías metabólicas.
Este resultado sugiere que en adolescentes y niños diabéticos la disminución de GSH pudiera estar relacionada con el incremento de su utilización para conservar la integridad de otras moléculas.9
En cuanto a los niveles de daño a proteínas no se ha podido demostrar una diferencia significativa entre los 2 grupos, aunque existe una tendencia al aumento en el grupo de los diabéticos. La formación continua de proteínas modificadas es una consecuencia de la inevitable formación de especies reactivas del oxígeno. Las proteínas oxidadas que se acumulan dentro y fuera de la célula experimentan significativas modificaciones en sus funciones, por lo que deben ser sustituidas por la maquinaria de síntesis proteica celular y por las enzimas proteolíticas.10
La disminución de la actividad de la enzima catalasa puede estar dada por el hecho de que la enzima SOD tiene también más baja actividad en este grupo. Esta última es la encargada de convertir el radical superóxido en H2O2 y O2 molecular por medio de una reacción de dismutación. Su alta constante específica de velocidad hace que se acumulen altas concentraciones de H2O2, como se ha discutido ampliamente en varios trabajos.11,12 Al acumularse esta sustancia se activa la enzima catalasa, por ser insuficiente la acción que la otra enzima encargada de la eliminación de peróxidos (glutatión peroxidasa) puede ejercer para mantener los niveles adecuados de esta especie reactiva. Si disminuye la actividad de la SOD, se acumulan cantidades de radical superóxido porque la conversión de estos a peróxidos tiene lugar a una velocidad 105 veces menor y altas concentraciones de radical superóxido inhiben a la enzima catalasa.13
La disminución en la actividad de la SOD puede explicarse por las reacciones de glicosilación que afecta a proteínas que cumplen diferentes funciones como factores de transcripción, enzimas y otras.14,15 La glicosilación de proteínas es un suceso que acontece en el paciente diabético. De hecho hay autores que definen a la diabetes desde el punto de vista químico como una enfermedad en la cual se produce una glicosilación acelerada del colágeno y otras proteínas cuyo recambio es lento. Existen numerosas publicaciones que sustentan este planteamiento16 y no es de extrañar que una enzima como la Cu- Zn SOD cuya localización es intraeritrocitaria sea un blanco ideal para este evento en los pacientes diabéticos. La glicosilación de la enzima puede disminuir su actividad hasta en 60 %.17
Es interesante señalar que en estudios donde se exploró el efecto de las ERO sobre la inducción de genes, se mostró que la inducción forzada del gen cmyc además de elevar los niveles de ROS parece alterar los niveles de antioxidantes en la mitocondria, suprimiendo la SOD mitocondrial e induciendo otros como peroxiredoxina.18
La desviación estándar de los valores de actividad de la enzima son altos si se comparan con el valor de las medias en cada grupo. Otros autores14 han reportado altos valores de este indicador estadístico que se puede explicar por la gran variación que existe en la población sana en la actividad de esta enzima. Los resultados encontrados al nivel sistémico en este estudio coinciden con el de otros autores4,16,19 y con los reportados antes por este grupo de trabajo.20
En este estudio se puede concluir que en los niños incluidos en la investigación, disminuyeron sus defensas antioxidantes, ya sea porque se están utilizando en la eliminación de sustancias prooxidantes, lo que pudiera ser transitorio o porque estas se encuentran dañadas, especialmente las que son de origen proteico. También se evidenció daño oxidativo a lípidos y una tendencia al incremento de daño a proteínas aunque sin significación estadística.
Valdría la pena considerar la aplicación de una terapia antioxidante en los niños diabéticos. Esto les permitiría durante mayor tiempo, proteger sus biomoléculas y por tanto retardar la aparición de daños en órganos que puedan comprometer el buen desempeño de sus funciones biológicas. El debilitamiento de las defensas antioxidantes puede desempeñar un papel importante en la aparición del daño oxidativo.
Reduction of the antioxidant capacity in diabetic children and adolescents
Summary
The aim of this study was to prove that diabetes in children and adolescents evolves with an increment of reactive species circulating at the systemic level and that may lead to biomolecular damage. It was evidenced that the diabetic children have the antioxidant defenses reduced due maybe to their greater utilization. In spite of the fact that a tendency to their increase was observed, the difference at the levels of protein damage was not significant, although the lipid damage among the diabetic patients and the control group of children was marked. The analysis of the values obtained will allow to lay down a therapeutic strategy including the indication of specific antioxidants in those patients requiring them.
Key words: Oxidative stress, diabetes mellitus, reduced glutathione, oxidized proteins, antioxidant enzymes, malondialdehyde.
Referencias bibliográficas
1. Varvarovska V, Racek J, Stozicky F, Soucek J, Trefil L, Pomahacova R.et al. Aspects of oxidative stress in children with Type 1 diabetes mellitus. Biomed Pharmacoth 2004;58:539-45.
2. Halliwell B. Antioxidants in human health and disease. Ann Rev Nutr 1996;
3. Kalousavá M, Skrha J, Zima T. Advanced Glycation End-Products and Advanced Oxidation Protein products in Patients with Diabetes Mellitus. Physiol Res 2002;51:597-604.
4. Martín-Gallán P, Carrascosa A, Gussinye M, Domínguez C. Biomarkers of diabetes-associated oxidative stress and Antioxidant status in young diabetic patients with or without subclinical complications. Free Radical Biol Med, 2003;34(12):1563–74.
5. Marklund S, Marklund G. Involvement of the superoxide anion radical in autoxidation of pyrogallol as a convenient assay for superoxide dismutasa. Eur J Biochem 1974;47:469-74.
6. Beer RF, Sizer IW. Sppectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase. J Biol Chem 1952;195:137-40.
7. Yagi K. Assay for blood plasma and serum. Oxygen radicals in biological systems. In: L Packer, ed. Methods in enzymology.
9. Darmaun D, Smith SD, Sweeten S, Sager BK, Welch S, Mauras N. Evidence for accelerated rates of glutathione utilization and glutathione depletion in adolescents with poorly controlled type 1 diabetes. Diabetes 2005,54:190-6.
10. Grune T, Merker K, Sandig G, Davies KJA. Selective degradation of oxidatively modified protein substrates by the proteasome. Biochem Biophysical Res Communications 2003;305:709-18.
11. Hartnett ME, Stratton RD, Browne RW, Rosner BA, Lanham RJ, Armstrong D. Serum Markers of Oxidative Stress and Severity of Diabetic Retinopathy. Diabetes Care 2000;23:234-40.
12. Álvarez S. The mitochodria. Published in Antioxidants and life style on line, 2003. Available at: www.antioxidants.com.ar
13. Pieper GM, Jordan N, Dondlinger LA. Peroxidative stress in diabetic blood vessel. Diabetes 1995;44:884-5.
14. Baynes J W, Thorpe SR. Role of the maillard reaction in diabetes mellitus and diseases of aging. Drugs Aging 1996;9(2):69-77.
15. Xue-Liang D, Edelstein D, Rossetti L, Fantus IG, Goldberg H, Ziyadeh F et al. Hyperglycemia-induced mitochondrial superoxide overproduction activates the hexosamine pathway and induces plasminogen activator inhibitor-1 expression by increasing Sp1 glycosylation. Develop Biol 2004;(100)26:15613-8.
16. Baynes JW, Thorpe SR. Role of the Maillard Reaction in Diabetes Mellitus and Diseases of Aging. Drugs Aging 1996;9(2):69-77.
17. Vessby J, Basu S, Mohsen R, Vessby B. Oxidative stress and antioxidant status in type 1 diabetes mellitus. J Internal Med 2002;251:69-76.
18. Evans JL, Goldfine ID, Maddux BA, Grodsky GM: Oxidative stress and stress-activated signalling pathways: A unifying hypothesis of type 2 diabetes. Endocrine Reviews 2002;23(5):599-622.
19. Varvarovska J, Racek J, Stozicky F, Soucek J, Trefil L, Pomahacova R. Parameters of oxidative stress in children with type 1 diabetes mellitus and their relatives. J Diabetic Complic 2003;17:7-10.
20. Clapés S, Torres O. Indicadores de estrés oxidativo en pacientes diabéticos. Educación Médica Continuada. Schering Ecuatoriana 2000;(66):22-6.
Recibido: 23 de febrero de 2006. Aprobado: 21 de marzo de 2005.
Dra. Sonia Clapés Hernández. Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. Correo electrónico: sclapes@giron.sld.cu