versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.25 n.2 Ciudad de la Habana abr.-jun. 2006
Instituto de Ciencias Básicas y Preclínicas Victoria de Girón
Aspectos relevantes de la S-adenosilhomocisteína hidrolasa relacionados con el metabolismo de la S-adenosilhomocisteína
Lic. Yelamy Travieso González, Lic. Pavel Mustelier Zamora, Lic. Zonia Martínez Benítez y Lic. Aimé Posada García
Resumen
Se realizó una revisión de la S-adenosil metionina, considerado como el donante fundamental de grupos metilo en el organismo. Por una reacción de transmetilación es obtenida la S-adenosil homocisteína, que es un potente inhibidor de transmetilasas dependientes de S-adenosil metionina. La inhibición de las reacciones de transmetilación dependientes de esta última, es revelada por la conversión metabólica de S-adenosil homocisteína en adenosina y L-homocisteína mediante una reacción reversible, catalizada por la enzima S-adenosil homocisteína hidrolasa. Esta enzima se encuentra fundamentalmente localizada en hígado, páncreas y riñón, en el organismo. Está compuesta por 2 cadenas alfa y 2 beta, unidas por 4 puentes disulfuro y contiene residuos sulfidrilos. Se encuentra regulada por sus sustratos, adenosina y L-homocisteína, además, por purinas y otros metabolitos in vitro. La S-adenosil homocisteína hidrolasa se encuentra inhibida de forma irreversible por 5-desoí-5-difluorometil tioadenosina y 5-deoxy-5-trifluorometil tioadenosina.
Palabras clave: S-adenosil metionina, S-adenosil homocisteína, L-homocisteína, adenosina.
La S-adenosilmetionina (SAM) es considerada como el donante fundamental de grupos metilos en el organismo. La incorporación de grupos metilos de la S-adenosilmetionina a proteínas es catalizado por proteínas específicas metiltransferasas. Tanto el ARNm como el ARNt son metilados por transmetilasas específicas que requieren de SAM. La metilación de ácidos nucleicos está probablemente involucrada en la síntesis de proteína al nivel ribosomal. La metilación de componentes celulares puede ser de gran utilidad en la regulación biológica, lo cual ha sido comparado con la fosforilación en cuanto a su importancia.1,2
La formación de S-adenosilhomocisteína (SAH) a partir de SAM mediante transmetilación fue demostrada por Cantoni y Scarano en 1953.3 La inhibición de la transmetilación dependiente de SAM por SAH fue reportada por Gibson y sus colegas,4 mostrando que la SAH es un potente inhibidor de un número de transmetilasas. En este sentido se indica que los sitios catalíticos de muchas transmetilasas tienen la misma o mayor afinidad para SAH o SAM.
La inhibición de reacciones de transmetilación dependientes de SAM es revelada por la conversión metabólica de SAH a adenosina (Ado) y L-homocisteína (LHcy). La reacción es catalizada por la enzima S-adenosilhomocisteína hidrolasa (SAHH) (EC 3.3.1.1), la cual se mostró por primera vez en hígado de rata en 1959.5 La actividad de esta enzima desempeña un papel crítico en el control del nivel tisular de la SAH y por tanto, influye en las reacciones de transferencia de metilo.
S-adenosilhomocisteína hidrolasa
Distribución y nivel celular
La distribución de la SAH hidrolasa en varios tejidos de pollo, perro, rata y conejo, fue investigada por Walker Duerre.6 La actividad enzimática fue alta en hígado, páncreas y riñón; intermedia en bazo y testículo y baja en corazón y cerebro. Estos hallazgos concuerdan plenamente con los realizados para la enzima en tejidos de ratas y ratones, donde se demuestra su mayor actividad en hígado y páncreas.7,8
La variación de la SAH hidrolasa en diferentes especies es considerable, así la actividad específica en homogenato de hígado de rata es 5 veces mayor que la actividad encontrada en hígado humano,9 aunque la distribución en este último no ha sido sistemáticamente investigada. La enzima ha sido demostrada en placenta humana,10 linfocitos,11 hígado9 y en células leucémicas.12 Estos datos y otros sugieren que la enzima está ampliamente distribuida en tejido animal.
Pocos datos existen sobre la localización extracelular de la enzima. Se ha reportado que el sobrenadante posmicrosomal de hígado de rata contiene casi toda la actividad de SAH hidrolasa y una cantidad sustancial es recogida en la fracción nuclear. En humanos la enzima se encuentra solo localizada en la fracción del citosol.7
Localización genética
El gen para las enzimas SAH hidrolasa y adenosina deaminasa fue localizado en el cromosoma 20.13,14 Esto sugiere que la ocurrencia de codificaciones de genes para estas enzimas en el mismo cromosoma pueda tener un significado evolutivo.
Fueron identificadas 2 variantes alélicas en la enzima SAH hidrolasa en eritrocitos. La frecuencia genética fue de 0,024 para la SAH hidrolasa 2 y 0,006 para la SAH hidrolasa 3.
La secuencia humana muestra considerable homología con la de rata, en la región codificadora del gen, y aunque menos extensa, tiene similitud con la parte distal de la región 3´ no trasladada.
Propiedades físico químicas
La enzima purificada de varios tejidos de mamíferos tiene un peso molecular de 18 000 a 19 000 Dalton.15-19 La SAH hidrolasa contiene 4 puentes disulfuro, presentando aproximadamente de 32,1 a 32,5 residuos de sulfidrilos por mol de enzima. Estos datos se comprobaron mediante valoración con 5,5´Dithiobis (2 nitrobenzoato) y p-cloromercuriobenzoato.20
La SAH hidrolasa purificada a partir de hígado bovino, de ratón y de corteza adrenal bovina ha sido sometida a filtración en gel en cromatografía líquida de alta resolución (HPLC). La enzima eluye exactamente al mismo tiempo de retención15 en las 3 fuentes citadas antes. Este método es caracterizado por una elevada resolución y reproducibilidad. Así la SAH hidrolasa de esta fuente tiene exactamente el mismo radio de stoke. Cuando las enzimas son analizadas en electroforesis discontinua en gel de poliacrilamida, bajo condiciones que favorecen la alta resolución, se pueden distinguir 2 bandas de igual densidad. Estos datos coinciden con la composición molecular de la SAH hidrolasa dada por el símbolo α2β2.
La SAH hidrolasa contiene unido NAD+, el cual participa en el sitio catalítico. Varios autores han coincidido en que un mol de NAD es unido aproximadamente por mol de subunidad de enzima.10,16-18
El punto isoeléctrico de la SAH hidrolasa de rata,19,21 ternero,18 bovino,15 y de la corteza adrenal de bovino15 está en el rango de pH 5,35 a 6. Se ha demostrado que la reacción en la dirección de síntesis procede más rápido a pH 7,8, mientras el pH óptimo de la reacción de hidrólisis se encuentra entre 6,4 y 7,2.
Los datos actuales sugieren que la enzima de diferentes fuentes de mamíferos muestra muy poca variación en cuanto a peso molecular, composición y carga. Sin embargo 2 variantes de punto isoeléctrico han sido observadas en hígado de ternera con valores de pH de 5,8 y 618 y en ratón es de 5,7.15
Catálisis. Interacción entre enzima y sustrato
La SAH hidrolasa cataliza la hidrólisis reversible de SAH a L–homocisteína y adenosina. Cuando la concentración de los sustratos excede al rango micromolar, la reacción favorece la síntesis de SAH.5 Esto puede ser expresado con más precisión por la constante de equilibrio de la reacción Keq, la cual es definida por la ecuación siguiente:

Tanto la adenosina como la L–homocisteína son potentes inhibidores de la reacción hidrolítica. La catálisis enzimática puede ocurrir en sentido directo hacia la hidrólisis. La ado forma un complejo estable con la SAH hidrolasa de varios tejidos.22 Una fracción de ado fuertemente unida a la enzima de hígado es convertida a adenina o a una sustancia liberadora de adenina. Esta reacción es reversible bajo ciertas condiciones.23 La ado unida no puede ser liberada o disociada suavemente por incubación de la enzima en exceso de ado no marcada, pero se disocia fácilmente por ebullición o por tratamiento de la enzima con duodecil sulfato de sodio (SDS) o etanol. El complejo de ado con SAH hidrolasa no queda disponible para la desaminación a inosina catalizada por la adenosina desaminasa. Este fenómeno ha sido denominado secuestro de ado e indica un posible error fisiológico de este proceso. Esto y la conversión de ado a adenina puede ser demostrado bajo condiciones de catálisis enzimática, por ejemplo durante la síntesis o hidrólisis de SAH.24
Altas concentraciones de ado inactivan a la enzima SAH hidrolasa de linfocitos humanos, placentas11 e hígado de rata.22 La cinética de inactivación se considera como un mecanismo suicida,11,22 el cual implica que el complejo inactivo se forma de manera reversible de un complejo enzima–ado. Estos fenómenos están quizá relacionados y han sido demostrados a altas y bajas concentraciones de la enzima. Así la enzima que forma el complejo con ado estable es enzimáticamente inactiva.
La enzima, que es un dímero, une 2 moléculas de adenosina. La unión de la primera molécula es rápida mientras que la unión de la segunda es un proceso lento que sugiere cooperatividad negativa entre los sitios de unión. El complejo enzima–ado reacciona lentamente para formar adenina, ribosa y enzimas activas. Así en contraste con la SAH hidrolasa de mamífero la adenosina no inactiva a la enzima. La vida media del complejo formado de nuevo es más corta, mientras el complejo más viejo se disocia lentamente.
Datos similares han sido obtenidos con la hidrolasa de hígado de ratón.23
Estudios cinéticos y experimentos de filtración en gel indican que SAH forma un complejo de vida larga con la SAH hidrolasa de hígado de rata. Este complejo muestra una vida media de 5 a 10 min.24
Mecanismo de catálisis
Se sugiere un mecanismo que se basa en la oxidación reducción de C 3' del residuo ribosa de ado o SAH, con una concomitante reducción/oxidación de NAD+ /NADH.17 La oxidación del sustrato activa al protón de C 4´, lo que facilita la eliminación del sustituyente de C 5´ (grupo OH de la ado o grupo homocisteinil de la SAH).
La hidrólisis de la SAH incluye la oxidación del grupo 3´ OH de la SAH por el NAD+ unido a la enzima. En subsiguiente oxidación, la L– Hcy es eliminada para dar 3´ ceto 4´5´ dihidroxiadenosina. Este compuesto reacciona con agua para formar 3´ cetoadenosina, el cual es reducido a adenosina (fig. 1).
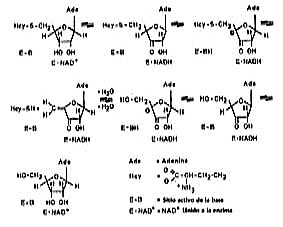
Fig. 1. Mecanismo de catálisis de la SAH hidrolasa.
Papel de la SAH hidrolasa en el metabolismo intermediario
Aunque la reacción catalizada por la SAH hidrolasa es a favor de la síntesis de SAH, el flujo metabólico se dirige quizá hacia la hidrólisis, dado que la ado y la L –Hcy son rápidamente metabolizadas en la célula.5,25
El papel de la reacción de la hidrolasa como fuente de ado en varios tejidos, no ha sido evaluado. Se ha sugerido que la SAH pueda ser una vía de producción de ado en corazón de mamífero.26 Esta es metabolizada de 2 formas: por desaminación a inosina catalizada por la ado deaminasa (EC 3.5.4.4.) o por fosforilación a AMP a través de la acción de adenosina quinasa (EC 2.7.1.20.).27 El otro producto formado de la SAH es la L– Hcy. Debe ser notado que la hidrólisis de la SAH es la única vía metabólica conocida en vertebrados para producir la L– Hcy.28
La L–Hcy es convertida en L– metionina en una reacción catalizada por 2 enzimas, la 5 metil tetrahidrofolato L homocisteína metiltransferasa (EC 2.1.1.13.) y la betaína L homocisteína S metiltransferasa (EC 2.1.1.5.). La L–Hcy reacciona también con serina para formar cistationina. Esta reacción es catalizada por la enzima cistationina beta sintasa (EC 4.1.22.).29
Cuando la ado, la L–Hcy o ambas se acumulan en la célula intacta, la reacción catalizada por la SAH hidrolasa se conduce en la dirección de síntesis de SAH, y la degradación de SAH es inhibida. Así los elevados niveles celulares de SAH pueden ser obtenidos por suplementación exógena de ado y/o Hcy, aun sin inhibición farmacológica de las enzimas que metabolizan a la ado. Esto ha sido mostrado con cultivos celulares30 y células aisladas,12 hígado, corazón prefusionado.31
Existe la posibilidad de que la adenosina sea compartimentada en la célula intacta mediante la interación con adenosil metionina hidrolasa. Esta información se basa en las observaciones siguientes:
- Una fracción de ado adicionada a un extracto concentrado de varios tejidos de mamíferos, se une firmemente a SAH hidrolasa y esta no es disponible para la desaminación y posterior degradación.23
El nivel celular de la enzima en el hígado de rata es de aproximadamente 10 micromol, el cual es del mismo orden de magnitud que el nivel de ado y SAH en los tejidos.23,32La relevancia de estos datos para el metabolismo de la ado en células intactas se indican por el secuestro de ado en presencia de la enzima purificada, lo cual ocurre tanto en la síntesis como en la hidrólisis de SAH.24
Se ha encontrado que la ado forma un complejo estable con la SAH hidrolasa intracelular en hepatocitos de ratas. La formación de este complejo es bloqueda por compuestos catalíticos de la enzima.33 Debe hacerse notar que una fracción de ado endógena unida a SAH hidrolasa libera fácilmente adenina. Esto puede permitir la determinación de la cantidad total de ado en el hepatocito.33
El transporte de ado por células de neuroblastoma deficientes de adenosina quinasa ha sido estudiado.34 Se observó que la concentración intracelular de ado excede a la concentración extracelular, y que la disminución de este efecto concentrador disminuye con el aumento de la concentración de ado. Se sugiere que la unión saturada de SAH hidrolasa en otros componentes celulares, puede explicar este efecto.
El efecto vasodilatador de la ado en el corazón es atribuido a la fracción de nucleósido libre extracelular. Una porción de ado intracelular se une a la SAH hidrolasa o a otras proteínas. En general el secuestro intracelular de ado debe tenerse en consideración cuando se relacione el efecto farmacológico y fisiológico de la ado con las concentraciones tisulares de este nucleósido.26-27
Un razonamiento similar puede ser hecho para la SAH. El complejo SAH hidrolasa puede no ejercer un efecto inhibitorio en transmetilasa dependientes de SAM. En adición de SAH puede unirse firmemente a otros componentes celulares.35 La compartimentación de SAH sugiere una explicación al hecho de que el nivel de esta en tejido, parece ser lo suficientemente alto para bloquear por completo algunas reacciones de transmetilación importantes.36
La conversión de ado a adenina es una reacción colateral catalizada por la SAH hidrolasa.24 La reacción puede ser demostrada bajo condiciones de síntesis e hidrólisis de SAH. Sin embargo, solo pequeñas cantidades de adenina son formadas a partir de ado en hígado de rata.31 Parece ser, por el contrario, que esta reacción es una fuente cuantitativamente importante de adenina celular. Esta idea se sustenta en observaciones recientes en células linfoblastoideas de humanos, donde la ado se deriva sobre todo de la división de metiltioadenosina, que es un producto de la síntesis de poliaminas.37
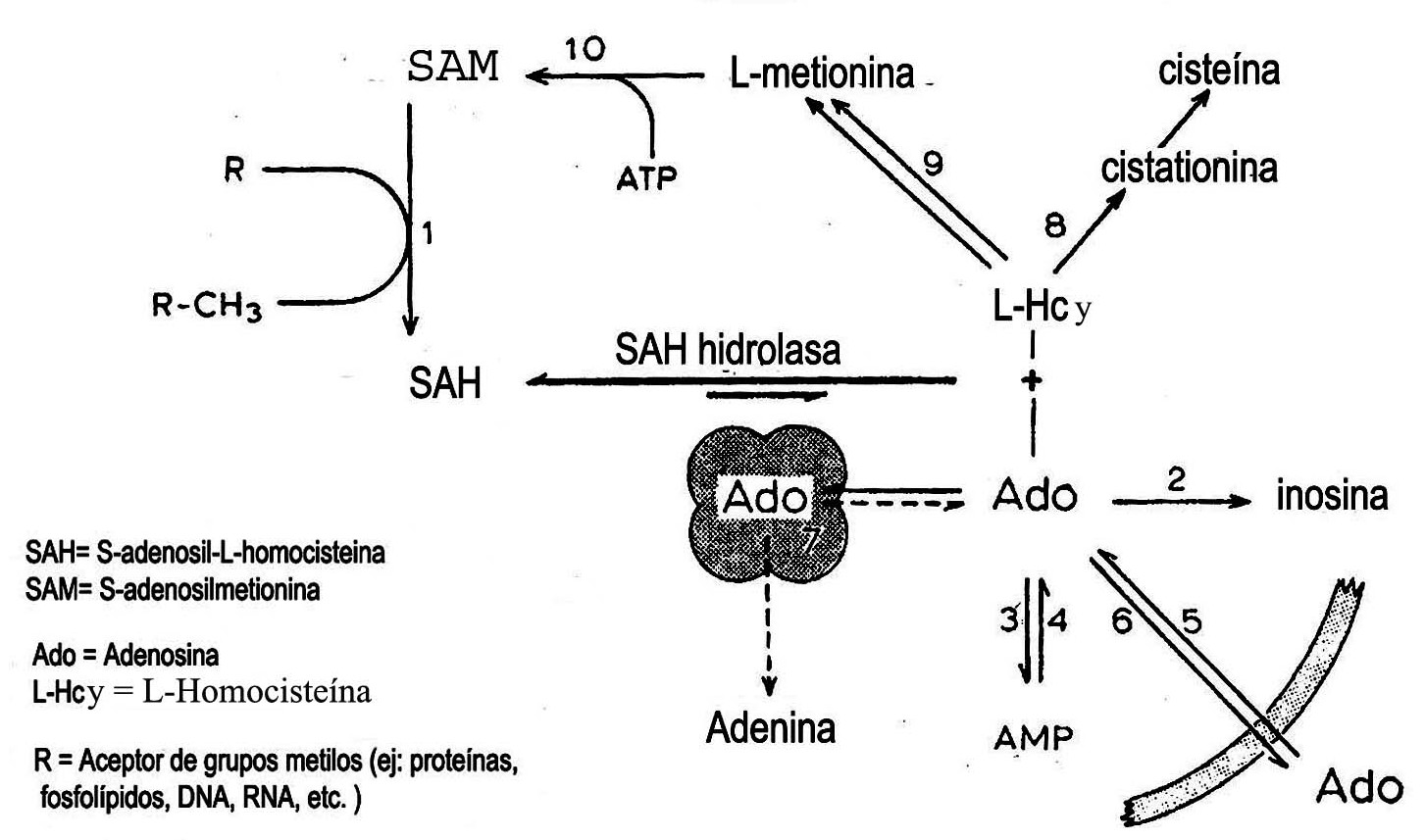
Fig. 2. Papel de la SAH hidrolasa en el metabolismo intermediario. Metiltransferasa dependiente de SAM (1), adenosina aminohidrolasa (adenosina deaminasa) (2), adenosina quinasa (3), adenosina 5'-monofosfato nucleotidasa (4), formación de adenosina (5), liberación de adenosina (6), complejo de adenosina con la SAH hidrolasa (7), cistationina b sintasa (8), 5-metiltetrahidrofolato: L-homocisteína metiltransferasa y betaína: L-homocisteína metiltransferasa (9), L-metionina S-adenosiltransferasa (10).
Sustratos, inhibidores e inactivadores de la SAH hidrolasa
La toxicidad de la ado en células de mamíferos se demostró por primera vez en 1961.38 Este descubrimiento fue seguido por la observación de que varios nucleótidos de ado son tóxicos para la célula y también efectivos agentes antitumorales y antivirales. Estos compuestos incluyen el 3'dideoxiadenosina (cor disepina),39 2'-3'-dideoxiadenosina,40 9 beta-D-xilofuranosiladenina41 y análogos carboxílicos de ado N6 metiladenosina. Algunos de estos compuestos son nucleótidos de origen natural encontrados en varios organismos.42
Se ha sugerido que la toxicidad de ado requiere de la fosforilación del nucleósido. Esta conclusión está basada en estudios con fibroblastos de ratón43 y de células de hámster chino a bajos niveles de adenosina quinasa.44
Además de los sustratos, la SAH hidrolasa se ve afectada por purinas y otros metabolitos, al menos in vitro. El 5'-deoxy-5'-metiltioadenosina (MTA) es un producto formado de la adenosil metionina durante la síntesis de poliaminas y espermita,45 el cual es un activador de la SAH de placenta humana, linfoblastos11 y eritrocitos.46 La inactivación de la enzima obedece a una cinética de primer orden, mostrando saturabilidad respecto al MTA y esto es irreversible. La enzima es protegida contra esta inactivación con ado y SAH.46 Estos datos sugieren un mecanismo de acción del MTA directo sobre el sitio activo, como se reporta para otros análogos de la adenosina.11
Por otra parte la 5'-deoxi-5'-difluorometil tioadenosina (DFMTA) y 5'-deoxi-5'-trifluorometil tioadenosina (TFMTA) son inhibidores de la enzima SAH hidrolasa. La inhibición es irreversible y tiempo dependiente para ambos. Estos inhibidores son oxidados por la enzima NAD y producen enzima NADH y anión fluoruro MTA. La adenina ha demostrado ser un inhibidor competitivo de la enzima en hígado de ratas y en linfoblastos humanos, induciendo una inactivación reversible, la cual es parcialmente inhibida por la presencia de fosfato inorgánico. Sin embargo se requieren altas concentraciones de adenosina para elevar los niveles de S–adenosil–homocisteína. Esto puede ser explicado por el rápido metabolismo de la adenina en la célula o por la intensitividad de la enzima intracelular hacia la adenina.
Los nucleótidos de adenina (AMP, ADP, ATP) se unen a la hidrolasa e inhiben competitivamente la catálisis.47 Estos metabolitos inducen también una inativación irreversible de la proteína purificada in vitro. Tanto la inhibición como la activación de la enzima es contrarrestada por el fosfato inorgánico, lo cual apunta a la posibilidad de que el efecto de los nucleótidos sea un fenómeno in vitro.
La inosina induce una inactivación reversible dependiente de fosfato en la SAH hidrolasa aislada de placenta humana, se ha demostrado una inhibición moderada de la enzima en células linfoblastoides y de linfocitos humanos.
La inosina funciona como sustrato para la SAH hidrolasa purificada de hígado de res, plantas28 y placentas humanas.48 Esta reacción es muy ineficiente porque la km para inosina es cerca de mil veces mayor que para la adenosina y su velocidad máxima es cuarenta veces menor.28,49 El producto de la reacción, S–inosil homocisteína es un inhibidor de las reacciones de transferencias de metilo, pero su inhibición es débil comparada con la que causan la S–adenosil homocisteína y muchos de sus análogos.50
Relevant aspects of S-adenosylhomocysteine hydrolase related to the metabolism of S-adenosylhomocysteine
Summary
A review of S-adenosylmethionine, considered as the fundamental donor of methyl groups in the organism, was made. S-adenosylhomocysteine, which is a powerful inhibitor of transmethylases depending on S-adenosylmethionine, is obtained by a transmethylation reaction. The inhibition of the reactions of transmethylation depending on SAM, is revealed by the metabolic conversion of S-adenosylhomocysteine into adenosine and L-homocysteine by a reversible reaction catalyzed by S-adenosylhomocysteine hydrolase. This enzyme is present in the liver, pancreas, and kidney. It is composed of two a and two b chains, which are joined by four disulphure bonds. It also has sulphidril residuals. The enzyme is regulated by its substrates, adenosine, L-homocysteine, in vitro purines and other metabolites. The S-adenosylhomocysteine hydrolase is irreversibly inhibited by 5-desoi-5-difluoromethyl tioadenosine and 5-deoxy-5-trifluoromethyl tioadenosine.
Key words: S-adenosylmethionine, S-adenosylhomocysteine, L-homocysteine, adenosine.
2. Shatkin AJ, Furuichi Y, Sonenberg N. 5-Terminal modification and translation of eukaryotic mRNAs. In Transmethylation, E Usdin, RT Borchardt, CR Creveling eds. North-Holland, New York, Amsterdam and Oxford:Elsevier;1979. p.341-50
3. Cantoni GL, Scarano E. The formation of S-adenosylhomocysteine in enzimatic transmethylation reactions. J Am Chem Soc 1954;76:4744.
4. Gibson KD, Wilson JD, Udenfriend S. The enzymatic conversion of phospholipid ethanolamine to phospholipid choline in rat liver. J Biol Chem 1961;236:673-9.
5. De la Haba G, Cantoni GL. The enzymatic synthesis of S-adenosyl-L-homocysteine from adenosine and homocysteine. J Biol Chem 1959;234:603-8.
6. Walker RD, Duerre JA. S-adenosylhomocysteine metabolism in various species. Can J Biochem 1975;53:312-9.
7. Finkelstein JD, Harris B. Methionine metabolism in mammals: Synthesis of S–adenosylhomocysteine in rat tissues. Arch Biochem Biophys 1973;159:160-5.
8. Schatz RA, Vunnam CR, Sellinger OZ. Species and tissue differences in the catabolism of S-adenosyl-L-homocysteine: A quantitative, chromatographic study. Life Sci 1977;20:375-84.
9. Ueland PM, Berge RK, Sǽbø J, Farstad M. S–adenosylhomocysteine hidrolase in human and rat liver is localized to the cytosol fraction of the tissues homogenate. Fed Eur Biochem Soc Lett 1979;101:184-6.
10. Hershfield MS. Human cytoplasmatic adenosine binding protein: Identification as S–adenosylhomocysteinase. Fed Proc 1978;37:1466.
11. Hershfield MS, Kredich NM, Small WC, Fredericksen ML. Suicide–like inactivation of human S–adenosylhomocysteine hydrolase by analogues of adenosine. In Transmethylation, E Usdin, RT Borchardt, CR Creveling eds. North-Holland, New York, Amsterdam and Oxford:Elsevier;1979. p.173-80.
12. Helland S, Ueland PM. Inactivation of S–adenosylhomocysteine hydrolase by 9–b–D–arabinofuranosyladenine in intact cells. Cancer Res 1982;42:1130-6.
13. Hershfield MS, Francke U. The human genes for S-adenosylhomocysteine hidrolase and adenosine deaminase are synthetic on chromosome 20. Science 1982;216:739-42.
14. Van Der Weyden MB, Kelley WN. Adenosine deaminase deficiency and severe combined immunodeficiency disease. Life Sci 1977;20:1645-50.
15. Døskeland SO, Ueland PM. Comparison of some physiochemical and kinetic properties of S-adenosylhomocysteine hidrolase from bovine liver, bovine adrenal cortex and mouse liver. Biochim Biophys Acta 1982;679:320-4.
16. Fujioka M, Takata Y. S-adenosylhomocysteine hidrolase from rat liver. Purification and some properties. J Biol Chem 1981;256:1631-5.
17. Palmer JL, Abeles RH. The mechanism of action of S-adenosylhomocysteinase. J Biol Chem 1979;254:1217-26.
18. Richards HH, Chiang PK, Cantoni GL. S-adenosylhomocysteine hydrolase. Crystallization of the purified enzyme and its properties. J Biol Chem 1978;253:4476-80.
19. Ueland PM, Døskeland SO. An adenosine 3´: 5´-monophosphate-adenosine binding protein from mouse liver. Purification and partial characterization. J Biol Chem1977;252:677-86.
20. Fujioka M, Takata Y. S-adenosylhomocysteine hidrolase from rat liver. Purification and some properties. J Biol Chem 1981;256:1631-5.
21. Ueland PM. S S-adenosylhomocysteinase from mouse liver. Inactivation of the enzyme in the presence of metabolites. Int J Biochem 1982;14:207-13. 22. Chiang PK, Guranowski A, Seagall JE. Irreversible inhibition of S-adenosylhomocysteine hidrolase by nucleoside analogs. Arch Biochem Biophys 1981;207:175-84. 23. Saebø J, Ueland PM. A study of the sequestration of adenosine and its conversion to adenine by the cyclic Amp-adenosinebinding protein/S-adenosylhomocysteinase from mouse liver. Biochim Biophys Acta 1979;587:333-40.
24. Ueland PM, Helland S. S-adenosylhomocysteinase from mouse liver. Catalytic properties at cellular enzyme level. J Biol Chem 1980;255:7722-7.
25. Crooks PA, Dreyer RN, Coward JK. Metabolism of S-adenosylhomocysteinase and S-tubercidinylhomocysteine in neuroblastoma cells. Biochemistry 1979;18:2601-9.
26. Schütz W, Schrader J, Gerlach E. Different sites of adenosine formation in the heart. Am J Physiol 1981;240:963-70.
27. Fox IH, Kelley WN. The role of adenosine and 2-deoxyadenosine in mammalian cells. Annu Rev Biochem 1978;47:655-86.
28. Cantoni GL, Chiang S-adenosylhomocysteinase PK. The role of S-adenosylhomocysteine and S- adenosylhomocysteine hidrolase in the controls of biological ethylations. In Natural Sulfur Compounds: Novel Biochemical and Structural Aspects. D Cavallini, GE Gaull and V Zappia eds. New York and London:Plenum Press; 1980. p.67-80.
29. Mudd SH, Poole JR. Labile methyl balances for normal humans on various dietary regimens. Metabolism 1975;24:721-35. 30. Kredich NM, Martin DWJr. Role of S-adenosylhomocysteine in adenosine mediated toxicity in cultured mouse T Lymphoma cells. Cell 1977;12:931-8.
31. Duerre JA, Briske-Anderson M. Effect of adenosine metabolites on methyltransferase reactions in isolated rat livers. Biochim Biophys Acta 1981;678: 275-82. 32. Hoffman DR, Cornatzer WE, Duerre JA. Relationship between tissues levels of S-adenosylmethionine, S-adenosylhomocysteine and transmethylation reactions. Can J Biochem 1979;57:56-65.
33. Ueland PM, Helland S. Binding of adenosine to intracellular S-adenosylhomocisteine hidrolase in isolated rat hepatocytes. J Biol Chem 1983;258:230-4.
34. Green RD. Adenosine transport by a variants of C1300 murine neuroblastoma cells deficient in adenosine kinasa. Biochim Biophys Acta 1980;598:366-74.
35. Ueland PM, Aarbakke J, Bessesen A. Characterization of S-adenosylhomocisteine binding to isolated rat hepatocytes and purified rat liver plasma membranes. Effect of analogues of S-adenosylhomocisteine. Mol Pharmacol 1982;21:108-13.
36. Fonlupt P, Rey C, Pacheco H. Phosphatidylethanolamine methylation in membranes from rat cerebral cortex: Effect of exogenous phospholipids and S-adenosylhomocisteine. Biochem Biophys Res Commun 1981;100:1720-6.
37. Kamatani N, Carson DA. Dependence of adenine production upon polyamines synthesis in cultured human lymphoblasts. Biochim Biophys Acta 1981;675:344-50.
38. Aranow L, Aranow L. Reversal of adenine toxicity by pyrimidine nucleosides. Biochim Biophys Acta 1961;47:184-5.
39. Jagger DV, Kredich NM, Guarino AJ. Inhibition of Ehrlich mouse ascites tumor growth by cordycepin. Cancer Res 1961;21: 216-20.
40. Doering AM, Cohen SS. Polymer synthesis in killed bacteria Lethality of 2, 3- dideoxyadenosine. J Bacteriol 1966;92:565-74.
41. Ellis DB, Lepage GA. Some inhibitory effects of 9–b–D–arabinofuranosyladenine, and adenosine analog; on nucleotide metabolism in ascites tumor cells. Mol Pharmacol 1965;1:231-8.
42. Suhadolnik RJ. Nuleoside Antibiotic. New York:Wiley-Interscience; 1970. p.442.
43. Ishii K, Green H. Lethality of adenosine for cultured mammalian cells by interference with pyrimidine biosynthesis. J Cell Sci 1973;13:429-39.
44. McBurney MW, Whitmore GF. Mutants of chinese hamster cells resistant to adenosine. J Cell Fisiol 1974;85:87-99.
45. Williams-Ashman HG, Canellakis ZN. Polyamines in mammalian biology and medicine. Perspect Biol Med 1979;22:424-53.
46. Ferro AJ, Vanderbalrk AA, Macdonald MR. Inactivation of S-adenosylhomocisteine hydrolase by 5-deoxy-5-methylthioadenosine. Biochem Biophys Res Commun 1981;100:523-31.
47. Ueland PM. An adenosine 3: 5-monophosphate/adenosine binding protein from mouse liver. Astudy of its interaction with synthetic and naturally occurring adenosine derivatives. Eur J Biochem 1978;86:27-34.
48. Hershfield MS. Proposed explanation for S-adenosylhomocisteine hydrolase deficiency in purine nucleoside phosphorylase and hypoxanthine-guanine phosphoribosyltransferase-deficent patients. J Clin Invest 1981;67:696-701.
49. Hersfield MS. Alternate reactions of S-adenosylhomocisteine hydrolase. Fed Proc 1980;39:1858.
50. Zappia V, Zydek-Cwick CR, Schlenk F. The specific of S-adenosylmethionine derivatives in methyl transfer reactions. J Biol Chem 1969;244:4499-509.
Recibido: 21 de enero de 2005. Aprobado: 4 de julio de 2005
Lic. Yelamy Travieso González. Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. 146 y 31, Cubanacán, Playa. Ciudad de La Habana. Correo electrónico: yelamy@giron.sld.cu
 Citado por SciELO
Citado por SciELO  Similares en
SciELO
Similares en
SciELO 















