Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.28 n.1 Ciudad de la Habana ene.-mar. 2009
ARTÍCULO DE INVESTIGACIÓN
Evaluación de la toxicidad in vitro del veneno del alacrán Rophalurus junceus a través de un ensayo celular
In vitro toxicity assessment caused by Rophalurus junceus scorpion poison though a cellular assay
Oscar Hernández BetancourtI; Imilla Casado HernándezII; Eldris Iglesias Huerta III; Ariel Ramírez Labrada IV; Jorge del Risco RamosV ; Ayni Rodríguez Pargas VI
I Doctor en Ciencias Biológicas. Investigador Auxiliar. Profesor Asistente. Centro de Inmunología y Productos Biológicos. Instituto Superior de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba.
II Investigador Agregado. Profesor Asistente. Centro de Inmunología y Productos Biológicos. Instituto Superior de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba.
III Investigador Agregado. Profesor Instructor. Centro de Inmunología y Productos Biológicos. Universidad Médica Camagüey. Camagüey, Cuba.
IV Profesor Instructor. Policlínico "Ignacio Agramonte". Camagüey, Cuba.
V Centro de Inmunología y Productos Biológicos. Instituto Superior de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba.
VI Máster en Medicina Natural y Tradicional. Profesor Auxiliar. Centro de Inmunología Y Productos Biológicos. Universidad Médica Camagüey. Camagüey, Cuba.
RESUMEN
El veneno del alacrán azul, Rophalurus junceus es comercializado con el nombre de Escozul. Este producto natural se emplea en el tratamiento de diferentes patologías.
OBJETIVO: este trabajo evaluó el efecto citotóxico in vitro de este producto en las líneas tumorales P3-X63/AG8/653 y Dunning R3327-G provenientes de mieloma murino y próstata de rata, respectivamente.
MÉTODOS: la citotoxicidad fue evaluada mediante la cinética de crecimiento celular y el daño metabólico. Se utilizaron dosis de 1, 10, 20, 50, 100 y 200 µg/mL.
RESULTADOS: el veneno presentó un efecto citostático dependiente de la línea tumoral en cuestión. Las dosis efectivas variaron entre las líneas celulares ensayadas. Se estudió además la estabilidad del producto almacenado durante 30 días a temperaturas de -20 y 4 ºC, se evidenció la pérdida de la actividad biológica.
CONCLUSIONES: El trabajo demostró la citotoxicidad del veneno crudo del alacrán azul en cultivos celulares.
Palabras clave: Rophalurus junceus, Escozul, citotoxicidad, escorpiones, líneas celulares, in vitro.
ABSTRACT
Poison of blue scorpion (Rophalurus junceus) is marketed as Escozul. This natural product is used in treatment of different pathologies.
OBJECTIVE: present paper evaluated the in vitro cytotoxic effect of this product in P3-X63/AG8/653 and Dunning R3327-G tumor lines from murine myeloma and rat prostate, respectively.
METHODS: cytotoxic effect was evaluated by means of cellular growing kinetics and the metabolic damage. Doses of 1,10, 20, 50, 100, and 200 µg/mL.
RESULTS: poison had a cytostatic effect dependent of tumor line at issue. Doses effective varied among the cellular lines assessed. We studied also stability of product stored during 30 days at temperatures of -20° and 4° C, evidenced the loss of biological activity.
CONCLUSIONS: we showed cytotoxic effect of crude poison of blue scorpion in cellular cultures.
Key words: Rophalutus junceus, Escozul, cytotoxic effect, scorpions, cellular lines, in vitro.
INTRODUCCIÓN
El cáncer constituye una de las principales causas de muerte a nivel mundial. Datos preliminares del Anuario Estadístico del Ministerio de Salud Pública (MINSAP) indican que el cáncer cobró 19 695 vidas en Cuba en el año 2006, que equivale al 28,13 % del total de muertes registradas en ese año.1
En el tratamiento de esta patología se utilizan tradicionalmente los fármacos citostáticos, las radiaciones y la cirugía, pero en la actualidad han surgido una serie de tratamientos alternativos que se denominan la bioterapia del cáncer, en la que se incluyen: terapia génica, elementos promotores de inmunogenicidad, agentes mutantes y otros que aceleran el proceso de apoptosis celular.2-5
El empleo terapéutico de la toxina del alacrán azul (Rhopalurus junceus) fue descubierta al cabo de una década de trabajo por el biólogo cubano Misael Bordier, que inició el criadero de escorpiones y su investigación, en la Facultad de Ciencias Médicas de Guantánamo a finales de los 80. La toxina, una vez formulada y esterilizada constituye el producto natural Escozul. A la misma se le atribuyen propiedades antimicrobianas y antitumorales demostradas a través de algunos estudios preclínicos.3 La evaluación farmacológica de extractos de organismos y su aislamiento, es un aspecto esencial del proceso de descubrimiento de la droga; precisamente los avances en el área de las técnicas in vitro han trasformado sustancialmente esta faceta de la química de productos naturales.
En el campo del cáncer, los ensayos in vitro son fundamentalmente de dos tipos: ensayos moleculares altamente específicos (dirigidos a una diana u objetivo subcelular único) y ensayos celulares. Los ensayos celulares a su vez, pueden ser divididos en: ensayos citotóxicos y otros tipos de ensayos que incluyen exámenes morfológicos. Dichos ensayos celulares o de crecimiento celular no radiactivos se clasifican en: ensayos de conteo celular o de colonia, de unión a colorantes macromoleculares, de metabolismo y de integridad de la membrana.6 En la literatura revisada, no aparece información alguna sobre estudios que utilicen el veneno crudo de alacrán (Escozul) en experimentos como los mencionados anteriormente.
A pesar de los resultados obtenidos en investigaciones preclínicas y clínicas mediante la administración de este veneno,7,8 las autoridades sanitarias cubanas no reconocen como evidencia científicamente documentada los reportes realizados hasta el momento, aunque las referencias sobre sus efectos y curas son sugerentes de una posible actividad y utilidad terapéutica.9 Partiendo de estos argumentos, nos propusimos evaluar en un sistema celular in vitro, la actividad citotóxica del veneno crudo del alacrán Rophalurus junceus, empleando las líneas tumorales de mieloma murino (P3-X63) y de próstata de rata (Dunning). Los métodos empleados fueron la cinética de crecimiento y el ensayo de daño metabólico. Fue importante para nuestro equipo definir la estabilidad que este producto presenta almacenado a 4 y -20 ºC. Nuestros resultados brindarán un mejor entendimiento para el tratamiento de diversas patologías de tipo tumoral empleando este producto, así como ayudarán a su mejor conservación y comercialización.
MÉTODOS
Diseño experimental:
1. Colección y preparación de la toxina
Se colectó el veneno de 50 alacranes de la especie Rophalurus junceus en un volumen de 20 mL de agua destilada, mediante la aplicación de corriente a baja intensidad en el apéndice terminal. Con la finalidad de concentrar la muestra se realizó una precipitación salina. (NH4SO4 al 70 %), seguidamente se resuspendió en 5mL de PBS 1X (137mM NaCl, 2,7mM KCl, 4,3mM Na2HPO4, 1,47mM KH2PO4) y se procedió a dializar durante 48 h a 4 ºC en PBS 1X. Se determinó la concentración de proteínas totales a través del método de Lowry. 10 La toxina fue filtrada utilizando membranas de 0,2 mm y posteriormente fue empleada para conformar los diferentes tratamientos. Las dosis preparadas fueron: 1, 10, 20, 50, 100, 200 µg/mL. Como control positivo se utilizó el citostático estándar 5-fluoruracilo a una concentración de 5 mg/mL de medio. Como control negativo se empleó el medio de cultivo carente de la toxina, donde el volumen correspondiente a esta fue reemplazado por PBS1X. Parte de la toxina fue almacenada durante 30 días a 4 y -20 ºC para estudios de estabilidad.
2. Líneas celulares y condiciones de cultivo
- Líneas celulares
Se utilizaron las líneas de mieloma de ratón Balb/c P3-X63/AG8/653 y Dunning R3327-G de próstata de ratas Copenhague. Ambas se cultivaron en medio RPMI suplementado con 10 % suero fetal bovino (SFB) y glutamina piruvato 2mM en ausencia de antibióticos, a 37 ºC y atmósfera de 5 % CO2.
- Densidad de la siembra
Las células se sembraron entre 2 y 3x104 células/pozo en placas de microtitulación de 96 pozos.
3. Ensayos de citotoxicidad in vitro
De los diferentes ensayos in vitro descritos para evaluar este efecto, se seleccionó la cinética de crecimiento y la evaluación del daño metabólico descrito por Rahman y otros, 2001.6
- Cinética de crecimiento
El ensayo se efectuó durante 72 h según lo establecido en la literatura, se realizaron los conteos celulares cada 24 h con la ayuda de la Cámara de Neubauer y una dilución 1:2 de la muestra en Tripán Azul. En el caso de los conteos realizados a las células Dunning, se empleó para su desprendimiento del soporte la tripsina 0,125 %, 53mM de EDTA en PBS 1X.
Se le concedió especial importancia a la observación de las características culturales propias de cada línea celular.
Las dosis seleccionadas fueron 1, 10, 100, 200 µg/mL.
El diseño experimental incluyó un original y dos réplicas para cada tratamiento.
- Ensayo de daño metabólico
Se empleó la técnica del rojo neutro, un colorante vital que se acumula en los lisosomas de las células vivas. El ensayo se llevó a cabo en triplicado como se describió anteriormente, pero las células permanecieron en contacto con los diferentes tratamientos durante 72 h. Cada 24 h hubo cambio de 100 µL de medio por medio fresco con las dosis correspondientes, incluyendo los controles. Los datos de la toxicidad celular del veneno, se brindan como la absorbancia a 540 nm del rojo neutro captado por los lisosomas.
4. Estabilidad de la toxina almacenada
Se realizó un análisis funcional de la estabilidad del producto basado en su actividad biológica, una vez que el producto fue sometido a temperaturas diferenciales de almacenamiento: refrigeración (2 a 8 ºC) y congelación (-5 a -20 ºC), durante 30 días
Se tomaron como criterios de actividad los referidos en los experimentos anteriores: cinética de crecimiento y daño metabólico, y se seleccionaron dosis intermedias al rango establecido: 1, 10, 20, 50, 100 µg/mL. Por cada dosis se incluyó un grupo de refrigeración y otro de congelación.
El diseño experimental incluyó un original y dos réplicas para cada tratamiento.
La línea celular empleada fue la P3X63.
5. Procesamiento estadístico
Dado que los datos responden a una distribución normal se procedió a hacer el análisis estadístico paramétrico,11 realizando un análisis de varianza múltiple (ANOVA) y la matriz de comparación de medias de Tukey.
Se consideró como variable dependiente el número de células y la DO medida en el ensayo metabólico, y como variables independientes los diferentes tratamientos. El paquete estadístico empleado fue SYSTAT versión 5.0 del 97.
RESULTADOS
Ensayos de citotoxicidad in vitro
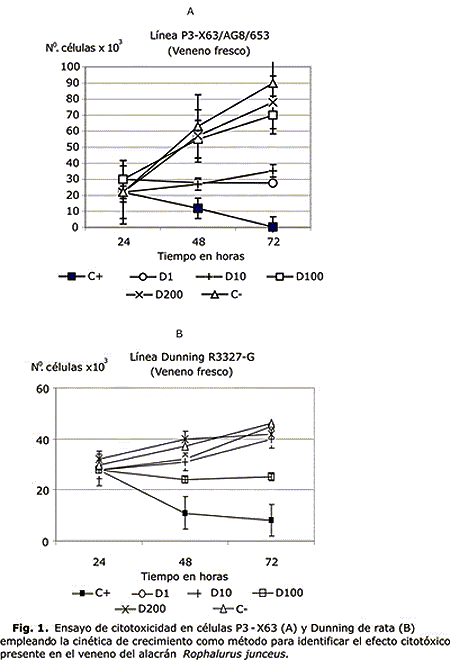
La figura 1A muestra los resultados obtenidos en la cinética de crecimiento realizada a las células tumorales murinas P3X63. En la misma se evidencia un marcado efecto inhibitorio en el crecimiento de las células, de un 72,3 y 66,7 % con relación al grupo control empleado, a las dosis de 1 y 10 µg/mL, respectivamente.
La figura 1B muestra la cinética obtenida para las células tumorales prostáticas de rata (Dunning) tratadas con iguales dosis. Se observó que el efecto citotóxico del veneno del alacrán azul se alcanzó con la dosis de 100 µg/mL, mostrando un 45,7 % de inhibición con relación al control en esta línea celular. Por otra parte, se observó un efecto marcado del 5FU a la dosis de 5 µg/mL dependiente del tiempo de exposición con las células en ambas líneas, se corroboró con la observación realizada al microscopio. En este caso se mostraron cambios morfológicos como pérdida de refringencia, disminución del tamaño celular y bordes irregulares. Además se observaron abundantes detritos.
Este ensayo se realizó empleando veneno fresco de 5 y 10 días posteriores a la extracción. A la derecha aparecen las dosis utilizadas: C- (control negativo) C+ (control positivo 5FU). D1, D10, D100, D200 se corresponden con 1, 10, 100, 200 µg/mL de la proteína respectivamente. Los resultados se expresan como las medias de las DO ± DE de ensayos realizados en triplicados.
Estabilidad de la toxina almacenada
- Temperatura de refrigeración
No se observó efecto citotóxico en ninguna de las cinco dosis ensayadas como se muestra en la figura 2A. Los porcientos de inhibición con respecto al control para 1, 10, 20, 50 y 100 µg/mL fueron 98,6, 102,7, 109,5, 109,5 y 78,08 % respectivamente (fig. 2A). El ensayo metabólico (2B) no mostró diferencias significativas (p= 0,215) entre las dosis empleadas y el control negativo, para p<0,05.
La fig. 2B muestra la captación del rojo neutro por los lisososmas y se expresan los resultados de la densidad óptica (X± DS) medida a 540 nm.
- Temperatura de congelación
Como se observa en la figura 3A, la curva de crecimiento no mostró efecto inhibitorio alguno causado por el veneno crudo presente en el medio de cultivo de las células P3X63. Estos resultados son corroborados por el ensayo metabólico realizado y que se observa en la figura 3B. El análisis de varianza (ANOVA) no mostró diferencias significativas (p=0,178) entre las dosis estudiadas para p<0,05.
El gráfico B muestra la captación del rojo neutro por los lisososmas y se expresan los resultados de la densidad óptica (X± DS) medida a 540nm.
DISCUSIÓN
Las toxinas producidas por diversos organismos han llamado desde hace mucho tiempo, la atención de los investigadores por sus propiedades terapéuticas. Entre los más estudiados se encuentran las serpientes, escorpiones y diversos organismos marinos. 12-20
El uso de dos líneas celulares (P3-X63 y Dunning), permitió evidenciar que existen diferencias entre las dosis con actividad citotóxica efectiva cuando se compararon ambas células. Las dosis 1 y 10 µg/mL causaron inhibición notable del crecimiento (72,3 y 66,7 % respectivamente) en los mielomas murinos (P3-X63), coincidiendo con resultados obtenidos por otros autores.21,22 Contradictoriamente, cuando el ensayo se efectuó con las mismas dosis en células Dunning, el efecto inhibitorio del crecimiento se observó con 100 µg/mL (45,7 %). Este resultado puede deberse a las diferentes características que ambas líneas celulares presentan durante su crecimiento. Las células Dunning son células con anclaje dependiente y a diferencia de las X63 crean una monocapa con una matriz celular que presupone la presencia del complejo proteico que garantiza la unión entre células, y entre estas y el soporte a la cual están ancladas. La unión estrecha presente en las células dependientes de anclaje puede constituir una barrera a la acción de la toxina. Esta ha sido una de las causas que ha llevado al surgimiento de los estudios tridimensionales in vitro, con el empleo de los esferoides celulares, dado que la acción del fármaco sobre la célula no es igual cuando estas crecen en monocapas a cuando lo hacen en pequeños "cluster" celulares aislados. 23,24 Por otra parte, se ha observado que cuando se emplean toxinas para el tratamiento de pacientes afectados con diversos tumores, existe una menor eficiencia en el tratamiento de aquellos casos donde existen tumores sólidos que en los pacientes con tumores hematopoyéticos. 25
Llamó poderosamente la atención el efecto no dependiente de la dosis en el tratamiento de estas células, ya que muchos autores que ensayan diferentes toxinas, han encontrado un efecto dosis dependiente. 14,15 En nuestros ensayos realizados con las células P3-X63 para las dosis de 100 y 200 µg/mL se obtuvo un crecimiento comparable al control negativo. Esta última dosis tampoco fue efectiva en las células Dunning. Un efecto de saturación del complejo ABC presente en la membrana celular puede ser la causa de este fenómeno. Se sabe que esta superfamilia es un transportador de membrana presente desde las bacterias hasta el humano, y es altamente específica para un sustrato o grupo de sustratos relacionados estructuralmente, entre los que se encuentran péptidos y proteínas. Pudiera también pensarse en un efecto de resistencia a la toxina a altas dosis. Este mecanismo resultaría de la sobrexpresión de MDR1 (multidrugs resistance), una proteína de 170 KDa presente en la membrana y cuya función es exportar fármacos al exterior celular causando resistencia a estos, si bien hay que señalar que es un mecanismo descrito para pequeños fármacos hidrófobos.26 Experimentos para confirmar estas hipótesis así como los mecanismos de acción molecular del veneno del alacrán, deberán ser diseñados posteriormente.
Estos ensayos mostraron que las dosis altas empleadas (100 y 200 µg/mL) ocasionaron un crecimiento atípico tanto en células dependientes de anclaje como en células libres en el medio. Este se manifestó mediante la formación de grupos celulares distribuidos de forma no homogénea en el fondo de la placa de cultivo y la desintegración de la monocapa de células Dunning. Se sabe que las cadherinas son un grupo de proteínas involucradas en la formación de las uniones intercelulares, estas moléculas son dependientes de Ca+2, el cual influye en la formación del dímero necesario para la unión entre las células.26 Ha sido ampliamente descrito el papel de las toxinas de diversos grupos animales activando el influjo de este ion calcio, lo cual puede estar relacionado al evento aquí descrito, ya que una disminución del Ca2+ extracelular impide la formación del dímero de cadherina ocasionando una disrupción entre las células. 27
El empleo de un homólogo catalíticamente inactivo del veneno de la serpiente Bothrops asper, la fosfolipasa A2 (Lys49), indujo diversos cambios en células linfoblastoides como necrosis, apoptosis y proliferación dependiendo de la concentración de la toxina, quienes además evaluaron el incremento del Ca2+ citosólico inducido por la misma. A altas concentraciones (100 µg/mL) la toxina induce una disrupción drástica de la membrana plasmática, asociada con un influjo de Ca2+ y la necrosis. 18
Un resultado similar al nuestro fue obtenido por Willinger C y otros, 28 quienes ensayando el veneno de Daboia russelii siamensis en cultivos celulares epiteliales, observaron la desintegración completa de la monocapa confluente a concentraciones superiores a 200 µg/mL.
Fue interesante evaluar la estabilidad de este producto natural empleado en el tratamiento de diversas patologías, fundamentalmente en pacientes afectados por diversos tipos de cáncer. El estudio realizado mostró por primera vez que la efectividad o actividad biológica, medida a través del efecto citotóxico, del principio activo presente en el veneno crudo, es sensible al tiempo y a la temperatura ya que este se obtuvo con el veneno fresco mantenido a 4 ºC hasta 15 días posteriores a la extracción. Una vez que el producto se almacenó por período de un mes a 4 ºC ó -20 ºC, su efecto citotóxico desapareció. La literatura revisada no mostró ningún estudio sobre la estabilidad de toxinas naturales (animales) en un biomodelo in vitro, lo cual realza la importancia de este resultado si se quiere establecer con efectividad un tratamiento prolongado en estos pacientes. Los resultados in vitro aquí mostrados confirmaron el efecto citotóxico dependiente del tiempo del producto Escozul y sugieren la necesidad de estudiar cuidadosamente el efecto dosis-respuesta en función de la patología presentada en cada paciente, además del uso de biomodelos in vivo que permitan ajustar estas dosis efectivas.
REFERENCIAS BIBLIOGRÁFICAS
1. Anuario Estadístico. [en lÍnea] 2006 [citado 2008]. Disponible en: http://bvs.sld.cu/cgi-bin/wxis/anuario/
2. Ruggles JA, Kelemen D, Baron A. Emerging therapies: controlling glucose homeostasis, immunotherapy, islet transplantation, gene therapy, and islet cell neogenesis and regeneration. Endocrinol Metab Clin North Am. 2004;33(1):239-52.
3. Rodríguez R, Guerra O, Baro E, Silva J, Magdelaine R. Acción antimicrobiana del veneno del escorpión Rhopalurus junceus (Scorpionida: buthidae). Rev Cubana Farm. 2004;38(2):134.
4. Gao L, Yu S, Wu Y, Shan B. Effect of spider venom on cell apoptosis and necrosis rates in MCF-7 cells. DNA Cell Biol. 2007;26(7):485-9.
5. Konety BR, Getzenberg RH. Novel therapies for advanced prostate cancer. Semin Urol Oncol. 1997;15(1):33-42.
6. Rahman A, Iqbal M, Thomsen W. Bioassay techniques for drug development. Harward Academic Publishers; 2001.
7. Pérez M, Rodríguez C, Guevara I, Romeaux R. Estudio de toxicidad aguda de las toxinas de los escorpiones Rophalurus junceus y Centruroides gracilis. Rev Cubana Farm. 2004;38(suplemento especial).
8. Kinast H. El veneno del alacrán en cáncer. Escozul. Cap 43. [serie en Internet] 2007 [citado 2007]. Disponible en: http://kinastchile.cl/ccc43.htm
9. Nota Oficial del Ministerio de Salud Pública. Granma. 2004 Nov 17 [serie en Internet] [citado 2007]. Disponible en: http://www.granma.cubasi.cu/2004/11/17/nacional/index.html
10.Sambrook J, Fritsch EF, Maniatis T. Molecular cloning: a laboratory manual. 2th ed. Nueva York: Cold Spring Harbor NY; 1989.
11. Sigarroa A. Biometría y Diseño Experimental. Ed. Pueblo y Educación; 1985.
12.Zeng X, Luo F, Li W. Molecular dissection of venom from Chinese scorpion Mesobuthus martensii: Identification and characterization of four novel disulfide-bridged venom peptides. Peptides. 2006;27(7):1745- 54.
13. Cao ZY, Mi ZM, Cheng GF, Shen WQ, Xiao X, Liu, et al. Purification and characterization of a new peptide with analgesic effect from the scorpion Buthus martensi Karch. J Pept Res. 2004;64(1):33-41.
14. Pipelzadeh MH, Dezfulian AR, Jalali MT, Mansouri AK. In vitro and in vivo studies on some toxic effects of the venom from Hemiscorpious lepturus scorpion. Toxicon. 2006;48(1):93-103.
15.Serafim FG, Reali M, Cruz MA, Fontana MD. Action of Micrurus dumerilii carinicauda coral snake venom on the mammalian neuromuscular junction. Toxicon. 2002;40(2):167-74.
16. Giron ME, Aguilar I, Romero L, Sanchez EE, Perez JC, Rodriguez A. A low-cost method to test cytotoxic effects of Crotalus vegrandis (Serpentes: Viperidae) venom on kidney cell cultures. Rev Inst Med Trop Sao Paolo. 2005;47(3):147-52.
17. Mora R, Maldonado A, Valverde B, Gutierrez JM. Calcium plays a key role in the effects induced by a snake venom Lys49 phospholipase A2 homologue on a lymphoblastoid cell line. Toxicon. 2006;47(1):75-86.
18.Villalobos JC, Mora R, Lomonte B, Gutierrez JM, Angulo Y. Cytotoxicity induced in myotubes by a Lys49 phospholipase A(2) homologue from the venom of the snake Bothrops asper: Evidence of rapid plasma membrane damage and a dual role for extracellular calcium. Toxicol In Vitro. En prensa 2007.
19. Pita M, Casanella O, Rodríguez A, López T, Perea S, Castañeda O. Capacidad antiproliferativa de fracciones cromatográficas procedentes de animales marinos en líneas tumorales in vitro. Rev Cubana Farm. 2004;38(2):152.
20. Rundbert T, Sándwik M, Larsen K, Pizarro G, Reguera B, Castberg T, et al. Extraction of microalgal toxins by large-scale pumping of seawater in Spain and Norway, and isolation of okadaic acid and dinophysistoxin-2. Toxicon. 2007;50(7):960-70.
21.Crachi M, Hammer L, Hodgson W. A pharmacological examination of venom from the Papuan taipan (Oxyuranus scutellatus canni). Toxicon.1999;37(12):1721-34.
22. Oliveira JC, de Oca HM, Duarte MM, Diniz CR, Fortes CL. Toxicity of South American snake venoms measured by an in vitro cell culture assay. Toxicon. 2002;40(3):321-5.
23. Doillon CJ, Gagnon E, Paradis R, Koutsilieris M. Three-dimensional culture system as a model for studying cancer cell invasion capacity and anticancer drug sensitivity. Anticancer Res. 2004;24(4):2169-77.
24. Zhang X, Wang W, Yu W, Xie Y, Zhang X, Zhang Y, et al. Development of an in vitro multicellular tumor spheroid model using microencapsulation and its application in anticancer drug screening and testing. Biotechnol Prog.2005;21(4):1289-96.
25. Ng H, Khoo H. Cancer homing toxins. Curr Pharm Des. 2002;8(22):1973-85.
26. Lodish H, Berk A, Zipursky L, Matsudaira P, Baltimore D, Darnell J. Biología Celular y Molecular. 4th Ed. New York: Freeman and Company eds; 2002. p. 595-7.
27.Ronzitti G, Hess P, Rehmann N, Rossini GP. Azaspiracid-1 alters the E-cadherin pool in epithelial cells. Toxicol Sci. 2007;95(2):427-35.
28. Willinger C, Thamaree S, Schramek H, Gstraunthaler G, Pfaller W. In vitro nephrotoxicity of Russell's viper venom. Kidney Int. 1995;47(2):518-28.
Recibido: 18 de junio de 2008.
Aprobado: 3 de noviembre de 2008.
Dr. C. Oscar Hernández Betancourt. Centro de Inmunología y productos biológicos. Instituto Superior de Ciencias Médicas "Carlos J. Finlay". Camagüey, Cuba.