Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.29 n.1 Ciudad de la Habana ene.-mar. 2010
ARTÍCULOS ORIGINALES
Interacción entre osteoblastos y superficies de titanio: aplicación en implantes dentales
Interaction between osteoblasts and titanium surfaces: application in dental implants
Juan Carlos Vanegas AcostaI; Diego Garzón-AlvaradoII; Martín CasaleIII
IMáster en Ingeniería Biomédica. Grupo de Modelado y Métodos Numéricos en Ingeniería-GNUM. Universidad Nacional de Colombia, Bogotá.
IIDoctor en Ciencias (PhD), Máster en Ciencias, Ingeniero Mecánico. Profesor Adjunto. Facultad de Ingeniería. Universidad Nacional de Colombia, Bogotá.
IIIFacultad de Odontología, Universidad Nacional de Colombia. Bogotá, Colombia.
RESUMEN
La oseointegración de un implante dental está condicionada por el tipo de material del implante, su topografía superficial y el tipo de recubrimiento. Aunque son varios los materiales utilizados para la fabricación de implantes dentales, actualmente el titanio es el material de preferencia por a su comportamiento inerte al entrar en contacto con los tejidos biológicos. Como la topografía superficial influye en la adhesión y proliferación celular, los implantes dentales son sometidos a tratamientos que crean irregularidades superficiales en la escala micro y sub-micrométrica. Así mismo, recubrimientos basados en minerales de origen orgánico son utilizados para mejorar la deposición de hueso sobre el implante. El objetivo de este estudio es realizar el cultivo de células osteoblásticas sobre sustratos de Ti-6Al-4V con cuatro tipos de superficies típicamente usadas en implantes dentales para determinar cuál de ellas tiene mejor comportamiento en términos de adhesión celular, proliferación celular y biomineralización. Las células osteoblásticas fueron cultivadas durante 24 horas para el ensayo de adhesión y durante 1, 2, 5, 6 y 7 días para el ensayo de proliferación. La biomineralización fue evaluada caracterizando mediante stereo zoom y SEM los depósitos de mineral coloreados mediante la técnica de tinción con alizarina roja. La cuantificación de estos depósitos de mineralización se realizó utilizando una herramienta de procesamiento de imágenes. Los resultados obtenidos revelan que las superficies rugosas y con recubrimiento poseen mejor comportamiento. Ninguna de las superficies estudiadas tuvo carácter tóxico para las células y todas presentaron perfiles de adhesión celular, proliferación celular y biomineralización.
Palabras clave: implante dental, morfología superficial, activación de osteoblastos, cultivo celular, oseointegración.
ABSTRACT
The bone integration of dental implants is dependent of type of material of implant, its superficial topography and also by the type of coating. Although there are many the materials used for the manufacture of dental implants, currently the titanium is the choice material by its inert behavior when it contact with biological tissues. As the superficial topography influenced on cellular adhesion and proliferation, the dental implants underwent treatments creating superficial irregularities in the micro and sub-micrometric scale. Likewise, the coats based on organic-origin minerals are used to improve the bone deposition on implant. The aim of present paper is to carry out the osteoblasts cells culture on Ti-6AI-4V substrates using four different types surfaces typically used in dental implants to determine which of them have the better behavior in terms of cellular adhesion, cellular proliferation and biomineralization. The osteoblasts cells were cultivated during 24 hr for the adhesion assay and during 1, 2, 5, 6 and 7 days for the proliferation assay. The biomineralization was assessed by characterization with estereozoom and SEM of the mineral depots colored using dying technique with red alizarin. The quantization of these mineralization depots was performed using a tool of images processing. The results obtained showed that the rough surfaces and coated have a better behavior. None of the study surfaces had a toxic character for cells and all showed cellular adhesion profiles, cellular proliferation and biomineralization.
Key words: Dental implant, superficial morphology, osteoblasts activation, cell culture, bone integration.
INTRODUCCIÓN
Un implante dental es un dispositivo de biomaterial insertado en el hueso mandibular para reemplazar la raíz de un diente ausente y lograr una conexión firme, estable y duradera con el hueso circundante en un proceso denominado oseointegración.1,2 Una adecuada oseointegración está condicionada a la aceptación del implante por parte de los tejidos vivos así como a la formación de nuevo hueso alrededor del implante.2,3 Esta conexión o interfase hueso-implante dental depende de factores biológicos y factores asociados al paciente,1,2,4 el diseño del implante y su superficie,5,6 la distribución de cargas entre el hueso y el implante,6,7 y el procedimiento quirúrgico para colocar el implante.3,8
En esta interfase, durante la cicatrización de los tejidos y la formación del nuevo hueso tienen lugar una serie de eventos biológicos y bioquímicos que pueden ser resumidos en cuatro etapas:9,10 formación del coágulo de sangre, degradación del coágulo (fibrinólisis), formación de tejido granular (fibroplasia y angiogénesis), y síntesis de nuevo hueso y mineralización (modelado y remodelado óseo). Sin embargo, cuando un cuerpo extraño como un implante dental se inserta en el cuerpo humano, su superficie interactúa con los tejidos vivos de tal manera que puede modificar la secuencia de eventos biológicos antes descrita.11,12 Por lo tanto, el éxito de la cicatrización en la interfase hueso-implante dental depende de dos fenómenos adicionales: osteoinducción y osteoconducción.2,12
La osteoinducción es el reclutamiento de células madres que de alguna manera son estimuladas a proliferar como células formadoras de matriz ósea. Si estas células logran colonizar la superficie del implante dental entonces se dice que esta superficie es osteoinductiva2. Por su parte, la osteoconducción se define como la formación de hueso sobre la superficie del implante.2,12 Este último fenómeno depende esencialmente de la biocompatibilidad del material del implante y las características de su superficie.13,14
Varios estudios evaluan la biocompatibilidad de diferentes materiales de uso común en la fabricación de implantes dentales.5,15 Se reporta que el titanio es el mejor material a escoger debido a su alta resistencia a la corrosión causada por el ambiente fisiológico y su estabilidad mecánica durante todo el proceso de cicatrización.16,17 Se conoce además que el niobio, el tantalio, el circonio, el vanadio, el aluminio y el molibdeno son los materiales más favorables para ser usados en aleaciones de titanio con fines biomédicos.18 Aunque estas aleaciones no son tóxicas y son altamente inertes,17,18 muchas de ellas no establecen una fuerte conexión con los tejidos circundantes y pueden llegar a inducir la formación de tejido fibroso en lugar de tejido óseo.19 Para evitar esto, las superficies de los implantes dentales son expuestas a tratamientos superficiales que crean patrones en la superficie metálica del biomaterial en la escala micro y sub-micrométrica. Estos patrones aumentan la retención de moléculas presentes en la interfase hueso-implante dental que conducen a un aumento en el grado de formación de los nuevos tejidos. Adicionalmente, el uso de recubrimientos con minerales inorgánicos mejoran la capacidad osteogénica de la superficie del implante con lo cual su osteoconducción es similar a la de una superficie ósea real.11,20
Una adecuada morfología superficial permite que las células osteogénicas se adhieran y proliferen sobre la superficie del implante,11 se crea así depósitos de mineral que constituyen la base de la formación del nuevo hueso.7,12 Por lo tanto, las estrategias que modifican la superficie del implante conducen a implantes con mejor respuesta osteoinductiva y osteoconductiva, y a tasas de deposición de hueso más elevadas que resultan en una osteointegración completa.20 Comercialmente, existe una amplia variedad de superficies en implantes dentales,12,19-22, muchas de las cuales poseen una comprobada eficiencia clínica.21,22 Sin embargo, varios de los mecanismos por los cuales una superficie es viable para su uso en implantes dentales son aún motivo de investigación.19 Debido a esto, la validación de nuevas superficies está basada en pruebas experimentales con el uso de técnicas de cultivo celular y modelos animales que en ningún caso están estandarizados.22-24 Por lo tanto, el estudio comparativo de diferentes superficies es la manera más acertada para realizar una evaluación formal del comportamiento de diferentes tratamientos superficiales y recubrimientos,21 metodología que curiosamente no es muy común en la literatura.22
El propósito de este estudio es analizar cuatro diferentes tipos de superficies de implantes dentales mediante ensayos de adhesión celular, proliferación celular y biomineralización con técnicas de cultivo celular y describir el comportamiento de cada una de las superficies en un ambiente similar al fisiológico y así como determinar cuál de ellas tiene mejor respuesta en términos de las propiedades osteoinductiva y osteoconductiva.
MATERIALES Y MÉTODOS
Sustratos
En este estudio se emplearon como sustratos 120 discos de Ti-6Al-4V con 15 mm de diámetro y 2 mm de espesor. Estos sustratos se dividieron en cuatro grupos de acuerdo a su morfología superficial: (1) maquinado, (2) superficie tratada con chorro de arena y grabado ácido (SBAE), (3) superficie recubierta con hidroxiapatita (HA) y fosfato tricálcico (TCP), y (4) superficie recubierta con TCP y tratada con grabado ácido (TCP + ácido). Todos los sustratos fueron proporcionados por MIS Technologies Ltda. de Shlomi, Israel. La superficie maquinada se obtuvo con un dispositivo de corte y pulido. La rugosidad y microgeometría de la superficie SBAE se obtuvo por la acción abrasiva de partículas de Al2O3 (300-400 mm) seguidas de grabado con HCl/H2SO4. La superficie TCP se obtuvo por abrasión de partículas de HA/TCP (200-400 mm). La superficie TCP + ácido se obtuvo mediante abrasión con partículas de HA/TCP (200-400 mm) y limpieza con HNO3.
Luego de su fabricación, los sustratos fueron esterilizados con radiación gamma y empacados al vacío en un ambiente limpio. Antes de ser utilizados en los experimentos descritos más adelante, los sustratos fueron distribuidos en porta muestras para cultivo celular de 24 pozos (Costar Corp., Cambridge, MA, EUA). Estos porta muestras fueron expuestos a radiación UV durante 12 horas y luego autoclavados a 120 °C durante 6 horas.
Caracterización de superficies
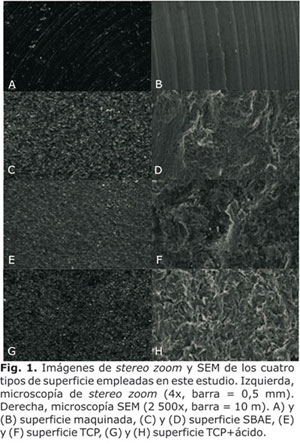
La caracterización de la morfología superficial de cada tipo de sustrato se realizó de dos formas. Primero, se utilizó un microscopio de estereo zoom tipo Zeiss Stemi SV11 con un lente de magnificación de 4x, y con la ayuda de una cámara de acople tipo Zeiss AxioCam MRC5. De esta forma se obtuvieron imágenes (2,0 × 1,5 mm de campo visual) de la macro estructura de las superficies. Luego, con el uso de un microscopio electrónico de barrido SEM tipo LEICA Stereo Scan 440 a 20KV se obtuvieron imágenes de la micro estructura de las superficies a una escala de 10 mm.
Cultivo celular
Para el cultivo celular se obtuvieron células osteoblásticas derivadas de cementoblastoma mediante una técnica convencional de explante y caracterizadas según se reporta en otros artículos.23,24 Durante este procedimiento se siguieron las consideraciones éticas aprobadas por la Comisión de revisión interna de la Escuela de Odontología de la Universidad Nacional Autónoma de México.24 Las células fueron cultivadas en frascos para cultivo de 75 cm2 con medio de Eagle modificado por Dulbecco (DMEM) suplementado con suero fetal bovino (SFB) al 10 % y una solución de antibiótico compuesta por 100 mg/mL de estreptomicina y 100 U/mL de penicilina (Sigma Chemical Co., St. Louis, MO, EUA). Las células fueron incubadas a 37 °C en un ambiente con 95 % de aire y 5 % de CO2. En todos los ensayos se utilizaron células del segundo pasaje.
Adhesión celular
Tres muestras de cada unos de los cuatro tipos de sustrato fueron usados en este ensayo. Para este ensayo las células fueron sembradas e incubadas durante 24 horas en 500 µL de medio de cultivo bajo condiciones estándar, como se describió anteriormente. Luego de la incubación, las células sin adherir al sustrato fueron retiradas mediante cuatro lavados con agua estéril. Las células que permanecieron adheridas al sustrato fueron fijadas y teñidas con 300 µL de una solución compuesta por 0,1 % de azul de toluidina y 3,5 % de paraformaldehido.25,26 Luego de 24 horas a temperatura ambiente, 100 µL del sobrenadante fueron usados para medir la absorción óptica a 630 nm mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA), esto debido a que el número de células adheridas al sustrato es proporcional a la absorbancia de las muestras experimentales a 630 nm.26
Proliferación celular
Tres muestras de cada uno de los cuatro tipos de sustrato fueron utilizados en este ensayo. Este ensayo está basado en la habilidad de las dehidrogenasas mitocondriales para oxidar el tiazol azul (MTT), una sal de tetrazolio (bromuro de 3-(3,5+di-metiltiazol-2-il)-2,5-difeniltetrazolio), en formazán azul.26 Para este ensayo, las células fueron sembradas de forma similar al ensayo de adhesión e incubadas durante 1, 2, 5, 6 y 7 días. Diariamente se agregó medio fresco y anticuerpo (500 µl) a los cultivos. Al final de cada término, las células fueron incubadas con 60 µl de MTT a 37 °C durante 4 horas. Luego, se removió el sobrenadante y se agregaron 250 de µl de dimetil sulfóxido (DMSO) a cada pozo. Luego de 30 minutos de incubación, se midió la absorbancia a 570 nm. Debido a que la generación de formazán azul es proporcional a la actividad de las dehidrogenasas, la disminución en la absorbancia a 570 nm proporciona una medida directa de la tasa de proliferación.27
Biomineralización
Para el ensayo de biomineralización se utilizaron dos muestras de cada uno de los cuatro tipos de sustratos. Las células fueron cultivadas en 500 µl de medio DMEM suplementado con 10 % de SFB con solución de antibiótico, 10 mM de b-glicerofosfato, 50 µl/mL de ácido ascórbico, y 10-7 M de dexametasona. Los cultivos fueron incubados a 37 °C durante 5 y 15 días, y diariamente se les agregó medio fresco y anticuerpo (500 µl).28 La biomineralización se evaluó después de 5 y 15 días de cultivo. Luego de cada término, el sobrenadante se removió y las células fueron deshidratadas usando etanol. Posteriormente, las muestras fueron cubiertas con alizarina roja, pH 4,1, y mantenidas a temperatura ambiente durante 24 horas. La tinción con alizarina roja es técnica histoquímica muy utilizada para detectar depósitos de calcio debido a que tiñe los cristales de calcio creados durante el proceso de biomineralización.29 Una vez teñidas, las muestras fueron lavadas cinco veces con SFB para eliminar el exceso de alizarina roja. Los cristales teñidos fueron caracterizados con el uso de un microscopio de estereo zoom (Zeiss Stemi SV11). Para el caso de las superficies TCP y TCP + ácido los cristales también se observó con un microscopio electrónico de barrido (LEICA Stereo Scan 440). Los cristales coloreados fueron cuantificados digitalmente con el software ImageJ (National Institutes of Health, EUA) a través del cual se obtuvo el porcentaje del total del área de la imagen que contiene deposición de mineral. Para este análisis se usaron dos imágenes de estereo zoom tomadas tras 5 y 15 días de cultivo por cada uno de los cuatro tipos de sustrato.
Análisis estadístico
Los datos obtenidos mediante los ensayos descritos se evaluaron con un valor p < 0,05 para evaluar la significancia estadística. Para los análisis estadísticos la empleó el estadígrafo Student's t-test presente en el programa SigmaStat V3.5 (Systat Software, Richmond, CA, EUA).
RESULTADOS
Morfología superficial
La morfología superficial de los cuatro tipos de sustrato se caracterizó con microscopio de estereo zoom y SEM. En la superficie maquinada a macro escala se observaron estructuras onduladas radiales e igualmente espaciadas creadas durante los procesos de cortado y pulido en la fabricación del sustrato (ver Fig. 1A). Las imágenes obtenidas con SEM muestran el perfil ondulado y paralelo de estas estructuras a escala micrométrica (Fig. 1B). En la superficie SBAE la observación a macro escala mediante estereo zoom reveló una superficie con perfil granular (Fig. 1C). A escala micrométrica, estos gránulos aparecieron como estructuras superficiales de tipo "pico y valle" debido al proceso abrasivo durante la fabricación del sustrato (Fig. 1D). En el caso de la superficie TCP se encontraron irregularidades con bordes y cortes como en la superficie SBAE (Fig. 1E y 1F). Finalmente, la observación de la superficie TCP+ ácido mostró la más compleja de las texturas superficiales. A través del estereo zoom se observó una superficie con un denso perfil granular (Fig. 1G) asociada a numerosas irregularidades con bordes y cortes observadas mediante SEM (Fig. 1H).
Adhesión y proliferación celular
Ensayos de adhesión y proliferación celular se realizaron para evaluar las primeras interacciones de las células osteoblásticas con la superficie del biomaterial. Para el ensayo de adhesión, el número de células adheridas a los sustratos se evaluó luego de 24 horas de cultivo. Los resultados se muestran en la figura 2 y están dados en término de la absorbancia medida a 630 nm. Se encontró diferencia estadística entre todos los resultados (p < 0,05, intervalo de confidencia del 95 %). La adhesión de osteoblastos es favorecida por las superficies TCP y TCP + ácido, lo que supera en más de 4 y 5 veces respectivamente el nivel de adhesión celular que se encontró en la superficie maquinada. Esto sugiere un incremento en la interacción celular como consecuencia de la presencia de bordes y cortes en la superficie del biomaterial. Además, demuestra que la adhesión en superficies con poco tratamiento superficial es menor, lo que corrobora la importancia de las estructuras a micro y sub-micro escala sobre el sustrato de prueba.20,22
La figura 3 muestra los resultados del ensayo de proliferación celular tras 1, 2, 5, 6 y 7 días de cultivo. Los valores estuvieron dados en términos de la absorbancia a 570 nm, una medida proporcional a la actividad metabólica de las células viables, inversamente proporcional a la toxicidad del material.30 Como se muestra, todas las superficies tienen una proliferación negativa luego de 1 y 2 días de cultivo, posiblemente a causa de la muerte celular durante la confluencia inicial de la siembra. Sin embargo, para la superficie maquinada, la superficie SBAE y la superficie TCP entre los días 2 y 5 de cultivo, los niveles de proliferación aumentaron casi linealmente hasta alcanzar un máximo de proliferación en el día sexto de cultivo, después del cual los niveles disminuyeron ligeramente hasta el día 7 de cultivo. Se encontró además que el máximo de proliferación fue mayor en la superficie SBAE. En contraste a lo anterior, el perfil de proliferación de la superficie TCP + ácido mostró una lenta disminución entre los días 1 y 2 de cultivo luego de lo cual aumentó de forma exponencial hasta el día 7 de cultivo. No se encontraron diferencias estadísticas significativas entre los resultados.
Biomineralización
El ensayo de biomineralización se llevó a cabo luego de 5 y 15 días de cultivo con alizarina roja como marcador de los cristales de mineral. La figura 4 muestra la caracterización mediante microscopio de estereo zoom de la morfología de estos cristales. En términos cualitativos, en todas las superficies la presencia de cristales (apariencia roja de las dos columnas de la figura 4) es mayor en el día 15 de cultivo comparada con el día 5 de cultivo.31 Sin embargo, para las superficies maquinada (Fig. 4A y 4B) y SBAE (Fig. 5C y 5D), el proceso de mineralización durante el intervalo de tiempo de cultivo que se analiza no alcanzó a cubrir completamente la superficie de los sustratos, de manera que parte de las líneas paralelas presentes en la superficie maquinada (Fig. 4B) y parte de la apariencia granular de la superficie SBAE (Fig. 4D) son aún visibles al cabo de 15 días de cultivo. Para las superficies TCP (Fig. 4E y 4F) y TCP+ácido (Fig. 4G y 4H) esto no sucede y de hecho la mineralización aparece distribuida de manera homogénea sobre los sustratos luego de 15 días de cultivo (Fig. 4F y 4H). Debido a esta distribución homogénea del mineral, la formación de cristales sobre estas dos superficies se observó en detalle con el uso de microscopía SEM (Fig. 5). De esta forma, y luego de 5 días de cultivo (Fig. 5A y 5C), se encontraron extensiones celulares que cubrían parte de las superficies denotando un estado de proliferación previo al comienzo de formación de mineral.7 Por su parte, luego de 15 días de cultivo se encontraron cristales de alizarina roja en la escala microscópica que indican la presencia de nódulos de mineralización debajo de ellos (Fig. 5B y 5D).
De acuerdo a los resultados de la figura 6 las superficies TCP y TCP + ácido poseyeron una mayor actividad de mineralización, las imágenes de estereo zoom tomadas a estos dos tipos de sustratos fueron analizadas con el software ImageJ. Cada imagen fue escalada para ajustar las unidades. Se realizó segmentación de la imagen mediante umbrales de color y se usó como referencia un depósito de mineral (rojo oscuro) que se aprecia en la figura 5B. Las áreas mineralizadas se detectaron mediante la herramienta de medición de áreas. Los resultados mostrados en la figura 6 corresponden al porcentaje de área total de la imagen cubierto por mineral.
De acuerdo con la figura 6, luego de 5 y 15 días de cultivo el porcentaje de área total cubierto por mineral fue mayor en la superficie TCP que en la superficie TCP + ácido. Esto es plausible ya que el ensayo de actividad de la fosfatasa alcalina mostró una mayor actividad en la superficie TCP. Hubo ausencia de diferencia estadística significativa en las áreas medidas para la superficie TCP + ácido luego de 5 días y 15 días de cultivo (p < 0,667), por lo que se estima una baja tasa de formación de mineral en este tipo de sustrato. Este hecho concuerda con el bajo perfil de proliferación mostrado por la superficie TCP + ácido (figura 3) y la considerablemente baja variación en la actividad ALP entre los días 5 y 15 de cultivo en comparación con la superficie TCP.
DISCUSIÓN
Este estudio está basado en los resultados obtenidos de pruebas in vitro de la activación de células osteogénicas en función de la morfología superficial del implante. Se reporta que para que exista una adecuada oseointegración y osteogénesis los implantes dentales deben tener superficies con patrones de rugosidad similares a los dejados en la superficie del hueso durante el proceso de resorción y remodelado.19,20 Por lo tanto, estos patrones deben tener dimensiones en la escala micrométrica con bordes y cortes en la escala sub-micrométrica.20 La caracterización de las superficies analizadas mediante SEM mostró la existencia de micro estructuras en cada una de los cuatro tipos de superficie (figura 1). En la superficie maquinada, estas micro estructuras correspondieron a estructuras onduladas paralelas separadas aproximadamente 5-10 mm. Los resultados para las superficies SBAE, TCP y TCP + ácido muestran numerosas irregularidades del tipo pico y valle, aunque la densidad de estas irregularidades es menor en la superficie SBAE y mayor en la superficie TCP + ácido. Este cambio en la densidad del patrón de rugosidad corresponde a las variaciones en la cantidad de irregularidades superficiales creadas por los procesos de abrasión y corrosión.
Debido a que las irregularidades en escala sub-micrométrica influencian la creación de contactos focales y por lo tanto, la adhesión celular, la deformación del citoesqueleto de las células y su orientación,19 la superficie maquinada presentó el rendimiento más bajo en términos de adhesión celular (figura 2). Además, como la presencia de recubrimientos basados en HA/TCP en las superficies TCP y TCP + ácido incrementó la osteoinducción,19 los perfiles de adhesión en estos dos tipos de superficie fueron mayores. A partir de los resultados presentados se infiere que la presencia de una morfología superficial en la escala sub-micrométrica y el uso de recubrimientos basados en HA/TCP aumenta la adhesión celular 5,8 veces con respecto a una superficie sin patrones de rugosidad y sin recubrimiento. Estos resultados confirman que una adecuada superficie de implante dental no sólo debe poseer una morfología superficial caracterizada por la presencia de patrones de rugosidad sino también un recubrimiento osteoconductivo que proporcione la respuesta bioactiva, es decir, que promueva la formación de compuestos basados en HA en la superficie del biomaterial al entrar en contacto con el tejido óseo in vivo.19,20
Por otra parte, para determinar la biocompatibilidad de las muestras, se evaluó la proliferación celular luego de 1, 2, 5, 6 y 7 días de cultivo. Debido a que el titanio y sus aleaciones poseen una comprobada biocompatibilidad,18 y específicamente la aleación Ti-6Al-4V posee una adecuada apacidad osteogénica.31 La superficie maquinada se considera como el control del ensayo de proliferación. En la figura 3 se observa que las cuatro superficies tuvieron un perfil de proliferación creciente y en los casos de las superficies SBAE, TCP y TCP + ácido los valores siempre se encontraron por encima de los valores del perfil de control, según lo cual, en principio, ninguna de las superficies es tóxica para las células osteoblásticas.30 Se encontró que luego de 5 días de cultivo, la proliferación celular en las superficies maquinada, SBAE y TCP decrece hasta un aparente nivel de saturación en el día 7, que puede estar en relación con la muerte celular debido a una elevada confluencia celular en el área de los sustratos. A pesar que la superficie TCP + ácido parece alcanzar el mismo nivel de saturación en el día 7 de cultivo, su comportamiento de carácter exponencial indica que el mecanismo particular de proliferación celular en este tipo de superficie difiere del que existió en las demás. Además, aunque es sobre la superficie TCP + ácido que se encontró el mejor perfil de adhesión, fue sólo hasta después del día 5 de cultivo que las células comenzaron a proliferar.
Este retraso en la proliferación se refiere tambien por otros autores32,33 como una consecuencia de la elevada rugosidad superficial creada por la acción combinada de las técnicas de abrasión y corrosión34 durante la fabricación de la superficie TCP + ácido. Aunque el mecanismo de señalización del retraso en la proliferación es aún desconocido, puede que sea causado por el aumento en las fuerzas de contacto que inducen el reordenamiento de las células y retrasan o incluso restringen el ciclo celular.32,35 No obstante, esta reducción en el perfil de proliferación para la superficie TCP + ácido no fue suficiente argumento para considerarla como no biocompatible ya que luego de 7 días de cultivo las células alcanzó un nivel de confluencia, lo cual sólo es posible si las células permanecen viables durante todo el tiempo de cultivo.27
Luego de la proliferación, las células osteoblásticas comienzaron la deposición y mineralización de la nueva matriz ósea.7 La biomineralización fue esencial para el rendimiento óptimo del implante dental, pues crea una conexión viable entre el hueso vivo y la superficie del implante que precede la oseointegración.3,7,9 La habilidad de las células osteoblásticas para producir nódulos de mineralización fue evaluada mediante la caracterización de los depósitos de mineral. Mediante el ensayo de biomineralización se encontró que la superficie maquinada y SBAE poseyeron una baja deposición de mineral luego de 15 días de cultivo como se muestra en la figura 4. Por su parte, la observación mediante SEM de las superficies TCP y TCP+ácido (figura 5) mostró la evolución temporal de la formación de cristales de mineral desde el día 5 de cultivo hasta el día 15. La agregación de estos cristales (figuras 5B y 5D) es una prueba de la osteoconductividad del sustrato por tanto las células osteoblásticas proliferaron sobre la superficie al punto que inician la síntesis de nódulos de mineral, respuesta propia de los osteoblastos maduros.7,19 El análisis cuantitativo de estos cristales que se realizó mediante el procesamiento de imágenes resumido en la figura 6 confirma que la superficie TCP es más favorable para la actividad osteoblástica que la superficie TCP + ácido ya que el porcentaje de área total cubierta por depósitos de mineral es 2,74 veces mayor que el de la superficie TCP + ácido.
CONCLUSIONES
En el presente trabajo se analizó la respuesta biológica de células humanas con carácter osteoblástico sobre cuatro superficies de implantes dentales comunes para determinar aquella con mejor comportamiento en términos de adhesión celular, proliferación celular y biomineralización. Los resultados del ensayo de adhesión celular mostraron que las células osteoblásticas se adhieren a las superficies TCP y TCP + ácido de mejor forma que sobre las superficies maquinadas y SBAE. De acuerdo a esto se concluyó que las superficies TCP y TCP + ácido demostraron tener una mejor osteoinducción. El ensayo de proliferación celular mostró que luego de 7 días de cultivo la superficie TCP + ácido poseyó la menor tasa de proliferación, debido a su mayor rugosidad superficial.32-34 El proceso de biomineralización se evaluó luego de 5 y 15 días de cultivo con el fin de determinar la formación de nódulos de mineral sobre las superficies. Las diferencias entre las respuestas osteoblásticas de los cuatro tipos de sustratos, caracterizadas por el adecuado perfil de adhesión de la superficie TCP y su considerable alta tasa de proliferación tras 7 días de cultivo, fueron confirmadas por los resultados del ensayo de biomineralización a partir del cual la superficie TCP fue más favorable para la mineralización. La cuantificación de los depósitos minerales así lo demuestra ya que el porcentaje de área total de las muestras cubierto por mineral fue 2,1 veces más alto en la superficie TCP que en la superficie TCP + ácido. Por lo tanto, los resultados obtenidos en este trabajo sugieren que la superficie TCP promueve la formación de depósitos minerales, es decir, la osteoconducción, a una tasa mayor que las superficies maquinada, SBAE y TCP + ácido. Aunque la formación de matriz ósea mineralizada es el proceso más importante para obtener una adecuada oseointegración.2,3 Ninguna de las superficies analizadas fue tóxica para las células osteoblásticas y todas permitieron la adhesión, proliferación y biomineralización. No obstante, es necesario realizar análisis adicionales para establecer el comportamiento de las superficies a largo plazo, ya que la respuesta temprana de las células osteoblásticas aquí presentada no necesariamente predice el grado de oseointegración de un determinado sustrato.
AGRADECIMIENTOS
Los autores agradecen al Dr. Higinio Arzate del Laboratorio de Biología Periodontal y Tejidos Mineralizados de la Facultad de Odontología de la Universidad Nacional Autónoma de México por su colaboración en la realización de los ensayos in vitro, y a la Dra. Cristina Piña del Instituto de Investigaciones en Materiales de la Universidad Nacional Autónoma de México por su colaboración en los análisis de microscopía. Agradecimiento especial para MIS Implants Technologies Ltd. y su Departamento de Investigaciones y Desarrollo por proporcionar las muestras utilizadas en este trabajo. J. C. Vanegas fue financiado por el proyecto de investigación 202010011460 de la Universidad Nacional de Colombia.
REFERENCIAS BIBLIOGRAFICAS
1. Schenk RK, Buser D. Osseointegration: a reality. Periodontology 2000. 1998;17:22-35.
2. Albrektsson T, Johansson C. Osteoinduction, osteoconduction and osseointegration Eur. Spine J. 2001;10:S96-S101.
3. Branemark PI. Osseointegration and its experimental background. J. Prosthet Dent. 1983;50(3):399-410.
4. Cooper L. Biological determinants of bone formation for osseointegration: Clues for future clinical improvements. J. Prosthet Dent. 1998;80(4):439-49.
5. Matsuno H, Yokoyama A, Watari F, Uo M, Kawasaki T. Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium. Biomaterials. 2001;22:1253-62.
6. Gapski R, Wang HL, Mascarenhas P, Lang N. Critical review of immediate implant loading. Clin Oral Impl Res. 2003;14:515-27.
7. Sikavitsas V, Temenoff J, Mikos A. Biomaterials and bone mechanotransduction. Biomaterials. 2001;22:2581-93.
8. Fragiskos FD, Alexandridis C. Osseointegrated Implants. En: Fragiskos FD, Alexandridis C. Oral Surgery. Springer Berlin, Heidelberg; 2007.
9. Lang N, Araujo M, Karring T. Alveolar bone formation. En: Lindhe J, Karring T, Lang N. Clinical Periodontology and Implant Dentistry. Blackwell Munksgaard; 2003.
10. Aukhil I. Biology of wound healing. Periodontology 2000. 2000;22:44-50.
11. Kasemo B. Biological surface science. Surface Science. 2002;500:656-77.
12. Davies J. Understanding peri-implant endosseous healing. Journal of dental education. 2003;67(8):932-49.
13. Huang Y, Xiropaidis AV, Sorensen RG, Albandar JM, Hall J, Wikesjö U. Bone formation at titanium porous oxide (TiUnite) oral implants in type IV bone. Clin Oral Impl Res. 2005;16:105-11.
14. Wennerberg A, Albrektsson T, Lindhe J. Surface topography of dental implants. En: Lindhe J, Karring T, Lang N. Clinical Periodontology and Implant Dentistry. Blackwell Munksgaard; 2003.
15. Metikos-Hukovic M, Kwokal A, Piljac J. The influence of niobium and vanadium on passivity of titanium-based implants in physiological solution. Biomaterials. 2003;24:3765-75.
16. Hansson HA, Albrektsson T, Branemark PI. Structural aspects of the interface between tissue and titanium implants. J Prosthet Dent. 1983;50(1):108-13.
17. Watari F, Yokoyama A, Omori M, Hirai T, Kondo H, Uo M, Kawasaki T. Biocompatibility of materials and development to functionally graded implant for biomedical application. Composites Science and Technology. 2004;64:893-908.
18. Niinomi N. Recent research and development in titanium alloys for biomedical applications and healthcare goods. Science and Technology of Advanced Materials. 2003;4:445-54.
19. Ellingsen J, Thomsen P, Lyngstadaas P. Advances in dental implant materials and tissue regeneration. Periodontology 2000. 2006;41:136-56.
20. Davies J. Bone bonding at natural and biomaterial surfaces. Biomaterials. 2007;28:5058-67.
21. Liu X, Chu PK, Ding C. Surface modification of titanium, titanium alloys, and related materials for biomedical applications. Materials Science and Engineering R. 2004;47:49-121.
22. Guéhennec LL, Soueidan A, Layrolle P, Amouriq Y. Surface treatments of titanium dental implants for rapid osseointegration. Dental Materials. 2007;23:844-54.
23. Arzate H, Alvarez-Pérez MA, Aguilar-Mendoza ME, Alvarez-Fregoso O. Human cementum turmo cells have different features from human osteoblastic cells in vitro. J Periodont Res. 1998;33:249-58.
24. Arzate H, Alvarez-Pérez MA, Alvarez-Fregoso O, Wusterhaus-Chávez A, Reyes-Gasga J, Ximénez-Fyvie LA. Electron microscopy, micro-analysis and X-ray diffraction characterization of the mineral-like tissue deposited by human cementum tumor-derived cells. J Dent Res. 2000;79:28-34.
25. Hayman EG, Engvall E, A'Hearn E, Barnes D, Pierschbacher M, Ruoslahti E. Cell attachment on replicas of SDS polyacrylamide gels reveals two adhesive plasma proteins. J Cell Biol. 1982;95:20-3.
26. Rodil SE, Olivares R, Arzate H, Muhl S. Properties of carbon films and their biocompatibility using in vitro tests. Diamond and Related Materials. 2003;12:931-7.
27. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 1983;65:55-63.
28. Alvarez-Pérez MA, Pitaru S, Alvarez-Fregoso O, Reyes J, Arzate H. Anti-cementoblastoma-derived protein antibofy partially inhibits mineralization on a cementoblastic cell line. Journal of structural biology. 2003;143:1-13.
29. Goug JE, Jones JR, Hench LL. Nodule formation and mineralisation of human primary osteoblasts cultured on a porous bioactive glass scaffold. Biomaterials. 2004; 25: 2039-46.
30. Rodil SE, Olivares R, Arzate H. In vitro cytotoxicity of amorphous carbon films. Biomedical materials and engineering. 2004;15:101-12.
31. Ahmad M, McCarthy M, Gronowicz G. An in vitro model for mineralization of human osteoblast-like cells on implant materials. Biomaterials. 1999;20:211-20.
32. Aita H, Hori N, Takeuchi M, Suzuki T, Yamada M, Anpo M, Ogawa T. The effect of ultraviolet functionalization of titanium on integration with bone. Biomaterials. 2009;30:1015-25.
33. Washburn NR, Yamada KM, Simon Jr. CG, Kennedy SB, Amis EJ. High-throughput investigation of osteoblast response to polymer crystallinity: influence of nanometer-scale roughness on proliferation. Biomaterials. 2004;25:1215-24.
34. Bächle M, Kohal RJ. A systematic review of the influence of different titanium surfaces on proliferation, differentiation and protein synthesis of osteoblast-like MG63 cells. Clin Oral Implants Res. 2004;15(6):683-92.
35. Siebers M, Brugge P, Walboomers X, Jansen J. Integrins as linker proteins between osteoblasts and bone replacing materials. A critical review. Biomaterials. 2005;26:137-46.
Recibido: 10 de noviembre de 2009.
Aprobado: 12 de diciembre de 2009.
Juan Carlos Vanegas. Grupo GNUM, Facultad de Ingeniería, Universidad Nacional de Colombia. Bogotá E mail: jcvanegasa@bt.unal.edu.co