Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.29 n.1 Ciudad de la Habana ene.-mar. 2010
ARTÍCULOS ORIGINALES
Modelo matemático del patrón de crecimiento de canales cartilaginosos y centros secundarios de osificación
Mathematical model of growth pattern of cartilaginous channels and ossification secondary centers
Liliana Mabel Peinado CortésI; Diego Alexander Garzón AlvaradoII; Rosy Paola Cárdenas SandovalIII
IIngeniera Electrónica. Facultad de Medicina. Universidad Nacional de Colombia, Bogotá.
IIDoctor en Ciencias (PhD), Máster en Ciencias, Ingeniero Mecánico. Profesor Adjunto. Facultad de Ingeniería. Universidad Nacional de Colombia, Bogotá.
IIIFisioterapeuta, Ingeniera de Sistemas. Facultad de Medicina. Universidad Nacional de Colombia. Bogotá.
RESUMEN
La biomatemática, en el caso del tejido esquelético, explica la morfogénesis de huesos largos, y explora aspectos sobre la aparición del centro secundario de osificación (SOC). Precisamente, el SOC es el principal responsable del crecimiento de la epífisis de los huesos largos. En este trabajo se presenta un modelo matemático de la formación de canales de cartílago y del patrón de crecimiento del SOC desde el enfoque biomecánico. La solución al modelo de formación de canales se basa en un Método Híbrido -Elementos Finitos y Autómatas celulares-. Mientras, la solución del crecimiento del SOC se resuelve mediante el Método de Elementos Finitos. Como resultado se obtienen patrones espacio-temporales de formación de canales y del crecimiento del SOC. Estos modelos concuerdan cualitativamente con resultados experimentales reportados. Se concluye que estos modelos pueden ser utilizados como base metodológica para plantear un modelo matemático completo del desarrollo epifisial.
Palabras clave: centro secundario de osificación, canales de cartílago, biomatemática.
ABSTRACT
The bio-mathematics, in the case of skeletal tissue, explains the morphogenesis of large bones and explores features on the appearance of ossification secondary centers (OSC). Precisely, the OSC is the main responsible of growth of large bone epiphysis. In present paper authors present a mathematical model of cartilage channels formation and the growth pattern of OSC from the biomechanical approach. Solution to channels formation model is based on a Hybrid Method-Finite Elements and cell Automaton. While, the solution of OSC growth is solved by means of the Finite Elements Method. The result achieved was the presence of space-temporary patterns of channels formation and OSC growth. These models agree qualitatively with the reported experimental results. We conclude that these models may be used as a methodological basis to propose a complete mathematical model of epiphyseal development.
Key words: Ossification secondary center, cartilage channels, biomathematics.
INTRODUCCIÓN
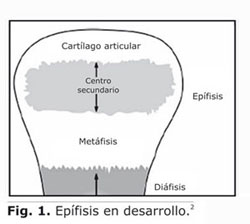
En los huesos largos, el centro secundario de osificación (SOC) se desarrolla dentro del cartílago epifisial (E.C) y se encuentra delimitado en la parte superior por el cartílago articular (A.C) y en la parte inferior por el fisis metafisial o plato de crecimiento metafisial (GP-Metaphyseal)1 (Fig. 1). Este plato de crecimiento metafisial permanece activo hasta la pubertad cuando cesa la división de células y la producción de matriz, y el cartílago se reemplaza gradualmente por tejido óseo.2 Este proceso de reemplazo se conoce como osificación endocondral (OE).1
El proceso de osificación endocondral se regula por fases sucesivas de proliferación, hipertrofia y muerte de condrocitos.3 El evento inicial que conlleva al desarrollo de la fase de hipertrofia en la zona central de la epífisis consiste en la aparición y formación de los canales de cartílago dentro del cartílago epifisial. La aparición de un canal de cartílago ocurre en sitios específicos del pericondrio. Sin embargo, no se conoce la razón específica que explique por qué se presentan estos brotes en algunos lugares del pericondrio.4 Los canales de cartílago se extienden dentro de la matriz del cartílago hacia la zona central de la epífisis.4-6 La expansión de estos canales se presenta a partir de la respuesta celular a esfuerzos mecánicos soportados por el hueso debido a la carga ejercida por los músculos adyacentes en la tracción del movimiento.3,7
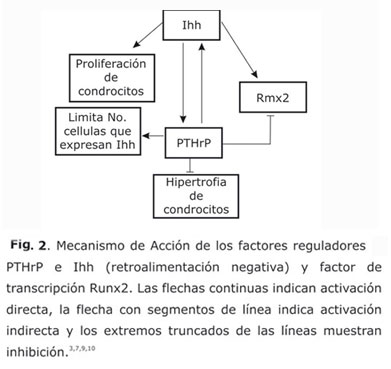
Los canales de cartílago transportan factores biológicos hacia la zona central.4,8 En la zona más interna de la epífisis, los canales liberan factores principalmente las metaloproteinasas de matriz tipo 9 (MMP9) y el factor de transcripción Runx25,6 que inician la hipertrofia. El Runx2 constituye un modulador positivo de hipertrofia y coayuda a la expresión del factor Ihh,3 quien induce la expresión del factor de la hormona paratiroidea péptida relacionada (PTHrP) en las células pericondriales de la región periarticular.3,9 El PTHrP reduce la tasa de hipertrofia de condrocitos, lo que inhibe la expresión de Runx2 y limita el número de células que expresan Ihh.3,7,9 Por tanto, existe una retroalimentación negativa entre la expresión de Ihh y la expresión de PTHrP, y entre PTHrP y el factor Runx23,7 (Fig. 2).
Precisamente, la difusión del Runx2 hipertrofia las células desde el centro hacia la periferia producie un aumento en la extensión del SOC. Esta expansión uniforme de condrocitos hipertróficos causa un patrón de crecimiento radial del SOC.4 Este patrón de crecimiento del SOC se puede describir mediante un modelo matemático que predice su comportamiento espacio-temporal (Patrón de Turing).11
De este modo, en un tiempo específico, se presenta un cambio que se denomina polaridad epifisial, en el cual la zona de hipertrofia cambia su patrón de crecimiento de forma radial a hemisférica.1,6 Es decir, la difusión del Runx2 produce hipertrofia de las células desde el centro hacia la periferia, hasta que encuentra el patrón de localización de PTHrP que inhibe este proceso y por tanto, se presenta la polaridad. De otro lado, la hipertrofia también se inhibe al hallar esfuerzos mecánicos: bajos esfuerzos cortantes y altos niveles de presión.3
En este trabajo nos proponemos plantear un modelo matemático que simule dos procesos biológicos. Primero, la relación entre la formación de los canales con los esfuerzos mecánicos a los que se encuentran sometidos y el recorrido de factores de hipertrofia. Segundo, el patrón de crecimiento del SOC dentro de la epífisis de los huesos largos.
MÉTODOS
Modelo matemático de formación de canales de cartílago e hipertrofia de condrocitos centrales
El modelo matemático de formación de los canales y de aparición de factores de hipertrofia se compone de dos partes. Primero, la descripción matemática del comportamiento poroelástico del cartílago bajo esfuerzos mecánicos existentes que actúan en la epífisis de los huesos. Segundo, el modelo matemático que se utiliza en el autómata celular para describir la expansión de los canales y la presencia de factores de hipertrofia en los extremos mediales de los canales.
Modelo matemático del patrón de crecimiento del SOC
La hipótesis del patrón de crecimiento del SOC se simula mediante un conjunto de ecuaciones diferenciales acopladas que describen la interacción entre el sistema de señalización hormonal, el sistema mecánico y el sistema biológico.
Desde el sistema de señalización hormonal se simuló la aparición del patrón de concentración de PTHrP e Ihh en la epífisis al usar ecuaciones de reacción-difusión en el espacio de Turing.12 Además, se simuló la evolución de Runx2 que se libera por los condrocitos hipertróficos, y por los canales de cartílago. El Runx2, causante de hipertrofia, se inhibe por la presencia de PTHrP, por lo cual disminuye la tasa de hipertrofia. La tasa de hipertrofia disminuye como consecuencia de las altas presiones que sufre la matriz de cartílago. Para simular los esfuerzos mecánicos, se implementó computacionalmente un modelo de poroelasticidad, que tiene en cuenta el flujo al interior del cartílago y los esfuerzos soportados por el tejido (Fig. 3).
Descripción de la simulación
Con el fin de implementar el modelo de crecimiento de canales y el modelo del patrón de crecimiento del SOC se utilizó una malla bidimensional de elementos lineales cuadriláteros de cuatro nodos. La malla se extendió sobre la geometría (16 mm de ancho y 20 mm de alto) de una epífisis de un mamífero12 (Fig. 4). A partir de esta malla se obtuvieron 3 990 nodos y 3 864 elementos cuadriláteros que miden en promedio 0,02 mm.
Los esfuerzos mecánicos presentes y el crecimiento del SOC se obtuvieron por medio de los elementos finitos con el uso de una rutina de usuario. Se realizó una simulación 2D de la respuesta del cartílago epifisial bajo esfuerzo cortante octaédrico y presión hidrostática. Para ello, se consideró en la simulación que el cartílago epifisial es un material continuo y homogéneo. Además, se aplicaron las cargas en el arco superior que definió la zona del cartílago articular. La carga que se aplicó en la simulación se obtuvo del reporte de Shefelbine y Carter14 que corresponde a la presión de 1 Mpa en el pericondrio. Los parámetros mecánicos del tejido se definieron por: E= 10MPa, G= 4,2844 MPa y K= 0,005.
RESULTADOS
En la Figura 5A se observa que a medida que transcurrió el tiempo se incrementó el esfuerzo en la zona central de la epífisis. Este esfuerzo constituyó el factor mecánico que influye en el crecimiento de canales de cartílago hacia la zona central. Los resultados de la simulación de dicha formación de los canales en sitios aleatorios del pericondrio se observa en la Figura 5B. Así mismo, se ilustra la expansión de los canales hacia la zona que presenta mayor esfuerzo octaédrico (Fig. 5B). En la zona central se observa la fusión entre canales y la convergencia de los mismos lo que ocasiona la hipertrofia de los condrocitos centrales debido a la liberación de los factores MMP9 y Runx2. De este modo, en la figura 5C se muestra el patrón espacio-temporal del recorrido de dichos factores dentro de los extremos mediales de los canales.
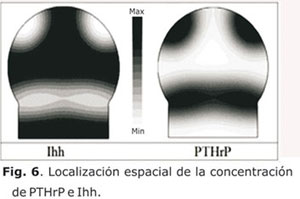
De igual forma, se realizó la simulación de la localización espacial de PTHrP e Ihh (Fig. 6) y del patrón espacio-temporal de difusión del Runx2 y de hipertrofia de condrocitos (Fig. 7). En la figura 6 se observa la retroalimentación negativa de los factores PTHrP e Ihh y su distribución localizada y estable en el tiempo similar a un patrón de Turing originado por un fenómeno de reacción-difusión.12,15,16 Por tanto, esa alta concentración de PTHrP en el lado distal inhibe el proceso de expansión de hipertrofia que ocasiona en conjunto con los niveles bajos de esfuerzo cortante la formación del plato óseo epifisial.
Adicionalmente, en la figura 7 se observa el patrón de evolución que se origina por la difusión del factor Runx2 y por el proceso de hipertrofia de condrocitos causado por tal difusión. Cuando los canales de cartílago alcanzan la zona de mayor esfuerzo octaédrico (zona central) de la epífisis se libera Runx2. Mediante este patrón de difusión del Runx2, se induce a los condrocitos a hipertrofiar desde la zona central hacia la periferia de la epífisis. Como se había mencionado, este patrón de hipertrofia se inhibe no sólo por la localización espacial del PTHrP sino por bajos esfuerzos cortantes y altos niveles de presión que se encuentran también en la zona periarticular, lo que se mantiene la estructura del cartílago articular.
DISCUSIÓN
Se conoce experimentalmente que existe una posible conexión entre el crecimiento de los canales de cartílago y los esfuerzos octaédricos que soporta la epífisis. Se reportan experimentos importantes que llevan a soportar nuestra hipótesis de formación de canales.6 Sin embargo, esta hipótesis es fenomenológica. En este sentido es importante llevar a cabo observaciones experimentales para conocer el comportamiento biológico del cartílago en el desarrollo de los canales.
Así mismo, existen limitantes en el modelo del patrón de crecimiento del SOC. Por ejemplo, no se consideran dentro del modelo factores moleculares importantes involucrados en el desarrollo del SOC como el MMP9, CBFbeta y Runx3 que son reguladores de hipertrofia. Además, factores de condrogénesis como el SOX9, SOX5 y SOX6. Finalmente, el factor de crecimiento endotelial vascular (VEGF), factor indispensable para el desarrollo de vasos sanguíneos en la epífisis.
En resumen, primero, este artículo describe la hipótesis de la formación de canales y la liberación de los factores moleculares como evento importante para la aparición del SOC. Los altos niveles de esfuerzo presentes en el centro de la epífisis rompen el tejido que envuelve al canal. Esto produce la extravasación de los factores moleculares en sitios diferentes al centro de la epífisis, y por tanto, puede formar múltiples centros secundarios de osificación en las epífisis de los huesos largos. Segundo, este artículo presenta la hipótesis del patrón de crecimiento del SOC, el cual se comprueba mediante la simulación computacional de un conjunto de ecuaciones diferenciales que describen la hipertrofia acoplada con factores mecánicos y bioquímicos. Se propone como trabajo futuro incluir todos los factores mecánicos y biológicos en un modelo mecanobiológico completo de todo el proceso del desarrollo epifisial.
REFERENCIAS BIBLIOGRAFICAS
1. Rivas R, Shapiro F. Structural Stages in the Development of the Long Bones and Epiphyses A Study in the New Zealand White Rabbit. JBJS. 2002;84-A(1):85-100.
2. Byers PD, Path FRC, Brown RA. Cell columns in articular cartilage physes questioned: A review. OsteoArthritis and Cartilage. 2006;14:3-12.
3. Provot S, Schipani E. Molecular mechanisms of endochondral bone development. BBRC. 2005;328(3):658-65.
4. Álvarez J, Costales L, Serra R, Balbín M, López J. Expression Patterns of Matrix Metalloproteinases and Vascular Endothelial Growth Factor During Epiphyseal Ossification. J Bone Min Res. 2005;20(6):1011-21.
5. Roach HI, Baker JE, Clarke NM. Initiation of the Bony Epiphysis in Long Bones: Chronology of Interactions Between the Vascular System and the Chondrocytes. J Bone Min Res. 1998;13(6):950-61.
6. Herrero MA, López JM. Bone formation: Biological aspects and modelling problems. J Theor Med. 2005;6(1):41-55.
7. Williams RW, Zipfel WR, Tinsley ML, Farnumz CE. Solute transport in growth plate cartilage: In vitro and in vivo. Biophys J. 2007;93(3):1039-50.
8. Blumer MJ, Longato s, Fritsch H. Structure, formation and role of cartilage canals in the developing bone. Ann Anat. 2008;190(4):305-15.
9. Mackie EJ, Ahmed YA, Tatarczuch L, Chen KS, Mirams M. Endochondral ossification: How cartilage is converted into bone in the developing skeleton. J Biochem Cell Biol. 2008;40(1):46-62.
10. Mericq V. Regulator factors of endochondral ossification. J Rev Med Clin Condes. 2007;18(4):325-29.
11. Madzvamuse A, Maini PK, Wathen AJ. A moving grid finite element method for the simulation of pattern generation by turing models on growing domains. J Sci Comput. 2005;24:247-62.
12. Garzón-Alvarado DA, García-Aznar JM, Doblaré M. Appearance and location of secondary ossification centres may be explained by a reaction-diffusion mechanism. Comput Biol Med. 2009;39(6):554-61.
13. Netter FH. Atlas of Human Anatomy Second edition. East Hanover, New Yersey. Mason, S.A. Section VII: Lower Limb. 2001. p. 476.
14. Shefelbine SJ, Carter DR. Mechanobiological predictions of growth front morphology in developmental hip dysplasia. J Orthop Res. 2004;22(2):346-52.
15. Garzón-Alvarado DA. Simulación de Procesos de Reacción-Difusión: Aplicación a la Morfogénesis del Tejido óseo [PhD Thesis]. Zaragoza, España: Centro Politécnico Superior de la Universidad de Zaragoza. 2007.
16. Garzón-Alvarado DA, García-Aznar JM, Doblaré M. A reaction-diffusion model for long bones growth. Biomech Model Mechanobiol. 2009;8(5):381-95.
Recibido: 4 de octubre de 2009.
Aprobado: 18 de noviembre de 2009.
Liliana Mabel Peinado Cortés. Departamento de Ingeniería Mecánica y Mecatrónica. Universidad Nacional de Colombia. E mail: lmpeinadoc@unal.edu.co