Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Investigaciones Biomédicas
versão impressa ISSN 0864-0300versão On-line ISSN 1561-3011
Rev Cubana Invest Bioméd v.29 n.1 Ciudad de la Habana jan.-mar. 2010
ARTÍCULOS DE REVISIÓN
Mecanobiología de reparación del ligamento
Mechanobiology of ligament repair
Rosy Paola Cárdenas SandovalI; Diego Alexander Garzón AlvaradoII; Liliana Mabel Peinado CortésIII
I Fisioterapeuta, Ingeniera de Sistemas. Facultad de Medicina. Universidad Nacional de Colombia.
II Doctor en Ciencias (PhD), Máster en Ciencias, Ingeniero Mecánico. Profesor Adjunto. Facultad de Ingeniería. Universidad Nacional de Colombia, Bogotá.
III Ingeniera Electrónica. Facultad de Medicina. Universidad Nacional de Colombia, Bogotá.
RESUMEN
Tras un período prolongado de recuperación, aproximadamente un año, el ligamento cicatrizado no alcanza las propiedades mecánicas ni las cualidades del ligamento normal, convirtiéndolo en un tejido susceptible de esguinces crónicos. Este hecho se asocia a la baja producción de colágeno y a la nueva orientación aleatoria de las fibras, lo cual ocasiona una distribución anormal de las cargas. Actualmente, es aceptado que la carga mecánica tiene efectos benéficos en la reparación del tejido, estimula la proliferación celular y producción de colágeno. Por ello, para entender cómo el tejido en reparación responde a los estímulos mecánicos, se recurre a la mecanobiología, un enfoque que describe los procesos de mecanostransducción en el tejido. Por tanto, el objetivo de este artículo es proveer una revisión sobre la mecanobiología y los factores que influyen en el proceso de reparación del ligamento tras sufrir una lesión.
Palabras clave: ligamento, mecanobiología, reparación ligamento, esguince, ejercicio.
ABSTRACT
After a lengthy period of recovery, approximately a year, the healed ligament neither achieve the mechanical properties nor qualities of a normal ligament becoming a tissue liable to chronic sprains. This fact is associated with a low production of collagen and to the new random direction of fibers, which leads to an abnormal distribution of stresses. Nowadays, it is accepted that mechanical load has beneficial effects on the tissue repair, to stimulate the cellular proliferation and the collagen production. Thus, to understand how the repairing tissue answers to mechanical stimuli, it is necessary to resort to mechanobiology, an approach describing the mechanotransduction in tissue. Thus, the aim of present paper is to provide a review on the mechanobiology and the factors influencing in repair process of ligament after a lesion.
Key words: Ligament, mechanobiology, ligament repair, sprain, exercise.
INTRODUCCIÓN
La ruptura parcial o total de los ligamentos se conoce como esguince.1 El esguince es una de las lesiones más comunes en deportistas y en personas sedentarias. Aproximadamente de 5 000 y 27 000 casos nuevos, se reportan diariamente en el Reino Unido y Estados Unidos, respectivamente.2
Esta patología ocasiona no sólo cambios en la estructura y fisiología del ligamento, altera la sinergia entre los tejidos adyacentes y el movimiento articular y causa un déficit funcional.3
La reparación del ligamento tras sufrir un esguince, sigue un proceso biológico muy similar al observado en la mayoría de los tejidos conectivos del cuerpo: inflamación, proliferación y remodelación.4 En promedio, se requiere alrededor de 52 semanas para semejar las propiedades del ligamento normal.5 Este tiempo depende de distintos factores, entre ellos, el medio celular, el género, la edad, el tamaño y contenido de la cicatriz, la carga aplicada, las señales hormonales,6 los neuropéptidos7 y el grado de la lesión. Sin embargo, los factores mecánicos pueden favorecer la calidad y el tiempo de reparación del ligamento.8
Experimentalmente, en animales, se aprecia una reducción en las propiedades mecánicas del tejido cicatrizado cuando se suspenden los estímulos de carga durante el período de reparación.9 Mientras que, al practicar ejercicio moderado se estimula la síntesis de colágeno, con el fin de reparar las fibras afectadas, lo que contribuye al reforzamiento del ligamento.10
La movilización asistida, el movimiento pasivo, el ejercicio, los estiramientos y el masaje con fricción son ejemplos de carga mecánica que afecta la matriz extracelular.11 La célula más importante en la matriz extracelular, es el fibroblasto, cuando éste es estimulado sintetiza matriz extracelular, colágeno, elastina, citoquinas y factores de crecimiento12 indispensables para la reparación del ligamento.
Con base en esta evidencia y con el fin de vislumbrar los cambios sucedidos en un esguince, se espera identificar las estrategias que aceleren y optimicen el proceso de recuperación del tejido. Para ello, se empleará en este artículo, una aproximación mecanobiológica, enfoque que relaciona la carga mecánica aplicada al tejido y su respuesta biológica en niveles celulares, útil para los planes de tratamiento de los profesionales encargados de prescribir cargas al tejido, como los fisioterapeutas.
Sin embargo, para comprender claramente el mecanismo de reparación del ligamento y predecir su respuesta ante estímulos mecánicos, aún es preciso desarrollar estudios y modelos que complementen los hallazgos experimentales encontrados sobre este fenómeno tan complejo. Esta revisión, ofrece un marco de referencia para la realización de dichos modelos, matemáticos y computacionales.
Inicialmente, el tejido será estudiado fisiológicamente, luego, se describirá su proceso de reparación tras lesionarse y finalmente, se establecerá su respuesta biológica ante cargas mecánicas.
MÉTODOS
La búsqueda de información se realizó mediante consulta a las bases de datos multidisciplinarias Science Direct, Springer Link, Annual Reviews y de ciencias de la salud Pubmed. Se utilizaron las palabras claves relacionadas con el proceso de reparación del ligamento bajo el enfoque biológico y mecánico. Los términos mesh que se emplearon fueron: wound healing, ligament, biological model, sprains, physiology, Physiotherapy techniques, anatomy, joint, fibrillar collagens, connective tissue, mechanotransduction, mechanoreceptors, exercise, load, stress, strain, mechanical stimulus.
Los criterios de inclusión de los artículos se establecieron con base en la fecha de publicación, no mayor a 10 años y el término de búsqueda debería estar contenido en el resumen, título o palabras claves. No hubo restricciones en el idioma, ámbito geográfico ni tipo de documento. Para la búsqueda de información concerniente al enfoque mecanobiológico se cotejó las referencias de los artículos filtrados en las bases de datos con las de otros artículos de revisión. Todas las fuentes de datos fueron bibliográficas.
ANÁLISIS
El ligamento en estudio fisiológico
Macroscópicamente, los ligamentos se evidencian como bandas densas de tejido conectivo, paquetes de fibras de colágeno orientados de forma paralela,5 que conectan hueso con hueso.13 Su inserción en el hueso se conoce como entesis y ocurre de forma directa o indirecta. Las fibras de colágeno del ligamento se conectan a una zona de fibrocartílago no mineralizado, esta continúa con fibrocartílago mineralizado hasta llegar al hueso, como ocurre en la inserción femoral del ligamento colateral lateral14 y en la forma indirecta, las fibras superficiales se insertan directamente en el periostio del hueso, como sucede en la inserción tibial de este mismo ligamento.5
La transición del ligamento a través de diferentes zonas ofrece una ventaja mecánica durante el proceso de carga al minimizar la concentración del esfuerzo, esto ocurre en la zona fibrocartilaginosa mineralizada de la entesis, a través de su interdigitación con el hueso adyacente lo cual aumenta el área seccional de la interfaz entre las dos estructuras.15
Los ligamentos varían en tamaño, forma y orientación de acuerdo a su localización articular16, de esta manera, se pueden clasificar como extra-articulares (ej: el ligamento colateral medial) o intra-articulares (ej: el ligamento cruzado anterior).
Los ligamentos extra-articulares están rodeados por una membrana superficial conocida como epiligamento, extremadamente celular, vascular y nerviosa, los intra-articulares están rodeados por sinovia,17 por tanto, son menos celulares, vasculares y nerviosos, lo cual es una desventaja en procesos de cicatrización.
Los nervios encontrados en dicha capa de epiligamento, contribuyen a los procesos de nocicepción, percepción del dolor y a la propiocepción, percepción de la posición articular, de ello se entiende, el papel fundamental que cumplen los ligamentos en el control motor.6
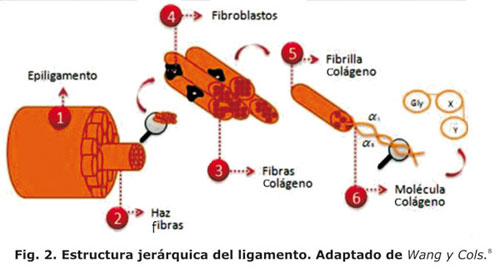
Microscópicamente, el ligamento está compuesto por dos elementos principales, un componente celular y otro de matriz extracelular.5 El primero, tiene en su gran mayoría fibroblastos y una pequeña cantidad de otras células,18 su función es sintetizar y mantener la matriz extracelular,19 la cual se caracteriza por ser una estructura organizada y funcional que le confiere al tejido su comportamiento viscoelástico debido a la interacción de sus componentes: proteínas, glicoproteínas y agua (Fig. 1).
Los fibroblastos se localizan en la matriz extracelular, se distribuyen de forma separada y se alinean en columnas a lo largo de la dirección de las fibras de colágeno,18 son células sensibles a la carga mecánica y cumplen la función de organizar y mantener el tejido durante el desarrollo y en procesos de reparación de heridas.8
De otro lado, la matriz extracelular (MEC) es una estructura organizada y funcional compuesta de proteínas (colágeno, elastina, proteoglicanos), glicoproteínas y agua (Fig. 1). Estos componentes no sólo proveen soporte estructural, fuerza mecánica y fijación de receptores en la superficie celular, también actúan como reservorio para muchas moléculas señaladoras que modulan varias funciones celulares tal como migración, crecimiento y diferenciación.20 Su elemento sólido más importante es el colágeno, éste se encuentra en proporción 9:1 para el ligamento cruzado anterior, tipo I y tipo III, respectivamente.18
La molécula de esta proteína representa una superhélice de forma espiral enrollada a lo largo de la fibra, conformada por dos hélices más pequeñas bajo una secuencia de péptidos básicos: glicinica, prolina (X) e hidroxiprolina (Y), repetidos sucesivamente18 (Fig. 2) Las fibras de colágeno son las encargadas de proveer fuerza tensil y rigidez al tejido, tienen la habilidad de formar puentes cruzados que mecánicamente les dan estabilidad.18 Por último, el 60 % del componente húmedo del ligamento corresponde a la molécula de agua, la cual contribuye igualmente a las propiedades mecánicas del tejido y disminuye su deformación ante una carga constante.10
Propiedades mecánicas
Las propiedades mecánicas de los ligamentos son estudiadas comúnmente bajo ensayos tensiles uniaxiales del complejo hueso-ligamento-hueso.21 Los resultados se muestran a través de dos curvas: carga-elongación (Fig. 3.a) y esfuerzo-deformación (Fig. 3.b).20 En la primera se identifican las propiedades estructurales del complejo hueso-ligamento-hueso. Las mediciones extrínsecas del rendimiento de la estructura son: la rigidez (pendiente de la curva entre dos límites definidos de elongación), la carga última (carga más alta impuesta al complejo antes del punto de falla), la elongación última, (elongación máxima del complejo en el punto de falla), y la energía absorbida que es el área bajo la curva entera, la cual representa la máxima energía almacenada del complejo.5
En la curva esfuerzo-deformación, son representadas las mediciones intrínsecas de la calidad de la sustancia del ligamento (Fig. 3.b). De la curva, el módulo se obtiene de la pendiente entre dos límites de deformación:la fuerza tensil y la densidad de la energía de deformación. La fuerza tensil es el esfuerzo máximo alcanzado, y la última deformación (en porcentaje), es la deformación en el punto de falla. La densidad de la energía de deformación es el área bajo la curva de esfuerzo-deformación.20
En esta curva se puede observar que, tras aplicar una carga de elongación en aquellas fibras que se encontraban en un estado rizado, se reorientan y se alinean en forma paralela.21 Este fenómeno ocurre en movimientos activos y pasivos ejecutados en humanos y en animales. Los niveles de deformación inducidos en el tejido permanecen en la región "toe" (punto de transición entre la región cóncava a la región lineal de la curva), esta porción muestra el comportamiento elástico inicial del ligamento y se encuentra dentro del rango fisiológico.17
Cuando el tejido ya no puede resistir la carga impuesta, es decir la carga se aleja del rango fisiológico, se produce una falla microscópica hasta ocasionar falla macroscópica y por ende, ruptura de las fibras del ligamento.20 Esto sucede frecuentemente en movimientos extremos como en accidentes automovilísticos o en deportes de alto contacto.3
En general, esta respuesta a la elongación o tensión es bastante compleja, presenta una forma no lineal y está sujeta a varios fenómenos dependientes del tiempo, tales como: creep (deformación que se incrementa con el tiempo bajo un esfuerzo constante), relajación-tensión, índice de deformación e histéresis (disipación de energía, tras la aplicación de un ciclo de carga y no carga al tejido). En adición, el comportamiento de la curva también depende de la temperatura, y exhibe una capacidad reducida para sostener la carga a medida que la temperatura aumenta, mientras se mantiene la misma longitud.24
El creep y la relajación son procesos irreversibles los cuales gobiernan estados de no-equilibrio.25 Ambos son dependientes del tiempo y tienden a retornan al nuevo estado de equilibrio después de un estado de perturbación. Usualmente, la deformación se incrementará con el tiempo bajo un esfuerzo constante (creep), mientras que durante el proceso de relajación, el esfuerzo decrecerá con el tiempo bajo una deformación constante.25,26
El efecto del creep en el tejido puede llegar a ser perjudicial. En el ligamento cruzado anterior se comprobó, que tras sostener una carga estática, la viscoelasticidad del tejido produce una activación reflexiva de los músculos asociados y puede incrementar el riesgo de lesión de la articulación,15 por esta razón, se sugiere la prescripción de ejercicios que proporcionen un efecto de relajación. Aunque es posible la recuperación del creep, tras un periodo de descanso, una vez que se remueve la carga,24 en los ligamentos cicatrizados el creep aumenta considerablemente y su recuperación es menor.27
Otro comportamiento propio de los ligamentos es el fenómeno de histéresis.25,28 Cuando el ligamento es estimulado repetidamente con una carga constante, se desarrolla este comportamiento a lo largo del eje longitudinal en una curva de carga versus desplazamiento. El desplazamiento del ligamento incrementa con cada ciclo de carga y no-carga. Esto refleja la asociación de histéresis con el desarrollo de creep.24,29
Por último, el índice de deformación es el factor del cual depende el esfuerzo desarrollado. Frecuentemente se observa que los bajos índices de deformación, están asociados con el desarrollo relativo de bajos esfuerzos, mientras que los altos índices de deformación ocasionan grandes esfuerzos.24
Lesión del ligamento
La elongación rápida del ligamento, observado en algunas actividades deportivas, tal como en un movimiento repetitivo de alta frecuencia, puede resultar en su daño o ruptura.30 Este daño o ruptura en los ligamentos se conoce como esguince. Se produce por una elongación máxima de las fibras, que causa ruptura parcial o total de las mismas. De acuerdo a los signos y síntomas clínicos puede clasificarse en tres grados según su complejidad.1,31 El grado I, manifiesta mínima pérdida de la función, mínimo dolor, no hay ruptura de fibras, no hay presencia de equimosis (hemorragia dentro de la piel y tejido subcutáneo mayor a 1 cm3),32 ni dificultad para soportar el peso,33 mecánicamente el tejido sufre deformación, sin embargo, se conserva dentro del rango fisiológico de la curva esfuerzo-deformación. El grado II, presenta ruptura parcial de las fibras, alguna pérdida de la función articular, dolor, equimosis y dificultad para soportar el peso.33 Esta lesión surge porque la magnitud de la carga es tal que excede el pico de fuerza tensil del ligamento, aunque no siempre alcance su fuerza de rompimiento. Así el ligamento es fuertemente debilitado, en ocasiones permanece físicamente intacto y conserva algo de fuerza mecánica.34 El grado III, presenta ruptura completa de las fibras, gran pérdida de la función articular, dolor e inflamación severos, equimosis y siempre hay dificultad para soportar el peso.33 En esta lesión la carga excede el pico de fuerza tensil del ligamento hasta alcanzar su fuerza de rompimiento.
Es común que la ruptura ocurra en la zona media del ligamento.15 Provenzano y Cols.34 muestra que la mayoría de los especímenes analizados fallan en el complejo hueso-ligamento-hueso bajo carga tensil, por ruptura de la porción media del ligamento.
Además de la presencia de los signos clínicos mencionados, esta lesión produce en la articulación inestabilidad mecánica o laxitud ligamentosa, considerada como el conjunto de movimientos artrocinemáticos que el individuo no puede ejecutar voluntariamente; como por ejemplo, el deslizamiento anormal de la articulación tibio-peronea con el astrágalo, tras sufrir un esguince de tobillo.3
Proceso de reparación
Este proceso varía según la ruptura del tejido parcial o total. En la ruptura completa, del esguince grado III, se presenta una respuesta extrínseca. En ella se exhiben todas las fases de reparación, coagulación, inflamación, proliferación y remodelación. Se caracteriza por una evidente respuesta inflamatoria y es origen de factores de crecimiento y citoquinas implicados en la cicatrización. Por el contrario, en el esguince grado II se presenta una respuesta intrínseca, es decir, localizada sin agentes inflamatorios, en este punto los fibroblastos se encargan directamente de la remodelación de las fibras de colágeno.35-39
Mecanobiología
La carga mecánica induce cambios en el tejido celular, estimula la activación de señales de transducción, genera expresión de genes, incrementa la unión entre la célula y la matriz extracelular, la proliferación celular, la expresión de proteínas, la síntesis de genes en la matriz extracelular y produce cambios en el citoesqueleto.15,23 El enfoque mecanobiológico se encarga de estudiar estos cambios y los mecanismos de mecanotransducción involucrados en distintos niveles, tisulares, celulares y moleculares.8,40
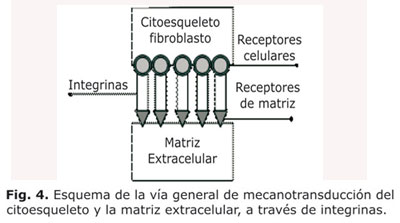
De esta forma, la mecanotransducción se define como el proceso por el cual la estimulación física es convertida intracelularmente dentro de varios tipos de señales químicas.41 Los mecanismos exactos de cómo sucede este proceso aún son desconocidos.42 Sin embargo, la vía de señalización más estudiada corresponde a la conexión estructural entre la matriz extracelular y el citoesqueleto celular, a través de los principales mecanorreceptores: las integrinas.8
Las integrinas son las principales proteínas transmembrana, las cuales se comportan como una interfase de señales entre la matriz extracelular y el citoesqueleto; permitien la transmisión de fuerzas mecánicas al otro lado de la membrana plasmática. El citoesqueleto, mantiene la forma celular ante esfuerzos mecánicos gracias a la red elástica de microfilamentos, monómeros de actina semiflexibles; microtúbulos, polímeros rígidos; y a los filamentos internos, polímeros muy flexibles, los cuales resisten las deformaciones.20,40
En general, las integrinas comunican los receptores celulares a los receptores de matriz extracelular (Fig. 4). Estos receptores se clasifican según su forma de agrupación como complejo focal, adhesión local y adhesión fibrilar y son los sitios candidatos para la transmisión de fuerzas.40,41
La agrupación por complejo focal, es el primer contacto formado entre la célula fibroblástica y la matriz extracelular, tiene un diámetro menor a 1 mm y se caracteriza por la presencia de contactos focales de proteína y receptores de matriz denominados vitronectina, los cuales permiten la unión entre el citoesqueleto celular y la integrina, y entre la integrina y la matriz extracelular, respectivamente.41
En la adhesión local se incluyen dos tipos de integrinas: avb3 y a5b1, conectadas con la actina del citoesqueleto celular mediante proteínas adaptativas, esta agrupación se caracteriza principalmente, por resistir esfuerzos.41
Por último, la adhesión fibrilar se distingue por el ensamble de monómeros de fibronectina secretados en la matriz, los cuales se conectan con la integrina, y ésta a su vez se une con las proteínas llamadas tensin y establecen la conexión con la actina del citoesqueleto.41 La importancia de estas agrupaciones radica en su función como transductores de señales mecánicas relevantes para la diferenciación, organogénesis y curación de heridas.43
Existen otros transductores y mecanorreceptores que participan en la transmisión de señales mecánicas, como la proteína G, las proteínas kinasas mitógeno-activado (MAPKs), los receptores-tirosina-kinasas (RTKs) y la elongación-activada de canales de iones (SAC),8 su función se resume en la tabla 1.
Efecto de la carga en la reparación del ligamento
Los tres tipos básicos de carga mecánica son: tensión, compresión y esfuerzo cortante. Estos en el contexto de la mecanobiología celular, están definidos como la imposición de esfuerzos o deformaciones a través de la aplicación de fuerzas físicas.15 Aunque los fibroblastos de los tejidos conectivos están sujetos a estas cargas, la carga de tensión es la más común para los fibroblastos en tendones y ligamentos.20
La respuesta adaptativa de los tejidos conectivos a esta carga, resulta en incremento del tamaño de las estructuras existentes y remodelación de las proteínas de las cuales está constituido el tejido.44,45 Esto sugiere que los estímulos mecánicos pueden llegar a ser favorables durante la etapa de remodelación del ligamento. Por ejemplo, la activación fisiológica o la ejecución de movimientos controlados, contribuyen de manera importante en la reparación del ligamento.46
Como prueba de lo anterior, en los estudios realizados por Chiquet y Cols.,41 se encontró mayor respuesta de los fibroblastos en la producción de matriz extracelular cuando se incrementó el esfuerzo tensil en cicatrización de heridas y procesos de fibrosis.
Experimentalmente Wang y Thampatty,20 encontraron un incremento en la expresión de genes para el colágeno tipo I, cuando se aplicó una carga cíclica de elongación, con una frecuencia de 1Hz durante 24 horas en los fibroblastos del ligamento cruzado anterior. Similarmente, a través de micromodelos de sustratos de silicona sujetos a una carga de elongación continua al 4 % y 8 %, en una frecuencia de 0.5 Hz, con duración de 4 horas/día durante dos días consecutivos y una relación carga/descanso de 2:1 días, se encontró un aumento en la proliferación celular y en la producción de colágeno del ligamento en reparación, mayor para la elongación al 8 %.46 Asimismo, se encontró que la organización celular recibe la influencia de la dirección de la carga aplicada; las células sujetas a elongación presentan una orientación más homogénea comparada con aquellas que no recibieron carga.46,47
Dado que los fisioterapeutas aplican cargas mecánicas al tejido mediante la prescripción de ejercicio físico para recuperar las propiedades mecánicas del ligamento tras sufrir un esguince, experimentalmente Benani y Cols.,10 evidenciaron que el ejercicio diario moderado genera síntesis de colágeno y deposición del factor de crecimiento TGF-a, mejorando el proceso de reparación del tejido mediante la formación de una nueva red de colágeno más homogénea y densa. Esto contribuyó a la organización del tejido y estimuló la diferenciación y migración de los fibroblastos, así, los ligamentos desarrollaron una estructura apropiada para resistir esfuerzos.
Se debe tener en cuenta que el ejercicio intensivo puede ser perjudicial, al provocar un microdaño en la cicatriz y reducir el módulo tensil del ligamento elongado, en comparación con un ligamento inmovilizado sin estímulo mecánico.48
Hasta ahora, se plantea que la carga mecánica tiene efectos benéficos en el proceso de reparación del ligamento. En la tabla 2, se especifica la intensidad, frecuencia y duración de la carga aplicada a los fibroblastos de diferentes ligamentos lo que genera un aumento en la producción de colágeno y otras proteínas.
Finalmente presentamos la antítesis de este artículo, la inmovilización, puede empeorar el proceso de reparación del ligamento.9 En efecto, la inmovilización por algunas semanas puede resultar en un marcado detrimento de la masa y área seccional del tejido mayor al 74 %, reducción de la fuerza máxima en 2/3, resorción ósea dentro de los sitios de inserción10,35 y adhesión sinovial.22
Cuando el movimiento articular es totalmente restringido, los fibroblastos no pueden adquirir su fenotipo y sintetizan componentes inapropiados de matriz extracelular, lo que resulta en la reincidencia de esguince bajo esfuerzos menores.10,11
En cambio, los resultados clínicos demuestran que la movilización pasiva o activa de la articulación reduce el dolor, permite retornar más tempranamente al trabajo e incrementa en un 50% la carga de falla del tejido.10,12
Diversos autores coinciden en la hipótesis que la carga mecánica favorece el proceso de reparación del tejido10,20,41,46 y favorece el aumento de formación de fibroblastos, los cuales sintetizarán mayor cantidad de matriz extracelular, sin embargo, difieren en la intensidad, frecuencia y duración de las cargas aplicadas al ligamento. Esto indica que la respuesta del ligamento ante estímulos mecánicos varía de acuerdo a distintos factores, magnitud, frecuencia y duración de la carga, ubicación anatómica del ligamento y grado de la lesión.
Cuando se inhibe el tejido de carga mecánica en la etapa de proliferación y de remodelación, por ejemplo, en situaciones de inmovilización articular prolongada, aumenta la distribución aleatoria de las nuevas fibras de colágeno, disminuye la producción de fibroblastos y por tanto, la producción de matriz extracelular, además se incrementa la presencia de colágeno inmaduro (colágeno tipo III).9-11,17 Todo esto conlleva a la disminución de las propiedades mecánicas del ligamento, fuerza tensil, carga última, rigidez, módulo de elasticidad, energía almacenada y función de energía de deformación.
Este artículo ofrece una descripción biológica y mecánica de la estructura, función, lesión y reparación del ligamento, explica el efecto de la carga en la curación del tejido y el mecanismo de mecanotransducción en niveles celulares.
Se deja a disposición de los fisioterapeutas y profesionales encargados de la prescripción de cargas en el ligamento una aproximación de las magnitudes y frecuencias de las cargas que favorecen la reparación del ligamento de manera organizada y resistente, gracias a los trabajos experimentales desarrollados por diversos autores.
Aún así, se debe mencionar que el enfoque mecanobiológico aún presenta vacíos en aspectos tales como la cuantificación del aumento de adhesión de los fibroblastos a la matriz extracelular, número de fibroblastos nuevos producidos, magnitud de la carga que puede llegar a saturar los mecanorreceptores y ocasionar inhibición de la transducción de señales, entre otros.
Por estas razones, se sugiere desarrollar nuevas investigaciones fundamentadas en modelos matemáticos y computacionales que permitan complementar los hallazgos experimentales del proceso de reparación del ligamento y respondan a los cuestionamientos mencionados, para ofrecer la posibilidad de predecir la respuesta del tejido ante distintas condiciones de ambiente y carga.
AGRADECIMIENTOS
Este trabajo es parte del proyecto "Modelo matemático del proceso mecanobiológico de reparación del ligamento" código DIB 202010013460, financiado por la Universidad Nacional de Colombia a través de la Convocatoria: Apoyo a tesis de programas de Posgrado sede Bogotá - año 2009.
REFERENCIAS BIBLIOGRÁFICAS
1. Nobes L, Ryles R, Foreman K. A grade II medial collateral knee ligament sprain in a professional football player. Physical Therapy in Sport. 2000;1:42-53.
2. Takakura Y, Rufai A, Milz S, Benjam M. The functional anatomy of the human anterior talofibular ligament in relation to ankle sprains. Journal of Anatomy. 2002;200:457-65.
3. Denegar CR, Miller SJ. Can chronic ankle instability be prevented? Rethinking management of lateral ankle sprains. Journal of Athletic Training. 2002;37(4):430-5.
4. Li J, Chen J, Kirsner R. Pathophysiology of acute wound healing. Clinics in Dermatology. 2007;25:9-18.
5. Woo SLY, Abramowitch SD, Kilger R, Liang R. Biomechanics of knee ligaments: injury, healing, and repair. Journal of Biomechanics. 2006;39:1-20.
6. Frank CB, Shrive N, Hiraoka H, Nakamura N. Optimisation of the biology of soft tissue repair. Journal of Science and Medicine in Sport. 1999;2(3):190-210.
7. Salo P, Bray R, Seerattan R, Ren C. Neuropeptides regulate expression of matrix molecule, growth factor and inflammatory mediator mRNA in explants of normal and healing medial collateral ligament. Regulatory Peptides. 2007;142:1-6.
8. Wang JHC, Thampatty BP, Lin JS, Im HJ. Mechanoregulation of gene expression in fibroblasts. Gene. 2007;391:1-15.
9. Provenzano PP, Martínez DA, Grindeland RE, Dwyer KW, Turner J, Vailas AC, et al. Hindlimb unloading alters ligament healing. American Physiological Society. 2003;94:314-24.
10. Benani A, Potti P, Fauchet M, Gossard C, Netter Pk, Gillet P, et al. How a daily and moderate exercise improves ligament healing. IRBM. 2008;29(4):267-71.
11. Hammer WI. The effect of mechanical load on degenerated aoft tissue. Journal of Bodywork and Movement Therapies. 2008;12:246-56.
12. Standley P. Presentation at Fascia Research Congress, Boston. Fascia Research. [En línea] 2007. [Citado el: 12 de Agosto de 2008.] [aprox. 5 p.]. Disponible en: http://www.fasciaresearch.com
13. Nordin M, Frankel VH. Basic biomechanics of the musculoskeletal system. 3. ed. Filadelphia: Lippincott Williams and Wilkins, 2001:476.
14. Subit D, Masson C, Brunet C, Chabrandc P. Microstructure of the ligament-to-bone attachment complex. Journal of the Mechanical Behavior of Biomedical Materials. 2008;4:360-7.
15. Doschak M, Zernicke R. Structure, function and adaptation of bone-tendon and bone-ligament complexes. J Musculoskelet Neuronal Interact. 2005;5(1):35-40.
16. Frank CB. Ligament structure, physiology and function. J Musculoskel Neuron Interact. 2004;4(2):199-201.
17. Frank CB, Hart DA, Shrive NG. Molecular biology and biomechanics of normal and healing. Osteoarthritis and Cartilage. 1999;7(1):130-40.
18. Doroski DM, Brink KS, Temeno JS. Techniques for biological characterization of tissue-engineered. Biomaterials. 2007;28:187-202.
19. Gray H, Williams PL, Bannister LH. Gray's anatomy: the anatomical basis of medicine and surgery. 38. ed. New York :Churchill Livingstone, 1995:2092.
20. Wang Y, Blasioli DJ, Kim HJ, Kim HS, Kaplan DL. Cartilage tissue engineering with silk scaffolds and human articular chondrocytes. Biomaterials. 2006;27:4434-42.
21. James R, Kesturu G, Balian G. Tendon: Biology, biomechanics, repair, growth factors, and evolving treatment options. J Hand Surg. 2008;33A:102-12.
22. Woo SLY, Debski RE, Zeminski J, Abramowitch SD, Chan Saw SS, Fenwick JA. injury and repair of ligaments and tendons. Annual Review of Biomedical Engineering. 2000;2:83-118.
23. Wang JHC. Mechanobiology of tendon. Journal of Biomechanics. 2006;39:1563-82.
24. Solomonow M. Ligaments: A source of musculoskeletal disorders. Journal of Bodywork and Movement. 2009;13(2):136-54.
25. Holzapfel GA. Nonlinear solid mechanics. 1. ed. London: John Wiley & Sons LTD, 2000. p. 455.
26. Oza A, Vanderby R, Lakes RS. Interrelation of creep and relaxation for nonlinearly viscoelastic materials: application to ligament and metal. Rheol Acta. 2003;42:557-68.
27. Majima T, Lo IK, Marchuk LL, Shrive NG, Frank CB. Effects of ligament repair on laxity and creep behavior of an early healing ligament scar. J Orthop Sci. 2006;11:272-77.
28. Dorow C, Krstin N, Sander FG. Experiments to determine the material properties of the periodontal ligament. Journal of Orofacial Orthopedics. 2002;63:94-104.
29. Eliasson P, Fahlgren A, Pasternak B, Aspenberg P. Unloaded rat Achilles tendons continue to grow, but lose viscoelasticity. J Appl Physiol. 2007;103:459-63.
30. Eversull E, Solomonow M, Zhou B, Baratta R. Neuromuscular neutral zones sensitivity to lumbar. Clinical Biomechanics. 2001;16:102-13.
31. De Vita R, Slaughter WS. A constitutive law for the failure behavior of medial collateral ligaments. Biomechan Model Mechanobiol. 2007;6:189-97.
32. Rubin A, Sallis R. Evaluation and diagnosis of ankle injuries. Am Fam Physician. 1997;55(3):788.
33. Ivins D. Acute ankle sprain: an update. American family Physician. 2006;74(10):1714-20.
34. Laws G, Walton M. Fibroblastic healing of grade ii ligament injuries. The Journal of Bone and Joint Surgery. 1988;70-B:390-96.
35. Provenzano PP, Alejandro-Osorio AL, Valhmu WB, Jensen KT, Vanderby R. Intrinsic fibroblast-mediated remodeling of damaged collagenous matrices in vivo. Matrix Biology. 2005;23(8):543-55.
36. Strecker-McGraw MK, Russel JT, Baer DG. Soft tissue wounds and principles of healing. Emerg Med Clin N Am. 2007;25:1-22.
37. Enoch S, Leaper DJ. Basic science of wound healing. Surgery. 2007;26(2):31-7.
38. Butler DL, Juncosa N, Dressler MR. Functional efficacy of tendon repair processes. Annu Rev Biomed Eng. 2004;6:303-29.
39. Schmid-Schönbein GW. Analysis of inflammation. Annu Rev Biomed Eng. 2006;8:93-151.
40. Janmey PA, McCulloch CA. Cell mechanics: integrating cell responses to mechanical stimuli. Annu Rev Biomed Eng. 2007;9:1-34.
41. Chiquet M, Gelman L, Lutz R, Maier S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochimica et Biophysica Acta. 2009;1793(5):911-920.
42. Kaneko D, Ono T, Nemoto K, Matsumoto H, Toyama Y, Sasazaki Y,et al. temporal effects of cyclic stretching on distribution and gene expression of integrin and cytoskeleton by ligament fibroblasts in vitro. Connective Tissue Research. 2009;50:263-9.
43. Linask K, Manisastry S, Han M. Cross talk between cell-cell and cell matrix adhesion signaling pathways during heart organogenesis: implicationsfor cardiac birth defects. Microsc Microanal. 2005;11:200-8.
44. Cowin SC. Tissue growth and remodeling. Annu Rev Biomed Eng. 2004;6:77-107.
45. Kjaer M, Magnusson S. mechanical adaptation and tissue remodeling. En: Fratzl P. Collagen: structure and mechanics. Frankfurt: Springer US, 2006. p. 249-67.
46. Park SA, Kim IA, Lee YJ, Shin JW, Kim JK, Yang YI, et al. Biological responses of ligament fibroblasts and gene expression profiling on micropatterned silicone substrates subjected to mechanical stimuli. Journal of Bioscience and Bioengineering. 2006;102(5):402-12.
47. Provenzano PP, Alejandro-Osorio AL, Grorud KW, Martinez DA, Vaila AC. Systemic administration of IGF-I enhances healing in collagenous extracellular matrices: evaluation of loaded and unloaded ligaments. BMC Physiology. 2007;7(2):1-17.
48. Culav ECC, Merrilees M. Connective tissues: matrix composition and its relevance to physical therapy. Physical Therapy. 1999;79(3):308-19.
Recibido: 4 de noviembre de 2009.
Aprobado: 10 de enero de 2010.
Ing. Rosy Paola Cárdenas Sandoval. Facultad de Medicina. Universidad Nacional de Colombia. E mail: rpcardenass@unal.edu.co