Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.32 no.1 Ciudad de la Habana ene.-mar. 2013
ARTÍCULO ORIGINAL
La somatostatina en el núcleo del tracto solitario comisural modula la retención de glucosa cerebral postestimulación anóxica de los quimioreceptores carotídeos en ratas
Somatostatin into the Commissural Nucleus Tractus Solitarius Modulates Brain Glucose Retention Post- Anoxic Stimulation of the Carotid Chemoreceptor in Rats
Dr. Sergio Adrián Montero CruzI, Dra. Mónica Lemus VidalI, José Francisco Figueroa AndradeI, Christian Edgar Ceja PelayoI, Pablo Morales HernándezI, José Alberto Pacheco ElizaldeI, Dr. José Luis Cadenas FreixasII, Prof. Elena Roces DorronsoroI
I Centro Universitario de Investigaciones Biomédicas, Universidad de Colima, México.
II Universidad de Ciencias Médicas de Camagüey, Cuba.
RESUMEN
El núcleo del tracto solitario comisural (NTSc) es el centro de relevo de las fibras aferentes procedentes de los baro y quimiorreceptores carotídeos, por lo que modula la presión arterial y la glucemia ante los estímulos en dichos receptores. La estimulación anóxica con cianuro de sodio (NaCN) en los cuerpos carotídeos produce una respuesta hiperglucemiante. La somatostatina (SS) inhibe la secreción de la hormona del crecimiento y del glucagón lo que produce un efecto hipoglucemiante. La SS y sus receptores en el NTS tienen un efecto inhibidor. Se postula que la somatostatina modula la respuesta hiperglucemiante después de la estimulación de los quimiorreceptores carotídeos (QRC) con NaCN. En este trabajo, la infunsión de SS en el NTSc 4 min antes del estímulo anóxico de los QRC, disminuyó el reflejo hiperglucemiante y la retención de glucosa cerebral a los 10 min del estímulo anóxico. Se concluye que la SS en el NTSc modula la respuesta hiperglucemiante y la retención de glucosa cerebral post-estimulación anóxica de los cuerpos carotídeos en ratas.
Palabras clave: somatostatina, quimiorreceptores carotídeos, glucemia arterial, retención de glucosa cerebral.
ABSTRACT
The commissural nucleus of the solitary tract (NTSc) is the relay center of the afferents fibers from the carotid baro and chemoreceptors, so that modulates blood pressure and blood sugar to stimuli in these receptors. Anoxic stimulation with sodium cyanide (NaCN) in the carotid bodies produces a hyperglycemic response. Somatostatin (SS) inhibits secretion of growth hormone and glucagon producing a hypoglycemic effect. The SS and its receptors in the NTS have an inhibitory effect. It is postulated that somatostatin modulates the hyperglycaemic response after stimulation of carotid chemoreceptors (QRC) with NaCN. In this work, the SS infusion into NTSc 4 min before the anoxic stimulation of the QRC, decreased the hyperglycemic reflex and cerebral glucose retention after 10 min of anoxic stimulus. We conclude that SS modulates the NTSc hyperglycemic response and brain glucose retention post-anoxic stimulation of the carotid bodies in rats.
Key words: somatostatin, carotid chemoreceptors, arterial glucose, brain glucose retention.
INTRODUCCIÓN
Brazeau logró aislar y secuenciar el péptido responsable de la inhibición de la secreción de la hormona del crecimiento, denominándolo como hormona inhibitoria de la liberación de la hormona del crecimiento (GH-RIH) ó somatostatina (SS), un péptido que se presenta bajo 2 formas moleculares con actividad biológica similar, de 14 (SS-14) ó 28 (SS-28) aminoácidos con un peso molecular de 1637 y 3500 Daltones respectivamente. Ambas derivan del procesamiento postraduccional del ARNm de un precursor común, la pre-proSS que se transforma en proSS tras su paso en el sistema Golgi. Posteriormente la prohormona sufre escisión para generar como producto final SS-14 y SS-28.1 La SS se produce, además del hipotálamo, en el sistema gastro-entero-pancreático, en las células parafoliculares de la glándula tiroides, en la médula adrenal y en las células endocrinas dispersas del tracto respiratorio y urogenital. 2
La SS inhibe las secreciones neuroendocrinas, la neurotransmisión y regula las funciones gastrointestinales e inmunes a través de la interacción con los 5 subtipos de receptores de membrana específicos (SST1-SST5) acoplados a proteína Gi que inhiben al sistema adenilato-ciclasa, lo que determina un descenso en el adenosin monofosfato cíclico (AMPc) intracelular.3,4 Los receptores a la SS se han encontrado en el hipotálamo (núcleo supraóptico, núcleo paraventricular y núcleo arcuato), núcleo amigdaloide basolateral, hipocampo, locus coeruleus, núcleo parabraquial del tallo cerebral y de la médula espinal, y en el cerebelo.5
Se describe a la SS-14 y SS-28 como potentes inhibidores en el núcleo del tracto solitario NTS.6 Múltiples subtipos de receptores a la SS, posiblemente combinados como heterodímeros, están involucrados en mediar los efectos modulatorios de la SS sobre la función autonómica, como la actividad cardiovascular, respiratoria y gastrointestinal.7
El núcleo del tracto solitario comisural (NTSc) es el centro de relevo de las fibras aferentes procedentes de los baro y quimiorreceptores carotídeos,8 por lo que modula la presión arterial 9 y la glucemia ante los estímulos en dichos receptores.10 La estimulación anóxica con cianuro de sodio (NaCN) en los cuerpos carotídeos produce una respuesta hiperglucemiante con aumento en la retención de glucosa por el cerebro.10 En el hipotálamo la SS constituye una señal del metabolismo energético.11 La SS y sus receptores en el NTS tienen un efecto inhibidor.6,12 Se postula que la SS modula la respuesta hiperglucemiante después de la estimulación de los quimiorreceptores carotídeos (QRC) con NaCN. No se han descrito los efectos producidos por la SS en el NTS en relación a la homeostasis de la glucosa. Los resultados aquí presentados ayudarán a dilucidar los factores que participan en la captación de glucosa por el SNC.
MÉTODOS
Animales y técnicas quirúrgicas
Los experimentos fueron llevados a cabo de acuerdo a la Guía para el cuidado y uso de animales de laboratorio en ratas Wistar machos de 250-300 gramos de peso corporal, con 3 meses de edad, mantenidas en condiciones de luz-oscuridad 12:12 hrs, con ingesta de alimento y líquidos a libre demanda. Los animales se anestesiaron con pentobarbital sódico (3 mg/100 g) por vía intraperitoneal (i.p). El nivel de anestesia fue preservado durante todo el procedimiento, por goteo i.p continuo del anestésico diluido con solución salina (0.063 mg/min), de igual forma se controló periódicamente la profundidad de la anestesia mediante la evaluación de los reflejos palpebral y flexor plantar ante un estímulo doloroso, no observando reacción alguna. Las ratas se mantuvieron bajo respiración artificial y la temperatura corporal se mantuvo a 37 °C.
Estimulación de los QRC
La estimulación de los QRC se llevó a cabo por la inyección lenta de 5 µg/100 g de NaCN en 0.1 ml de solución salina a través de una aguja de calibre 27 y un catéter delgado (PE-10; Clay Adams) en el seno carotídeo para evitar la estimulación de los barorreceptores.10 Para asegurar que la respuesta es debida al NaCN, los QRC se aislaron de la circulación cefálica. El aislamiento del seno carotídeo se describe brevemente: se ocluyeron temporalmente (15 - 20 s) la arteria carótida externa (más allá de la rama lingual) y la carótida interna (cerca del foramen yugular) mientras se inyectó el NaCN en el seno yugular a través de la arteria carótida común izquierda para perfundir el cuerpo carotídeo izquierdo, simultáneamente se retiró el NaCN por medio de un catéter introducido en la arteria lingual y se restauró la circulación. (Fig. 1)
Muestras sanguíneas y medición de glucosa
Se cateterizaron la arteria femoral izquierda y el seno venoso yugular para la obtención de sangre arterial y venosa y la determinación posterior de glucosa. Todas las cateterizaciones se realizaron con cánulas heparinizadas sin interrumpir la circulación vascular normal. La posición correcta de los catéteres se confirmó al finalizar cada experimento. La colección sanguínea fue de 0.15 ml de sangre arterial (arteria femoral) e igual cantidad de sangre venosa procedente del cerebro (seno yugular). Esto se realizó en los siguientes tiempos: t=-10 y -5 min (antes de la aplicación de las drogas en NTSc y de estimular los QRC), y t= 5, 10,20 y 30 min (después de la estimulación de los QRC); la inyección de somatostatina en NTS se hizo al t= -4 min. (4 min. previos a la estimulación de los QRC). En cada experimento la extracción total de sangre fue de 2 mL (16 % del volumen total). Las muestras de sangre se centrifugaron (centrífuga refrigerada, Beckman T J-6) a 3000 rpm durante 5 min para efectuar la determinación de glucosa en plasma por el método de glucosa-oxidasa (analizador Beckman).
Infusión de somatostatina en el NTSc
Posterior a la exposición de la superficie dorsal del cráneo de la rata, se fijó la cabeza en aparato estereotáxico (Stoelting) con el propósito de realizar la craneotomía occipital e insertar en el NTS una aguja de 200 µm de diámetro conectada mediante un tubo de silastic (Dow Corning 602-155) a una microjeringa (Hamilton, de 0.1 a 0.5 µl). Las coordenadas establecidas para lograr el abordaje al NTSc fueron: AP= 25.1 mm, L= 3.9 mm y V= 23.4 mm, tomando a Lambda como punto de de referencia cero.13
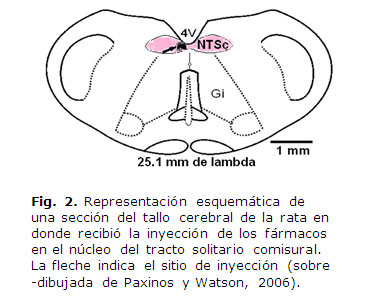
Para verificar el punto de inyección se procedió a realizar la tinción de azul de metileno al 1 %, a la par de la inyección de los fármacos utilizados. Al finalizar los experimentos, la rata se sacrificó por decapitación con guillotina, retirando el cerebro para ser almacenados a -70 °C en ultracongelador (Revco) para posteriormente realizar los cortes en un criostato (Leica) en secciones coronales de 40µm, teñirlos con violeta de cresilo y comprobar histológicamente el sitio de punción (fig. 2).
Fármacos aplicados
Pentobarbital sódico (Anestesal, Pfizer), 3 mg/100 g; cianuro de sodio (NaCN) 5µg/100 g; líquido cefalorraquídeo artificial (LCRa pH 7.3-7.4, composición en mM: NaCl 145, KCl 2.7, NaHCO3 9.52, NaH2PO4 2, CaCl2 1.2, MgCl2 1.0; somatostatina-14 (S-165) 1 ng diluido en 100 nL de LCRa.
Protocolo experimental
Los grupos de ratas se distribuyeron de la siguiente manera: Control 1: cuantificación de los niveles de glucosa en el plasma y retención de glucosa cerebral en ratas normales anestesiadas después de la estimulación de los QRC con NaCN, precedida (4 min) de la inyección de LCRa en el NTS (grupo LCRa + NaCN). Experimental 1: mismas cuantificació en ratas después de la estimulación de los RSCC con NaCN, precedida (4 min) de la inyección de SS en el NTS (grupo SS + NaCN). Experimental 2: misma cuantificación en ratas después de la inyección de solución salina en el seno carotídeo, precedida (4 min) de la inyección de SS en el NTS (grupo SS + Sal) (fig 3).
Análisis estadístico
Los valores se representan como medida de la tendencia central de las medias aritméticas ± errores estándar. Con respecto a la estadística inferencial se utilizaron las pruebas de ANOVA y Scheffé para la comparación intergrupal. El nivel de significancia se fijó en p < 0.05.
RESULTADOS
En las fig. 4 A y B se presentan, para su comparación, los resultados obtenidos en relación con la glucemia arterial y la retención de glucosa cerebral en las ratas normales anestesiadas, después de la infusión de LCRa ó SS con estimulación de los QRC. La estimulación de los QRC 4 min después de la infusión de SS provocó un descenso significativo en la retención de glucosa cerebral al t = 10 min; cuando este resultado se comparó con el resultado obtenido con la inyección de LCRa antes de la estimulación de los QRCs, la retención de glucosa cerebral bajó de 31.2 ± 4.7 mg /dL hasta 15.21 ± 2.1 mg/dL (P = 0.029, ANOVA de medidas repetidas, 2 grupos). Por otro lado, la infusión de SS en el NTSc sin estimulación de los QRC (inyección de solución salina en el seno carotídeo, grupo SS+Sal) no produjo cambios significativos en la retención de glucosa cerebral en ninguno de los tiempos analiza dos (P = 0.94, ANOVA de medidas repetidas, 2 grupos).
Cuando se compararon las glucemias arteriales del grupo experimental 2 (SS+NaCN) con el grupo de ratas estimuladas con NaCN (LCRa+NaCN, control) se observaron cambios significativos en los tiempos 10, 20 y 30 minutos. Respecto a la retención de glucosa cerebral los cambios fueron a los 10 y 30 minutos post-estimulación. La comparación de los grupos SS+Sal vs SS+NaCN mostraron cambios significativos tanto en la glucemia arterial como en la retención de glucosa cerebral al minuto 30 (fig 4).
DISCUSIÓN
En este trabajo, la anoxia en los QRC produjo un reflejo hiperglucemiante con aumento en la retención de glucosa cerebral. Estos resultados corroboran el efecto descrito por Álvarez-Buylla, 10 que demuestran la importancia de los cuerpos carotídeos en la homeostasis de la glucosa.
La SS infundida en el NTSc 4 min antes del estímulo anóxico de los QRC disminuyó el reflejo hiperglucemiante y la retención de glucosa cerebral a los 10 min del estímulo anóxico. Este efecto se explica por la acción inhibitoria de la SS, en el que se describe que esta hormona secretada por el hipotálamo inhibe la secreción de la hormona de crecimiento y en el páncreas la SS inhibe la secreción de insulina y de glucagón, efectos que pueden llevar a la hipoglucemia.2
Se sabe que todos los subtipos de los receptores a la SS inhiben a la enzima adenilato-ciclasa, por lo que disminuyen la producción de AMPc y la liberación de neurotransmisores.2 También, se describe que la SS activa al canal rectificador entrante de K (GIRK o Kir3), produciendo una hiperpolarización de membrana celular con reducción en la entrada de Ca2+ y, por lo tanto, la concentración intracelular de este ión se reduce dando como consecuencia un bloqueo en la liberación de neurotransmisores.14 También se indica que la SS al interactuar con su receptor inhibe los canales de Ca2+ tipo N y P/Q en el NTSc, y por consiguiente, se bloquea la neurotransmisión.15
Otro mecanismo que pudiera explicar la disminución de la respuesta hiperglucemiante y de la retención de glucosa cerebral es la depresión de la corriente postsináptica excitatoria glutamatérgica debida a la acción inhibitorio de la SS en el NTS.16 Se concluye en este trabajo que la somatostatina inyectada en el núcleo del tracto solitario comisural produce una disminución en la glucemia arterial y en la retención de glucosa cerebral después de la estimulación anóxica de los quimiorreceptores carotídeos en ratas.
Agradecimientos
Fondo Ramón Álvarez-Buylla de Aldana.
REFERENCIAS BIBLIOGRÁFICAS
1. Brazeau P, Vale W, Burgus R, Ling N, Butcher M, Rivier J, Guillemin R. Hypothalamic polypeptide that inhibits the secretion of immunoreactive pituitary growth hormone. Science 1973; 179:77-79.
2. Iwanaga T, Miki T, Takahashi-Iwanaga H Restricted expression of somatostatin receptor 3 to primary cilia in the pancreatic islets and adenohypophysis of mice. Biomed Res. 2011; 32: 73-81.
3. Møller LN, Stidsen CE, Hartmann B & Holst JJ. Somatostatin receptors. Biochimica et Biophysica Acta. 2003; 1616: 1-84.
4. Durán-Prado M, Bucharles C, Gonzalez BJ, Vázquez-Martínez R, Martínez-Fuentes AJ, García-Navarro S, Rhodes SJ, Vaudry H, Malagón MM, Castaño JP. Porcine somatostatin receptor 2 displays typical pharmacological sst2 features but unique dynamics of homodimerization and internalization. Endocrinology. 2007; 148: 411-21.
5. Goebel M, Stengel A, Wang L, Coskun T, Alsina-Fernandez J, Rivier J, Taché Y. Pattern of Fos expression in the brain induced by selective activation of somatostatin receptor 2 in rats. Brain Research. 2010; 1351: 150-164.
6. Jacquin T, Champagnat J, Madamba S, Denavit-saubio M, Siggins G. Somatostatin depresses excitability in neurons of the solitary tract complex through hyperpolarization and augmentation of IM, a non-inactivating voltage-dependent outward current blocked by muscarinic agonists (somatomedin-release-inhibitory factor/K+ conductance). Proc. Natl. Acad. Sci. USA. 1988; 85: 948-952.
7. Spary EJ, Maqbool A, Batten TF. Expression and localisation of somatostatin receptor subtypes sst1-sst5 in areas of the rat medulla oblongata involved in autonomic regulation. J Chem Neuroanat. 2008; 35: 49-66.
8. Suzuki M, Nishina M, Nakamura S, Maruyama K. Benzodiazepine-sensitive GABA(A) receptors in the commissural subnucleus of the NTS are involved in the carotid chemoreceptor reflex in rats. Auton Neurosci. 2004; 110: 108-13.
9. Pedrino GR, Rossi MV, Schoorlemmer GH, Lopes OU, Cravo SL. Cardiovascular adjustments induced by hypertonic saline in hemorrhagic rats: Involvement of carotid body chemoreceptors. Auton Neurosci. 2011; 160: 37-41.
10. Álvarez-Buylla R and Álvarez-Buylla E. Carotid sinus receptors participate in glucose homeostasis. Respir Physiol. 1988; 72: 347-360.
11. Fox EA, Powley TL. Tracer diffusion has exaggerated CNS maps of direct preganglionic innervation of pancreas. J Auton Nerv Syst. 1986; 15: 55-69.
12. Finley JC, Maderdrut JL, Roger LJ, Petrusz P. The immunocytochemical localization of somatostatin-containing neurons in the rat central nervous system. Neuroscience. 1981; 6: 2173-92.
13. Paxinos G, Watson C. The Rat Brain in Stereotaxic Coordinates. New York: Academic Press 1986.
14. Bronstein-Sitton N. Somatostatin and the Somatostatin Receptors: Versatile Regulators of Biological Activity. Pathways 006 2006.Disponible en: http://www.alomone.com. Acceso: 2 de febrero de 2011.
15. Rhim H, Toth PT, Miller RJ. Mechanism of inhibition of calcium channels in rat nucleus tractus solitarius by neurotransmitters. Br J Pharmacol. 1996; 118(6):1341-50.
16. Selmer I, Schindler M, Allen JP, Humphrey PP, Emson PC. Advances in understanding neuronal somatostatin receptors. Regul Pept. 2000; 90: 1-18.
Recibido: 12/01/2012
Aprobado:02/02/2013
Dr. Sergio Adrián Montero Cruz. Centro Universitario de Investigaciones Biomédicas. Universidad de Colima, México. E mail: che_colima@yahoo.com.mx