My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
Print version ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.1 Ciudad de la Habana Jan.-Mar. 2014
ARTÍCULO ORIGINAL
Determinación cuantitativa de enterococos en aguas utilizando un método cromogénico alternativo
Quantitative determination of enterococci in water using an alternative chromogenic method
Marilyn Díaz Pérez,I Raisa Zhurbenko,I Tamara Lobaina Rodríguez,I Dianelys Quiñones Pérez,II Claudio Rodríguez MartínezI
I Centro Nacional de Biopreparados (BioCen). La Habana, Cuba.
II Instituto "Pedro Kourí" (IPK). La Habana, Cuba.
RESUMEN
Introducción: el control de la calidad de las aguas es vital para la protección de la salud humana y la biodiversidad en el ambiente acuático. Varios microorganismos son utilizados como indicadores de contaminación fecal para este propósito, dentro de ellos los enterococos son considerados buenos indicadores, porque sobreviven más tiempo ante condiciones adversas en la naturaleza.
Objetivos: evaluar la capacidad de un nuevo método cromogénico alternativo para la detección y enumeración de enterococos en aguas por la técnica de filtración por membrana, en comparación con el método estándar ISO 7899:2.
Métodos: se recolectaron muestras de aguas de tres orígenes diferentes para determinar su calidad. Las muestras se ensayaron en paralelo por las dos metodologías (alternativa y referencia), empleando la técnica de filtración por membrana. Para evaluar el desempeño de los métodos se determinaron varios parámetros: sensibilidad, especificidad, exactitud, porcentaje de falsos positivos, porcentaje de falsos negativos, índice kappa. Los tres primeros parámetros se calcularon para ambos métodos antes y después de la confirmación por pruebas bioquímicas. Los resultados se analizaron desde el punto de vista estadístico, teniendo en cuenta los principales criterios definidos en las normas ISO 16140 e ISO 177994.
Resultados: con el método alternativo los resultados se obtuvieron a las 24 h, estos mostraron valores de sensibilidad (99 %) y exactitud (98 %) más elevados que con el de referencia (97 % y 97 %, respectivamente), el cual demoró más de 48 h. La eficiencia y exactitud de ambos métodos fue similar y se obtuvo una concordancia entre ellos casi perfecta (kappa = 0,96) con el total de las muestras de aguas ensayadas.
Conclusiones: los resultados alcanzados indican que el método alternativo es eficiente para el recuento de enterococos provenientes de diferentes tipos de muestras de agua. Resulta además un método simple, más rápido y económicamente factible.
Palabras clave: enterococos, glucosidasa, método alternativo, aguas.
ABSTRACT
Introduction: water quality control is essential for the protection of human health and biodiversity in the aquatic environment. For this purpose, several microorganisms are used as indicators of fecal contamination. Among them are enterococci, which are considered to be good indicators, since they survive for a longer time in adverse natural conditions.
Objectives: evaluate the suitability of a new alternative chromogenic method for the detection and enumeration of enterococci in water by membrane filtration technique, in comparison with the ISO 7899:2 standard method.
Methods: water samples were collected from three different sources to determine their quality. The samples were assayed in parallel with the two methodologies (alternative and reference) using the membrane filtration technique. The following parameters were determined to evaluate the performance of the methods: sensitivity, specificity, accuracy, percentage of false positives, percentage of false negatives, kappa index. The first three parameters were estimated for both methods before and after confirmation by biochemical testing. Results were analyzed statistically based on the main criteria defined by ISO standards 16140 and 177994.
Results: with the alternative method, results were obtained at 24 h, whereas the reference method required more than 48 h. Sensitivity and accuracy were higher with the alternative method (99 % and 98 %, respectively) than with the reference method (97% and 97%, respectively). Both methods had similar efficiency and accuracy, with almost perfect concordance between them (kappa = 0.96) in all the water samples tested.
Conclusions: results show that the alternative method is efficient for the enumeration of enterococci from different types of water samples. It is also a simple, faster and economically feasible method.
Key words: enterococci, glucosidase, alternative method, water.
INTRODUCCIÓN
La calidad microbiológica del agua se evalúa en todo el mundo para proteger la salud humana y la biodiversidad en el medio ambiente acuático.1 La detección y cuantificación de microorganismos patógenos en el agua es importante para reducir los riesgos asociados a la salud pública y tomar las acciones más adecuadas para prevenir la transmisión de enfermedades.2 Varios microorganismos indicadores de la contaminación fecal se utilizan para evaluar la calidad y la seguridad de los distintos tipos de agua.3 Enterococcus está recibiendo una amplia aceptación como indicador muy útil en la determinación de la calidad microbiológica del agua, debido a que siempre están presentes en las heces de los animales de sangre caliente, son incapaces de multiplicarse en las aguas y sobreviven largos períodos en condiciones adversas de la naturaleza.2 Algunos estudios realizados con aguas recreativas y potables consideran que los enterococos son indicadores más estables que Escherichia coli y los coliformes fecales.4
Existen dos métodos estándar para la detección de enterococos en aguas: la técnica de fermentación de tubos múltiples (NMP = Número Más Probable) y la técnica de filtración por membrana (FM).5 El método FM ha sido recomendado para la enumeración de enterococos en varios tipos de muestras de agua y puede ser utilizado para analizar grandes volúmenes de muestra, y es más rápido que el procedimiento NMP.6
Se han desarrollado diferentes procedimientos para la detección de enterococos en aguas.7 La mayoría de ellos utilizan medios de cultivo selectivos que contienen ingredientes como la azida de sodio y las sales biliares para inhibir el crecimiento de otros microorganismos. Por otra parte, muchos de ellos requieren un aislamiento primario y posteriormente una etapa de confirmación, lo que compromete la capacidad de tomar la acción más apropiada.8
En la actualidad se han desarrollado medios de cultivo cromogénicos para la detección de la actividad β-D-glucosidasa presente en Enterococcus. Estos constituyen herramientas útiles para la enumeración y detección específica de enterococos en agua7 y contienen mezclas de sustratos cromogénicos que son escindidos por ciertas enzimas producidas por el microorganismo, dando como resultado colonias bacterianas de diferentes colores, proporcionando una identificación más simple y rápida, ya que no requieren pruebas adicionales, lo que permite obtener los resultados en menos tiempo y con gran precisión, en comparación con los métodos tradicionales. 9
El objetivo de este estudio consistió en evaluar la capacidad de un nuevo método cromogénico alternativo para la detección, aislamiento e identificación de enterococos en muestras de aguas por la técnica de filtración por membrana, basado en la detección de su actividad glucosidasa, en comparación con el método estándar ISO 7899:2.
MÉTODOS
Muestras
Varias muestras de agua (n=135) de tres fuentes diferentes fueron recogidas, ensayadas y procesados los resultados, en el período de marzo 2007 a diciembre 2012: agua industrial (n=59), agua potable (n=43) y aguas recreacionales (n=33). Las muestras se recogieron en frascos estériles y se transportaron al laboratorio en contenedores, protegidas de la luz y de las elevadas temperaturas, y se procesaron dentro de las 6 horas después de su recolección. Para determinar los valores de pH y conductividad se utilizaron un pHmetro (modelo PHM 83 AUTOCAL) y un conductímetro (MDC 230) (Radiometer, Dinamarca), respectivamente.
Contaminación artificial de las muestras de agua
Noventa y cuatro muestras se contaminaron artificialmente con un cultivo puro de Enterococcus faecalis (cepa ATCC 29212) para garantizar 5 niveles de contaminación: nivel de ausencia (n=4), 1-10 UFC/100 mL (n=18), 11-30 UFC/100 mL (n=21), 31-100 UFC/100 mL (n=31), más de 100 UFC/100 mL (n=20). Antes de la contaminación artificial de las muestras, se determinó el nivel de cloro mediante un método colorimétrico utilizando Aquaquant® (Darmstadt, Alemania) y se inactivó el cloro residual al adicionar 5 mL/L de muestra de una solución estéril de tiosulfato de sodio al 18 % (p/v). El cultivo puro de E. faecalis ATCC 29212 se estandarizó al 75 % de transmitancia en el espectrofotómetro (T70 UV/VIS, Espectrómetro, PG Instruments Ltd., Reino Unido) a 580 nm, lo que corresponde aproximadamente a una concentración microbiana de 3,0×108 células/mL. Posteriormente, se prepararon diluciones seriadas en solución salina estéril para la contaminación artificial de las muestras de agua, según los diferentes niveles deseados.
Muestras de agua naturalmente contaminadas
En algunas muestras de agua (n=41) se evaluó la presencia natural de contaminación con enterococos.
Preparación de los medios de cultivo
Los medios se prepararon de acuerdo a las instrucciones del fabricante. Se dispensaron aproximadamente 8 mL de cada medio de cultivo en placas de Petri estériles (60×15 mm, Becton Dickinson, U.S.A.).
Filtración por membrana
Para la detección y recuento de enterococos, las muestras se probaron en paralelo por el método estándar descrito en la ISO 7899:2, 10 y la técnica de FM utilizando el medio cromogénico alternativo m-CromoCen ENT (BioCen, Cuba).
Se filtraron 100 mL de cada muestra de agua, por duplicado, a través de una membrana estéril de nitrocelulosa (47 mm de diámetro y 0,45 µm de tamaño de poro, Sartorius, Göttingen, Alemania) y los filtros se colocaron en la superficie de cada uno de los medios de cultivo ensayados para la recuperación de enterococcus. La primera membrana se depositó sobre m-CromoCen ENT, incubándose a 35 ± 2 °C por 24 h y la segunda membrana se colocó sobre el agar Slanetz-Bartley (SB) (Oxoid, Ltd, Basingstoke, Reino Unido) y se incubó a 35 ± 2 °C por 48 h, transfiriéndose posteriormente al medio agar bilis esculina azida (BEA) (Merck, Darmstadt, Alemania) y se incubó a 44 ± 1 °C por 2 h.
Se determinó el color de las colonias típicas que crecieron sobre cada medio de cultivo y se realizó su recuento. Los resultados se expresaron como UFC/100 mL. Se consideraron colonias típicas aquellas con coloración de rosado claro a oscuro sobre el medio cromogénico y las de color de marrón o negro en el medio de referencia y se reportaron como enterococos.
Verificación bioquímica
Siempre que fue posible, se seleccionaron al azar para su comprobación, hasta diez colonias típicas y no típicas procedentes de los medios de cultivo ensayados y se identificaron utilizando las siguientes pruebas bioquímicas: catalasa, oxidasa, motilidad, crecimiento en agar sangre de carnero, hemólisis, hidrólisis de la arginina, crecimiento en caldo con 6,5 % de cloruro de sodio, crecimiento en presencia de 40 % de bilis, crecimiento a 45 °C, crecimiento a pH 9,6, hidrólisis de la esculina, prueba de Voges-Proskaüer, crecimiento en caldo Chromocult® para enterococcus (Merck, Alemania), fermentación de (piruvato, arabinosa, manitol, sorbitol, lactosa, sorbosa).11-13 Se realizó la prueba rápida PYR (detección de la hidrólisis de L-pirrolidonil-β-naftilamida, O.B.I.S. PYR, Oxoid LTD, Basingstoke, Inglaterra) para la confirmación de los resultados.14 Los resultados de las pruebas bioquímicas se interpretaron consultando diferentes tablas de identificación bioquímica publicadas.11,12 Los aislamientos que no pudieron identificarse hasta el nivel de especie y que fueron positivas a la prueba PYR, a la hidrólisis de la esculina, que crecieron a 45 °C y en caldo con 6,5% de cloruro de sodio, se reportaron como Enterococcus sp.
Análisis estadístico
Los resultados de este estudio se evaluaron desde el punto de vista estadístico de acuerdo con los principales criterios definidos en la ISO 1614015 e ISO 1799416 utilizando el programa SmartVal.17
Para evaluar el desempeño de los métodos se determinaron los siguientes parámetros: (1) sensibilidad, (2) especificidad, (3) exactitud, (4) porcentaje de falsos positivos, (5) porcentaje de falsos negativos, y (6) índice kappa. Los tres primeros parámetros se calcularon antes y después de la comprobación bioquímica para ambos métodos.
El índice kappa se calculó por la siguiente ecuación:18

po: valor observado
pe: valor esperado sobre las bases del chance aleatorio
RESULTADOS
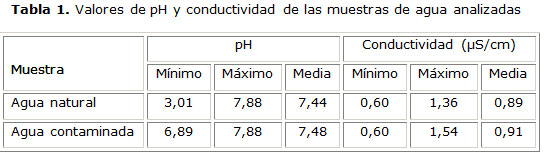
Los valores de pH y conductividad se muestran en la tabla 1. Se seleccionaron e identificaron 1 452 colonias (diana y no diana) procedentes de los medios alternativo y de referencia.
La tabla 2 muestra los valores de exactitud obtenidos en la identificación de enterococos utilizando los medios m-CromoCen ENT y agar BEA. El 98,03 % de las colonias identificadas presuntivamente como diana fueron confirmadas como Enterococcus spp. Por otra parte, el número de enterococos que crecieron como colonias no típicas en m-CromoCen ENT no excedió el 10 %.
La mayoría de los aislamientos en m-CromoCen ENT fueron E. faecalis (460/597 o 77,05 %), seguidos por Enterococcus faecium (23/597 o 3,85 %) y Enterococcus solitarius (9/597 o 1,51 %). Otras especies de Enterococcus se aislaron en menor proporción (<1 %). Las especies más comunes aisladas de las muestras de agua fueron E. faecalis seguidas por E. faecium.
De las 609 colonias que fueron identificadas presuntivamente como enterococos (rosa) y 115 colonias presuntivamente negativas de ser enterococos (blanco o color) aisladas en m-CromoCen ENT, solo 8 (1,31 %) correspondieron a falsos positivos y 4 (0,66 %) a falsos negativos. En contraste, en el método de referencia ISO el número de falsos negativos fue mayor que en el método alternativo.
La clasificación de los falsos positivos y negativos se basó en las diferencias encontradas al tener en cuenta el color de la colonia, la confirmación bioquímica y la prueba PYR.
Se hallaron falsos positivos en muestras naturalmente contaminadas con enterococos, que estaban correctamente cloradas, los cuales fueron en su mayoría aislados de aguas procedentes de la industria. Esos aislamientos fueron identificados como Aerococcus viridans, Streptococcus spp., Pediococcus pentosaseus, Bacillus spp. y Abiotrophia elegans, y pertenecen a especies estrechamente relacionadas con Enterococcus.
En m-CromoCen ENT se aislaron colonias rosadas muy pequeñas, con diámetros ≤ 0,5 mm, que fueron confirmadas como falsos positivos. La ocurrencia de falsos negativos fue más significativa en los niveles más altos de contaminación microbiana de las muestras, particularmente en los niveles tercero y cuarto.
Después de la confirmación bioquímica se comprobó la ausencia de falsos positivos, y 1,92 % de resultados falsos negativos en m-CromoCen ENT.
En las tablas 3 y 4 se muestran los resultados de los indicadores de calidad relativos del método alternativo con respecto al de referencia.
En general, con el método m-CromoCen ENT se obtuvo una elevada sensibilidad, aunque la especificidad (89,47 %) estuvo afectada debido al número de resultados falsos negativos (3,11 %) obtenidos con el método de referencia. Sin embargo, la eficiencia del método alternativo fue adecuada. Elvalor de kappa fue 0,96. Las pruebas para comprobar la hipótesis de que kappa es verdadero a un nivel de significación del 5 % confirmaron que ambos métodos no son diferentes.
DISCUSIÓN
Se está incrementando la selección de enterococos como indicador de contaminación fecal de las aguas. Varios trabajos sugieren que Enterococcus y E. coli tienen más estrecha correlación con las enfermedades transmitidas por el agua que los coliformes totales.19 Dos grandes limitaciones del método ISO 7899-2 son: el tiempo prolongado que se requiere para obtener la confirmación de los resultados de la identificación de los microorganismos diana y el complejo resultante que se forma, como resultado de la hidrólisis de la esculina, que se propaga a través del medio.20 Esto puede dificultar la discriminación entre los microorganismos diana y no diana en un cultivo mixto. Con el nuevo método cromogénico se reduce el tiempo de análisis a 24 h, en contraste con el método de referencia que tarda más de 48 h para ofrecer los resultados. Además, el método alternativo prescribe el uso del agar m-CromoCen ENT que contiene rosa-glc (6-cloro-3-indolil-β-D-glucopiranósido), para la detección de la actividad de β-D-glucosidasa, lo que posibilita el fácil reconocimiento de enterococos por el desarrollo de colonias de coloración rosada. Varios sustratos cromogénicos evaluados para la detección de la actividad β-D-glucosidasa han demostrado ser tan eficaces como la esculina, además, el uso de tales sustratos elimina la difusión del complejo negro formado producto de la hidrólisis.21,22 Por otra parte, el método alternativo mostró similar eficiencia y exactitud que la norma ISO 7899-2; este es un método sencillo, rápido y económicamente factible. El procedimiento de referencia incluye una etapa presuntiva y una confirmativa, lo cual incrementa los costos de los controles de calidad del agua.
El método cromogénico mostró una elevada especificidad para Enterococcus. Estudios previos han reportado muy bajas tasas de recuperación de Enterococcus utilizando el agar bilis esculina azida y el agar kanamicina esculina azida, dos medios de cultivo que se emplean como rutina para la recuperación de enterococos en aguas. Además, el bajo porcentaje de enterococos que crecieron como colonias atípicas sobre m-CromoCen ENT demostró una adecuada especificidad del medio.23 Budnick y colaboradores,24 al evaluar el método Enterolert ® para la determinación de la calidad de aguas recreativas marinas y dulces, informaron porcentajes de falsos positivos y falsos negativos de 5,1 % y 0,4 %, respectivamente.
Estudios previos plantean que E. faecalis y E. faecium son las especies de Enterococcus que se aíslan del agua con mayor frecuencia.25 Ciertas bacterias como A. viridians y Pediococcus, que se aislaron de las muestras analizadas, son también β-D-glucosidasa positivas y, por lo tanto, pueden producir reacciones falsas positivas significativas.26 Algunas de ellas han sido reportadas por otros autores como la principal microbiota acompañante recuperada con otros medios de cultivo utilizados para el aislamiento de enterococos en aguas.26
Varios autores han planteado que el tamaño de las colonias de enterococos, que es de 0,5 a 3 mm de diámetro, es un aspecto fundamental a tener en cuenta para la clasificación de las colonias típicas.27 Nuestros resultados enfatizan este aspecto. Una posible explicación de los falsos negativos encontrados en los niveles más altos de contaminación microbiana de las muestras pudiera ser la presencia en ellas de otras bacterias β-D-glucosidasa positivas que compiten por el sustrato, lo cual podría explicar la aparición de colonias incoloras de enterococos en estas muestras.
Messer y Dufour28 encontraron una mayor tasa de falsos positivos (6,0%) y falsos negativos (6,5 %) al emplear el medio mEI para la búsqueda de enterococos en aguas recreacionales marinas y dulces.
La coincidencia entre los resultados presuntivos y confirmados demuestra una elevada concordancia entre ambos métodos, con valores superiores al 95 % de todos los indicadores de calidad.
La sensibilidad y especificidad de diversos métodos existentes para identificar enterococos en aguas es diferente. En el presente estudio, la sensibilidad de m-CromoCen ENT fue ligeramente superior a la del método ISO y similar a la reportada por Abbott y colaboradores29 al evaluar el método Enterolert® con muestras medioambientales marinas. Los sistemas Enterlolert®-DW y Quanti-Tray ® han sido utilizados para la detección cuantitativa de enterococos en muestras de agua potable, y se ha reportado un 92 % de sensibilidad,30 valor más bajo que el alcanzado en este estudio. Adcock y Santa31 obtuvieron un valor elevado de sensibilidad (99,60 %) utilizando el agar glucosidasa, otro medio cromogénico para la confirmación de enterococos que se transmiten por el agua, pero también con una baja especificidad (84,30 %), incluso menor que en este estudio.
Cohen kappa fue otro parámetro estadístico calculado que permitió establecer los criterios de equivalencia entre los métodos. Los criterios apropiados para este parámetro estadístico deben ser de al menos 0,6.18 Kappa estadísticas revelaron un excelente acuerdo entre m-CromoCen ENT y el método ISO. Este estudio demostró la equivalencia entre los dos métodos evaluados y confirma la idoneidad del método cromogénico m-CromoCen ENT como una alternativa de la norma ISO 7899:2 para la identificación y recuento de enterococos en muestras de agua, sin la necesidad de realizar pruebas bioquímicas adicionales para la identificación, solo la prueba rápida PYR para la confirmación de los resultados. El nuevo método permite la detección rápida de la presencia de contaminación fecal en el agua, lo que facilita la ejecución de cualquier acción para la protección de la salud y la seguridad públicas.
REFERENCIAS BIBLIOGRÁFICAS
1. Njie C, Duke M. Detection of Enterococcus species in groundwater from some rural communities in the Mmabatho area, South Africa: A risk analysis. Afr J Microbiol Res. 2011;5(23):3930-5.
2. Figueras MJ, Borrego JJ. New perspectives in monitoring drinking water microbial quality. Int J Environ Res Public Health. 2010;7(12):4179-202.
3. Salwa SM, Shaban AM, Kamel MM, Huda H, Hendawy EI, Abada EA. New definite-substrate media for Enterococci detection in Nile water, Egypt. J Appl Sci Res. 2010;6(11):1801-6.
4. Byappanahalli MN, Nevers MB, Korajkic A, Staley ZR, Harwood VJ. Enterococci in the environment. Microbiol Mol Biol Rev. 2012;76(4):685-706.
5. Noble RT, Blackwood AD, Griffith JF, McGee CD, Weisberg SB. Comparison of Rapid Quantitative PCR-Based and Conventional Culture-Based Methods for Enumeration of Enterococcus spp. and Escherichia coli in Recreational Waters. Appl Environ Microbiol. 2010;76(22):7437-43.
6. US Environmental Protection Agency (2002). Method 1600: enterococci in water by membrane filtration using membrane-Enterococcus indoxyl-D-glucoside agar (mEI), EPA 821/R-02/022, 2002. US Environmental Protection Agency, Office of Water (4303T), Washington DC.
7. Díaz Pérez M, Rodríguez Martínez C, Zhurbenko R. Enterococcus, medios de cultivo convencionales y cromogénicos. Rev Cubana Hig Epidemiol. 2013;51(1):97-110.
8. Bukh AS, Roslev P. Characterization and validation of a chemiluminescent assay based on a 1,2-dioetane for rapid detection of enterococci in contaminated water and comparison with standard methods and qPCR. J Appl Microbiol. 2011;111(2):407-16.
9. Orenga S, James AL, Manafi M, Perry JD, Pincus DH. Enzymatic substrates in microbiology. J Microbiol Meth. 2009;79(2):139-55.
10. Asociación Española de Normalización y Certificación (2001) Calidad del agua. Detección y recuento de enterococos intestinales. Parte 2: Método de filtración por membrana, UNE-EN ISO 7899-2:2000. AENOR, Madrid, España.
11. Barrow GI, Feltham RKA. Cowan and Steel's manual for the identification of medical bacteria. 3rd ed. Cambridge, Great Britain: Cambridge University Press; 1993.
12. De Vos P, Garrity GM, Jones D, Krieg NR, Ludwig W, Rainey FA, et al. Bergey's Manual® of Systematic Bacteriology. 2nd ed. Vol. 3. The Firmicutes; 2009.
13. Maheux AF, Picard FJ, Boissinot M, Huppé V, Bissonnette L, Bernier JL, Cantin P, Huletsky A, et al. Analytical limits of three b-glucosidase-based commercial culture methods used in environmental microbiology, to detect enterococci. Water Sci Technol. 2009;60(4):943-55.
14. Moniri R. Ghasemi A, Moosavi SGA, Dastehgoli K, Rezaei M. Virulence Gene's Relationship With Biofilm Formation and Detection of aac(6') / aph(2") in E. faecalis Isolated From Patients With Urinary Tracts Infection. Jundishapur J Microbiol. 2013;6(5):e6244. DOI:10.5812/jjm.6244.
15. ISO 16140 (2003). Microbiology of food and animal feeding stuffs-Protocol for the validation of alternative methods, NF ISO 16140:2003. International Organization for Standardization, Geneva, Switzerland.
16. ISO 17994 (2004). Water quality-Criteria for establishing equivalence between microbiological methods, NF ISO 17994:2004. International Organization for Standardization, Geneva, Switzerland.
17. Rodríguez C, Mayo O. Paquete de hojas de cálculo SmartVal. Versión 1.0/09, BioCen, Habana: Cuba; 2010.
18. McBride G (2003). Statistical validation criteria for drinking-water microbiological methods. NIWA Client Report: HAM2003-012.
19. Saati AA, Faidah HS. Environmental Prevalence of Pathogens in Different Drinking Water Resources in Makkah City (Kingdom of Saudi Arabia). Curr World Environ. 2013 [citado: 4 de junio de 2013];8(1):37-53. Available from: http://www.cwejournal.org/?p=3173
20. Daoust RA, Litsky W. Pfizer selective enterococcus agar overlay method for the enumeration of faecal streptococci by membrane filtration. Appl Microbiol. 1975;29(5):584-9.
21. Perry JD, Morris KA, James AL, Oliver M, Gould FK. Evaluation of novel chromogenic substrates for the detection of bacterial β-glucosidase. J Appl Microbiol. 2007;102(2):410-5.
22. Parveen R, Saha SK, Shamshuzzaman SM, Rashid AL, Chowdhury A, Muazzam N. Detection of Uropathogens by Using Chromogenic Media (Hicrome UTI agar), CLED agar and other Conventional Media. Faridpur Med Coll J. 2011;6(1):46-50.
23. Catalao Dionisio LPO, Borrego J. Evaluation of media for the enumeration of faecal streptococci from natural water samples. J Microbiol Methods. 1995;23:183-203.
24. Budnick GE, Howard RT, Mayo DR. Evaluation of Enterolert for enumeration of enterococci in recreational waters. Appl Environ Microbiol. 1996;62(10):3881-4.
25. Bennani M, Amarouch H, Oubrim N, Cohen N. Identification and antimicrobial resistance of fecal Enterococci isolated in coastal Mediterranean environments of Morocco. Eur J Sci Res. 2012;70:226-75.
26. Hartman PA, Deibel RH, Sieverding LM. Enterococci. In: Vanderzant C, Splittstoesser DF (eds.). Compendium of methods for the microbiological examination of foods. 3rd ed. Washington DC, USA: American Public Health Association; 1992. p. 523-31.
27. Slanetz LW, Bartley CH. Numbers of enterococci in water, sewage, and feces determined by the membrane filter technique with an improved medium. J Bacteriol. 1957;74(5):591-5.
28. Messer JW, Dufour AP. A rapid, specific membrane filtration procedure for enumeration of enterococci in recreational waters. Appl Environ Microbiol. 1998;64(2):678-80.
29. Abbott S, Caughley B, Scott G. Evaluation of Enterolert® for the enumeration of enterococci in the marine environment. New Zeal J Mar Freshwat Res. 1998;32(4):505-13.
30. IDEXX (2010) An ISO/TR 13843 Method performance validation for the Enterlolert*-DW and Quanti-Tray* System for the quantitative detection of enterococci in drinking water. [Consultado 23 de junio 2014]. Disponible en: http://www.idexx.com/pubwebresources/pdf/en_ca/water/8980-01-enterolert-dw-validation-report-final.pdf
31. Adcock PW, Saint CP. Development of glucosidase agar for the confirmation of water-borne enterococcus. Wat Res. 2001;35(17):4243-6.
Recibido: 23 de septiembre de 2013.
Aprobado: 9 de octubre de 2013.
Marilyn Díaz Pérez. Centro Nacional de Biopreparados (BioCen), Carretera a Beltrán km 1½, Bejucal, Mayabeque, Cuba. Apartado 6048. Tel: (047) 68 2441. Fax: (5347) 68 2850.
Correo: marilyn.diaz@biocen.cu