Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO ORIGINAL
Determinación de la bioactividad de capas de alginato de sodio en discos de hidroxiapatita
Determination of bioactivity in sodium alginate layers of hydroxyapatite disks
MSc. María Elena Fernández Abreu,I Dr. Clodomiro Alves Junior,II Dr. Jesús Eduardo González Ruíz, III MSc. Meyli Valin Fernández,IV Dr. José Luis Valin RiveraI
I Instituto Superior Politécnico "José Antonio Echeverría" (ISPJAE). La Habana, Cuba.
II Universidade Federal do Rio Grande do Norte. Natal, Brasil.
III Centro de Biomateriales, Universidad de La Habana. La Habana, Cuba.
IV Universidad de São Paulo, USP. Brasil.
RESUMEN
Objetivo: el propósito central de este trabajo es evaluar la bioactividad in vitro de capas de alginato de sodio en discos de hidroxiapatita.
Métodos: los discos de hidroxiapatita fueron elaborados mediante procesos sucesivos de prensado y de sinterizado en un horno eléctrico. Las capas de alginato de sodio se obtuvieron empleando el método de sobrepresión y una disolución acuosa de alginato de sodio al 5 %. En el ensayo de bioactividad las muestras a estudiar fueron sumergidas en fluido biológico simulado. La caracterización de las muestras se realizó empleando microscopia electrónica de barrido y energía dispersiva de rayos X.
Resultados: en las muestras de hidroxiapatita sometidas al ensayo de bioactividad, con y sin capas de alginato de sodio, se observó la formación de precipitados ricos en calcio y fósforo. Además, se determinó que con el aumento del tiempo de inmersión en el fluido biológico simulado se incrementan las dimensiones de los aglomerados formados por partículas apatíticas.
Conclusiones: los resultados experimentales corroboran que la hidroxiapatita es bioactiva y demuestran que las capas estudiadas de alginato de sodio en discos de hidroxiapatita poseen un comportamiento bioactivo.
Palabras clave: hidroxiapatita, alginato de sodio, bioactividad, fluido biológico simulado.
ABSTRACT
Objective: the main purpose of the study is to evaluate in vitro bioactivity in sodium alginate layers of hydroxyapatite disks.
Methods: the hydroxyapatite disks were manufactured by successive pressing and sintering in an electric furnace. The sodium alginate layers were obtained by overpressure and a 5% sodium alginate aqueous solution. For the bioactivity assay, the study samples were soaked in simulated biological fluid. Characterization of the samples was conducted by scanning electron microscopy and energy dispersive X rays.
Results: the bioactivity assay of hydroxyapatite samples with and without sodium alginate layers revealed the formation of precipitates rich in calcium and phosphorus. It was also found that an increase in the time of immersion in the simulated biological fluid brought about an increase in the size of agglomerates of apatite particles.
Conclusions: experimental results show that hydroxyapatite is indeed bioactive, and that the sodium alginate layers of hydroxyapatite disks which were studied behave bioactively.
Key words: hydroxyapatite, sodium alginate, bioactivity, simulated biological fluid.
INTRODUCCIÓN
Existe una gran variedad de materiales cerámicos que pueden ser usados como implantes en el cuerpo humano, los que comúnmente se conocen como biocerámicas.1 Las biocerámicas empleadas con mayor frecuencia como sustitutos óseos son los fosfatos de calcio y dentro de estos la hidroxiapatita (HAp) ocupa un lugar especial. Las piezas porosas de HAp se han usado de forma exitosa debido a que favorecen la adhesión celular y, por consiguiente, la formación de enlaces entre el material implantado y el hueso.1 No obstante, la HAp es frágil, aspecto que limita su uso en zonas del cuerpo humano sometidas a elevadas cargas dinámicas.
Los biomateriales cerámicos pueden combinarse con los poliméricos para formar materiales compuestos, posibilitando con ello mejorar, en comparación con los materiales de origen, su comportamiento biológico y obtener propiedades mecánicas más cercanas al tejido óseo a sustituir.2 También los materiales compuestos pueden ser utilizados como sistemas de liberación controlada de fármacos. Una de las características deseadas en este tipo de materiales es la bioactividad. Los materiales bioactivos forman una unión fuerte con la superficie del tejido óseo (se osteointegran).1
El ensayo de bioactividad in vitro, mediante el método propuesto por T. Kokubo y otros, es utilizado en la evaluación de las biocerámicas y de los materiales compuestos.3-6 En él se simulan las condiciones del cuerpo humano, con el objetivo de valorar las potencialidades de los materiales de estimular o no el crecimiento óseo en su superficie.3,7 En este ensayo se sumergen las muestras en un fluido fisiológico simulado (SBF), el cual tiene una composición iónica similar a la del plasma sanguíneo humano.7,8 Durante el ensayo de bioactividad en la superficie de las muestras bioactivas se forman estructuras apatíticas, y en algunos casos se llega a obtener una capa rica en calcio y fósforo.9-12
El objetivo principal de este trabajo es evaluar la bioactividad in vitro de capas de alginato de sodio en discos de HAp.
MÉTODOS
Obtención de los discos
Los discos de hidroxiapatita (HAp) fueron elaborados con un polvo cubano (B1) fabricado en el Centro de Biomateriales de la Universidad de La Habana, con un diámetro medio de partícula de 8,56 µm. Estos discos se confeccionaron sin aditivos formadores de poros por prensado uniaxial empleando una presión de 4 toneladas. Luego fueron sinterizados en un horno eléctrico de atmósfera controlada con una razón de calentamiento de 4 °C/min, empleando temperaturas de 900 °C y 1 200 °C y un tiempo de 1 h. Como resultado del régimen anteriormente descrito se obtuvieron porosidades aparentes de 20 y 40 %, respectivamente. Las dimensiones de los discos utilizados en los experimentos fueron las siguientes: diámetro = 16,2-18,8 mm; espesor = 1,5-1,7 mm; diámetro de los poros, entre 18 y 100 nm.
En los discos de hidroxiapatita el calcio y el fósforo se encuentran distribuidos homogéneamente. Además, la porosidad de la hidroxiapatita permite un contacto mayor con los fluidos biológicos que rodean el material del implante, debido al aumento de su área superficial.1
Obtención de una capa de alginato de sodio en discos de HAp
Las características reológicas de la solución acuosa de alginato de sodio (5g/L) utilizada fueron: viscosidad aparente media de 35 mPa·s y comportamiento seudoplástico. La infiltración del alginato de sodio en los discos de HAp fue realizada por el método de sobrepresión en un dispositivo con un radio del pistón de 20 mm. En los experimentos se utilizaron prensiones uniaxiales de 15,61 y 31,22 MPa durante 1 min.
Determinación de la bioactividad in vitro
La evaluación de la interacción del biomaterial con el medio fisiológico se realizó a partir de la inmersión de muestras de hidroxiapatita y del material compuesto estudiado en un fluido biológico simulado (SBF por sus siglas en inglés). El SBF se preparó empleando la técnica descrita por Kokubo y otros.3,5,8 La concentración iónica de la disolución empleada en los experimentos (en mM) fue la siguiente: Na1+ =142,0; K1+ = 5,0; Mg2+ = 1,5; Ca2+ = 2,5; Cl1- = 147,8; HCO31- = 4,2; HPO42- = 1,0; SO42- = 0,5. La relación volumen de SBF/área de biomaterial utilizada fue 10 mL/cm2. Las muestras embebidas en la disolución se mantuvieron en una incubadora a 37 °C durante 6, 12 o 27 días con el objetivo determinar cambios en su morfología (surgimiento en su superficie de estructuras apatíticas) y en su composición elemental.
Equipos
La microscopia electrónica de barrido (MEB) y la espectroscopia de energía dispersiva de rayos X (EDX) se emplearon para evaluar la bioactividad del biomaterial. En los ensayos se utilizó un microscopio PHILIPS, Modelo XL30- ESEM, ambiental.
RESULTADOS
Caracterización de los discos de HAp
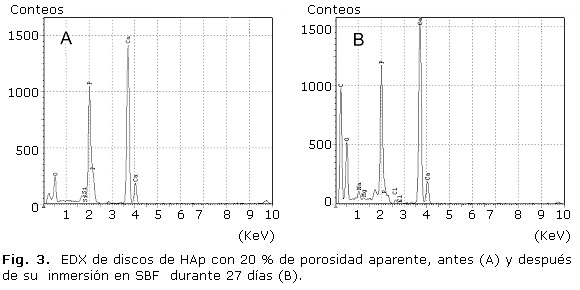
Los discos de HAp estudiados (con porosidades aparentes de 20 y 40 %) estaban formados por partículas con una configuración globular y un tamaño generalmente inferior a 500 nm. Además, presentaban numerosos poros en su superficie con dimensiones nanométricas o submicrométricas (figuras 1A, 2A y 3A). El análisis elemental mediante EDX mostró que se encontraban constituidos fundamentalmente por los elementos calcio, fósforo y oxígeno (figura 3A), lo cual resulta típico de las apatitas.
Ensayo de bioactividad
La inmersión de discos de HAp, con ambas porosidades aparentes estudiadas (20 y 40 %) en SBF durante 6 días, redundó en cambios significativos de su morfología (figuras 2B y 3B). En ambos casos se apreció que desaparecen los poros de la superficie de los discos de HAp. Además, se observó la formación de pequeñas partículas con una configuración globular, las que formaban algunos aglomerados con dimensiones de aproximadamente 3 mm.
En las muestras expuestas al SBF durante 12 o 27 días (figuras 1C, 1D, 2C y 2D), se apreció un incremento en las dimensiones de los aglomerados en comparación con el obtenido en las ensayadas durante 6 días (figuras 1B y 2B). Los aglomerados llegaron a alcanzar dimensiones en el orden de 10 y 15 mm a los 12 y 27 días de inmersión en SBF, respectivamente.
El análisis elemental a nivel superficial de los discos de HAp después del ensayo de bioactividad demostró que están constituidos fundamentalmente por calcio y fósforo (figura 3A y 3B), lo cual resulta típico de las estructuras apatíticas. También en el espectro EDX se revelaron picos que se corresponden con elementos que originalmente no están presentes en los discos de HAp (Na, Cl y Mg).
Caracterización de capas alginato de sodio en discos de HAp
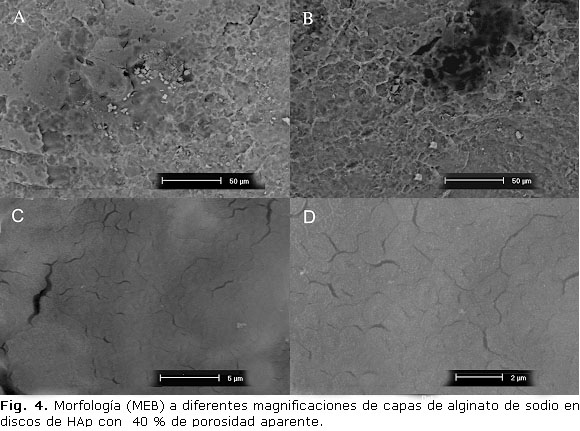
En los discos con capas de alginato de sodio se observó una variación significativa de su morfología y topografía en comparación con el material del sustrato (figura 4A, 4B, 4C, 4D). Las partículas apatíticas de los discos de HAp no se apreciaron, comportamiento que indica que quedaron cubiertas por la capa de alginato de sodio. En las micrografías con menor magnificación se divisaron algunas irregularidades en la superficie (figura 4A y 4B), mientras que al aumentar la magnificación se observaron zonas con mayor homogeneidad y algunas microgrietas (figuras 4C y 4D).
Ensayo de bioactividad de capas alginato de sodio en discos de HAp
El ensayo de bioactividad de capas de alginato de sodio en discos de HAp también produjo cambios significativos en su morfología y topografía (figura 5A). En dichas superficies, de forma similar al comportamiento observado en los discos de HAp sometidos al ensayo de bioactividad, se observó el crecimiento de partículas que forman aglomerados. Las referidas partículas cubren todas las superficies estudiadas (con la excepción de algunas microgrietas diseminadas en las superficies estudiadas) (figura 5A). Además, los ensayos de EDX revelaron que las partículas depositadas durante el ensayo de bioactividad se encuentran formadas por Ca, P, O, Cl, Mg y Na (figura 5B). La presencia de los elementos Cl, Mg en las partículas formadas, corrobora la deposición de apatitas desde el SBF.
DISCUSIÓN
Los ensayos de microscopia electrónica de barrido demostraron la formación de una capa de alginato de sodio en discos de HAp. En general, la capa de alginato de sodio provocó una disminución significativa de los poros superficiales en comparación con los discos de HAp, comportamiento relacionado con la penetración del referido polímero en el material base.
El ensayo de bioactividad provocó cambios significativos en la morfología y composición elemental en la superficie de las muestras de HAp con y sin capas de alginato de sodio. Este comportamiento se encuentra relacionado con la deposición de uno o más fosfatos de calcio.2-4 La obtención de estructuras apatíticas y la posterior formación de aglomerados de estas fases ha sido reportada, tanto en la superficie de muestras sometidas al ensayo de bioactividad como en recubrimientos obtenidos en SBF.9,13,14
Los ensayos de EDX de las superficies sometidas al ensayo de bioactividad mostraron la presencia Cl, Mg y Na (figuras 3B y 5B), elementos que no se encuentran dentro de los componentes de la HAp utilizada como sustrato en los experimentos (figura 3A). Por otra parte, dichos elementos se encuentran dentro de los componentes del SBF empleado en el estudio de bioactividad, ello corrobora la formación de partículas apatíticas producto de la interacción que ocurre a nivel superficial entre los discos y el SBF. Además, diferentes autores han reportado la presencia de estos elementos en los depósitos obtenidos en SBF sobre diferentes superficies bioactivas.12,15-17
La significativa variación de la morfología en toda la superficie de las capas de alginato de sodio en los discos de HAp después de su inmersión en SBF durante 6-27 días, unida a la presencia de algunas grietas en dichas superficies (figura 5A), debe encontrarse relacionada con la obtención de un depósito apatítico. La existencia de grietas superficiales en dichas capas coincide con el comportamiento reportado para diferentes materiales bioactivos al incrementar el tiempo de exposición en SBF.17-19 La deposición de un recubrimiento apatítico sobre las capas de alginato de sodio en los discos de HAp durante su inmersión en SBF, puede ser un indicador de que el material compuesto desarrollado tiene una elevada bioactividad. No obstante, es necesario realizar estudios complementarios para fundamentar la aseveración anterior.
La deposición de estructuras apatíticas sobre la superficie de capas de alginato de sodio en discos de HAp se produce debido a que algunas partículas de HAp quedan expuestas al SBF durante el ensayo de bioactividad, lo que permite que actúen como centros de nucleación de dichas estructuras. A esto se une el efecto positivo del alginato de sodio sobre la bioactividad del material compuesto (HAp + alginato de sodio) obtenido en la superficie de los discos estudiados.
También se demostró que los niveles de porosidad aparente estudiados en los discos de HAp no influyen significativamente sobre la morfología obtenida en las muestras después del ensayo de bioactividad. Este comportamiento se observó en los discos de HAp con y sin capas de alginato de sodio.
En general, las micrografías y los espectros de EDX realizados a los discos de HAp después del ensayo de bioactividad corroboran el comportamiento bioactivo de esta fase reportado por diferentes autores. En el caso de los discos de hidroxiapatita con capas de alginato de sodio, también se demostró su comportamiento bioactivo.
Dentro de las limitaciones del trabajo, los resultados indican la factibilidad de evaluar el material desarrollado como implante óseo en zonas que no se encuentran sometidas a elevadas solicitaciones mecánicas. Además, permiten sugerir su estudio como posible sistema para la liberación controlada de fármacos.
Agradecimientos
A la Universidad Federal de Río Grande del Norte de Natal, Brasil; a la CAPES de Brasil por el financiamiento del proyecto "Efeito das modificações induzidas por plasma na bioativida de biomateriais implantáveis" (Projeto número 066/2009) y al Instituto Superior Politécnico "José Antonio Echeverría" de La Habana, Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1. Barrios I, Vásquez M, Spadavecchia U, Camero S, González G. Estudio comparativo de la bioactividad de diferentes materiales cerámicos sumergidos en fluido simulado del cuerpo. Rev LatinAm Met Mat. 2005;(1):23-30.
2. Qu H, Xia Z, Knecht DA, Wei M. Synthesis of Dense Collagen/Apatite Composites Using a Biomimetic Method. J Am Ceram Soc. 2008;91(10):3211-15.
3. Kokubo T, Takadama H. How useful is SBF in predicting in vivo bone bioactivity? Biomaterials. 2006;27:2907-15.
4. Morejón L, Delgado JA, Mendizábal E, Ochoa JI, Ávila G, Martínez S. Efecto de la silanización sobre la bioactividad de cementos acrílicos modificados. VII Congreso de la Sociedad Cubana de Bioingeniería. La Habana: 2007.
5. Castro H, Ledea OE. Determinación de la bioactividad y la resistencia a la compresión de bloques de poliapatita. Quim Nova. 2010;33(4):891-2.
6. Hui Wang, Changjian Lin, Ren Hu. Effects of structure and composition of the CaP composite coatings on apatite formation and bioactivity in simulated body fluid. Appl Surf Sci. 2009;255:4074-81.
7. Bohner M, Lemaitre J. Can bioactivity be tested in vitro with SBF solution? Biomaterials. 2009;30:2175-9.
8. ISO 23317: 2007. Implants for surgery- In Vitro evaluation for apatite-forming ability of implant materials. 2007.
9. Vanzillotta PS, Sader MS, Bastos IN, de Almeida G. Improvement of in vitro titanium bioactivity by three different surface treatments. Dent Mater. 2006;22:275-82.
10. Amin MS, Randeniya LK, Bendavid A, Martin PJ, Preston EW. Biomimetic apatite growth from simulated body fluid on various metal-oxide containing DLC thin films. Diam Relat Mater. 2012;21:42-9.
11. González JE, Paz A. Composición de las disoluciones y parámetros de los procesos empleados en la aplicación de recubrimientos biomiméticos sobre titanio. Estado del arte. Rev CENIC Ciencias Químicas. 2009;40(2):73-9.
12. Aparecida AH, Lia Fook MV, dos Santos ML, Guastaldi AC. Estudo da influência dos íons K+, Mg2+, So4 2- e CO3 2- na cristalização biomimética de fosfato de cálcio amorfo (acp) e conversão a fosfato octacálcico (OCP). Quim Nova. 2007;30(4):892-6.
13. Kumar GS, Girija EK, Thamizhavel A, Yokogawa Y, Kalkura SN. Synthesis and characterization of bioactive hydroxyapatite-calcite nanocomposite for biomedical applications. J Colloid Interf Sci. 2010;349:56-62.
14. Kizuki T, Takadama H, Matsushita T, Nakamura T, Kokubo T. Preparation of bioactive Ti metal surface enriched with calcium ions by chemical treatment. Acta Biomaterialia. 2010;6: 2836-42.
15. Wang G, Meng F, Ding C, Chu PK, Liu X. Microstructure, bioactivity and osteoblast behavior of monoclinic zirconia coating with nanostructured surface. Acta Biomaterialia. 2010; 6:990-1000.
16. Huang J, Best SM, Bonfield W, Buckland T. Development and characterization of titanium-containing hydroxyapatite for medical applications. Acta Biomaterialia. 2010;6:241-9.
17. Jonasova L, Müller FA, Helebrant A, Strnad J, Greil P. Hydroxyapatite formation on alkali-treated titanium with different content of Na + in the surface layer. Biomaterials. 2002;23:3095-101.
18. Liu F, Xua J, Wang F, Zhao L, Shimizu T. Biomimetic deposition of apatite coatings on micro-arc oxidation treated biomedical NiTi alloy. Surf Coat Tech. 2010;204:3294-9.
19. Chen XB, Li YC, Du Plessis J, Hodgson PD, Wen C. Influence of calcium ion deposition on apatite-inducing ability of porous titanium for biomedical applications. Acta Biomaterialia. 2009;5:1808-20.
Recibido: 11 de noviembre de 2013.
Aprobado: 27 de noviembre de 2013.
MSc. María Elena Fernández Abreu. Instituto Superior Politécnico "José Antonio Echeverría", (ISPJAE). La Habana, Cuba. Correo electrónico: mary@mecanica.cujae.edu.cu












 Curriculum ScienTI
Curriculum ScienTI