Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Investigaciones Biomédicas
versão impressa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.1 Ciudad de la Habana jan.-mar. 2014
ARTÍCULO ORIGINAL
Desarrollo y evaluación de un método de obtención de larvas estériles de Lucilia eximia para su uso en terapia larval
Development and evaluation of a method to obtain sterile Lucilia eximia larvae for use in larval therapy
Lissette Retana Moreira, Kattia Belfort Arguedas, Olger Calderón Arguedas, Adriana Troyo Rodríguez, María del Mar Gamboa Coronado
Centro de Investigación en Enfermedades Tropicales (CIET). Universidad de Costa Rica.
RESUMEN
Objetivo: desarrollar un método de tratamiento de huevos de Lucilia eximia para la obtención de larvas estériles y evaluar la capacidad de supervivencia de dichas larvas en condiciones de refrigeración a 4°C.
Métodos: se estableció un sistema de crianza para L. eximia. Los huevos fueron colectados en el sustrato de oviposición, se lavaron con solución salina estéril (0,85%), se trataron con hipoclorito de sodio (0,5%) y finalmente se esterilizaron con formalina, evaluando tres diferentes concentraciones (2,5%; 5,0% y 10,0%). Se verificó la esterilidad de los huevos empleando medios de cultivo bacteriológicos y la eclosión de los huevos esterilizados fue expresada mediante el cálculo de un índice de eclosión (IE). Además, se evaluó la supervivencia de las larvas de segundo y tercer estadio temprano (L2 y L3, respectivamente) en condiciones de refrigeración, durante las 4 primeras horas y luego a las 24 y 48 horas.
Resultados: todas las concentraciones de formalina evaluadas fueron capaces de esterilizar los huevos. No se encontró una correlación entre el IE y las concentraciones de formalina utilizadas (R Spearman = -0,030, p = 0,848). Durante las primeras 4 horas a 4°C, un 100% de las L2 y las L3 sobrevivieron. Sin embargo, en ambos estadios larvales hubo un marcado descenso de la supervivencia a las 24 y 48 horas, siendo las L2 las más sensibles a las condiciones de refrigeración.
Conclusiones: los resultados mostraron que la obtención de larvas estériles de L. eximia con el método utilizado es un proceso sencillo, pero la supervivencia de las larvas en condiciones de refrigeración es limitada.
Palabras clave: Terapia larval, úlceras dérmicas, Lucilia eximia, larvas estériles, supervivencia.
ABSTRACT
Objective: develop a method to treat eggs of Lucilia eximia to obtain sterile larvae and evaluate the survival capacity of those larvae under refrigeration at 4°C.
Methods: a rearing system was set up for L. eximia. The eggs were collected from the oviposition substrate, washed with sterile saline solution (0.85%), treated with sodium hypochlorite (0.5%), and sterilized with formalin. Three concentrations were evaluated: 2.5%; 5.0% and 10.0%. Egg sterility was verified by bacteriological culture. Eclosion of sterilized eggs was expressed by estimation of an eclosion rate (ER). An evaluation was conducted of the survival of larvae from the second and third early stages (L2 and L3, respectively) under refrigeration during the first 4 hours and then at 24 and 48 hours.
Results: all the formalin concentrations evaluated were capable of sterilizing the eggs. No correlation was found between the ER and the formalin concentrations used (Spearman's Rho = -0.030, p = 0.848). During the first 4 hours at 4°C, 100% L2 and L3 survived. However, both larval stages showed a marked decrease in survival at 24 and 48 hours, L2 being the most sensitive to refrigeration.
Conclusions: results show that obtaining sterile L. eximia larvae by this method is a simple process. However, larval survival under refrigeration is limited.
Key words: larval therapy, skin ulcers, Lucilia eximia, sterile larvae, survival.
INTRODUCCIÓN
La terapia larval es un procedimiento biológico que se aplica al tratamiento de úlceras dérmicas.1 Diferentes tipos de úlcera han sido eficientemente tratados con estos procedimientos, dentro de éstas se pueden citar las úlceras en los pies, las úlceras de presión, las heridas quirúrgicas, las heridas traumáticas, por quemaduras y las úlceras arteriovenosas.1 Para la ejecución de dicha terapia, se emplean larvas de mosca de carácter necrobiontófago, las cuales, como su denominativo lo indica, se alimentan de tejido necrótico pero respetan el tejido sano. Los procesos de desbridación ocurren gracias a la acción mecánica de las piezas bucales de las larvas y la secreción de enzimas tipo tripsina, quimiotripsina, metaloproteasas y colagenasas.2 Por otro lado, se ha podido demostrar que los productos de excreción/secreción de las larvas tienen actividad antimicrobiana3 y actividad promotora de la multiplicación celular, lo cual favorece los procesos de cicatrización dérmica.1,4 Lucilia sericata (Diptera: Calliphoridae) es una especie que ha sido empleada de forma eficiente en este tipo de procedimientos en diversos países de Europa, Norteamérica y Suramérica.2,5 En Costa Rica, Lucilia eximia, especie relacionada taxonómicamente, constituye una especie muy común en todo el territorio nacional.6 Recientemente, L. eximia ha sido propuesta como una especie de utilidad en el tratamiento de úlceras dérmicas y ha mostrado una eficacia mayor que L. sericata en los procesos de solución de diversos tipos de heridas dérmicas.7 La terapia con larvas de esta especie ha sido ensayada en Colombia con el propósito principal del desbridamiento y en algunos casos para disminuir el mal olor resultante de la descomposición bacteriana en úlceras de gran tamaño.
La aplicación de la terapia larval requiere el uso de larvas estériles. Aun cuando se pueda dar un eficiente tratamiento microbicida a las larvas, la desinfección se realizaría solamente en la superficie, sin poder esterilizarse el tracto intestinal.8 Es por esta razón que se prefiere utilizar procedimientos para la esterilización de huevos.
Los primeros procedimientos de este tipo incluían un pretratamiento con solución de Dakin (hipoclorito de sodio diluido o cloro) seguido de una inmersión en cloruro de mercurio o formalina.1 Otros agentes desinfectantes y esterilizantes que han sido utilizados incluyen el ácido hidroclorhídrico y el Lysol comercial,9 además de sulfito de sodio al 1 % en solución salina y formaldehído al 2,5 %. 4 También, ha sido reportado el empleo de alcohol y bicloruro de mercurio.8
En el presente trabajo se pretendió desarrollar un procedimiento práctico y económico para poder ser implementado en laboratorios de instituciones nosocomiales, y así garantizar la obtención de larvas estériles de L. eximia para su eventual uso en terapia larval. Asimismo, se evaluó su supervivencia en condiciones de refrigeración para conocer el tiempo que estas larvas podrían almacenarse bajo esas condiciones. Estos aspectos constituyen un paso previo a su uso en terapia larval.
MÉTODOS
Colecta, identificación y establecimiento de las colonias de L. eximia
Para iniciar una colonia de L. eximia, se realizó una colecta de moscas califóridas en la Reserva Leonel Oviedo, ubicada en la Ciudad Universitaria "Rodrigo Facio" de la Universidad de Costa Rica en San Pedro de Montes de Oca (9°56'07 N y 84°03'04 O).10 Se utilizaron trampas verticales construidas de acuerdo a la metodología establecida por Meegan y otros11 en las cuales se empleó pescado crudo como cebo. También, se realizó una colecta directa con red entomológica. Las moscas obtenidas fueron trasladas al laboratorio, donde se inactivaron parcialmente con acetona para su identificación taxonómica, la cual se basó en las características propuestas por Aubertin,12 Barros de Carvalho y Antunes de Mello-Patiu13 y Amat y colaboradores.14 Con el fin de establecer las colonias, las moscas que correspondieron a L. eximia fueron transferidas a cajas plásticas cuyas medidas fueron 45 x 30 x 30 cm, a las que se les colocó una mezcla 1:1 de azúcar y leche en polvo como substrato alimenticio y un recipiente con agua libre de cloro, invertido sobre una placa de Petri con un papel absorbente.
Como medio de oviposición se utilizó un trozo de hígado fresco colocado en un tubo cónico recubierto de plástico negro. Los huevos obtenidos a partir de cada oviposición fueron contados y posteriomente se utilizaron en la implementación de la técnica de obtención de formas larvales estériles. Una fracción se utilizó para la generación de nuevas moscas con el fin de repoblar la colonia. Para este efecto, los huevos fueron colocados en trozos de hígado en un recipiente cuyas medidas fueron 40 x 18 x 15 cm. Estos recipientes se colocaron en una caja plástica con una cama de arena como ambiente de pupación. Las pupas generadas fueron transferidas de nuevo a las cajas de mantenimiento de adultos para su eclosión.
Esterilización de los huevos de L. eximia y cálculo de los índices de eclosión
Los huevos destinados a la generación de larvas estériles fueron manejados utilizando como base la metodología descrita por Figueroa y otros para la esterilización de huevos de Lucilia sericata.2,5 Para la ejecución de dicha técnica se colectaron los huevos a partir del sustrato de oviposición y se emulsificaron en solución salina estéril al 0,85 % en una placa de Petri.
Posteriormente, fueron transferidos a un tubo de ensayo de 10,0 x 1,5 cm con hipoclorito de sodio al 0,5 % el cual constituyó el tratamiento previo a la esterilización. El hipoclorito fue decantado y se agregó formalina en tres concentraciones de prueba (2,5 %, 5,0 % y 10,0 %), como esterilizante definitivo en procedimientos separados para cada una de las concentraciones. El tiempo de tratamiento fue de 5 min para las tres concentraciones utilizadas, luego de las cuales se llevaron a cabo tres lavados con solución salina estéril al 0,85 %. Los huevos fueron secados sobre un papel de filtro estéril y posteriormente se colocaron en placas de agar sangre bacteriológico. El agar sangre constituyó el medio para la eclosión y a la vez sirvió como fuente de nutrientes para el crecimiento larval. Como control de viabilidad se reprodujo el mismo procedimiento sustituyendo el tratamiento con formalina por solución salina al 0,85 %.
Una muestra de los huevos procesados en cada ensayo se colocó en caldo tripticasa soya y caldo tioglicolato para la evaluación microbiológica de la esterilidad.
Para evaluar el éxito en el proceso de eclosión se calculó un índice de eclosión
(IE) el cual se definió como sigue:
IE = % de huevos eclosionados bajo tratamiento/% de huevos eclosionados en el control
Capacidad de supervivencia de las larvas de L. eximia a temperaturas de refrigeración
Para evidenciar la capacidad de supervivencia en las condiciones de refrigeración usuales (4 °C±1), se utilizaron larvas de segundo estadio (L2) y de tercer estadio tempranas (L3), las cuales fueron obtenidas mediante los procedimientos descritos anteriormente y suprimidas de alimento en el momento de la evaluación.
Los huevos esterilizados se colocaron en agar sangre para la eclosión de las larvas, las cuales fueron mantenidas en dicho medio hasta alcanzar los estadios por evaluar. Dichas larvas fueron colocadas en placas de Petri de 5 cm de diámetro con un trozo de papel filtro humedecido con solución salina estéril, a razón de 5 larvas por placa.
La capacidad de supervivencia fue comprobada al observarse características de motilidad evidentes en las larvas, una hora después de extraídas de las condiciones de refrigeración y colocadas a temperatura ambiente. La observación de las larvas se realizó en intervalos de 1 h hasta las 4 h y posteriormente se extrajeron grupos de larvas a las 24 h y a las 48 h de permanecer en refrigeración. Se realizaron al menos siete réplicas en el caso de las larvas mantenidas a 4 °C y 3 réplicas en el caso de las larvas mantenidas a temperatura ambiente, las cuales se utilizaron como control.
Análisis estadístico de los datos
Se calculó el promedio de huevos por oviposición a partir del total obtenido en quince oviposiciones, así como el intervalo de confianza al 95 %. Se implementó el cálculo del coeficiente de correlación de Spearman para evaluar si existe correlación entre las tres diferentes concentraciones de formalina empleadas y los índices del porcentaje de eclosión obtenidos, utilizando un α = 0,05.
Para evaluar si existen diferencias estadísticamente significativas con respecto a la supervivencia de las larvas a temperaturas de refrigeración se utilizaron las pruebas de Kruskal-Wallis y T de Tukey, considerando un p ≤ 0,05 como significativo. Todas las pruebas estadísticas se efectuaron utilizando los programas SPSS 17.0 (IBM) y XLStat versión 2012.6.01 (Addinsoft). Los gráficos se realizaron utilizando el programa GraphPad Prism (GraphPad Software).
RESULTADOS
Las oviposiciones de L. eximia observadas mostraron gran variabilidad en cuanto al número de huevos que las conformaron. Los resultados obtenidos permitieron el cálculo de un promedio de 334 huevos cuyo intervalo de confianza al 95 % fue de 220 a 448 huevos.
El efecto de los tratamientos con formalina, independiente de las concentraciones, permitió una eficiente esterilización de los huevos, según las pruebas en caldo tioglicolato y caldo tripticasa soya. No obstante, hubo porcentajes de eclosión muy variables entre los sistemas (tabla). Cuando se utilizó la concentración de 2,5 % se pudo observar porcentajes de eclosión que fluctuaron entre el 0 y el 93,3 %. Los índices de eclosión (IE) para este sistema tuvieron valores entre 0,00 y 0,93. Cuando se aplicó una concentración del 5,0 % los porcentajes de eclosión tuvieron valores entre el 0 y el 20 %, con IE entre 0,00 y 1,19. El tratamiento con formalina al 10,0 % permitió obtener porcentajes de eclosión que estuvieron entre el 0 y el 26 %, con IE entre 0,00 y 0,93 (tabla). El análisis de correlación de Spearman no permitió observar correlaciones significativas entre las concentraciones de formalina utilizadas y los índices del porcentaje de eclosión (R Spearman = -0,030, p = 0,848).
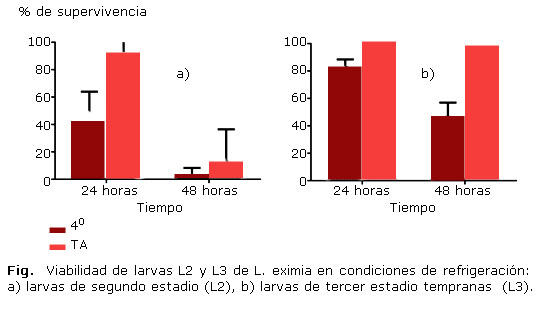
Con respecto a la supervivencia en condiciones de refrigeración, tanto para las L2 como para las L3 se pudo determinar un 100 % de viabilidad en las larvas refrigeradas así como en los controles a temperatura ambiente durante las primeras 4 horas. Con respecto a las L2, a las 24 h se pudo determinar que solo un 42,0 % de las larvas en refrigeración sobrevivieron, en comparación con un 93,3 % del control a temperatura ambiente. Estas diferencias porcentuales fueron estadísticamente significativas (p = 0,044). A las 48 h, tanto las larvas refrigeradas como sus controles a temperatura ambiente mostraron un decrecimiento en la supervivencia, alcanzándose un 2 % para las larvas mantenidas a 4 °C y un 13,3 % para las mantenidas a temperatura ambiente (Fig. 1a). Estas diferencias no fueron estadísticamente significativas (p = 0,705). Con respecto a las L3, la supervivencia a 4 °C a las 24 horas fue del 83,1 % mientras que un 100 % de las larvas utilizadas como control a temperatura ambiente sobrevivió. Sin embargo, estas diferencias no fueron estadísticamente significativas (p = 0,395). A las 48 h, 46,6 % de las larvas en refrigeración sobrevivió, en comparación con el 100 % a temperatura ambiente (Fig. 1b). A pesar de la tendencia en términos de diferencia porcentual, ésta tampoco fue estadísticamente significativa (p =0,082). Para las L2 se pudo advertir una disminución significativa en la supervivencia entre las 24 y las 48 horas a temperaturas de refrigeración (p = 0,002), disminución que no fue evidenciada con las L3 (p = 0,058).
DISCUSIÓN
El establecimiento de las colonias de L. eximia fue realizado con éxito lo que supone que esta es una especie que puede ser manejada eficientemente con un insectario de tamaño regular y con una inversión económica relativamente baja. El comportamiento de oviposición, si bien es cierto resultó variable, permitió obtener un número razonable de huevos por oviposición (220 a 448 huevos/oviposición). Para algunas moscas califóridas la tasa de oviposición promedio es de aproximadamente 280 huevos,15 por lo que se puede suponer un comportamiento de L. eximia en condiciones de laboratorio similar al que se ha reportado para otras especies.
La utilización de formalina permitió una esterilización adecuada de los huevos, la cual fue efectiva contra microorganismos aerobios y anaerobios. A partir de este procedimiento se generó la progenie larval estéril. La formalina ha sido empleada como agente esterilizante en otros sistemas que han abordado especies como L. sericata para su empleo en terapia larval,5 lo que parece indicar que la manipulación y comportamiento de estas dos especies en condiciones de laboratorio es similar. El análisis de correlación no permitió identificar ningún efecto asociado con la concentración de formalina que incidiera sobre la eclosión. En primera instancia, este hallazgo corrobora el hecho de que el corion de los huevos de insecto representa una barrera altamente eficiente contra agentes químicos que garantiza la viabilidad del embrión.16 Por esta razón, la utilización de concentraciones en el ámbito empleado no compromete el rendimiento en término de formas larvales por obtener. Este hallazgo representa una ventaja en el sentido de que la formalina es un reactivo que se encuentra muy frecuentemente en la mayoría de laboratorios hospitalarios.
En este estudio, llama la atención la variabilidad observada en la eclosión, evidenciándose porcentajes e índices de eclosión muy diferentes en cada experimento. En este sentido, la manipulación mecánica de los huevos podría haber incidido en la disrupción de la integridad de los huevos provocando la muerte del embrión.
El análisis de la supervivencia de las larvas a temperatura de refrigeración demostró que las L2 estériles son menos resistentes a 4 °C que las L3, de las cuales se pudo observar una importante proporción viable aún a las 48 horas. Estos resultados indican que en un programa sostenido de terapia larval, el proceso de esterilización de huevos para obtener larvas estériles podría efectuarse cada dos a tres días, representando una pequeña inversión de tiempo laboral de personal especializado destinada al proceso. Algunos autores como Chan y otros17 han sugerido el mantenimiento de las larvas a temperaturas superiores a los 8 °C. En este sentido, dichos autores reportaron el mantenimiento idóneo de las larvas recién eclosionadas de Lucilia sericata a temperaturas de 8 a 10 °C, lo que podría aumentar la vida útil de dichas larvas.
Agradecimientos
Los autores desean externar su agradecimiento a Iván Coronado del Departamento de Parasitología de la Facultad de Microbiología de la Universidad de Costa Rica (UCR) por su apoyo a la labor operativa y a la Vicerrectoría de Investigación (UCR) por su soporte financiero a los proyectos 803 A8 2008 y 803 B1 067.
REFERENCIAS BIBLIOGRÁFICAS
1. Sherman RA, Hall MJR, Thomas S. Medical Maggots: An ancient remedy for some contemporary afflictions. Annu Rev Entomol. 2000;45:55-81.
2. Figueroa L, Uherek F, Yusef P, López L, Flores J. Experiencia de terapia larval en pacientes con úlceras crónicas. Parasitol Latinoam. 2006;61:160-4.
3. Bexfield A, Bond AE, Roberts EC, Dudley E, Nigam Y, Thomas S, et al. The antibacterial activity against MRSA strains and other bacteria of a < 500Da fraction from maggot excretions/secretions of Lucilia sericata (Diptera: Calliphoridae). Microbes Infect. 2008;10:325-33.
4. Mumcuoglu KY, Ingber A, Gilead L, Stessman J, Friedman R, Schulman H, et al. Therapy for the treatment of intractable wounds. Int J Dermatol. 1999;38:623-7.
5. Figueroa L, Flores J, Rodríguez S. Método de cultivo de larvas de moscas Lucilia sericata para terapia larval. Parasitol Latinoam. 2007;62:79-82.
6. Jirón LF. Sobre moscas califóridas de Costa Rica (Diptera: Cyclorrhapha). Brenesia. 1979;16:221-3.
7. Wolff-Echeverri MI, Rivera-Álvarez C, Herrera-Higuita SE, Wolff-Idárraga JC, Escobar-Franco MM. Lucilia eximia (Diptera: Calliphoridae) una alternativa para la terapia larval y reporte de casos en Colombia. Iatreia. 2010;2:107-16.
8. Namias N, Varela JE, Varas RP, Quintana O, Ward CG. Biodebridement: a case report of maggot therapy for limb salvage after fourth-degree burns. J Burn Care Rehabil. 2000;21:254-7.
9. Sherman RA, Wyle FA. Low-cost, low-maintenance rearing of maggots in hospitals, clinics and schools. Am J Trop Med Hyg. 1996;54:38-41.
10. Di Stefano JF, Nielsen V, Hoomans J, Fournier LA. Regeneración de la vegetación arbórea en una pequeña reserva forestal urbana del nivel premontano húmedo, Costa Rica. Rev Biol Trop. 1996;44:275-80.
11. Meegan M, Morley D, Chavasse D. Fly traps. Lancet. 1997;349:886.
12. Aubertin D. Revision of the Genus Lucilia (Diptera, Calliphoridae) Linn. Soc J. 1933;XXXVIII;28-536.
13. Barros de Cavalho CJ, Antunes de Mello-Patiu C. Key to the adults of the most common forensic species of Diptera in South America. Rev Bras Entomol. 2007;3:390-406.
14. Amat E, Vélez MC, Wolf M. Clave ilustrada para la identificación de los géneros y las especies de califóridos (Diptera: Calliphoridae) de Colombia. Caldasia. 2008;30:231-44.
15. Thomas DB. Fecundity and oviposition in laboratory colonies of the screwworm fly (Diptera: Calliphoridae). J Econ Entomol. 1993; 86:1464-72.
16. Gordon RM, Lavoipierre MM. Entomology for students of medicine. Oxford: Blackwell Scientic Publications; 1962. Chapter 9, 52-70.
17. Chan DCW, Fong DHF, Leung JYY, Patin NG, Leung GKK. Maggot debridement therapy in chronic wound care. Hong Kong Med J. 2007;13:382-6.
Recibido: 9 de octubre de 2013.
Aprobado: 25 de octubre de 2013.
MSc. Lissette Retana Moreira. Universidad de Costa Rica, Sede Rodrigo Facio. San Pedro de Montes de Oca. Correo electrónico: lissette.retanamoreira@ucr.ac.cr (506)2511-8631