Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.1 Ciudad de la Habana ene.-mar. 2014
ARTÍCULO ORIGINAL
Interleucina-12 exógena evita disminución de actividad de mieloperoxidasa de macrófagos en gérbiles
con esporotricosis
Exogenous interleukin-12 prevents the decrease in myeloperoxidase activity of macrophages in gerbils with sporotrichosis
Dr. Aurelio Flores-García, MSc. Rogelio Sánchez-Gutiérrez, Dr. C.M. Raymundo Velasco-Rodríguez, Dr. Alejandro Zambrano-Parra, MSc. Salvador Ruiz-Bernés, Dr. Cecilio Paredes Estrada
Universidad Autónoma de Nayarit. Tepic, Nayarit, México.
RESUMEN
Introducción: la interleucina-12 es una citosina inmunorreguladora con múltiples funciones biológicas, incluyendo la activación de macrófagos. La mieloperoxidasa es una enzima que desempeña un papel importante en la función antimicrobiana de fagocitos activados. En presencia de peróxido de hidrógeno, esta cataliza la oxidación de cloruro para generar ácido hipocloroso, potente agente microbicida.
Objetivo: determinar el efecto estimulador de interleucina-12 recombinante murina sobre la actividad de mieloperoxidasa en macrófagos peritoneales en gérbiles infectados experimentalmente con levaduras de Sporothrix schenckii.
Métodos: 500 ng de interleucina-12 recombinante murina fueron suministrados diariamente por vía intraperitoneal durante 5 días consecutivos a gérbiles machos, los cuales al sexto día fueron inoculados por vía subcutánea en el cojinete plantar posterior izquierdo con 6x106 levaduras de S. schenckii. siete días después de la infección los macrófagos fueron obtenidos de la cavidad peritoneal y la actividad de su mieloperoxidasa fue determinada mediante el método de Kaplow, expresándose como porcentaje de actividad de macrófagos peritoneales. Los resultados son expresados como el promedio del por ciento de actividad de mieloperoxidasa ± desviación estándar de 3 experimentos independientes. Las diferencias estadísticas entre grupos fueron evaluadas por medio de t de Student y un valor de p < 0,05 fue considerado significativo.
Resultados: la administración de interleucina-12 recombinante murina a gérbiles previa infección con S. schenckii aumentó significativamente la actividad de mieloperoxidasa de macrófagos peritoneales (p = 0,0001) comparada con los controles sanos. En contraste, macrófagos de gérbiles infectados no tratados mostraron actividad de mieloperoxidasa significativamente disminuida comparada con los controles sanos (p= 0,001), lo cual sugiere activación deteriorada de macrófagos.
Conclusiones: la administración in vivo de interleucina-12 recombinante murina antes de la infección con S. schenckii, induce activación de macrófagos evidenciada por un aumento en la actividad de mieloperoxidasa, lo que contribuiría a la defensa del organismo contra este agente infeccioso vía sistema oxidativo dependiente de mieloperoxidasa.
Palabras clave: interleucina-12, macrófagos, Sporothrix schenckii, mieloperoxidasa.
ABSTRACT
Introduction: interleukin-12 is an immunoregulatory cytokine with multiple biologic functions, including macrophage activation. Myeloperoxidase is an enzyme that plays an important role in the antimicrobial function of activated phagocytes. In the presence of hydrogen peroxide, myeloperoxidase catalyzes chloride oxidation to produce hypochlorous acid, a powerful microbicidal agent.
Objective: determine the stimulating effect of murine recombinant interleukin-12 on myeloperoxidase activity in peritoneal macrophages of gerbils experimentally infected with Sporothrix schenckii yeasts.
Methods: 500 ng murine recombinant interleukin-12 were administered intraperitoneally on a daily basis on 5 consecutive days to male gerbils. On the sixth day the gerbils were inoculated subcutaneously on the left posterior plantar pad with 6x106 S. schenckii yeasts. Seven days after infection, macrophages were obtained from the peritoneal cavity. Myeloperoxidase activity was determined by Kaplow's method and expressed as percentage of peritoneal macrophage activity. Results are expressed as the average percentage of myeloperoxidase activity ± standard deviation from 3 independent experiments. Statistical differences between groups were evaluated by Student's t test. A value of p < 0.05 was considered significant.
Results: administration of murine recombinant interleukin-12 to gerbils following infection with S. schenckii significantly increased the myeloperoxidase activity of peritoneal macrophages (p = 0.0001) in comparison with healthy controls. Macrophages of untreated infected gerbils, however, showed significantly reduced myeloperoxidase activity in comparison with healthy controls (p= 0.001), suggesting poor macrophage activation.
Conclusions: in vivo administration of murine recombinant interleukin-12 before infection with S. schenckii induces macrophage activation evidenced by an increase in myeloperoxidase activity, enhancing the organism's defense against that infectious agent via the myeloperoxidase-dependent oxidative system.
Key words: interleukin-12, macrophages, Sporothrix schenckii, myeloperoxidase.
INTRODUCCIÓN
Sporothrix schenckii es un hongo termodimórfico ampliamente distribuido en la naturaleza, que causa una infección granulomatosa crónica llamada esporotricosis. Se adquiere generalmente por implantación traumática en la piel y raramente por inhalación de esporas lo que puede causar una infección pulmonar. Esta micosis presenta diferentes formas clínicas, de las cuales las más frecuentes son la linfocutánea y la cutánea fija.1 Sin embargo, un aumento de formas cutáneas diseminadas y/o formas viscerales ha sido descrito principalmente en pacientes inmunodeprimidos, particularmente aquellos con síndrome de inmunodeficiencia adquirida (SIDA), en quienes la infección es potencialmente fatal.2
En los mecanismos de defensa contra S. schenckii, la resistencia innata y la inmunidad mediada por células desempeñan un papel importante.3-6 Como parte del sistema inmune innato, los macrófagos tienen un papel clave en la eliminación de este hongo a través de la fagocitosis y subsecuente activación de procesos oxidativos.7,8 Asimismo, se ha establecido que la interleucina 12 (IL-12) es una citosina proinflamatoria de 70 kDa, crucial en la regulación de la resistencia innata y la inmunidad adquirida, la cual es producida primariamente por fagocitos y células presentadoras de antígenos.9 IL-12 induce la producción de interferón gamma (IFN- g) por células T y asesinas naturales e induce la diferenciación de células T CD4+ nativas a células T cooperadoras 1 (Th1 por sus siglas en inglés), las cuales son grandes productoras de IFN- g.9,10 Esto proporciona una fuente de IFN- g, que a su vez induce la activación de macrófagos para aumentar sus actividades microbicidas entre las que se incluyen la fagocitosis y el metabolismo oxidativo.11 Además, se ha reportado que la IL-12 puede activar directamente mecanismos microbicidas de macrófagos.12
Dentro de los mecanismos oxidativos que desempeñan un papel importante en la actividad microbicida de los fagocitos se encuentra el sistema mieloperoxidasa-peróxido de hidrógeno-cloruro. La mieloperoxidasa (MPO) es una enzima que en presencia de peróxido de hidrógeno (H2O2), cataliza la oxidación de cloruro para producir ácido hipocloroso, el cual es un potente agente microbicida.13,14 La MPO se encuentra principalmente en leucocitos polimorfonucleares neutrófilos y en menor grado en monocitos. Los macrófagos carecen de MPO, sin embargo, macrófagos activados internalizan la MPO liberada por los neutrófilos al medio extracelular.15
Un número importante de estudios desarrollados con modelos infecciosos experimentales en ratones deficientes en MPO, han demostrado in vivo, que el sistema oxidativo dependiente de MPO es un importante mecanismo de defensa del hospedero contra diversos patógenos infecciosos, entre los que se incluyen Candida albicans, Aspergillus fumigatus y Cryptococcus neoformans.16-19 Por otra parte, en un estudio previo realizado por nuestro grupo de investigación se demostró que en gérbiles inoculados en el cojinete plantar con levaduras de S. schenckii e inmediatamente inyectados diariamente vía intraperitoneal (i.p.) con 500 ng de IL-12 recombinante murina (rIL-12) durante 5 días consecutivos, sus macrófagos peritoneales mostraron un aumento significativo en la actividad de su MPO.20
El objetivo del presente trabajo fue conocer más acerca del papel de la rIL-12 sobre el metabolismo oxidativo de macrófagos peritoneales (MP) mediante la cuantificación de la actividad de la MPO en gérbiles machos inoculados con S. schenckii 24 horas después de haberles administrado rIL-12 previamente y durante 5 días consecutivos.
MÉTODOS
Animales
Gérbiles machos de 3 meses de edad con peso de 65-70 g fueron facilitados por el laboratorio animal del Centro de Investigación Biomédica de Occidente (CIBO) en Guadalajara, Jalisco, México. Los animales fueron alojados en un ambiente libre de patógenos y con acceso libre a comida y agua. El experimento fue aprobado por el comité de ética para experimentos con animales del Centro de Investigación Biológico de Occidente (CIBO) y se apegó a los requerimientos de la NOM-062-ZOO-1999 que determina la producción, cuidado y manejo de animales de laboratorio.21
S. schenckii
Las células de S. schenckii fueron obtenidas de una cepa mantenida en el laboratorio de inmunología del CIBO. La fase de levaduras de este hongo se obtuvo por subcultivo en infusión cerebro-corazón (ICC) como ha sido previamente descrito.7 Las células obtenidas del medio de cultivo fueron >95 % diferenciadas hacia la forma de levaduras, las cuales fueron lavadas 3 veces con solución salina balanceada de Hanks (SSBH) y pH 7,4. El número de células fue determinado en una cámara de Neubauer y ajustado a una concentración de 1,2 x 107 células de levadura/mL.
Infección experimental
Dos grupos de gérbiles machos (n=5 por grupo) fueron inoculados en el cojinete plantar posterior izquierdo con 6x106 células de levaduras de S. schenckii suspendidas en 0,5 mL de solución buffer de fosfatos (SBF 7,4). Un grupo control (n= 5), de gérbiles no infectados, fueron inyectados solo con PBS de la misma manera.
Tratamiento con IL-12 recombinante murina (rmIL-12)
Gérbiles no inoculados con S. schenckii (n=5) fueron inyectados i.p. con 500 ng de rmIL-12 diluida en 0,3 mL solución buffer de fosfatos (SBF), diariamente por 5 días consecutivos. Veinticuatro horas después del tratamiento con rIL-12, los gérbiles fueron inoculados en el cojinete plantar posterior izquierdo con 6x106 células de levaduras de S. schenckii suspendidas en 0,05 mL de solución estéril de NaCl al 0,15 M iniciando al séptimo día de la inoculación, mientras los otros 5 gérbiles infectados recibieron solamente SBF. Los animales del grupo control (n=5) también recibieron SBF solamente.
Macrófagos peritoneales
Siete y 13 días después de la infección, macrófagos activados con tioglicolato fueron cosechados de los gérbiles por medio de lavado peritoneal usando 10 mL de SBF estéril (pH 7,4). Las células peritoneales fueron lavadas 2 veces por centrifugación a 200 g por 5 minutos y resuspendidas en medio de cultivo RPMI - 1640 (Sigma St Louis, MO). La viabilidad de células fue valorada con tinción de azul Trypano. Ordinariamente, más del 95 % de células colectadas fueron viables.
Valoración de la actividad de mieloperoxidasa
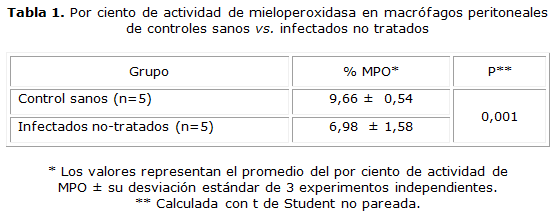
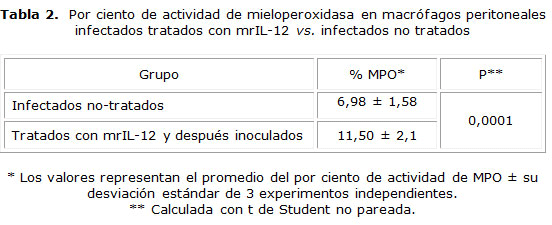
La actividad de MPO de macrófagos peritoneales se determinó en frotis con suspensión de estas células fagocíticas usando el método de Kaplow, como ha sido previamente descrito,22 y se realizó de la siguiente manera: los frotis se dejaron secar a temperatura ambiente y se fijaron con formol-alcohol (10 %) durante 1 minuto. Después se lavaron gentilmente con agua corriente y posteriormente los frotis fueron cubiertos con solución de peroxidasa de bencidina compuesta por alcohol etílico (30 %) 100 mL, dihidrocloruro de bencidina 0,3 g, solución de sulfato de zinc (1 %) 1 mL, hidróxido de sodio (1,0) N) 1,5 mL y safranina O 0,2 g) dejándose reaccionar por 30 s. Se lavaron con agua corriente y se dejaron secar al aire a temperatura ambiente. Los frotis fueron observados en microscopio de luz con el objetivo 100x con aceite de inmersión. Los gránulos de MPO en macrófagos fueron teñidos de azul pálido. 300 macrófagos peritoneales fueron contados y se reportó como 0, 1, 2, 3, o 4+ de actividad de MPO y los resultados expresados como el por ciento de un máximo de 1 200 puntos que podría ser alcanzado.
Análisis estadístico
Los resultados son expresados como el promedio del por ciento de actividad de MPO ± DE de tres experimentos independientes. Los resultados fueron procesados con el uso del Statistical Program for Social Sciences (SPSS v16.0) for Windows medical pack (SPSS, Chicago, IL). La diferencia estadística entre los grupos fue evaluada con la prueba t de Student no pareada y un valor de p< 0,05 fue considerado significativo.
RESULTADOS
Actividad de MPO
Los resultados de este trabajo muestran que la actividad de la mieloperoxidasa de macrófagos peritoneales de gérbiles infectados, fue significativamente más baja (p= 0,001), cuando se comparó con la actividad de MPO de los macrófagos del grupo control saludables (tabla 1).
Lo contrario fue observado cuando los macrófagos peritoneales de los gérbiles infectados y tratados 1 día después de terminada la administración de rIL-12, expresaron una actividad a la mieloperoxidasa significativamente más alta (p= 0,0001) comparada con los macrófagos peritoneales del grupo de gérbiles infectados no tratado (tabla 2).
DISCUSIÓN
Numerosos estudios han demostrado que la administración de rIL-12 puede promover una respuesta inmune Th1 protectora contra diversos agentes patógenos entre los que se incluyen Coccidiodes immitis,23 Histoplasma capsulatum24 and Cryptococcus neoformans.25 La respuesta Th1 se caracteriza por producción de IFN-g, entre otras citosinas, y se ha establecido que IFN- g aumenta las actividades antimicrobiales de fagocitos, incluyendo fagocitosis y metabolismo oxidativo.10,11,26,27
Los resultados de este estudio indican que rIL-12 administrada i.p. antes de la inoculación con S. schenckii, induce activación del metabolismo oxidativo de macrófagos, como se evidenció por un aumento significativo de la actividad de MPO en los MP de gérbiles infectados con S. schenckii, comparado con controles infectados no tratados con rIL-12. Asimismo, se observó que rIL-12 influenció favorablemente la evolución de las lesiones cutáneas desarrolladas en la pata inoculada, ya que estos animales desarrollaron únicamente inflamación de la pata inoculada una semana después de la inoculación. En contraste, gérbiles no tratados exhibieron inflamación y ulceración en ese mismo lapso lo cual indica una fase más severa de la enfermedad (resultados no mostrados).
Estos datos sugieren que rmL-12 al estimular MP podría contribuir en la defensa del huésped contra S. schenckii, vía el sistema oxidativo dependiente de MPO, al aumentar la actividad de esta enzima. Esto basado en la información de que la MPO, a partir de peróxido de hidrógeno y cloruro cataliza la formación de ácido hipocloroso, el cual es un potente agente microbicida.13,14
La relevancia del sistema oxidativo dependiente de MPO en la defensa contra agentes infecciosos ha sido evidenciada in vitro, observándose que fagocitos desprovistos de esta enzima expresan una deficiencia marcada en su actividad fungicida contra Candida albicans.28 Asimismo, se ha demostrado en modelos de infecciones experimentales en ratones deficientes en MPO, que el sistema oxidativo dependiente de MPO es importante in vivo en las defensas del hospedero contra diversos patógenos, entre los que se incluyen C. albicans y Aspergillus fumigatus.16-18 Además, resultados de un estudio más reciente, en un modelo en ratones deficientes en MPO, sugieren que esta enzima juega un papel principal en la defensa contra Cryptococcus neoformans.22
Por otra parte, en un estudio reciente realizado con gérbiles inoculados experimentalmente en el cojinete plantar con S. schenckii e inmediatamente inyectados i.p. con rIL-12, se observó un aumento de la actividad de MPO en sus macrófagos peritoneales.20 Los resultados de este trabajo son concordantes con ese estudio ya que rIL-12 también aumentó la actividad de MPO, sin embargo, se debe enfatizar que el aumento de actividad de esta enzima fue menor a la observada cuando la inoculación de S. schenckii y la administración de rIL-12 se realizaron al mismo tiempo.
Con base en nuestros resultados, sugerimos que la administración de mrIL-12 favorece la estimulación de los MP lo que podría contribuir a la defensa del huésped contra S. schenckii, vía el sistema oxidativo dependiente de MPO. Esta información ayuda a un mejor entendimiento de los mecanismos de defensa del hospedero contra este patógeno fúngico. Sin embargo, se requiere de investigación adicional para conocer los mecanismos precisos involucrados en este proceso.
CONFLICTO DE INTERESES
El presente trabajo no tiene conflicto de interés de carácter financiero o con alguna institución.
AGRADECIMIENTOS
Los autores del presente trabajo agradecen las observaciones y comentarios realizados por los árbitros y revisores de Revista Cubana de Investigaciones Biomédicas la cuales, sin duda alguna contribuirán a enriquecer la investigación aquí presentada.
REFERENCIAS BIBLIOGRÁFICAS
1. Morris-Jones R. Sporotrichosis. Clin Dermatol. 2002;27:427-31.
2. Silva-Vergara ML, Maneira FR, De Oliveira RM, Santos CT, Etchebehere RM, Adad SJ. Multifocal sporotrichosis with meningeal involvement in a patient with AIDS. Med Mycol. 2005;43(2):187-90.
3. Carlos IZ, Sgarbi DB, Angluster J, Alviano CS, Silva CL. Detection of cellular immunity with the soluble antigen of the fungus Sporothrix schenckii in the systemic form of the disease. Mycopathologia. 1992;117(3):139-44.
4. Shirashi A, Nakagaki K, Arait T. Role of cell-mediated immunity in the resistance to experimental sporotrichosis. Mycopathologia. 1992;120(1):15-21.
5. Carlos IZ, Sassá MF, Sgarbi DBG, Placeres MCP, Maia DC. Current research on the immune response to experimental Sporotrichosis. Mycopathologia. 2009;168:1-10.
6. Tachibana T, Matsuyama T, Mitsuyama E. Involvement of CD4+ T cells and macrophages in acquired protection against infection with Sporothrix schenckii in mice. Med Mycol. 1999;37:397-404.
7. Fernandez KSS, Coelho AL, Lopez-Becerra LM, Barja-Fidalgo C. Virulence of Sporothrix schenckii conidia and yeast cells, and their susceptibility to nitric oxide. Immunology. 2000;101:563-9.
8. Kajiwara H, Saito M, Ohga S, Uenotsuchi T, Yoshida A. Impaired host defense against Sporothrix schenckii in mice with chronic granulomatous disease. Infect Immun. 2004;72(9):5073-9.
9. Trinchiery G. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat Rev Immunol. 2003;3(2):133-46.
10. O'Garra A, Murphy KM. From IL-10 to IL-12: how pathogens and their products stimulate APCs to induce TH1 development. Nat Immunol. 2009;10(9):929-32.
11. Gattoni A, Parlato A, Vangieri B, Bresciani M, Derna R. Interferon-gamma: biologic functions and HCV therapy (type I/II) (1 of 2 parts). Clin Ter. 2006;157(4):377-86.
12. Puddu P, Fantuzzi L, Borghi P, Varano B, Rainaldi G, Guillemard E, et al. IL-12 induces IFN-gamma expression and secretion in mouse peritoneal macrophages. J Immunol. 1997;159(7):3490-7.
13. Klebanoff SJ. Myeloperoxidase: friend and foe. J Leukoc Biol. 2005;77(5):598-625.
14. Hansson M, Olsson I, Nauseef WM. Biosynthesis, processing, and sorting of human myeloperoxidase. Arch Biochem Biophys. 2006;445:214-24.
15. Marcinkiewicz J. Neutrophil chloramines: missing links between innate and acquired immunity. Immunol Today. 1997;18(12):577-80.
16. Aratani Y, Koyama H, Nyui S, Suzuki K, Kura F, Maeda N. Severe impairment in early host defense against Candida albicans in mice deficient in myeloperoxidase. Infect Immun. 1999;67(4):1828-36.
17. Aratani Y, Kura F, Watanabe H, Akagawa H, Takano Y, Suzuki K, et al. Differential host susceptibility to pulmonary infections with bacteria and fungi in mice deficient in myeloperoxidase. J Infect Dis. 2000;182(4):1276-9.
18. Aratani Y, Kura F, Watanabe H, Akagawa H, Takano Y, Suzuki K, et al. Relative contributions of myeloperoxidase and NADPH-oxidase to the early host defense against pulmonary infections with Candida albicans and Aspergillus fumigatus. Med Mycol. 2002;40(6):557-63.
19. Aratani Y, Kura F, Watanabe H, Akagawa H, Takano Y, Ishida-Okawara A, et al. Contribution of the myeloperoxidase-dependent oxidative system to host defense against Cryptococcus neoformans. J Med Microbiol. 2006;55(9):1291-9.
20. Flores-García A, Velarde-Félix JS, Aguilar-García P, Sánchez-Gutiérrez R, Flores-García EB, Cancino Marentes ME, et al. Interleucina-12 aumenta la actividad de la mieloperoxidasa de macrófagos en gérbiles infectados experimentalmente con Sporothrix schenckii. Rev Fuente. 2011;8:95-101.
21. Norma Oficial Mexicana NOM-062-ZOO-1999, especificaciones técnicas para la producción, cuidado y manejo de animales de laboratorio. [ Citado: 2 de junio de 2013]. Disponible en: http://www.fmvz.unam.mx/fmvz/principal/archivos/062ZOO.PDF
22. Ramos-Zepeda R, Gonzalez-Mendoza A. Metabolic activity of phagocytes in experimental sporotrichosis. Mycopathologia. 1986;93(2):109-12.
23. Magee DM, Cox RA. Interleukin-12 regulation of host defenses against Coccidioides immitis. Infect Immun. 1996;64(9):3609-13.
24. Zhoou P, Sieve MC, Bennett J, Kwon-Chung KJ, Tewari RP. IL-12 prevents mortality in mice infected with Histoplasma capsulatum through induction of IFN-g. J Immunol. 1995;155:785-95.
25. Kawakami K, Tohyama M, Xie Q, Saito A. IL-12 protects mice against pulmonary and disseminated infection caused by Cryptococcus neoformans. Clin Exp Immunol. 1996;104:208-14.
26. Murray HW. Gamma interferon, cytokine-induced macrophage activation, and antimicrobial host defense. In vitro, in animal models, and in humans. Diagn Microbiol Infect Dis. 1990;13(5):411-21.
27. Schoroeder K, Hertzog PJ, Ravasi T, Hume DA. Interferon-g an overview of signals, mechanisms and functions. J Leukoc Biol. 2004;75:163-89.
28. Diamond RD, Clark RA, Haudenschild CC. Damage to Candida albicans hyphae and pseudohyphae by the myeloperoxidase system and oxidative products of neutrophil metabolism in vitro. J Clin Invest. 1980;66(5):908-17.
Recibido: 20 de septiembre de 2013.
Aprobado: 6 de octubre de 2013.
Dr. Raymundo Velasco Rodríguez. Universidad de Colima, Facultad de Enfermería, Av. Universidad 333, Colonia Las víboras; CP 28040, Colima, Colima, México. Teléfono: 013123161069, 013123120018. Fax: 3161069, rayvel@ucol.mx con copia a Dr. Aurelio Flores-García Afflores@gmail.com