Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.2 Ciudad de la Habana abr.-jun. 2014
ARTÍCULO ORIGINAL
Reibergrama para evaluar la síntesis intratecal de Lectina de unión a Manosa
Reibergram to evaluate the Mannan binding Lectin intrathecal synthesis
Barbara Padilla-DocalI, Pedro Juan Ramírez AgüeraII, Hansotto ReiberIII, Jens Christian Jensenius IV, Alberto J Dorta-ContrerasI
I Laboratorio Central de Líquido Cefalorraquídeo. Facultad de Ciencias Médicas Dr Miguel Enríquez. Universidad de Ciencias Médicas de La Habana. Cuba.
II Policlínico Universitario Ángel Machaco Ameijeiras. La Habana, Cuba.
III Laboratorio de Neuroquímica. Universidad de Göttingen. Alemania.
IV Departamento de Biomedicina. Universidad de Aarhus. Dinamarca.
RESUMEN
Introducción: la dinámica particular de las proteínas derivadas del cerebro en el líquido cefalorraquídeo es diferente a la dinámica de las proteínas derivadas de la sangre.
Objetivo: describir los datos empíricos de la lectina de unión a manosa y brindar una interpretación teórica de la dinámica de esta proteína a través de la confección un nuevo reibergrama.
Métodos: la lectina de unión a manosa en suero y líquido cfalorraquídeo, fue medida en 40 adultos normales a través de un ensayo inmunofluorométrico. El criterio diagnóstico estuvo basado en; muestras controles (pacientes normales) y muestras de pacientes con enfermedades que cursaron con disfunción de barrera sangre-líquido cefalorraquídeo.
Resultados: el coeficiente de correlación entre la lectina de unión a manosa en el líquido cefalorraquídeo y en el suero, fue muy bajo. El reibergrama de la lectina de unión a manosa se diseñó de acuerdo con procedimientos previos.
Conclusiones: bajo cualquier condición de barrera sangre-líquido cefalorraquídeo, el reibergrama puede identificar la ocurrencia de síntesis intratecal de lectina de unión a manosa.
Palabras clave: barrera sangre/líquido cefalorraquídeo, lectina de unión a manosa, líquido cefalorraquídeo, reibergrama, sistema de complemento.
ABSTRACT
Background: The dynamics of brain derived proteins in cerebrospinal fluid is different from the dynamics of blood-derived proteins. Aim: To describe the empirical data for mannan binding lectin and gives a theoretical interpretation of the dynamics of this protein in cerebrospinal fluid through a new reibergram.
Methods: Serum and cerebrospinal fluid mannan binding lectin were measured in 40 normal adults by immunofluorometric assays. The diagnostic criteria were based in; normal control samples defined clinically and diseases with blood-cerebrospinal fluid barrier dysfunction.
Results: Correlation coefficient between cerebrospinal fluid MBL and serum MBL was very low. Mannan binding lectin reibergram was designed according with previous procedures.
Conclusion: Under all conditions of the blood-cerebrospinal fluid barrier, the reibergram can identify the occurrence of intrathecal mannan binding lectin synthesis.
Keywords: Blood-cerebrospinal fluid barrier, cerebrospinal fluid, complement system, mannan binding lectin, reibergram.
INTRODUCCIÓN
El incremento de la relevancia diagnóstica de las proteínas derivadas del cerebro en el líquido cefalorraquídeo (LCR) condujo a tomar conciencia de su dinámica particular en este fluido biológico, que es diferente a la dinámica de las proteínas derivadas de la sangre. 1
El sistema de complemento puede ser activado por tres vías: por la vía clásica, que es iniciada por complejos antígeno-anticuerpo; por la vía alterna, que se inicia por la presencia de ciertas estructuras en la superficie de los microorganismos y por una vía anticuerpo-independiente;2 la vía de las lectinas. Esta vía es iniciada por la unión de la lectina de unión a manosa (MBL) a carbohidratos que pueden estar presentes en la superficie de algunos microorganismos.3
La MBL es considerada una colectina, análoga estructural del C1q, que juega un rol importante en la inmunidad innata. El sistema inmune innato reconoce, por ejemplo, bacterias y levaduras por reconocimiento y unión a manosa y/o residuos de N-acetil-glucosamina presentes en las paredes celulares de los microorganismos.3 La MBL sérica humana es Ca2+- dependiente y se une a carbohidratos con especificidad por estructuras que contienen manosa o N-acetil-glucosamina. La nueva teoría que combina el flujo molecular y la velocidad de flujo del LCR,4 muestra que la velocidad de flujo del LCR constituye el principal modulador de las concentraciones patológicas de proteínas en el LCR, por ejemplo, una velocidad de flujo de LCR reducida es suficiente para explicar cuantitativamente el incremento no lineal de las concentraciones de proteínas derivadas de la sangre en el LCR, en las enfermedades neurológicas.
Unido a los cambios patológicos de las concentraciones de proteínas derivadas de la sangre en el LCR, se observa una modulación particular de las concentraciones de proteínas derivadas del cerebro, 5 dependiendo del origen de las proteínas.
Este artículo describe los datos empíricos de la MBL, los cambios en la velocidad de flujo del LCR y brinda por vez primera una interpretación teórica y fisiológicamente relevante de la dinámica de esta proteína a través de la confección un nuevo reibergrama para evaluar su síntesis intratecal.
MÉTODOS
Pacientes
Las muestras de suero y LCR fueron procedentes de 40 pacientes del Laboratorio de Neuroquímica, Universidad de Göttingen, Alemania, en el año 2012. Todas las muestras se tomaron para los análisis de rutina con el consentimiento informado de los pacientes.
Cuantificación de las concentraciones de suero y LCR
MBL como antígeno: se recubrió la superficie de los pocillos de una placa de microtitración con anticuerpo monoclonal anti-MBL. Las muestras de suero se diluyeron en un buffer que contenía: 20 mM Tris, 1 M NaCl, 10 mM CaCl2, 0.05 % (v/v) Triton X-100, 0.1 % Albúmina de suero bovino (peso/volumen), IgG humana normal agregada por calor (10 mg/ml), 1 % (volumen/volumen) de suero bovino, pH 7.4. Los sueros se adicionaron a los pocillos.
Después de una incubación, los pocillos fueron lavados y se añadió el anticuerpo anti-MBL conjugado con europium. Después de un tiempo de incubación con el conjugado se lavó nuevamente con buffer y se midió el europium por fluorometría en tiempo real. Diluciones de suero estandar y muestras de suero de concentraciones conocidas se incluyeron como controles internos. Estas diluciones tenían concentraciones altas (1046 ng MBL/ml), medias (251 ng MBL/ml) y bajas (38 ng MBL/ml). El coeficiente de variación interensayo ( %CV) calculado en 20 réplicas fue de 8 %, 8 % y 11 % respectivamente.6
La concentración de MBL se midió de forma similar a un ELISA convencional. La diferencia es que se usó europium en lugar de enzima: las microplacas se cubrieron con antisuero anti-MBL y luego se incubaron a diferentes concentraciones de suero y la cantidad de MBL enlazado se midió con la actividad del anticuerpo anti-MBL marcado con europium. La concentración de MBL en LCR se midió por el mismo procedimiento pero no se diluyeron las muestras.
Los datos en este artículo estuvieron basados en los siguientes criterios diagnósticos:
1. Sueros controles que provenían de sujetos normales definidos clínicamente. No obstante pudieron incluirse las muestras de los pacientes con cefalea tensional y con polineuropatías no inflamatorias de tal manera que los valores de concentración, no se diferenciaran en su media y rango de concentración, en relación al rango de referencia normal agrupados para la evaluación estadística.
2. Enfermedades con disfunción de barrera sangre-LCR: Este grupo contenía pacientes con un incremento de la razón Albúmina (QAlb) debido a diferentes causas y poseían reducción de la razón de flujo al LCR. La IgG oligoclonal constituyó un criterio de exclusión.
RESULTADOS
Las características moleculares de las proteínas derivadas del cerebro y de la sangre y su contenido en el LCR pueden ser observadas en la tabla 1. De acuerdo a nuestros datos el porciento de transferencia de la sangre al LCR fue de 0,03 %.
Transtiretina 54 kDa pasa de la sangre al LCR asociada con retinol-unido a una proteína de 21 kDa.
En la tabla 2 se muestra la estadística de la MBL en suero y LCR.
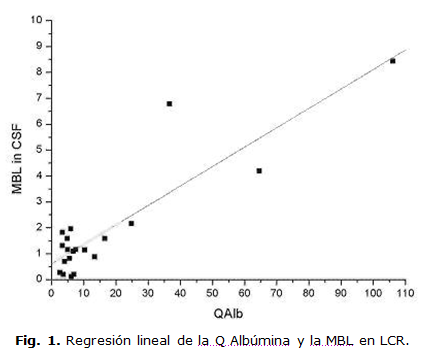
La MBL en LCR tiene en el rango normal de QAlb, una media representativa de 2.28 x103 y un CV de 93 %. Este es más pequeño que el CV en sangre (100 %). El coeficiente de correlación entre la MBL en LCR y la MBL en suero resultó muy bajo (0,3169, p=0,0463). La correlación de MBL en LCR con la QAlb puede ser observada en la figura 1.
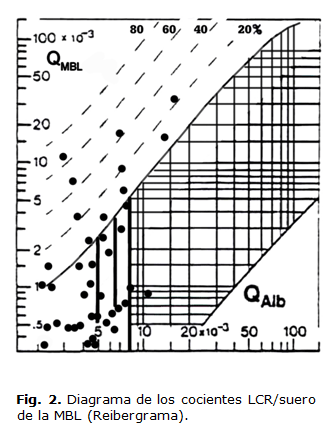
El reibergrama de la MBL fue diseñado de acuerdo con previos datos y teniendo en cuenta su peso molecular. El método para establecer este tipo de gráfico ha sido descrito con anterioridad.7-12 El diagrama de los cocientes MBL LCR/suero o reibergrama se muestra en la Figura 2. Se aprecia que doce de los pacientes mostraron síntesis intratecal de MBL, que representa el 30 % del total de la muestra.
DISCUSIÓN
Características estructurales de la MBL
La manosa fue primeramente reportada por Kawasaki et al., en 1978, quién aisló esta molécula del hígado de los conejos y la nombró manosa de unión a proteína.13 La MBL consiste en multímeros de una cadena polipeptídica idéntica de 32 KDa. El trímero constituye la subunidad básica estructural para todas todas las formas circulantes de MBL. En suero, esta consiste en oligómeros de la subunidad, que van desde dímeros hasta hexámeros. Se plantea que los oligómeros de mayor orden (por ejemplo, de tetrámeros a hexámeros) son las formas más efectivas en términos de funciones de la proteína, por ejemplo, la interacción del glicano y la activación del complemento en la superficie microbiana.14 La MBL posee un peso molecular que oscila entre 384 y 576 KDa sin las moléculas de Proteasas Séricas Asociadas a la Manosa (MASPs).
La MBL interactúa con la MASP-1 y MASP-2, activa la vía clásica y la alternativa del complemento y además puede unirse a receptores de los fagocitos, resultando en la opsonización, fagocitosis y lisis celular.14-15
MBL como proteína derivada de la sangre y proteína sintetizada en el cerebro
Las proteínas derivadas de la sangre entran al LCR por difusión pasiva siguiendo el gradiente de concentración. Los procesos de difusión son descritos por Fick a partir de la primera y segunda ley de la difusión. 16-17 La principal fracción de MBL en el LCR no se deriva de la sangre a pesar de que la concentración de MBL en LCR fue menor que la concentración de MBL en suero. La MBL en LCR tiene en el rango normal de QAlb, una media representativa de 2.28 x103 y un CV de 93 %. Este es más pequeño que el CV en sangre (100 %). Esto significa que la principal fracción de la MBL en el LCR no se deriva de la sangre.
La no existencia de un coeficiente de correlación entre la MBL en LCR y la MBL en suero es un factor importante que señala que un incremento de la MBL en suero no significa necesariamente un incremento de la MBL en LCR.
El mecanismo del paso de la MBL a través de la barrera sangre-LCR puede no ser dependiente de la concentración. La localización de la MBL en los vasos sanguíneos puede indicar su unión a los capilares endoteliales. Es posible que el transporte al sistema nervioso central (SNC) pueda ocurrir vía unión a los receptores del C1q o de la colectina, los cuales además de unen a la MBL.3
Alrededor del 20 % de las proteínas en el LCR son predominantemente derivadas del cerebro, pero raramente, especificas del cerebro.16 La característica básica de las proteínas derivadas del cerebro es su elevada concentración en LCR comparado con el suero, induciendo un flujo neto fuera del LCR, comparado con las proteínas de la sangre con un flujo neto en el LCR. Para algunas de las proteínas predominantemente derivadas del cerebro, la fracción derivada de la sangre es insignificante.
Barreras entre la sangre, cerebro y LCR
El intercambio restringido de material entre la sangre y el fluido extracelular perivascular es manifestado en términos de "barreras", barrera sangre-cerebro, barrera sangre-testículo, barrera sangre-retina, etc. 16 Ciertas moléculas no pasan la barrera sangre-cerebro. La extensión de la transferencia de las proteínas depende de su tamaño molecular.
Sin embargo, existen algunas características similares entre la barrera sangre-cerebro y la barrera sangre-LCR, debe tenerse en cuenta que las bases celulares de estas dos estructuras así como sus funciones primarias, difieren. 16-17
La barrera sangre-cerebro constituye el mecanismo mayor de protección del SNC contra microorganismos circulantes. Las células cerebrales pueden sintetizar los componentes líticos completos del complemento y los receptores de este sistema,18 sugiriendo la importancia del sistema de complemento en la barrera sangre-cerebro. Como la MBL humana contiene suficiente C1 hasta C9 para brindar actividad hemolítica, y el MASP-1 cliva C2 y C3, la vía de las lectinas pudiera funcionar dentro de la barrera sangre-cerebro.
Se ha encontrado que las células gliomas pueden expresar MASP-1 y MASP-3 sugiriendo la posibilidad de que la expresión de los componentes de la vía de las lectinas del complemento puede tener características comunes para los astrocitos.19
Las moléculas como la MBL de elevado peso molecular se demoran más en pasar al LCR. La selectividad del transporte a través de la barrera para algunas proteínas puede venir dado por su peso molecular, pero para otras moléculas, dicha selectividad puede estar dada por su reconocimiento específico a transportadores, uniones y fuerzas diferentes. Solo el transporte por pinocitosis experimenta selectividad para diferentes moléculas.16-17
En las enfermedades neurológicas con disfunción de la barrera sangre-LCR, las fracciones de proteínas derivadas de la sangre en el LCR están incrementadas. Esta transferencia incrementada de las proteínas de la sangre en el LCR está caracterizada por una función hiperbólica entre las concentraciones de proteínas en el LCR.
La teoría del flujo molecular de proteínas al LCR 16-17 sugiere que no hay pérdida de selectividad durante la disfunción de la barrera sangre-LCR, y que solo el coeficiente de difusión molecular, el cual es inversamente proporcional al peso molecular de la proteína, es la única variable que determina el paso de una proteína de la sangre al LCR. Las concentraciones de proteínas en el LCR dependen de su concentración en sangre, de la función de la barrera sangre-LCR y la síntesis intratecal. 16-17
En el caso de valores elevados de QAlb, como ocurre en algunas enfermedades neurológicas, la MBL en el LCR presenta mayor concentración ya que como la velocidad de flujo está reducida hay más probabilidad de que la MBL de la sangre cruce la barrera sangre-LCR y su contenido en el LCR esté incrementado. A través del reibergrama es posible discriminar la fracción de MBL procedente de la sangre de la que se sintetice intratecalmente.
La transferencia reducida de MBL procedente de la sangre en el LCR está caracterizada por una función hiperbólica entre las concentraciones de proteínas en el LCR. En el reibergrama de MBL (Figura 2). La curva hiperbólica superior (línea gruesa) representa la línea de discriminación entre las proteínas derivadas del cerebro y las proteínas derivadas de la sangre. Los valores por encima de esta línea indican síntesis intratecal. Las líneas discontinuas indican la magnitud de la fracción sintetizada intratecalmente, con 20, 40, 60 y 80 % de la concentración total de la proteína medida en el LCR, y se calcula a partir de Q límite = 0 %. Los rangos de referencia para las razones LCR/suero del reibergrama se apoyan en la línea discriminatoria superior (Q límite) dibujada más fuerte en la figura y el borde inferior (Q bajo). El reibergrama usa escala logarítmica que cubren los rangos más frecuentes para las proteínas, siendo para la QAlb desde 1,5 a 150 x10-3. El límite del rango de referencia para la QAlb entre las concentraciones de proteínas normales e incrementadas debido a la disfunción de la barrera sangre/LCR es indicada por líneas verticales y es dependiente de la edad, la QAlb de 5.5 × 10-3 (hasta 15 años), Q Alb de 6.5 × 10-3 (hasta 40 años), y Q Alb de 8 × 10-3 (hasta 60 años). Esta línea hiperbólica es la base para establecer los diagramas de los cocientes LCR/suero, cuyo uso se ha ampliado para el diagnóstico de las enfermedades neurológicas.16-17,20
Bajo cualquier condición de barrera sangre-LCR, el reibergrama puede identificar la ocurrencia de síntesis intratecal de MBL. Es posible cuantificar la fracción de MBL localmente producida en el SNC y diferenciarla de la fracción de MBL que puede haber pasado al LCR procedente de la sangre.
REFERENCIAS BIBLIOGRÁFICAS
1. Reiber H. Dynamics of brain-derived proteins in cerebrospinal fluid. Clin Chim Acta 2001; 310:173-86.
2. Selander B, Martensson U, Weintraub A, Holmström E, Matsushita M, Thiel S, Jensenius JC,Truedsson, Anders G. Sjöholm A. Mannan-binding lectin activates C3 and the alternative complement pathway without involvement of C2. J Clin Invest 2006; 116: 1425-34.
3. Lanzrein AS, Thiel T, Jensenius JC, Sim RB, Hugh PV, Sim E. Mannan-binding lectin in human serum, cerebrospinal fluid and brain tissue and its role in Alzheimer´s disease. NeuroReport 1998; 9: 1491-5.
4. Reiber H. Flow rate of cerebrospinal fluid CSF-a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. J Neurol Sci 1994;122: 189-203.
5. Reiber H. CSF flows-its influence on CSF concentration of brain-derived and blood-derived proteins. In: Teelken A, Korf J, editors. Neurochemistry. New York: Plenum 1997: 51-72.
6. Steffen T, Møller-Kristensen M, Lisbeth J, Jenseniues JC. Assays for the functional activity of the mannan-binding lectin pathway of complement activation. Immunobiol 2002; 205: 446-54.
7. Reiber H. The hyperbolic function: a mathematical solution of the protein flux/CSF flow model for blood CSF barrier function. J Neurol Sci 1994; 126: 243-45.
8. Padilla-Docal B, Dorta-Contreras AJ, Bu-Coifiu-Fanego R, Rodríguez-Rey A, Gutiérrez-Hernández JC, de Paula-Almeida OS. Reibergram of intrathecal synthesis of C4 in patients with eosinophilic meningitis caused by Angiostrongylus cantonensis. Am J Trop Med Hyg 2010; 82:1094-98.
9. Dorta-Contreras AJ, Noris-García E, Padilla-Docal B, Rodríguez-Rey A, Magraner-Tarrau ME, Bu Coifiú-Fanego R. Reibergrama para la evaluación de la síntesis intratecal de C3c. Arq Neuropsiquiatr 2006;64(3-A):585-88.
10. Padilla-Docal B, Dorta Contreras AJ, Bu Coifiu-Fanego R, Barroso Callol J,Hernández-Fundora H. Intrathecal synthesis of IgE in children with eosinophilic meningoencephalitis caused by Angiostrongylus cantonensis. Fluids Barriers CNS [Internet]. 2008, [cited 2008 Sep 14]; 5: 18 [about 5 p.]. Available from: http://www.cerebrospinalfluidresearch.com/content/5/1/18
11. Abood S. Quality improvement initiative in nursing homes: the ANA acts in an advisory role. Am J Nurs [Internet]. 2002 Jun [cited 2002 Aug 12]; 102(6): [about 1 p.]. Available from: http://www.nursingworld.org/AJN/2002/june/Wawatch.htmArticle.
12. Dorta-Conteras AJ, Noris-García E, Escobar-Pérez X, Padilla-Docal B. IgG1, IgG2 and IgE intrathecal synthesis in Angiostrongylus cantonensis meningoencephalitis. J Neurol Sci 2005; 238: 65-70.
13. Kawasaki T, Etoh R, Yamashina I. Isolation and characterization of a mannan-binding protein from rabbit liver. Biochem Biophys Res Commun 1978; 81:1018-24.
14. Eddie Ip WK, Takahashi K, Ezekowitz Alan R, Stuart Lynda M. Mannose-binding lectin and innate immunity. Immunol Rev 2009; 230: 9-21.
15. Foley J, Mullighan CG, McGrath DS, Pantelidis P, Marshalf S, Lympany PA, Welsh KI, du Bois RM. Mannose-binding lectin promoter and structural gene variants in sarcoidosis. Eur J Clin lnvest 2000; 30: 549-52.
16. Reiber H. Proteins in cerebrospinal fluid and blood: Barriers, CSF flow rate and source-related dynamics. Rest Neurol Neurosc 2003; 21:79-96.
17. Dorta Contreras AJ, Reiber H. Teoría de la difusión molecular/ flujo del líquido cefalorraquídeo. Rev Neurol 2004, 39:564-69.
18. Zoran Redzic. Molecular biology of the blood-brain and the blood-cerebrospinal fluid barriers: similarities and differences. Fluids Barriers CNS [Internet]. 2011, [cited 2011 Feb 10]; 8:3: [about 10 p.] Available from: http://www.fluidsbarrierscns.com/content/8/1/3
19. Kuraya M, Matsushita M, Endo Y, Thiel S, Fujita T. Expression of H-ficolin/Hakata antigen, manosse-binding lectin-associated serine protease (MASP)-1 and MASP-3 by human glioma cell line T98G. Internat Immunol 2003; 15: 109-17.
20. Dorta Contreras AJ. Reibergramas: elemento esencial en el análisis inmunológico del líquido cefalorraquídeo. Rev Neurol 1999; 28:996-8.
Recibido: 20 de abril de 2013.
Aceptado: 15 de mayo de 2013.
Barbara Padilla Docal. Laboratorio Central de Líquido Cefalorraquídeo. Facultad de Ciencias Médicas Dr Miguel Enríquez. Ramón Pinto No 202. Luyanó. La Habana, Cuba. Correo electrónico: barbara.padilla@infomed.sld.cu