Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión impresa ISSN 0864-0300
Rev Cubana Invest Bioméd vol.33 no.2 Ciudad de la Habana abr.-jun. 2014
ARTÍCULO ORIGINAL
Resistencia a la insulina y efecto sobre la excitabilidad y contracción del músculo esquelético en rata
Insulin resistance and its effect on excitability and contraction of the skeletal muscle in rats
Raymundo Velasco-Rodríguez I, Carlos Enrique Tene-Pérez II, Mario Del Toro-Equihua II, Clemente Vásquez III
I Facultad de Enfermería, Universidad de Colima. México.
II Facultad de Medicina, Universidad de Colima. México.
III Centro Universitario de Investigaciones Biomédicas. Universidad de Colima. México.
RESUMEN
Introducción: la resistencia a la insulina es una condición metabólica que afecta múltiples tejidos entre ellos al músculo esquelético. El propósito del presente trabajo es analizar si la resistencia a la insulina inducida experimentalmente en ratas, modifica la excitabilidad y las propiedades contráctiles del músculo esquelético.
Métodos: se incluyeron 22 ratas Sprague Dawley sanas para formar 2 grupos: Al grupo experimental (n=10) se le indujo resistencia a la insulina mediante la administración oral de prednisona (45mg/Kg.) durante 7 días. Al grupo control (n=12) se le administró solo agua. En ambos grupos se compararon principalmente los parámetros de la contractura muscular: tensión al pico, tensión total, activación contráctil y grado de excitabilidad muscular mediante una curva de umbrales así como su respuesta a una infusión continua de insulina intravenosa. Los experimentos fueron realizados en músculo gastrocnemio utilizando registros de tensión isométrica y estimulación eléctrica. Se analizaron las varianzas entre grupos para utilizar prueba t de Students o U de Mann Whitney, determinándose diferencias significativas entre ambos grupos cuando p<0.05.
Resultados: (Control vs. Experimental):
1) Excitabilidad muscular: Reobase: 0.59± 0.12 V vs. 0.27 ± 0.03V (p = 0.19); Cronaxia: 0.07 ms vs. 0.08 ms.
2) Parámetros de la contractura muscular: Tensión al pico: 58.5±5.1 g vs. 48.3±4.3 g (p =0.19). Tensión total: 0.55±0.13 V/ms vs. 0.44±0.05 V/ms (p=0.45). Activación contráctil: 9.13±1.3 ms vs. 10.5±1.6 ms (p=0.19).
Conclusiones: los resultados del presente estudio sugieren que la resistencia a la insulina al parecer modifica parcialmente la excitabilidad de la fibra muscular además de favorecer el desarrollo de contracciones musculares de menor intensidad y mas lentas, lo que sugiere una posible afección del acople excitación-contracción del músculo esquelético.
Palabras clave: Resistencia a insulina, músculo esquelético, contracción muscular, excitabilidad muscular.
ABSTRACT
Introduction: Insulin resistance is a metabolic condition that affects many tissues including skeletal muscle tissue. The objective of the present study was to analyze whether or not experimentally induced insulin resistance modifies skeletal muscle excitability and contraction in the rat.
Methods : Twenty-two healthy Sprague-Dawley rats were used to form two groups. In the experimental group (n=10) insulin resistance was induced by means of oral prednisone administration (45mg/Kg) over a period of 7 days. The control group (n=12) received only water. The following muscle contraction parameters were compared between groups: peak tension, contractile activation, total tension, degree of muscle excitability during threshold curve and response to continuous intravenous insulin infusion. Experiments were carried out in gastrocnemius muscle, utilizing isometric tension registers and electrical stimulation. Variance between groups was analyzed to determine use of Student t test or Mann Whitney U test. Difference between groups was considered statistically significant when P<0.05.
Results : (Control group vs Experimental group):
1) Muscle excitability: Rheobase: 0.59± 0.12 V vs 0.27 ± 0.03V (P = 0.19); Chronaxie: 0.07 ms vs 0.08 ms.
2) Muscle contraction parameters: Peak tension: 58.5±5.1 g vs 48.3±4.3 g (P =0.19). Total tension: 0.55±0.13 V/ms vs 0.44±0.05 V/ms ( P=0.45). Contractile activation: 9.13±1.3 ms vs 10.5±1.6 ms (P=0.19).
Conclusions: In the results of the present study insulin resistance appears to partially modify muscle fiber excitability in addition to favoring the development of slow, low intensity muscle contractions, suggesting a possible affectation of excitation-contraction coupling in skeletal muscle.
Keywords: insulin resistance, skeletal muscle, muscle contraction, muscle excitability.
INTRODUCCIÓN
Son múltiples los trabajos que apoyan la influencia que tiene el ejercicio sobre la resistencia a la insulina (RI) ya que se ha visto que el ejercicio favorece la recaptura de glucosa por el músculo esquelético tanto en los individuos con RI como en los que tienen diabetes tipo 2. 1- 4
Se ha documentado que la realización de ejercicio durante 4 semanas, es capaz de duplicar el número de receptores a insulina en el músculo esquelético, independientemente del descenso de peso corporal. 5 - 7
Por otro lado, estudios experimentales demuestran cómo el ejercicio favorece el reclutamiento capilar en modelos animales con RI, lo que favorece la recaptura de glucosa por el tejido muscular. 8
En el fenómeno del acople excitación-contracción muscular (AEC), la liberación de calcio desde el retículo sarcoplásmico y su ingreso desde el medio extracelular en respuesta a estímulos despolarizantes, juegan un papel muy importante. 9 - 13 Para el estudio del AEC a nivel macroscópico, puede observarse la contracción muscular, tanto en situaciones normales como patológicas.
De acuerdo a nuestro conocimiento, no existen reportes sobre el efecto de la resistencia a la insulina sobre la excitabilidad y sobre los diferentes componentes de la respuesta contráctil del músculo esquelético en ratas, motivo por el cual se realizó el presente trabajo.
MÉTODOS
Se utilizaron 22 ratas machos de la raza Sprague-Dawley sanos con pesos de 250 a 350 g los cuales, fueron divididos en 2 grupos: experimental (n=10) y control (n=12). A ambos grupos se les proporcionó agua y alimento a libre demanda, ciclos de luz / oscuridad normales y una temperatura ambiente de 25 ˚C. Todas las ratas fueron mantenidas en cajas de acrílico con limpieza de las mismas durante todos los días que duro la investigación.
Inducción y evaluación de la resistencia a la insulina
El grupo experimental recibió prednisona (PDN) vía oral a razón de 45 mg/Kg de peso durante 7 días necesario para inducir RI. 14
Una vez terminado el tiempo de tratamiento con el esteroide, ambos grupos de ratas fueron sometidas a evaluación del metabolismo de los carbohidratos mediante la evaluación del estado de sensibilidad a la insulina que tenía cada uno de los animales. Para ello se calculó el área bajo la curva (ABC) de la caída de glucemia ante la infusión continua, por vía intravenosa, de 1 mUI/Kg.min de insulina de acción rápida. Cada 5 minutos se realizó la medición de la glucemia venosa mediante el método de la glucosa-oxidasa con un glucómetro ( USA Presissium) y la prueba fue dada por terminada cuando la glucemia de la rata estudiada fuera igual o menor a 70 mg/dL. 15
El cálculo del área bajo la curva de la caída de glucemia ante la infusión continua, se realizó para establecer las diferencias en el metabolismo de carbohidratos que presentaba cada uno de los dos grupos de ratas sometidas al estudio.
Obtención y registro de las respuestas motoras
Una vez desarrollada la RI, se procedió a la obtención de las respuestas contráctiles las cuales fueron comparadas con sus controles respectivos. Para llevar a cabo lo anterior y bajo anestesia general con pentobarbital sódico (40 mg/Kg, vía intraperitoneal), se procedió mediante disección roma a la exposición tanto del músculo gastrocnemio (fascículo externo) como del nervio ciático. El extremo proximal del músculo permaneció unido a la cabeza del fémur, en tanto que el distal fue sujetado con seda 4/0 y enganchado a la palanca de un transductor mecano-eléctrico lineal (FT 10, Grass Co. USA) con el cual fue estirado 1.5 veces su longitud de reposo antes de proceder a llevar a cabo los registros de tensión isométrica.
Las respuestas mecánicas fueron desencadenadas a través del nervio ciático mediante la aplicación de pulsos eléctricos supraumbrales de duración constante (5 ms) para el caso de las contracturas musculares y, de duración e intensidad variable para el caso de la curva de excitabilidad muscular (curva intensidad-duración). Para ello, se utilizó un estimulador de pulsos cuadrados (Grass S8, USA). Ambos tipos de respuestas fueron amplificadas (Ciberamp 320, Axon Instruments, USA), y enviadas a una tarjeta analógico/digital (Digidata 1200 interfase, USA), para finalmente ser visualizada y almacenadas en un sistema de cómputo para su posterior análisis ( Clampfit, Pclamp 6.0) y elaboración de gráficas (Sigmaplot, Jandel Co. y SPSS).
Es importante mencionar que durante todo el experimento se cuidó la hidratación tanto del nervio ciático (aceite mineral) como del músculo gastrocnemio (NaCl al 0.9%).
Respuestas analizadas de la contracción muscular
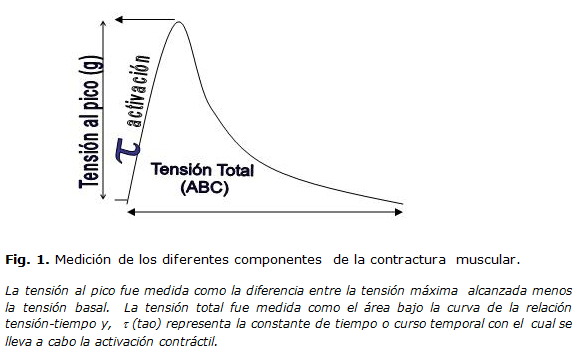
Los componentes de la contractura muscular que fueron analizados en presencia y ausencia de resistencia a la insulina fueron: a) amplitud o tensión al pico, b) tensión total y c) curso temporal de la activación contráctil.
La figura 1 muestra una contractura muscular y la forma en que fueron medidos cada uno de los parámetros anteriormente citados.
Para obtener la constante de tiempo (t) de la activación contráctil, se utilizó la siguiente ecuación de Boltzman:
A / (1+ B * exp { - ( t - K ) / t } ) + C
Donde K, es la posición inicial del ajuste - generalmente el tiempo cero; t - K, es el tiempo recorrido durante el proceso de ajuste; A, es el factor de escala que afecta la amplitud; B, es el factor de escala que afecta el retardo antes de la fase de ascenso de la contractura; C, es el desplazamiento vertical en la curva y t, es la constante de tiempo que afecta la pendiente de la fase de ascenso de la contractura. Esta función fue calculada automáticamente mediante la subrutina Clampfit del software Pclamp 6.04 ( Axon Instruments) al igual que las lecturas de tensión total y al pico.
Curva Intensidad-duración
También llamada curva de excitabilidad, fue realizada mediante la relación de los voltajes umbrales contráctiles con sus respectiva duración de estimulación eléctrica, las cuales fueron las siguientes: 0.01, 0.05, 0.1, 0.5, 1, 5, 10 y 50 ms. Esta gráfica, permitió la obtención de 2 parámetros electrofisiológicos: reobase y cronaxia, donde la segunda de ellas representa el tiempo que necesita aplicarse un estímulo de doble intensidad a la reobase para desencadenar la contractura muscular. Este último parámetro, constituye un indicador útil en la excitabilidad de una preparación, ya que, cuanto mayor es el valor de la cronaxia, tanto menos excitable es la preparación. 16 -18
Consideraciones éticas
El presente estudio fue aprobado por el comité de investigación y ética de la facultad de medicina. Los experimentos en animales fueron realizados bajo los lineamientos establecidos por the Institute for Laboratory Animal Research Guide for Care and Use of Laboratory Animals, 19 cuyas consideraciones contempla la generación del mínimo dolor y estrés a los animales, así como el método de eutanasia mas humano posible.
Análisis estadístico
Los resultados obtenidos de los 3 parámetros de la contractura muscular, fueron normalizados y presentados como el promedio ± desviación estándar. Estos datos así como los de la sensibilidad a la insulina, fueron sometidos a la prueba de t de Student y U de Mann Whitney respectivamente. En ambas pruebas, las diferencias fueron consideradas estadísticamente significativas cuando p < 0.05.
RESULTADOS
No se encontraron diferencias estadísticamente significativas entre ambos grupos al comparar las características generales de las ratas: peso corporal 305.4 ± 46.2g vs. 339.5 ± 46.5g (p=0.09) y dosis de anestésico empleado 0.18 ± 0.03 ml vs 0.20 ± 0.02 ml (p= 0.06).
Parámetros metabólicos
En la tabla 1 se muestran las características metabólicas de ambos grupos de ratas sometidas al estudio. En ella se muestra que el área bajo la curva (ABC) de glucosa fue mayor en el grupo experimental (PDN) respecto a la situación control. Aunque la mayoría de las mediciones de glucemia venosa fueron similares entre ambos grupos, las obtenidas a los 15 y a los 30 minutos de la infusión de insulina, fueron significativamente menores en el grupo control (0.032 y 0.010 respectivamente).
Tensión al pico de la contractura
En la figura 2 puede observarse que la tensión al pico de la contractura del músculo resistente a insulina (PDN) fue de 48.29 ± 4.35 g. respecto a la que presentó su control la cual fue de 58.52 ± 5.11 g. Lo anterior evidencia una diferencia promedio del 17,5 %. La diferencia entre ambos grupos, sugiere un posible efecto de la RI sobre la tensión al pico (p=0.19).
Curso temporal de la activación contráctil
Como se observa en la figura 3, el curso temporal de la activación contráctil en los músculos de las ratas resistentes (PDN) fue de 10.47±1.6 ms respecto al obtenido en las ratas sanas, en las cuales fue de 9.13±1.3 ms. Lo anterior sugeriría que, ante la presencia de un estimulo despolarizante, el inicio de la contracción del músculo resistente a insulina tarda 14,5 % mas en promedio que el tiempo que tarda en activarse el músculo sano (p=0.19).
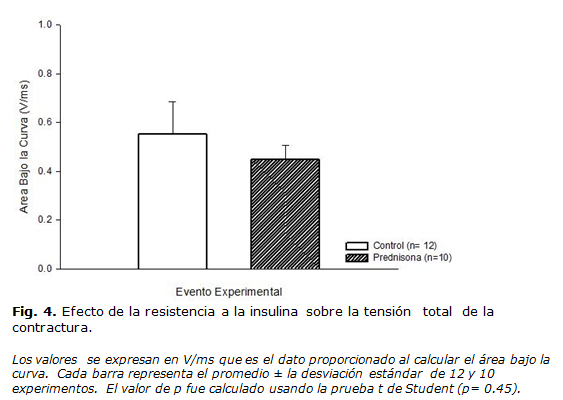
Tensión total de la contractura
Este parámetro fue medido como el área bajo la curva de la relación tensión-tiempo de la contractura, expresándose en V/ms. Los resultados obtenidos muestran que los fascículos del músculo gastrocnemio de las ratas controles presentaban una tensión total promedio de 0.55±0.13 V/ms en tanto que los músculos resistentes a insulina (PDN) la presentaron de 0.44±0.05 V/ms. Lo anterior, denota una diferencia del 20 % menos de tensión total desarrollada en las ratas resistentes respecto a sus controles (p= 0.45). Ver figura 4.
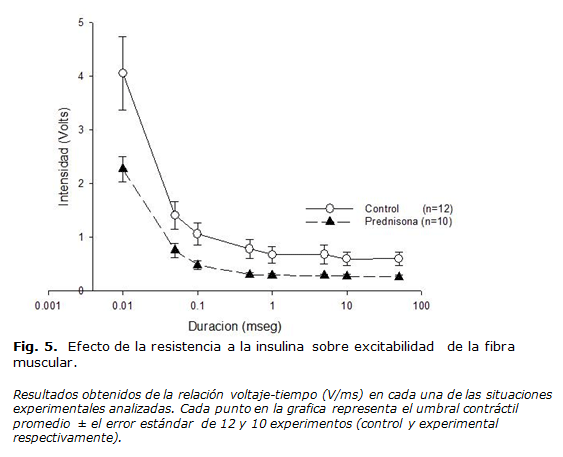
Efectos sobre la excitabilidad muscular (curva de umbrales )
Este parámetro fue obtenido como se observa en la figura 5, a partir de la relación voltaje-tiempo al cual se alcanzaron los umbrales contráctiles para cada una de las duraciones de estímulo utilizadas (0.01, 0.05, 0.1, 0.5, 1, 5, 10 y 50 ms). La maniobra fue utilizada tanto para músculos sanos (controles) como resistentes a la insulina (PDN). De esta manera se obtuvieron 2 curvas de umbrales de curso exponencial decreciente donde el valor de la cronaxia del grupo control fue de 0.07 ms. vs. 0.08 ms que presento el grupo resistente a insulina. Lo anterior sugiere que se requiere un 14,3 % de mayor duración del estimulo para activar la fibra resistente a insulina respecto a la situación control. Las reobases obtenidas fueron de 0.59 ± 0.12 V para el grupo control vs 0.27± 0.03 V que presentaron los músculos resistentes (p= 0.19). Lo anterior evidencia una diferencia promedio del 43,3 % entre ambos grupos.
DISCUSIÓN
De acuerdo a nuestro conocimiento, el presente estudio es el primero en abordar el efecto de la RI sobre los mecanismos de la contracción muscular y sobre los diferentes componentes de la respuesta contráctil del músculo esquelético de rata. Otros autores ya han abordado en modelos animales, el efecto de la RI y la diabetes mellitus tipo 2 sobre la respuesta contráctil cardiaca. 20, 21
Estos autores concluyeron que en músculo cardiaco, existe una disminución de los flujos de calcio hacia el retículo sarcoplásmico en modelos de ratón con diabetes mellitus tipo 2 que no se mostraron asociados con un cambio en la función del transportador de Na+/Ca ++. Este mismo fenómeno podría estar ocurriendo en el músculo esquelético, sugiriendo que no existe una apropiada recaptación de calcio por parte del retículo sarcoplásmico de la fibra muscular como fue evidenciado por otro grupo de investigación. 22 Lo anterior podría ser evidenciado por los registros de tensión isométrica que se realizaron en el presente trabajo y en los cuales se apreció un retardo en la fase inicial de la contractura muscular que sugiere la posibilidad de que se esté liberando el calcio hacia el citosol en forma más lenta. Por otro lado, nuestros datos mostraron además que existe una disminución tanto de la amplitud al pico de la contractura muscular (que representa la cantidad de calcio que se libera desde el retículo sarcoplásmico) como de la tensión total generada en la misma (cantidad total de calcio liberado por el retículo mas el que ingresa desde el medio extracelular). Lo anterior sugiere que la resistencia a la insulina induce en los músculos resistentes, una reducción en la salida de calcio hacia el citosol de las fibras musculares, la cual fue manifestada por una respuesta contráctil menos intensa y mas lenta en respuesta a un estimulo eléctrico despolarizante. Estos resultados concuerdan con los obtenidos por Waring y cols (2000) quienes investigaron los flujos de calcio intracelular en el músculo liso de la rata diabética. 23
En lo referente a las curvas de excitabilidad obtenidas entre los dos grupos, los valores mayores de cronaxia (14,3 %) en el grupo experimental y la necesidad de un menor voltaje para alcanzar la reobase en esta mismas fibras respecto a su situación control (43,3 %, p=019), sugieren una reducción de la excitabilidad de las fibras tratadas con prednisona.
Los resultados obtenidos en el presente trabajo, sugieren que la RI tendría al menos en este tipo de preparación experimental, un efecto directo sobre las concentraciones intracelulares de calcio, lo cual se ve reflejado en las características de la respuesta motora así como en la excitabilidad del músculo. Esto último podría ser confirmado de manera definitiva si se incrementara el número de observaciones experimentales o si se incrementara el tiempo del efecto de la resistencia insulínica.
Los resultados del presente estudio sugieren que la resistencia a la insulina al parecer modifica la excitabilidad de la fibra muscular y favorece el desarrollo de contracciones musculares de menor intensidad y mas lentas, lo que sugiere una afección del acople excitación-contracción del músculo esquelético.
No descartamos que los efectos observados en las respuestas del músculo, pudiesen haber sido secundarios al efecto per se del corticoesteroide utilizado para inducir la resistencia a la insulina. Existen reportes previos que argumentan que dichos fármacos son capaces de inducir atrofia y reducción de la fuerza muscular después de 14 días de tratamiento, lo cual es secundario a la reducción de elementos fibrilares del músculo más que a un efecto directo sobre los mecanismos del acople excitación-contracción los cuales, de acuerdo a nuestra hipótesis, pudiesen ser afectados por la resistencia a la insulina y la diabetes mellitus tipo 2. 24
Estudios adicionales habrán de evaluar el posible efecto directo de los corticoides sobre las propiedades contráctiles del músculo esquelético independientemente del estatus de resistencia a la insulina.
Contribuciones de los autores
RVR y CETP participaron en el diseño y realización de cada una de las fases de la investigación así como en el análisis de resultados y elaboración de manuscritos para publicación; MDE participo en la asistencia técnica de la fase experimental así como en el mantenimiento y control de los animales; CV participo en el análisis y corrección estadística así como en la elaboración y envío del manuscrito para su publicación.
Agradecimientos
Los autores agradecemos a las autoridades de la universidad de Colima y en particular a los directivos de las facultades de medicina y enfermería por las facilidades otorgadas para la realización del presente trabajo.
REFERENCIAS BIBLIOGRÁFICAS
1. Ruzzin J, Jensen J. Contraction activates glucose uptake and glycogen synthase normally in muscles from dexamethasone-treated rats. Am J Physiol Endocrinol Metab 2005; 289(2):E241-50.
2. Hallsten K , Yki-Jarvinen H, Peltoniemi P, Oikonen V, Takala T, Kemppainen J, et al. Insulin- and exercise-stimulated skeletal muscle blood flow and glucose uptake in obese men. Obes Res 2003; 11(2):257-65.
3. Braun B, Sharoff C, Chipkin SR, Beaudoin F. Effects of insulin resistance on substrate utilization during exercise in overweight women. J Appl Physiol 2004; 97(3):991-7.
4. Borghouts LB . Exercise and insulin sensitivity: a review. Int J Sports Med. 2000; 21(1):1-12.
5. Howlett KF, Sakamoto K, Garnham A, Cameron-Smith D, Hargreaves M. Resistance exercise and insulin regulate AS160 and interaction with 14-3-3 in human skeletal muscle. Diabetes 2007; 56(6): 1608-14.
6. Wadley GD, Konstantopoulos N. Increased insulin-stimulated Akt pSer473 and cytosolic SHP2 protein abundance in human skeletal muscle following acute exercise and short-term training. J Appl Physiol 2007; 102(4):1624-31.
7. Howlett KF. Insulin-stimulated insulin receptor substrate-2-associated phosphatidylinositol 3-kinase activity is enhanced in human skeletal muscle after exercise. Metabolism 2006; 55(8):1046-52.
8. Wheatley CM, Rattigan S, Richards SM, Barret EJ, Clark MG. Skeletal muscle contraction stimulates capillary recruitment and glucose uptake in insulin-resistant obese Zucker rats. Am J Physiol Endocrinol Metab 2004; 287(4):E804-9.
9. Schnider MF and Chandler WK. Voltaje dependent charge movement in skeletal muscle: a possible step in excitation contraction coupling. Nature 1973; Vol. 242: 244-246.
10. Mathias RT, Levis RA, Eisenberg RS. Electrical model of excitation-contraction coupling and charge movement in skeletal muscle J Gen Physiol 1980; 76: 1-31.
11. Vergara J, Tsien RY, Delay M. Inositol (1,4,5)-trisphosphate: a possible chemical link in excitation-contraction coupling in muscle. Proc Natl Acad Sci 1985; 82:6352-6356.
12. Endo M, Tanaka M, Ogawa Y. Calcium induced release of calcium from sarcoplasmic reticulum of skinned skeletal muscle fibres. Nature 1985; 228: 34-37.
13. Ríos E, Karhanek M, González A. An allosteric model of the molecular interactions of excitation-contraction coupling in skeletal muscle. J Gen Physiol 1993; 102: 449-481.
14. Yasuda K, Hines E, Kitabchi AE. Hypercortisolism and insulin resistance: comparative effects of prednisone, hydrocortisone, and dexamethasone on insulin binding of human erythrocytes. J Clin Endocrinol Metab 1982; 55(5): 910-5.
15. Short KR, Bigelow ML, Nair KS. Short-term prednisone use antagonizes insulin's anabolic effect on muscle protein and glucose metabolism in young healthy people. Am J Physiol Endocrinol Metab 2009; 297(6): E1260-8.
16. Sawaya SG, Combet D, Chanoit G, Thiebault JJ, Levine D, Marcellin-Little DJ. Assessment of impulse duration thresholds for electrical stimulation of muscles (chronaxy) in dogs. Am J Vet Res 2008; 69(10):1305-9
17. Wittenberger C, Rusdea D. Values of muscular and cardiac chronaxia in some crabs from the North Sea. J Physiol (Paris) 1960; 52: 247-8.
18. Martini G, Saracco C. Statistical data on the behavior of the accommodation quotient in relation to the normal values of chronaxy of the tibial, peroneus and gastrocnemius muscles. Minerva Ortop 1965;16(12):658-62.
19. Institute for Laboratory Animal Research. National Research Council. Guide for the Care and Use of Laboratory Animals. Washington, DC: National Academy Press, 1996.
20. Belke DD . Decreased sarcoplasmic reticulum activity and contractility in diabetic db/db mouse heart. Diabetes 2004; 53(12):3201-8.
21. Misra T, Gilchrist JS, Russell JC, Pierce GN. Cardiac myofibrillar and sarcoplasmic reticulum function are not depressed in insulin-resistant JCR: LA-cp rats. Am J Physiol 1999; 276(6): H1811-7.
22. Henriksen EJ . Invited review: Effects of acute exercise and exercise training on insulin resistance. J Appl Physiol 2002; 93(2):788-96.
23. Waring JV , Wendt IR. Effects of streptozotocin-induced diabetes mellitus on intracellular calcium and contraction of longitudinal smooth muscle from rat urinary bladder. J Urol 2000; 163 (1):323-30.
24. Laszewski B, Ruff RL. Effects of glucocorticoid treatment on excitation-contraction coupling. Am J Physiol 1985; 248(3ª pt):E363-9.
Recibido: 15 de mayo de 2013.
Aceptado: 2 de julio de 2013.
Dr. Raymundo Velasco Rodríguez PhD . Universidad de Colima, Facultad de Enfermería, Av. Universidad 333, Colonia Las víboras; CP 28040, Colima, Colima, México. Teléfono: 013123161069, 013123120018 Fax: 3161069. E mail: rayvel@ucol.mx