Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.33 no.4 Ciudad de la Habana oct.-dic. 2014
ARTÍCULO ORIGINAL
Combinaciones de bases nutritivas empleadas en el desarrollo del medio caldo nitrato
Nutritional bases combinations used in the development of nitrate broth medium
MSc. Lic. Diana Rosa Viera Oramas, DrC. Raisa Zhurbenko, Ana Luisa Cabrera González, DrC. Tamara Lobaina Rodríguez
Centro Nacional de Biopreparados (BioCen). Bejucal, Mayabeque. Cuba.
RESUMEN
Introducción: el medio caldo nitrato es utilizado en los laboratorios de microbiología clínica como prueba bioquímica para la identificación de enterobacterias por la capacidad que tienen para reducir los nitratos a nitrito.
Objetivo: evaluar diferentes combinaciones de bases nutritivas destinadas al desarrollo del medio de cultivo.
Métodos: se seleccionó como material biológico un conjunto de cepas certificadas y aisladas pertenecientes a especies representativas de varios géneros de la familia de Enterobacteriaeceae. Se diseñaron cinco variantes y se utilizó como bases nutritivas la peptona de gelatina y el extracto de carne, en diferentes combinaciones y concentraciones, para determinar el incremento de absorbancia en el tiempo como indicador de la densidad microbiana y se calculó la velocidad de crecimiento. Se evaluó la capacidad funcional del medio de cultivo por la habilidad de las especies de reducir o no el nitrato a nitrito.
Resultados: la mejor combinación de bases nutritivas correspondió a la de mayor concentración de peptona de gelatina (10 g/L) y extracto de carne (3 g/L). La evaluación organoléptica y fisicoquímica del medio de cultivo mostró características satisfactorias para este tipo de producto. Se comprobó la reducción satisfactoria del nitrato a nitrito, por los microorganismos empleados como control positivo.
Conclusiones: el medio de cultivo caldo nitrato desarrollado, cumple con los requisitos de calidad y su funcionalidad microbiológica y permite la caracterización de especies bacterianas que poseen la capacidad de reducir los nitratos a nitritos.
Palabras clave: caldo nitrato, reducción de nitratos, bases nutritivas.
ABSTRACT
Introduction: the nitrate broth culture medium is used in clinical microbiology laboratories as a biochemical test for the identification of Enterobacteriaceae by the ability of these microorganisms to reduce nitrate to nitrite.
Objective: to evaluate different combinations of nutritive bases for the development of the culture medium.
Methods: certificed strains were selected as biological test material. The strains belong to different generu of the Enterobactericiae family. Five variants were designed with gelatin peptone and meat extract as nutrient bases at different concentrations and combinations, the growth rate was calculated by measuring the increase in absorbance over time as an indicator of microbial density. The functionality of the culture medium was evaluated by the ability of tested bacteria or reduce nitrate to nitrite
Results: the best combination of nutritive bases contained the highest concentration of gelatin peptone (10 g/L) and beef extract (3 g/L). Physicochemical and sensory evaluation of the culture medium showed results characteristic for this type of product. Reductions of nitrate to nitrite were observed for all tested microorganisms choosed as the positive control.
Conclusions: the nitrate broth culture medium developed complies the quality requiment and its microbiological functionality allows the characterization of bacterial species by the ir ability to reduce nitrate to nitrite.
Key words: nitrate broth, nitrate reduction, nutritive base.
INTRODUCCIÓN
Los laboratorios de microbiología aplican diversos procedimientos para la identificación fenotípica y caracterización de los agentes etiológicos responsables del proceso infeccioso para evaluar sus implicaciones patogénicas y patológicas en el contexto epidemiológico, así como la evolución clínica al aplicar una terapia antimicrobiana eficaz.1
La identificación de un aislamiento bacteriano puede realizarse al utilizar diferentes criterios microbiológicos. Los ensayos bioquímicos, tradicionalmente empleados, determinan la actividad de una vía metabólica (conjunto de reacciones químicas) a partir de un sustrato que se incorpora en un medio de cultivo y que los microorganismos lo transforman o no durante su crecimiento.2
La mayoría de las bacterias patógenas requieren, para llevar a cabo su metabolismo, de la presencia de proteínas, ácidos nucleicos, polisacáridos, vitaminas y lípidos. Estos componentes forman parte de diferentes medios de cultivo, especialmente diseñados para proveer el adecuado desarrollo del microorganismo o sintetizados por la propia célula.3 Adicionalmente, la incorporación de mezclas y combinaciones proteicas de diferentes orígenes aporta una gran cantidad de nutrientes, indispensables para el crecimiento microbiano.4
La capacidad de ciertas bacterias para reducir los nitratos ha sido utilizada como criterio al incluirse dentro de los esquemas tradicionales de identificación. De esta forma, Gorham,5 en 1901, recomendó el uso del medio de cultivo caldo nitrato para clasificar, en diferentes grupos, las especies bacterianas responsables de las infecciones sistémicas, por su capacidad de reducir el nitrato a nitrito, mediante la enzima nitrato-reductasa. Esta prueba se emplea en la identificación bioquímica de microorganismos entéricos, no entéricos y de vibrionáceas como V.cholerae y V.parahaemolyticus.6
El objetivo de la presente investigación consistió en evaluar y seleccionar una combinación de bases nutritivas adecuada para el desarrollo del medio de cultivo caldo nitrato en BioCen, a través del ensayo de la promoción del crecimiento de un significativo grupo de microorganismos y su identificación de acuerdo a su capacidad para reducir el nitrato.
MÉTODOS
Se utilizaron las bases nutritivas peptona de gelatina (PG) y extracto de carne (EC), ambos procedentes de la firma Biotécnica Internacional de México, y las sales cloruro de sodio (Merck, Alemania) y nitrato de potasio (Applichem, Alemania).
Cepas microbianas y medios de cultivo: se manejaron los microorganismos de referencia clasificados según la American Type Culture Collection (ATCC) y otras cepas aisladas, procedentes del cepario central del Centro Nacional de Biopreparados (BioCen). En el estudio del incremento de la densidad microbiana en el tiempo se utilizaron dos cepas de la ATCC: Escherichia coli 25922 y Pseudomonas aeruginosa 27853. Para la evaluación funcional del caldo nitrato, los microorganismos (todos de la ATCC, a excepción de E. coli 770 aislada) se agruparon en 11 géneros: Salmonella (S. Typhimurium 13111, S. Abony 6017, S. Typhimurium 14028, S. Enteritidis 13076), Escherichia (E. coli 25922,E. coli 11775, E. coli 770), Shigella (S. sonnei 25931, S. flexneri 12028), Proteus ( P. vulgaris 13315, P. mirabilis 12453, P. mirabilis 7002, P. inconstans 9886), Citrobacter (C. freundii 8090, C. amalonaticus 24405, C. diversus 27156, C. Vi 10625), Enterobacter (E. cloacae 23355, E. cancerogenes 33241, E. aerogenes 13048), Serratia (S. rubideae 29593, S. odorífera 33077, S. marcescens 13880, S. marcescens 14576), Klebsiella (K. oxytoca 43663, K. pneumoniae 13883), Aeromonas (A. hydrophila 23211, A. jandai 49568, A. bestiarium 51108), Providencia (P. rettgeri 29544), Alcaligenes (A. faecalis 8156) y Pseudomonas (P. aeruginosa 27853).
Las suspensiones microbianas se prepararon a partir de cultivos puros de 18-24 h en caldo cerebro corazón (BioCen, Cuba). Estos cultivos se diluyeron en solución salina estéril al 0,85 % (p/v) (NaCl, grado analítico; Merck, Alemania) en el agitador de tubos (VF2, IKA-Labortechnik, Alemania). La suspensión de células microbianas se ajustó con el uso de un método espectrofotométrico al 0,125 de adsorbancia a 550 nm, al utilizar una concentración microbiana aproximadamente de 3,0 x 108 UFC/mL (espectrofotómetro Ultrospec 2000, Pharmacia Biotech, Inglaterra).
Se utilizó como control el medio de cultivo caldo nitrato (Merck, Alemania) y como revelador de la prueba de nitrato, el reactivo de GRIESS-ILOSVAY, compuesto por ácido acético, ácido sulfanílico y a-naftilamina (Merck, Alemania).
Determinación del incremento de la densidad microbiana en el tiempo: se formularon composiciones nutricionales a través de diferentes concentraciones de bases nutritivas y nitrato de potasio (tabla 1). Estas composiciones se inocularon con 0,1 mL de las suspensiones estandarizadas de E. coli ATCC 25922 y P. aeruginosa ATCC 27853 (ambas de la ATCC). El incremento de la biomasa de cada cepa de ensayo se determinó al medir el valor de la absorbancia cada 1 h en un espectrofotómetro (Ultrospec 2000, Pharmacia Biotech, Inglaterra) a 640 nm durante un período de 12 h de cultivo incubadas a 35 ± 2 °C. Se utilizó un total de 5 réplicas y la media de los valores de absorbancia obtenidos se emplearon para confeccionar las curvas de crecimiento microbiano.7
Análisis físico-químico del medio caldo nitrato: el análisis comprendió la pérdida por desecación a través de un método gravimétrico,8 al secar la muestra en una estufa a 105 °C (Heraeus, Alemania) hasta peso constante. Se determinó el valor de pH mediante un método potenciométrico (pH metro PHM 240, Radiometer, Dinamarca).9
Funcionalidad microbiológica del caldo nitrato: el medio se preparó en tubos de cultivo según las instrucciones del fabricante. Los tubos se inocularon con una asada a partir de cultivos frescos de 18-24 h, en el medio agar triptona soya (BioCen, Cuba) y se incubaron a una temperatura de 35 ± 2 °C por 24 h en la incubadora Heraeus (Alemania). Posteriormente, se añadió el reactivo de GRIESS-ILOSVAY y se observó el cambio de coloración de amarillo a rojo. Se comparó la respuesta microbiológica obtenida por la composición experimental definida por BioCen con respecto a la del medio de referencia caldo nitrato de Merck (Alemania).
Análisis estadístico: se calcularon las medias y la desviación estándar para comparar las diferencias con un nivel de confianza del 95 % (p<0,05), con el programa Microsoft Excel.
RESULTADOS
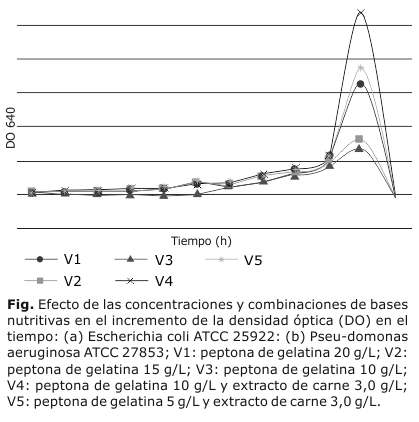
Los valores de absorbancia representan la densidad óptica registrada en cada variante de ensayo. A partir de la media de los resultados se confeccionaron las curvas de crecimiento microbiano, donde el incremento de los valores registrados es proporcional al desarrollo de la biomasa microbiana en el tiempo.
Al evaluar el desarrollo de E. coli (fig.) en las composiciones diseñadas con diferentes combinaciones y concentraciones de las bases nutritivas se evidenció que en la variante V4 se alcanzan los mayores valores de absorbancia, a partir de las 5 h de incubación. En las siguientes horas de cultivo se mantuvieron los valores de densidad óptica de modo ascendente y significativo, para las V1, V5 y V4, permaneciendo esta última con valores superiores con relación a las demás, expresado en 9, 10 y 11 veces su incremento en cuanto al valor inicial, respectivamente.
Las V2 y V3 no resultaron idóneas para el desarrollo del microorganismo de ensayo, pues mostraron valores de absorbancia muy cercanos a los registrados en las primeras horas de incubación.
En el caso del cultivo de P. aeruginosa ATCC 27853 (fig.) no se observaron diferencias significativas entre las variantes durante las primeras diez horas de incubación. Sin embargo, a partir de la siguiente hora de cultivo se observó un incremento significativo de la biomasa microbiana y se destacó como la mejor la V4, siendo esta significativamente superior al resto. Igualmente, en el mismo período de cultivo se registraron valores de densidad óptica elevados para las V5 y V1, sin superar los valores obtenidos por la V4, se encuentra un incremento de la densidad microbiana con respecto a la etapa inicial de cultivo de 5 veces en V4, así como de 4 y 3,5 veces para V5 y V1, respectivamente. Sin embargo, para las V2 y V3 los valores resultaron significativamente inferiores a los registrados para el resto de las variantes de ensayo.
Este posibilitó definir que la composición correspondiente a la V4, formulada con peptona de gelatina y extracto de carne en cantidad de 10 y 3 g/L de medio de cultivo, respectivamente, resultó la combinación de bases nutritivas idónea para promover el desarrollo y crecimiento de las especies E. coli y P. aeruginosa.
El estudio de los indicadores de calidad realizados a la composición definida del caldo nitrato, mostró valores de pérdida por desecación de 3,55 ± 0,34 % y un pH de 7,14 ± 0,01.
La adición del revelador recomendado para la interpretación de la prueba de reducción del nitrato, para las 32 especies de los 11 géneros de la familia Enterobacteriaceae, permitió observar un cambio de coloración de amarillo a rojo en ambos medios de cultivo (BioCen y Merck) en 31 de las especies utilizadas en el ensayo, al ser negativa la prueba para A. faecalis, cepa utilizada como control negativo (tabla 2).
Se evidenció como elemento favorable que la coloración roja, indicador de la reacción positiva de la reducción del nitrato obtenida en la composición definida por BioCen, se mostró con mayor permanencia que la encontrada en el medio de referencia de la Merck disipada en breves minutos al igual que la intensidad del color rojo.
DISCUSIÓN
Varios estudios demuestran que las bacterias crecen y se dividen hasta el nivel máximo posible, en función de su potencial genético, el tipo de medio y las condiciones adecuadas de cultivo.10 A su vez, es reconocido que los derivados proteicos constituyen aditivos altamente valiosos para los medios de cultivo, pues son portadores de una gran cantidad de nutrientes indispensables para el crecimiento microbiano. 5 Por ello, la selección de la combinación de bases nutritivas apropiadas, generalmente contempla numerosos factores tales como, el microorganismo a cultivar, la microbiota acompañante y el propósito del medio de cultivo.11
Las diferentes proporciones de peptona de gelatina y/o extracto de carne, utilizadas en las cinco variantes de ensayo demostró que las V4 y V5, diseñadas con la incorporación de la mezcla de peptona de gelatina y extracto de carne, en proporciones de 13 y 8 g/L, respectivamente, propiciaron mejores condiciones de cultivo para E. coli y P. aeruginosa. Sin embargo, las demás composiciones que contenían solamente la peptona de gelatina en cantidad de 20, 15 y 10 g/L (V1, V2 y V3, respectivamente) mostraron resultados inferiores para el cultivo de ambas cepas de ensayo.
La adecuada combinación de aminoácidos, péptidos, polipéptidos, vitaminas y macronutrientes en las variantes V4 y V5, proporcionada por la mezcla de bases nutritivas utilizadas, favoreció la síntesis de nuevo material celular de forma constante, al inhibir la acumulación de productos tóxicos que afecten el crecimiento de E. coli y P. aeruginosa, durante las 12 h de incubación. 10 Estos hallazgos coinciden con lo referido por Tsoraeva y Zhurbenko, en el año 2000, pues demuestran que los medios de cultivo que contienen mezclas de peptonas de diferentes naturalezas proporcionan un mejor crecimiento y una buena recuperación bacteriana.5,12
Según Martín 11 las poblaciones microbianas crecen más lentamente cuando la disponibilidad de nutrientes esenciales se encuentra en concentraciones bajas. Los nutrientes que garantizan un adecuado desarrollo se manifiestan en los indicadores del contenido de nitrógeno y otras formas nitrogenadas (aminoácidos esenciales) que poseen las bases nutritivas. Este elemento justifica que las variantes V1, V2 y V3, formuladas solamente con la peptona de gelatina, caracterizada por contener bajos porcentajes de aminoácidos sulfurados (cistina, triptófano y metionina)12 y registrados en ordenes inferiores al 0,60; 0,50 y 1,10 % no son suficientes para garantizar un adecuado desarrollo microbiano. A su vez, los valores de relación de nitrógeno amínico con respecto al contenido total de nitrógeno de la base nutritiva 13 están reportados entre 12 y 25 %, niveles que son inferiores a los que presenta el extracto de carne (21 y 33 %) presente en las combinaciones que conforman V4 y V5.
A modo de conclusión, la combinación V4, que contiene peptona de gelatina al 1 % y de extracto de carne al 0,3 %, resultó ser la más factible a incluir en la formulación del medio caldo nitrato de BioCen, y su selección se beneficia porque la mezcla de bases se encuentra en proporción de 13 g/L, valor superior al que se utiliza en V5 de 8 g/L, elemento que favorece el incremento de la densidad microbiana en un menor período de tiempo.
Los indicadores de la pérdida por desecación resultaron inferiores al 7 %, de acuerdo con lo descrito por Lobaina (2010),14 los valores obtenidos se ajustan a los parámetros exigidos para productos similares que entre sus características fundamentales se destaca su elevada higroscopicidad. Los valores bajos de humedad favorecen la estabilidad del medio de cultivo durante su almacenamiento y ello evita la interacción química y la degradación de sus componentes.
En cuanto al pH del medio de cultivo, este es considerado un parámetro crítico para garantizar el adecuado desarrollo de los microorganismos; por otro lado la formulación del medio de cultivo debe contener sustancias capaces de compensar cualquier desbalance del pH, provocado por la acumulación de productos del metabolismo microbiano. Los valores obtenidos de este indicador se mantuvieron dentro del rango especificado y corroboran lo planteado por Zhurbenko (2009) y otros autores, que las condiciones óptimas de pH favorecen el crecimiento y la adecuada actividad enzimática de los microorganismos.9
La definición de la calidad funcional de una composición diseñada para los ensayos de reacciones bioquímicas se realiza a través de su desempeño ante diferentes microorganismos. La capacidad de algunas especies microbianas de reducir el nitrato a nitrito, se evidenció por el cambio de coloración del medio a rojo, elemento que demostró la presencia de la enzima nitrato-reductasa y su acción sobre los nitratos aportados en los ingredientes del medio de cultivo.
Los resultados de esta investigación ponen en evidencia lo descrito por Gorham en 1901, quien desarrolló el medio caldo nitrato para la caracterización e identificación de bacterias gran-negativas. 6 De acuerdo con estudios reportados por Koneman 3 y MacFadin 15 la adición de ácido sulfanílico y α-naftilamida después del cultivo facilita revelar los nitritos presentes en el medio, al formarse el complejo nitrito-ácido sulfanílico, el que a su vez reacciona con el α-naftilamina, dando lugar a la aparición de un precipitado de color rojo.
La persistencia de la coloración roja e intensidad que se observó en la composición desarrollada por BioCen, de acuerdo con Wallace, 16 se deben al empleo de la peptona de gelatina en combinación con el extracto de carne, la cual provee, entre otros elementos nutricionales, los aminoácidos sulfurados, que posibilitan la activación de las propiedades químicas necesarias para el mantenimiento del color. El menor período de permanencia de la respuesta positiva en la composición de la Merck puede estar atribuido al uso exclusivo de la peptona de gelatina en esta composición y la misma está desprovista de aminoácidos sulfurados.
El resultado obtenido para Alcaligenes faecalis, considerado como control negativo, responde a la incapacidad de este microorganismo para incorporar el nitrato en el proceso respiratorio y reducirlo a amoníaco, nitrógeno molecular u óxido nitroso. Estos resultados coinciden con lo reportado por MacFadin en el 2006.15
El medio de cultivo caldo nitrato desarrollado en BioCen cumple con los requisitos de calidad y su funcionalidad microbiológica permite la caracterización de especies bacterianas que poseen la capacidad de reducir los nitratos a nitritos.
REFERENCIAS BIBLIOGRÁFICAS
1. Germán B, Fernández-Olmos A, García C, Sáez-Nieto JA, Valdezate S. Métodos de identificación bacteriana en el laboratorio de microbiología. Enferm Infecc Microbiol Clin. 2011;29(8):601-8.
2. Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Wenn WC. Color Atlas Textbook of Diagnostic Microbiology. 5th ed. Philadelphia, New York: Lippincott; 1997.
3. Pachón DA. Aislamiento, identificación y serotipificación de enterobacterias del Género Salmonella en una población de Crocodylus intermedius y Testudines mantenidos en cautiverio en la Estación de Biología Tropical Roberto Franco EBTRF de la Facultad de Ciencias - Universidad Nacional de Colombia en Villavicencio - Meta [Tesis de grado]. Bogotá: Pontificia Universidad Javeriana; 2009.
4. Tsoraeva A, Zhurbenko R. Development and Characterization of mixed nutrient base for the culture of a wide range of microorganisms. Rev Latinoam Microbiol. 2000;42:155-61.
5. Gorham FP. Laboratory source in bacteriology. 1901. [citado 21 Ene 2013] Disponible en: http://www.archive.org/stream/laboratoryguidei00frosrich/laboratoryguidei00frosrich_djvu.txt
6. Frágenas N. Detección de bacterias patógenas en muestras de Ostras (Crassostrea rhizophorae) y agua, colectadas en Tucacas, Edo. Falcón y Ocumare de la Costa de Oro, Edo. Aragua. (Tesis doctoral). Universidad de Venezuela; 2010.
7. Viera Oramas DR, Zhurbenko R, Rodríguez Martínez C. Caracterización de un hidrolizado ácido de caseína. Rev Cub Med Trop [online]. 2009[citado 21 Ene 2013];61(2) Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602009000200005
8. Vielma RA, Sánchez K, Márquez E, Rial L. Estudio preliminar del uso de la harina de lombriz de tierra (Eisenia fetida) como fuente nutricional para el cultivo de microorganismos. Rev Fac Farm. 2012;54(1):12-6.
9. Zhurbenko R, Rodríguez Martínez C. Bases nutritivas para el cultivo de los microorganismos: Parte 2. Principales indicadores de calidad. Salud y Ciencia. 2009;16(6):645-8.
10. Madigan MT, Martinko JM, Parker J. Biologia de los microorganismos. 10ma ed. Madrid: Pearson Prenticen Hall; 2003.
11. Martín I. Diversidad Microbiana y Taxonomía. Capítulo III. Las bacterias. Departamento de Microbiología. Universidad de Granada. 2005.[Citado 20 de febrero de 2013] Disponible en: http://www.diversidadmicrobiana.com
12. Zhurbenko R, Rodríguez Martínez C, Lobaina Rodríguez T, López Hernández OD, Viera Oramas DR. Peptona papaínica de corazón de vaca como fuente de nutrientes para los microorganismos. SIIC. 2012 Septiembre 21 [citado 21 Ene 2013]. Disponible en: http://www.siicsalud.com/dato/experto.php/113774
13. Zhurbenko R. Metodología para el aprovechamiento de los subproductos de la industria alimenticia y otras proteínas en la evaluación de la calidad sanitaria de los alimentos [Tesis doctoral]. Habana: Universidad de La Habana; 2005.
14. Lobaina Rodríguez T. Métodos cromogénicos y fluorogénicos para el diagnostico de especies de Candida de relevancia clínica [Tesis doctoral]. Habana: Instituto de Medicina Tropical “Pedro Koirí”; 2010.
15. MacFaddin JF. Prueba de reducción de nitratos/nitritos. Pruebas bioquímicas individuales. En: Pruebas bioquímicas para la identificación de bacterias de importancia clínica. 3ra ed. La Habana: Editorial Ciencias Médicas; 2006.
16. Wallace GI, Neave SL. The nitrate test as applied to bacterial cultures. J Bacteriol. 1927 [Citado 13 de diciembre de 2012];14(6):377–84.. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC374965/
Recibido 4 de agosto de 2014
Aprobado: 4 de septiembre de 2014
Diana Rosa Viera Oramas. Investigadora Agregado. Máster en Ciencias. Licenciada en Farmacia. Centro Nacional de Biopreparados (BioCen), Apartado 6048. Tel: (047) 682441. Fax: (5347) 682850. Mayabeque. Cuba. Correo Electrónico: diana@biocen.cu