Meu SciELO
Serviços Personalizados
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Investigaciones Biomédicas
versão On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.34 no.2 Ciudad de la Habana abr.-jun. 2015
Rev Cubana de Investigaciones Biomédicas. 2015;34(2)
ARTÍCULO ORIGINAL
Daño a células endoteliales en cultivo inducido por el isoprostano 8-iso-PGF2a
Damage to cultured endothelial cells induced by isoprostane 8-iso PGF2
Dra. Nayade Pereira Roche,I Dr. José Carlos García PiñeiroII
I Centro Nacional de Genética Médica. La Habana, Cuba.
II Universidad de Ciencias Médicas de La Habana. La Habana, Cuba.
RESUMEN
Introducción: el endotelio vascular posee un papel esencial en los procesos asociados a la enfermedad cardiovascular. Existe estrecha relación entre el desbalance redox de estas células y la aparición y evolución de estas enfermedades. Entre los marcadores de daño oxidativo a los lípidos de membranas se encuentra el isoprostano 8-iso-PGF2a, que aumenta en estos pacientes.
Objetivo: evaluar el efecto del isoprostano 8-iso-PGF2a sobre células endoteliales en cultivo y la protección con la proteína de estrés térmico a-cristalina.
Métodos: se cultivaron células endoteliales de la línea H5V y se evaluó el efecto del isoprostano 8-iso-PGF2a y del análogo del tromboxano A2, U46619, sobre la supervivencia celular. Se evaluó el efecto protector de la proteína de estrés térmico a-cristalina a través de la incubación de los cultivos con 1 mg/ml de la proteína previo a la inducción del daño con los compuestos en estudio.
Resultados: la supervivencia celular disminuyó proporcional al aumento de la concentración del isoprostano y del U46619. La a-cristalina aumentó la supervivencia celular en un 20 % al preincubar los cultivos sometidos al efecto de ambos compuestos.
Conclusiones: el isoprostano 8-iso-PGF2a, además, de ser un marcador de daño oxidativo puede ser considerado un inductor directo de daño a las células del endotelio vascular, efecto mediado a través, de la generación de tromboxano A2 o la activación de su receptor. La proteína de estrés térmico a-cristalina, añadida de forma exógena, puede considerarse un protector endotelial.
Palabras clave: estrés oxidativo, isoprostano, endotelio vascular, tromboxano A2, a-cristalina.
ABSTRACT
Introduction: the vascular endothelium plays an essential role in processes associated with cardiovascular disease. There is a close relationship between redox imbalance in these cells and the appearance and evolution of such diseases. Increased isoprostane 8-iso PGF2 is among the markers of oxidative damage to membrane lipids in these patients.
Objective: evaluate the effect of isoprostane 8-iso PGF2 on cultured endothelial cells and the protection provided by -crystallin heat-shock stress protein.
Methods: endothelial cells from line H5V were cultured to evaluate the effect of isoprostane 8-iso PGF2 and thromboxane A2 analog U46619 on cell survival. An evaluation was conducted of the protective effect of -crystallin heat-shock stress protein by incubation of the cultures with 1 mg/ml of the protein prior to damage induction with the study compounds.
Results: cell survival decreased as isoprostane and U46619 concentration increased. -Crystallin increased cell survival by 20% upon preincubation of the cultures subjected to both compounds.
Conclusions: besides being an oxidative damage marker, isoprostane 8-iso PGF2 may be considered a direct inducer of damage to vascular endothelial cells. This effect is mediated by the generation of thromboxane A2 or the activation of its receptor. Added exogenously, -crystallin heat-shock stress protein may be considered to be an endothelial protector.
Key words: oxidative stress, isoprostane, vascular endothelium, thromboxane A2, -crystallin.
INTRODUCCIÓN
El endotelio vascular posee un importante papel en los procesos inflamatorios. Sus modificaciones constituyen un factor patogénico inicial de muchas enfermedades, cuya activación y disfunción conducen a procesos de inflamación vascular.
La generación de radicales libres del oxígeno y la activación de vías transcripcionales sensitivas a oxidantes, puede ser el mecanismo fisiopatológico común en el desarrollo de numerosas e importantes enfermedades vasculares. En situaciones de estrés oxidativo aumentado, como las que se observan en la hipercolesterolemia, el tabaquismo, y las infecciones e inflamaciones agudas o crónicas, se activan genes de respuesta a oxidantes y se sintetizan factores de crecimiento, citoquinas y moléculas de adhesión que aumentan la interacción entre las células endoteliales y los leucocitos, estimulan el crecimiento de las células musculares lisas vasculares y participan en procesos de inflamación vascular y su remodelamiento.1,2
Durante la aterogénesis aumenta la producción de Especies Reactivas del Oxígeno (ERO) y los productos derivados de su acción, como los productos de la peroxidación lipídica y, dentro de ellos, los isoprostanos.3,4 Los isoprostanos del grupo F2 son potentes vasoconstrictores5,6 y son utilizados como marcadores del estrés oxidativo en diferentes condiciones.7-10 Casi todos sus efectos biológicos están mediados por la generación secundaria del tromboxano A2 (TxA2)4,11 y se ha reportado que pueden utilizar diferentes receptores, tales como los de la prostaglandina F2 y el TxA2.4,12,13
El receptor del TxA2 (TP) y sus ligandos aumentan durante enfermedades vasculares y aterotrombóticas. Su activación estimula procesos de inflamación vascular y sistémica asociados a varias enfermedades,13,14 en respuesta a la acción de citoquinas proinflamatorias que incitan la síntesis de moléculas de adhesión.2,15 Los leucocitos y las células endoteliales activados liberan gran cantidad de ERO, mediadores del daño celular y en el endotelio producen activación de cascadas de señales que aumentan la expresión y activación de varias Proteínas de Estrés (Shock) Térmico, moduladores de la respuesta intracelular del citoesqueleto y otras estructuras celulares al estrés oxidativo.1,2,16
La protección al endotelio vascular constituye un pilar fundamental en la profilaxis y el tratamiento de los procesos que modifican el fisiologismo vascular. A pesar de los ensayos clínicos fallidos con antioxidantes, se busca nuevas alternativas de protección que incluyen la utilización de ligandos que interfieran directo con el proceso de muerte celular.
Las proteínas de estrés térmico son inducidas bajo situaciones de estrés y protegen las estructuras celulares de cambios irreversibles que afectan su funcionamiento.17. Existen evidencias de la implicación de las pequeñas proteínas de estrés térmico en la aterosclerosis, en la función de la célula endotelial y en la muerte celular.18,19
El objetivo del presente trabajo es evaluar el efecto del isoprostano 8-iso-PGF2α sobre células endoteliales en cultivo y la posible protección de la a-cristalina, proteína de estrés térmico de bajo peso molecular.
MÉTODOS
Cultivo celular
Se utilizó la línea celular endotelial H5V con medio de cultivo DMEM suplementado con suero fetal bovino (SFB) al 10 %.20 Los experimentos se realizaron en placas de cultivo de 96 pozos con el 70 % de confluencia celular. Se eliminó el SFB 24 horas antes de los estudios para detener la división celular y evitar el efecto del suero.
Diseño experimental
Inducción de daño con el isoprostano 8-iso-PGF2a y el análogo del TxA2, U46619
Las células en cultivo se trataron con el isoprostano 8-iso-PGF2a (Cayman Chemical) a las concentraciones de 0,1, 0,5 y 1 mM durante 12, 18 y 48 horas y con el compuesto U46619 (Cayman Chemical) a las concentraciones de 0,01, 0,1, 1,0 y 10 mM durante 18 horas. Posterior se retiró el medio de cultivo y se realizó el estudio de viabilidad o supervivencia celular.
Evaluación del efecto de la a-cristalina sobre las células en cultivo tratadas
La proteína a-cristalina se añadió a los cultivos a la concentración de 1 mg/ml, 2 horas antes a la adición del 8-iso-PGF 2a (0.5 mM) y el U46619 (1 mM). Las células fueron tratadas con los agentes inductores de daño, durante 18 horas y al finalizar este período se retiró el medio de cultivo y se realizó el estudio de viabilidad o supervivencia celular.
Estudio de viabilidad o supervivencia celular
Se estimó la supervivencia celular mediante el ensayo de reducción del [3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazolium bromide] (MTT, SIGMA). El método se basa en la actividad deshidrogenasa de las mitocondrias de las células vivas sobre esta sal, transformándola en otro compuesto que es cuantificado a través, de la determinación de su absorbancia. La cantidad del compuesto producido en el cultivo es solo proporcional a la cantidad de células vivas.21
Se calculó el porciento de supervivencia celular como:
Análisis estadístico
Cada experimento se realizó al menos tres veces, con cinco réplicas por condición experimental como mínimo. Se calculó la media, la desviación estándar y el error estándar de la media en cada condición experimental. Las diferencias entre las medias se establecieron mediante análisis de varianzas de una vía, seguido de la prueba de Tukey-Kramer. Se estableció el 95 % como valor de significación estadística.
RESULTADOS
Efecto del Isoprostano 8-iso-PGF2 a y el análogo del Tromboxano A2, U46619 sobre la supervivencia de las células endoteliales en cultivo
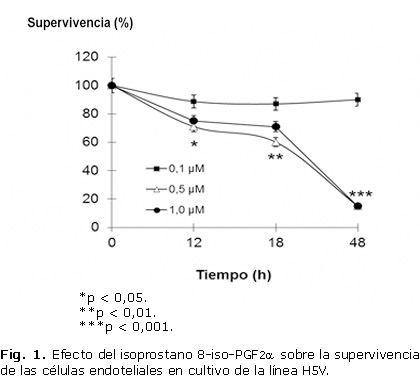
En la figura 1 se observa la disminución de la supervivencia celular con el aumento de la concentración y del tiempo de incubación del isoprostano 8-iso-PGF2α. La exposición de las células endoteliales a 0,1 mM de 8-iso-PGF2α no disminuyó (87 %), la supervivencia durante los tiempos del ensayo. Sin embargo, concentraciones mayores de 8-iso-PGF2α (0,5 mM y 1,0 mM) indujeron la muerte celular a partir de las 12 horas de exposición con un efecto máximo a las 48 horas.
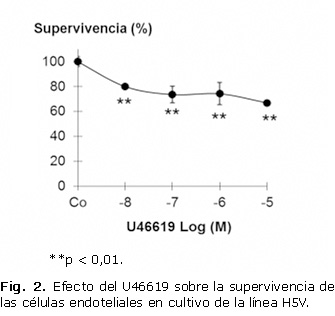
Debido a la disminución de la supervivencia celular provocada por el isoprostano 8-iso-PGF2α, unido a los reportes de su posible efecto a través, de la activación del receptor TP o la generación secundaria de TxA2, se decidió evaluar el efecto del compuesto U46619, análogo del TxA2, sobre las células endoteliales en cultivo con la utilización de concentraciones ascendentes de este compuesto y 18 horas de exposición.
En la figura 2 se observa que al incubar las células con el U46619, la supervivencia celular disminuyó alrededor de un 30 % a concentraciones entre 0,1 y 10 mM.
Efecto de la a -cristalina sobre las células en cultivo tratadas con isoprostano 8-iso-PGF2 a y el análogo del TxA2, U46619
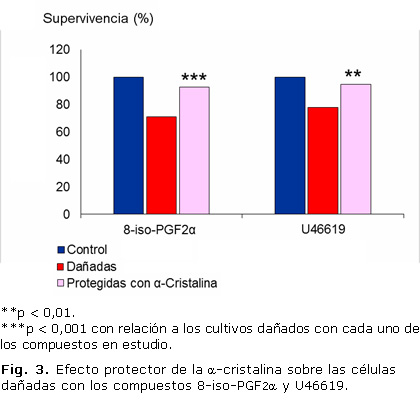
Para la realización de este estudio se seleccionó la concentración del 8-iso-PGF2α de 0,5 mM y del U46619 de 1 mM, y 18 horas de exposición. La selección se basó en la existencia de reportes bibliográficos de la utilización de similares concentraciones,12,14 además, de la disminución de la supervivencia celular de alrededor de un 30 % obtenida en nuestros estudios, lo que permite evaluar el posible efecto de moléculas protectoras.
La incubación de los cultivos celulares con la a-cristalina a la concentración de 1 mg/ml durante 2 horas, previo al tratamiento con el 8-iso-PGF 2α y el U46619, evidenció una protección de las células al daño inducido con estos compuestos. La a-cristalina atenuó la toxicidad inducida en un 20 % en ambos casos (Fig. 3).
DISCUSIÓN
El endotelio constituye un elemento fundamental en el control de la homeostasis vascular. Existen considerables evidencias que vinculan la disfunción endotelial con el estrés oxidativo vascular incrementado, además, de estar relacionada con eventos que ocurren en la diabetes mellitus, la hipertensión arterial y la aterosclerosis.2,8
Entre los eventos moleculares ocasionados por las ERO se encuentra la peroxidación lipídica y la formación de los isoprostanos, cuyos efectos biológicos han sido objeto de intensas investigaciones, los que están mediados por la síntesis de TxA2.5-7,11
Aunque se ha postulado la implicación de los isoprostanos en la muerte celular, hasta el momento, existen muy escasos estudios publicados acerca su citotoxicidad.22,23 Existen además, muy escasos reportes de la implicación del 8-iso-PGF2α en las modificaciones del endotelio vascular relacionadas con la aterosclerosis.
En el presente trabajo se apreció la disminución de la supervivencia celular de las células endoteliales en cultivo inducido por el isoprostano 8-iso-PGF2α. La adición del análogo del TxA2, U46619, también disminuyó la supervivencia celular en igual magnitud. Similares resultados son reportados por Brault y colaboradores, quienes describieron el efecto citotóxico del 8-iso-PGF 2α sobre cultivos primarios de células endoteliales de microvasos cerebrales, con efecto dependiente de la concentración y del tiempo de exposición. Además, de reportar relación del efecto del 8-iso-PGF2α con la generación de TxA2.11,22
Se reporta que las células endoteliales son más vulnerables a la acción del 8-iso-PGF2α que otras células vasculares y perivasculares, lo que podría ser debido al efecto diferente que produce el TxA2 en cada una de ellas.22
Se conoce que la vía del tromboxano está asociada con eventos tempranos de aterosclerosis relacionados con disfunción endotelial e hipertrofia vascular24 y que la activación del receptor TP, estimula mecanismos de inflamación a través, de la activación del factor nuclear de transcripción NF-kB, proceso reportado con el uso del compuesto análogo U46619.14
Benndorf y colaboradores demostraron que los isoprostanos inhiben la migración de las células endoteliales y la angiogénesis inducida por el VEGF, lo que se producen a través de la activación del receptor TP.4,13,25 Recién la utilización del isoprostano como marcador de ECV se ha tornado controversial. Se considera que aunque sea o no calificado un factor de riesgo independiente o un marcador predictivo de ECV, el hecho de encontrarse niveles elevados de este compuesto en estos pacientes, unido a los resultados mostrados en el presente trabajo y otros reportes de la literatura, los isoprostanos pueden ser causantes directos de disfunción endotelial.
Aunque el tratamiento con antioxidantes en la enfermedad aterosclerótica es muy controversial, se han desarrollado un gran número de investigaciones en la búsqueda de las posibilidades de tratamiento para la prevención y método de estas enfermedades.
En el presente trabajo se evidenció que la α-cristalina atenuó el efecto del 8-iso-PGF2α y el U46619 en alrededor de un 20 %. No se encontraron reportes en la literatura acerca de la protección o estabilización de la función de las células endoteliales por parte de la α-cristalina ante las modificaciones inducidas por prostanoides.
Se reporta que el 8-iso-PGF2α, a través, de la activación del receptor TP, estimula la entrada de calcio a la célula, lo que activa proteínas con función proteasa y fosfolipasa. Esta entrada de calcio desestabiliza la función de la mitocondria por de la ruptura del poro de transición de la permeabilidad mitocondrial, la disminución de la síntesis de Adenosín Trifosfato (ATP) y el aumento de la generación mitocondrial de ERO.22
Los mismos mecanismos que inducen muerte celular son capaces de expresar proteínas de estrés térmico, dentro de ellas la a-cristalina, lo que le confiere protección a la célula ante este daño.26 Se reporta que la exposición de células endoteliales ante determinados estímulos nocivos induce la expresión directa de la αB-cristalina.27
Es conocido que la αB-cristalina, bajo condiciones de estrés oxidativo, se transloca a la mitocondria donde interactúa con proteínas mitocondriales, dentro de ellas los canales aniónicos mitocondriales dependientes de voltaje que media el transporte de aniones, cationes, ATP, calcio y otros metabolitos entre la mitocondria y el citosol. El mecanismo protector de la αB-cristalina en la muerte celular inducida por ERO involucra, entre otros factores, la estabilización de la mitocondria.26,28 De esta forma podría inhibir los efectos que ocasiona sobre este organito el 8-iso-PGF2α y el U46619.
La α-cristalina posee, además, propiedades antioxidantes,29 efecto que pudiera estar involucrado en la protección de los cultivos, pues la activación del receptor TP promueve la generación de ERO a través, de la activación de la enzima Nicotinamina Adenina Dinucleótido Fosfato Reducido (NADPH) oxidasa.12 Sin embargo, en un estudio realizado en células endoteliales y musculares lisas vasculares en cultivo, se determinó que las ERO generadas a partir de la activación del receptor TP no participaban en el mecanismo de activación del NF-kB.14
Otra de las posibles hipótesis acerca del mecanismo de protección de la α-cristalina radica en el hecho de que esta proteína es capaz de realizar interacciones hidrofóbicas.30 De esta forma la pre-incubación con la α-cristalina podría producir interacciones con la membrana celular, produce el apantallamiento de los receptores TP y disminuir la acción del 8-iso-PGF2α y el U46619. Por otro lado, también podrían existir uniones entre las moléculas de α-cristalina y de estos compuestos al ser estos de estructura lipídica.
Este trabajo abre una nueva línea en el estudio de las causas y mecanismos de la disfunción endotelial y sugiere una fuente potencial de su prevención.
REFERENCIAS BIBLIOGRÁFICAS
1. Mudau M, Genis A, Lochner A, Trijdom HS. Endothelial dysfunction: the early predictor of atherosclerosis. Cardiovasc J Afr. 2012;23:222-31.
2. Thomas SR, Witting PK, Drummond GR. Redox Control of Endothelial Function and Dysfunction: molecular mechanisms and therapeutic opportunities. Antioxid. Redox Signal. 2008;10:1710-65.
3. Zhang ZJ. Systematic review on the association between F2-isoprostanes and cardiovascular disease. Ann Clin Biochem. 2013;50:108-14.
4. Niki E. Biomarkers of lipid peroxidation in clinical material. Biochim Biophys Acta . 2014;1840:809-17.
5. Von Harsdorf R, Li PF, Dietz R. Signaling pathways in reactive oxygen species-induced cardiomyocyte apoptosis. Circulation. 1999;99:2934-41.
6. Kromer BM, Tippins JR. Coronary artery constriction by the isoprostane 8-epi-PG2a. Br J Pharmacol. 1996;119:1276-80.
7. Hoffman SW, Moore S, Ellis EF. Isoprostanes: free radical-generated prostaglandins with constrictor effects on cerebral arterioles. Stroke. 1997;28:844-9.
8. Milatovic D, Montine TJ, Aschner M. Measurement of Isoprostanes as Markers of Oxidative Stress. Methods Mol Biol. 2011;758:195-204.
9. lyasova D, Spasojevic I, Base K. Urinary F2-isoprostanes as a biomarker of reduced risk of type 2 diabetes. Diabetes Care. 2012;35:173-4.
10. Galano JM, Mas E, Barden A, Mori TA, Signorini C. Isoprostanes and neuroprostanes: total synthesis, biological activity and biomarkers of oxidative stress in humans. Prostaglandins Other Lipid Mediat. 2013;107:95-102.
11. Benndorf R, Schwedhelm E, Gnann A. Isoprostanes inhibit vascular endothelial growth factor induced endothelial cell migration, tube formation, and cardiac vessel sprouting in vitro, as well as angiogenesis in vivo via activation of the thromboxane A(2) receptor: a potential link between oxidative stress and impaired angiogenesis. Circ Res. 2008;103:1037-46.
12. Muzaffar S1, Shukla N, Massey Y, Angelini GD, Jeremy JY. NADPH oxidase 1 mediates upregulation of thromboxane A2 synthase in human vascular smooth muscle cells: inhibition with iloprost. Eur J Pharmacol . 2011;658:187-92.
13. Miao Zhang, Ping Song, Jian Xu, Ming-Hui Zou. Activation of NAD(P)H oxidases by thromboxane A2 receptor uncouples endothelial nitric oxide synthase. Arterioscler Thromb Vasc Biol. 2011;31:125–32.
14. Hausermann L, St-Louis J. Thromboxane and isoprostane share the same prostanoid receptors to increase human placental tone. Placenta. 2011;32:941-8.
15. He J, Zhou Y, Xing J, Wang Q, Zhu H, Zhu Y, et al. Liver kinase B1 is required for thromboxane receptor-dependent nuclear factor-κB activation and inflammatory responses. A rterioscler Thromb Vasc Biol. 2013;33:1297-305.
16. Poredos P, Jezovnik MK. Testing endothelial function and its clinical relevance. J Atheroscler Throm. 2013;20:1-8.
17. Vita JA. Endothelial Function. Circulation. 2011;124:e906-e912.
18. Derham BK, Harding JJ. a-Crystallin as a Molecular Chaperone. Prog Ret Eye Res. 1999;18:463-509.
19. Basha E, O’Neill H, Vierling E. Small heat shock proteins and α-crystallins: dynamic proteins with flexible functions. Trends Biochem Sci. 2012;37:106-17.
20. Xu Q, Metzler B, Jahangiri M, Mandal K. Molecular chaperones and heat shock proteins in atherosclerosis. Am J Physiol Heart Circ Physiol . 2012;302:H506-14.
21. Garlanda C, Parravicini C, Sironi M, De Rossi M, Wainstok de Calmanovici R. Progressive growth in immunodeficient mice and host cell recruitment by mouse endothelial cells transformed by polyoma middle-sized T antigen: implications for the pathogenesis of opportunistic vascular tumors. Proc Natl Acad Sci USA. 1994;91:7291-5.
22. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Imm Meth. 1986;89:271-7.
23. Brault S, Martinez-Bermudez AK, Marrache AM, Gobeil F Jr, Hou X, Beauchamp M, et al. Selective neuromicrovascular endothelial cell death by 8-Iso-prostaglandin F2alpha: possible role in ischemic brain injury. Stroke. 2003;34:776-82.
24. Basu S. F2-isoprostanes in human health and diseases: from molecular mechanisms to clinical implications. Antioxid Redox Signal. 2008;10:1405–34.
25. Petri MH,Tellier C, Michiels C, Ellertsen I, Dogné JM, Bäck M, et al. Effects of the dual TP receptor antagonist and thromboxane synthase inhibitor EV-077 on human endothelial and vascular smooth muscle cells. Biochem Biophys Res Commun . 2013;441:393-8.
26. Chis R, Sharma P, Bousette N, Miyake T, Wilson A, Backx PH, et al. α-Crystallin B prevents apoptosis after H2O2 exposure in mouse neonatal cardiomyocytes. Am J Physiol Heart Circ Physiol. 2012;303:H967–H978.
27. Golenhofen N, Ness W, Wawrousek EF, Drenckhahn D. Expression and induction of the stress protein alpha-Bcrystallin in vascular endothelial cells. Histochem Cell Biol. 2002;117:203–9.
28. McGreal RS, Kantorow WL, Chauss DC, Wei J, Brennan LA, Kantorow M, et al. αB-Crystallin/sHSP Protects Cytochrome c and Mitochondrial Function Against Oxidative Stress in Lens and Retinal Cells. Biochim Biophys Acta. 2012;1820:921-30.
29. Ahmad MF, Singh D, Taiyab A, Ramakrishna T, Raman B, Rao CM. Selective Cu2+ binding, redox silencing, and cytoprotective effects of the small heat shock proteins αA- and αB-Crystallin. J Mol Biol. 2008;382:812-24.
30. Cobb BA, Petrash JM. Characterization of alpha-crystallin plasma membrane binding. J Biol Chem. 2000;275:6664-72.
Recibido: 15 de febrero de 2015.
Aprobado: 18 de marzo de 2015.
Nayade Pereira Roche. Centro Nacional de Genética Médica. Universidad de Ciencias Médicas de La Habana. 31 y 146, No. 3102. Playa. La Habana, Cuba.