My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
Print version ISSN 0864-0300On-line version ISSN 1561-3011
Rev Cubana Invest Bioméd vol.34 no.3 Ciudad de la Habana July.-Sept. 2015
Rev Cubana de Investigaciones Biomédicas. 2015;34(3)
ARTÍCULO ORIGINAL
Nuevos materiales para mejorar los niveles de corrosión
New materials for reduction of corrosion levels
Ing. Mauricio Plaza Torres, Ing. William Aperador
Universidad Militar Nueva Granada.
RESUMEN
Introducción: dos millones de personas en todo el mundo sufren de artritis o traumatismos causados por accidentes y están sometidos a remplazos de cadera y rodilla. El grupo de investigación VOLTA (nombres inspirado en el Físico Italiano Alexander Volta) de la Universidad Militar Nueva Granada ha enfocado sus esfuerzos y propuso un nuevo recubrimiento para el implante.
Objetivos: identificar un nuevo material que puede ayudar a reducir el desgaste de los implante y evitar la reacción biológica adversa con los tejidos.
Métodos: los nuevos materiales que se propusieron por el grupo VOLTA están basados en átomos de titanio y aluminio para reemplazar materiales de implantes, utilizados en las cirugías actuales. Este material ha sido probado para determinar la compatibilidad biológica y resistencia a la corrosión. El nuevo material de recubrimiento propuesto, produce una barrera cinética que impide, real, reacciones de corrosión.
Resultados: la primera prueba necesaria para caracterizar el material de revestimiento fue la prueba de dureza. Otro experimento adicional para obtener información sobre el material de recubrimiento metálico fue la prueba Rockwell, bajo la norma ASTM E18. La información obtenida es la resistencia a tracción, resistencia a desgaste y ductilidad del material de recubrimiento. La prueba se realizó en un diámetro en el cual se considera no destructiva.
Conclusiones: el grupo de investigación VOLTA realizó pruebas en prótesis de rodilla, usó el nuevo material recomendado para mejora la vida útil del dispositivo y mejorar la compatibilidad.
Palabras clave: biomateriales, prótesis, recubrimientos, reemplazo de cadera, reemplazo de rodillas.
ABSTRACT
Introduction: two million people worldwide suffer from arthritis or accident traumas and they are subjected to hip and knee replacements. The research group VOLTA (named after the Italian physicist Alexander Volta) of the Military University Nueva Granada has focused their efforts to submit a new coating for implants.
Objectives: to identify a new material thata may help to reduce the implant wear and to avoid adverse biological reactions with the tissues.
Methods: the new materials that the VOLTA group suggests are based on Titanium and Aluminum atoms to replace the implant materials used in present surgery. This material has been tested to determine the biological compatibility and the corrosion resistance. The suggested coating material produces a kinetic barrier that prevents real corrosion reactions.
Results: the first test to characterize the coating material was the hardness test. An additional experiment was Rockwell's test under the ASTM E18 standard to obtain information about the metallic coating material. The resulting data include traction resistance, wear resistance and malleability of the coating material. The test was performed within a diameter that was not considered as destructive.
Conclusions: the research group VOLTA performed testing on knee prosthesis and used the new recommended material for extending the device's lifetime and improving compatibility.
Keywords: biomaterials, prosthesis, coatings, hip replacement, knee replacement.
INTRODUCCIÓN
La artritis es una de las enfermedades más comunes relacionadas con la edad. La causa de esta enfermedad sigue desconocida. Otra razón adicional, que genera esta problemática, es el contexto reciente del terrorismo global y el trauma provocado por accidentes. El Nylon, teflón, silicona, acero inoxidable y titanio fueron algunos de los materiales utilizados después de la Segunda Guerra Mundial para aplicaciones médicas.
El uso de nuevos equipos, nuevos protocolos, mejores herramientas de diagnóstico y los nuevos conocimientos sobre los materiales utilizados en la ortopedia, han sido de mucha utilidad para fabricar los actuales bioimplantes. El primer requisito para la elección biomaterial, fue su aceptabilidad por el cuerpo humano. El material no debe causar ningún efecto como la alergia, la inflamación o toxicidad. Los Biomateriales seleccionados para la prótesis, deben tener una resistencia mecánica suficiente para responder, adecuado, a las fuerzas a que están sometidos durante la marcha, los procesos de corrosión y las características de desgaste. En las exigencias actuales debe permanecer en buen estado durante períodos más largos (15 a 20 años para las personas más jóvenes).
Este artículo aborda las razones que conducen a la corrosión de bioimplantes en el entorno biológico. El comportamiento de la corrosión en superficies con recubrimiento TiAlN podría evitar en alto grado, la corrosión mediante técnicas de revestimiento apropiadas. La degradación gradual de materias por ataque electroquímico es de gran preocupación, en particular, cuando un implante metálico se coloca en el ambiente hostil dentro del cuerpo humano con sustancias que incluyen sangre, agua, sodio, cloro, proteínas, plasma o amino ácidos.1
Dentro de los elementos que reducen la vida útil de la prótesis están las proteínas. Estos elementos en la superficie del material de revestimiento reducen la difusión de oxígeno y causa corrosión. El hidrógeno es un inhibidor de la corrosión, sin embargo, las bacterias absorben el hidrógeno en el implante, aumentando el nivel del corrosión y deteriora material. Otro factor adicional es el pH, su valor en el cuerpo humano está cercano de 7,0, pero este valor cambia por el desequilibrio en el sistema biológico debido a enfermedades o infecciones, es un factor adicional que contribuye a la corrosión.
Las formas más comunes de corrosión que se producen son:
· La corrosión uniforme.
· La corrosión intergranular.
· La corrosión galvánica.
· Agrietamiento por corrosión bajo tensión, picaduras y fatiga.
El costo a nivel mundial de articulaciones artificiales en la actualidad, está alrededor de € 14 mil millones al año. La artroplastia total de rodilla representa una de las intervenciones quirúrgicas más comunes, mejora la calidad de vida a los pacientes que tienen problemas de movilidad y dolor articular. Adicional al creciente número de operaciones de rodilla, está el aumento creciente del número de procedimientos de revisión.
Estos factores exigen implantes de mayor duración y una reducción en las tasas de fracaso. La vida útil de los remplazos articulares está enfocado en hacer un gran avance en el desarrollo de biomateriales para mejorar el desgaste y la corrosión mediante el uso de nuevos materiales como la película propuesta de nitruro de aluminio titanio (TiAlN). Este material ofrece la posibilidad de obtener una alta resistencia al desgaste y poco porcentaje de partículas liberadas para reducir las reacciones tisulares.
El reemplazo de la articulación es un gran reto de ingeniería por la selección del material que debe cumplir con los requisitos de biocompatibilidad, especificación mecánica y propiedades tribológicas. Por esta razón, nuevas investigaciones en esta área son importantes para obtener nuevos materiales que cumplan con estos requisitos.1
El reemplazo total de rodilla es el mayor reto biomecánico de la ingeniería, desde el punto de vista de la ciencia materiales. La selección del material para reemplazo de rodilla no es sencillo. Las propiedades mecánicas como elasticidad, dureza y ductilidad, así como las características tribilogical, de baja fricción, bajo desgaste, biocompatilibilty y resistencia a la corrosión, son algunos de los aspectos que deben ser considerados.2
La opción más común para el reemplazo de rodilla por lo general, incluyen aleaciones metálicas (acero inoxidable, de CoCr y TI), (Al2O3 cerámica, ZrO2), polyetileno de peso molecular ultra-alto (UHMWPE), alúmina (Al2O3) o zirconia (ZrO2).
Esta prótesis se debe reemplazar después de 10 años de uso. El paciente debe someterse a una cirugía de rodilla para su cambio, lo que implica la necesidad de tener prótesis de larga duración. El Desgaste de las prótesis está relacionada de partículas de desechos. Estos residuos producen proceso inflamatorio, pérdida del material de recubrimiento y problemas de asepsia.
El primer requisito que se revisa es la biocompatibilidad del material sugerido. La Biotribología es la ciencia de la tribología aplicada al sistema biológico funcional como reemplazo de articulaciones sinoviales. Para mejorar la vida útil de una prótesis, es necesario un estudio profundo en el proceso de desgaste para reducir las partículas dañinas liberadas y como resultado, el reducir los problemas de asepsia. El grupo VOLTA tiene en la actualidad una amplia gama de equipos de laboratorio y procedimientos de prueba y medición para el estudio de la mecánica de desgaste en el reemplazo total de rodilla. Estos equipos permiten la revisión de los sistemas que simulan la función de la articulación de la rodilla humana.
La investigación del grupo VOLTA está relacionada con nuevos materiales para mejorar la resistencia al desgaste y minimizar la generación de desechos, mejorar la vida útil de la prótesis, es el objetivo de la presente investigación. El recubrimiento de los implantes con una película de material sugerido, puede proporcionar un bajo desgaste y como resultado reacción biológica adversas bajas. El recubrimiento Titanio nitruro de aluminio (TiAlN) ha sido probado en la actual investigación con varios procedimiento para determinar las propiedades mecánicas, biocompatibilidad y propiedades tribológicas. El resultado de la investigación actual es que el recubrimiento satisface las necesidades exigidas para los materiales en las prótesis.
Otro material utilizado en prótesis de cadera y rodilla son elementos cerámicos. La cerámica ha sido utilizada en prótesis hace varios años. La cerámica en una excelente alternativa para reducir el desgaste a largo plazo. Se usa cerámica sobre cerámica y cerámica sobre plástico en las prótesis de cadera y rodilla. La cerámica la utilizan como una superficie de articulación de reemplazo de rodilla pero a pesar de que la cerámica es un material muy fuerte, resistente al desgaste, es susceptible a rotura.
El polietileno es el material entre metales utilizado en reemplazo de rodilla. Existen nuevas técnicas en la fabricación del plástico, mejora la resistencia a largo plazo y durabilidad del material, reduce las partículas de desgaste al mínimo.
MÉTODOS
Los nuevos materiales que se propusieron por el grupo VOLTA se basaron en átomos de titanio y aluminio para reemplazar materiales de implantes, utilizados en las cirugías actuales. Este material fue probado para determinar la compatibilidad biológica y resistencia a la corrosión. 4
Una factor que determinó la corrosión del implante son las fuerzas termodinámicas que causan la corrosión por oxidación o reducción. Otras causas que producen corrosión en el material y que aceleran los procesos es el desgaste por rozamiento, que conduce a tribocorrosión. El nuevo material de recubrimiento propuesto, logró producir una barrera cinética que impide reacciones de corrosión.
El material de recubrimiento propuesto fue sometido a pruebas de resistencia a la corrosión, según la especificación estándar ASTM:
· ASTM G 61-86, ASTM G 5-94, desempeño a corrosión de biomateriales metálicos.
· ASTM G71-81, corrosión galvánica en presencia de electrolitos.
· ASTM F746-87, corrosión en picaduras o grieta de materiales para implantes quirúrgicos metálicos.
· ASTM F2129-01, medidas de ciclos de polarización potenciodinámica.
Prueba de desgaste
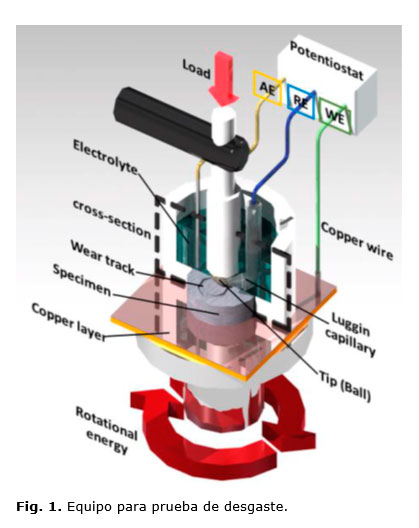
Una de las pruebas realizadas por grupo VOLTA es la prueba de desgaste de rodilla, se siguió el estándar ISO 14243-3 ISO 14243-1 ISO (The International Organization for Standardization), con la finalidad de medir el desgaste entre la prótesis tibial y femoral. La figura 1 es la imagen del equipo de prueba, utilizado para medir el desgaste entre los dos componentes; una de las partes representa la unidad fémur y la otra representa la unidad tibial.
El estándar ISO 14243 (Implantes para cirugía - Desgaste de las prótesis totales de rodilla) e ISO 14243-1 (Hueso y reemplazos articulares) fueron consultados por el grupo VOLTA para ajustar las unidades de carga y desplazamiento a los parámetros de la máquina de ensayos de desgaste con control de carga y condiciones ambientales similares al cuerpo humano. El protocolo utilizó este estándar para diseñar los métodos de medición y pruebas
El estándar ISO 14243 especificaba el movimiento angular relativo de flexión / extensión entre los componentes de la articulación: el patrón de la fuerza aplicada, la velocidad y la duración de la prueba, la configuración de la muestra y el entorno ambiental, para ser utilizado en la prueba de desgaste de las prótesis totales de articulación de la rodilla y aplicado en la máquina de desgaste diseñada por el grupo VOLTA para las pruebas con control de carga.
El diseño de la unidad por el grupo VOLTA simulaba la fuerza axial (pequeño desplazamiento), flexión y extensión (gran movimiento) y rotación (rotación pequeña). Con estos movimientos, la simulación estaba muy cerca de los movimientos de la rodilla humana. Las pruebas de desgaste pudieron caracterizar las propiedades tribológicas de la prótesis que simula la cinemática y la cinética. La prueba simularon las fuerzas y desplazamientos de la marcha, utilizando la norma ISO 14243-1 (control de carga) o ISO 14243-3 (control de desplazamiento).
La prueba incluyó una carga específica en el recorrido tibial, utilizando la norma ASTM F1800 (Práctica estándar para ensayos de fatiga cíclica de prótesis tibiales de componentes articulares de reemplazo total de rodilla) y la ISO 14879 (Determinación de las propiedades de resistencia de componentes de prótesis tibiales de rodilla). La norma específica la ejecución de 10 millones ciclos bajo una carga de 900N.
Los otros componentes, como el polietileno de ultra alto peso molecular, también fueron probados bajo diferentes cargas. El polietileno de ultra alto peso molecular (UHMWPE, UHMW) es un polietileno termoplástico. Para aplicaciones médicas UHMWPE es inodoro, insípido, no tóxico, alto resistente a productos químicos corrosivos, excepto ácidos oxidantes, de extremada baja absorción de humedad, muy bajo coeficiente de fricción, autolubricantes y resistente a la abrasión, en algunos casos es 15 veces más resistente a la abrasión que el acero al carbono. Su coeficiente de fricción es bajo, menor que la de nylon y es comparable a la de politetrafluoroetileno (PTFE, teflón), pero UHMWPE tiene mejor resistencia a la abrasión que el PTFE.
Para los implantes femoral y tibial también se probó el desgaste. Las propiedades de desgaste de prótesis de rodilla están influenciado por la magnitud de la presión de contacto y la distribución de la superficie de la presión de contacto. El área y la presión aplicada en la prótesis fueron similares a la dinámica de la rodilla humana. Los implantes femorales fueron evaluados para determinar las propiedades de fatiga por compresión del implante y de flexión mediante pruebas de 10 millones de ciclos. Adicional, el rango de movimiento propuesto para la prótesis de rodilla fue fundamental para las pruebas. El equipo de ensayo permitió simular los movimientos de rotación y traslación (flexión/extensión, interna/externa, medial/lateral, anterior/posterior) de acuerdo con el estándar ASTM F1223.
Con el uso del protocolo de prueba ASTM F1044, ASTM F1147, ASTM F1160 y ASTM F1978 para las pruebas de porosidad en la parte mecánica y ASTM F1854 sobre el procedimiento metalúrgico, se encontró algunos resultados como la composición química, microestructura, prueba de Gran, el espesor del recubrimiento, resistencia superficial, porosidad y profundidad/tamaño de los poros, para encontrar el daño ocasionado a la prótesis por uso y reacción química. Las pruebas de recubrimiento de porosidad mecánica y metalúrgica, incluyeron la abrasión, tensión dinámica, corte y flexión, con las normas ASTM F1044, ASTM F1147, ASTM F1160 y ASTM F1978, con lo que pudimos determinar el espesor del recubrimiento, rugosidad de la superficie de revestimiento y el nivel de porosidad. Antes de la prueba, la preparación de muestras incluye el corte, montaje, pulido y grabado.
La herramienta utilizada para la evaluación de revestimiento fue el equipo SEM (Scanning Electron Microscopy) con capacidad de alta magnificación para llevar a cabo evaluación de microestructura granular y evaluar el impacto y defectos en los materiales e impurezas, formaciones mecánicas, estrés, desgaste y la corrosión.
Para la evaluación metalúrgica macroscópica, el laboratorio realizó pruebas a baja magnificación, utilizando la fotografía digital y el análisis de procesamiento de imágenes.
El equipo SEM ofrece una alta resolución, para las imágenes no destructivas del recubrimiento en evaluación. El SEM utiliza rayos de electrones de alta energía para proporcionar imágenes ampliadas. La imagen se monopoliza para analizar la superficie del material de revestimiento y la presencia de material corrosivo.
Posterior, la prueba para el material de revestimiento hecha en el SEM se manipuló para la caracterización de partículas. La prueba ayudó a determinar el número, el tamaño y la morfología de las partículas pequeñas que permitieron comprender las propiedades de desgaste del material de revestimiento. La prueba adicional realizada por el grupo VOLTA fue el ensayo de tracción. El equipo para ensayo de tracción realizó cargas hasta de 60,000 libras, para predecir fallas por tracción en el material de revestimiento. La prueba se basa en la norma ASTM E8.
RESULTADOS
La primera prueba necesaria para caracterizar el material de revestimiento fue la prueba de dureza. Esta prueba de desgaste es conocida como pin-on-disk. Se usó para la caracterización del material de revestimiento, y para determinar las características mecánicas del metal y material de recubrimiento. La unidad que se utiliza para este propósito es calibrada bajo la norma ISO 17025.
Otro experimento adicional para obtener información sobre el material de recubrimiento metálico es la prueba Rockwell, bajo la norma ASTM E18. La información obtenida fue la resistencia a tracción, resistencia a desgaste y ductilidad del material de recubrimiento. La prueba se realizó en un diámetro en el cual se considera no destructiva. Aunque en la presente investigación no se realiza la prueba de dureza Brinell se puede tomar en cuenta, pero se debe tener presente que la prueba es destructiva. Adicional a la prueba Rockwell, no es necesario realizar la prueba de microdureza de acuerdo con la norma ASTM E384. La prueba de Vickers y Knoop no es necesario porque el tamaño de la muestra no es demasiado pequeño.
Para material no metálico del inserto, y porque es un material plástico, el grupo VOLTA usó el durómetro para realizar una prueba de dureza del inserto. Para este material se realizó ensayo de fatiga en un plano axial, torsión con ciclos de alto estrés, corte, doblado y prueba de rotación. La carga a realizar fue de 60,000 libras a una frecuencia de 60 ciclos.
Como resultado de la prueba de desgaste, el nivel de corrosión se pudo determinar en los implantes biomédicos. El desgaste acelera la corrosión en el material biomédico, por este motivo, parte de la prueba de desgaste fue el comportamiento a la corrosión del material de recubrimiento y los resultados de la corrosión y el desgaste simultáneos (Fig. 2).
La disolución del metal con forme avanza la corrosión daría lugar a la erosión y al final, la fractura del implante. Una vez el material se fractura, la corrosión se acelera, debido a la superficie expuesta y la pérdida de la capa protectora. El fragmento de metal debe ser extraído o como resultado se genera inflamación en los tejidos.5 La corrosión en algunos biomaterial metálicos puede producir daños severos en los tejidos y posibles efectos dañinos colaterales a largo plazo. Por ejemplo corrosión en níquel puede conducir a dermatitis, corrosión en cobalto puede producir anemia, y corrosión en cromo puede producir úlceras. Otro material puede generar más de un problema, como el aluminio que puede contribuir a la enfermedad de Alzheimer o el vanadio que es elemento conocidamente tóxico dentro del cuerpo humano.
La corrosión en biomateriales con aleación de cromo-cobalto (cobalto, cromo, níquel y molibdeno) libera toxinas en el cuerpo y conduce a la formación de tumores cancerosos. Por lo tanto hay una necesidad de desarrollar nuevos y materiales más seguros que tengan alta resistencia a la corrosión.
Los implantes quirúrgicos comunes utilizados son hechos de uno de los tres siguientes tipos de materiales: acero inoxidable, aleación de cobalto-cromo o titanio. El acero inoxidable 316L, es el material de implante más usual, utilizado, ya que es de bajo costo y recomendado por la norma ASTM por su baja presencia de carbono. Estos materiales tienen baja generación de carburo de cromo que son los elementos que producen corrosión intergranular. El carbono hace que acero inoxidable aumente su resistencia a la corrosión por acción de la solución salina fisiológica, pero el acero inoxidable es susceptible a la corrosión por los iones cloruro, también bacterias aerobias y anaerobias, aumentando la posibilidad de daños por corrosión. Hay otros materiales que exhiben la actividad bacteriana baja. Los materiales son de oro, titanio, cobalto, vanadio, aluminio, cromo y hierro. El nuevo material propuesto ha sido probado para garantizar resistencia bacteriana.
Los materiales biomédicos que están sometidos a cargas cíclicas y altas tensiones en presencia de ambiente agresivo, fallan debido a la fatiga. El proceso de fatiga se acelera debido a la formación de partículas de desgaste. La mayor parte de daños encontrados en los implantes son corrosión de agrietamiento, picaduras, grietas, agrietamiento superficial intergranular, y estrés. El daño más importante a tratar en materiales biomédicos es la fatiga por corrosión.6
Actuales materiales biológicos
Aleaciones con base a cobalto tienen mejor resistencia mecánica, mayor módulo de elasticidad, alta resistencia a la abrasión y alta resistencia a la corrosión en comparación con la de acero inoxidable. La biocorrosión de esta aleación es uno de los principales problemas a tratar, ya que es mayor la liberación de iones metálicos que causa efectos adversos. Aleación de Co-Cr-Mo, se utiliza como prótesis en cabeza femoral de la articulación de cadera en unión con un polietileno de peso ultra-alto molecular (UHMWPE).7
Las aleaciones con base en titanio poseen alta resistencia, módulo elasticidad bajo, menor densidad y una buena combinación de mecánica y excelente resistencia a la corrosión. El alto módulo de elasticidad de las aleaciones convencionales, se ha traducido en un efecto de estrés alto en el recubrimiento y por consiguiente en el fracaso del implante. Estas aleaciones se utilizan como implantes para reemplazos de articulaciones, debido a su alta resistencia específica y la estabilidad química. Sin embargo, estos implantes, tales como articulaciones artificiales y placas óseas son propensos a sufrir daños debido en lo principal, a la fatiga del material.7
Aleaciones de magnesio son una mejor alternativa para los implantes temporales pero el comportamiento a la corrosión de magnesio en medio biológico y citotoxicidad de magnesio presente en el cuerpo humano es bastante alto.
Corrosión en implantes ortopédicos
La causa principal del fracaso de los implantes ortopédicos es el desgaste, que a su vez acelerar la corrosión del material. Por esta razón, materiales resistentes al desgaste como los elementos cerámicos, Co-Cr son los preferidos para fabricar prótesis ortopédica. En los implantes de cadera el Titanio (Ti) sólo se utiliza para hacer el componente femoral y el socket está hecho con elementos cerámicos duros. Ti con Paldio (Pd) presenta una alta resistencia a la corrosión, en un amplio intervalo de niveles de pH debido al enriquecimiento de paladio sobre la superficie.8
La naturaleza de los productos de corrosión que se liberan en el cuerpo del desgaste de prótesis ortopédicas es una preocupación para la salud de los pacientes. En la actualidad los investigadores del grupo VOLTA, trabajan en la mejora de las propiedades de los recubrimientos superficiales de aleaciones a base de titanio. Debido a esta preocupación, el grupo de investigación ha conseguido mejorar las propiedades de la superficies de biomateriales para reducir las fallas de los implantes debido a la lixiviación de iones producidas por el desgaste y la corrosión.9
Varios métodos de recubrimiento se utilizan en la actualidad. Algunas de las técnicas utilizadas son el tratamiento químico, implantación de iones de plasma, implantación iónica con fuente de plasma (PSII), láser fusión (LSM), aleación láser (LSA), nitración láser, la implantación iónica, la deposición física de vapor (PVD) y texturización de la superficie.
El grupo de investigación VOLTA utiliza técnicas convencionales, esto porque cada uno de los métodos usados también tiene alguna limitación. Recubrimiento de superficies con láser (LSE), es una de las técnicas empleadas en el área de los biomateriales que está crecimiento, ya que ofrece varias ventajas como la alta velocidad, baja el tiempo de procesamiento, fácil aplicación en diferentes y complejas geometrías, mayor adherencia entre el sustrato y la capa de revestimiento y, además, la composición de la superficie puede ser modificada sin ninguna dificultad en un corto tiempo.10
El método de recubrimiento usado en la presente investigación es el láser CO2, que se utiliza debido a la alta resistencia a la corrosión.11-13
Con el uso del Ti-6Al- 4V se demostró que este recubrimiento proporciona una protección significativa contra la corrosión electroquímica en un entorno biológico. Adicional a este proceso de revestimiento usa TiAlN para mejorar la vida útil y obtener un mejor resultado que los obtenidos hasta el momento.14-15
Como resultado de esta investigación se observa que la resistencia a la corrosión y desgaste por rozamiento de Ti, mejora considerable, las veces cuando se revisten con TiAlN.
Actuales y futuros desarrollos
El campo de la corrosión en implantes ortopédicos se enfrenta a muchos desafíos y todavía bastantes problemas por resolver. El hueso y el cartílago humanos son elementos naturales, esta investigación se centra en el desarrollo de materiales compuestos para aplicaciones de implantes que imiten las características que han creado la naturaleza.16
El grupo VOLTA está trabajando para entender el comportamiento de los materiales compuestos en el interior del cuerpo humano y el comportamiento de la absorción de los biofluido, porque no son claras en este momento las condiciones y comportamiento en los sistemas reales. Los elementos cerámicos son otra clase de materiales que tienen alta biocompatibilidad y resistencia a la corrosión. Son de mucha utilidad en la actualidad para reemplazo de cadera y hueso, pero tienen un alto módulo elástico y pueden fracturarse ya que poseen baja plasticidad. Los elementos como Alúmina y zirconio, son alternativas para reemplazos metálicos. No presentan corrosión y tienen alta resistencia al desgaste, pero presentan fallas mecánicas.
La corrosión biológica debe entenderse en el nivel atómico. Se adopta una única metodología para pruebas de resistencia a la corrosión desarrolladas con base a las normas ASTM. Esta Metodología debe ser uniforme para comparar los resultados de los diferentes grupos de trabajo en esta dirección. Debido a que la prueba no puede considerarse dentro del cuerpo humano, es necesario el desarrollo de un simulador con todas las características para medir la corrosión en las condiciones similares a su situación dentro del cuerpo humano, simula el funcionamiento de la rodilla para probar las propiedades tribológicas de los materiales. Los problemas adicionales que surgen por el uso de prótesis son los efectos adversos de los productos de corrosión. Se necesitan nuevas pruebas para evaluar las concentraciones reales de los metales que inducirán toxicidad y otros efectos adversos. Recubrimientos superficiales, que usan TiAlN, fueron desarrollados en la presente investigación para implantes biomédicos con el objetivo de mejorar la resistencia a la corrosión, resistencia al desgaste, textura superficial homogénea y la biocompatibilidad. Las superficies modificadas han sido probadas para determinar la resistencia ante la corrosión y además, para mejorar otras propiedades que son deseables.17
El entorno biológico incluye el movimiento y partículas atómicas de los implantes dentro del sistema humano. Los nuevos materiales se han estudiado con el fin de obtener los implantes por un período más largo en el sistema humano. Entendemos que el campo de la corrosión en los sistemas biológicos es un área de estudio donde se desconoce las interacciones fisiología y así la necesidad de trabajos de investigación en nuevos materiales.18
Pruebas adicionales para revestimiento con TiAlN
Valores de fricción y el desgaste de coeficiente de 0,69, bajo condición fisiológicas simuladas, fueron exploraradas mediante pruebas de pin-on-plate. Esta prueba tribológica simula la superficie de articulación de la prótesis de rodilla (tibial y el implante femoral) con recubrimiento TiAlN.
Para el proyecto se usó una muestra cilíndrica con recubrimiento de TiAlN y un pin que fueron pulidos con silicona hasta que se obtuvo una superficie tipo espejo. Ambos elementos fueron utilizados en la prueba tribilogical. El líquido utilizado era solución salina equilibrada de Hank (HSS) contenía 8g de NaCl, 1g de glucosa, 0,4 g de KCCL, 0,35 g de Na HCO3, 00,09g de NaHJPO4 y 0,06g de KH2Po. Se adicionó suero bovino fetal (FBS) diluido a 50 % para contener 18,5mg de proteína, de esta manera se simuló la concentración presente en el líquido sinovial.
El equipo probó la prótesis con un golpe constante sobre una superficie de 6mm y una frecuencia de 1 Hz. Este procedimiento simuló el movimiento de la articulación de la rodilla durante su recorrido. Esta prueba se realizó con más de 500,000 ciclos. Con este número de ciclo se puede simular el movimiento de una rodilla en distancia de 6 km y una carga normal de 45 N. El parámetro más importante que fue necesario registrar fue el coeficiente de fricción. Se utilizó un pin plano para asegurar que la tensión de contacto es de alrededor de 3,5 MPa. El valor es semejante condición de estrés de una rodilla.
El SEM se utilizó para caracterizar la microestructura y la evolución de desgaste.15 La tasa de desgaste fue calculada mediante el sistema de Microscopio de fuerza atómica (AFM), cuantificandose la pérdida de volumen. Con el material de revestimiento usado la rugosidad de la superficie fue de (RMS) = 70-130nm. El material presentó una menor rugosidad de la superficie que otros materiales, como materiales a base de diamante (RMS = 200-400nm).
La prueba en el SEM permitió analizar la presencia de los pico de fricción generados sobre material de revestimiento y los cambios abruptos en el pin en la prueba de recorrido plano (Fig. 3). El otro parámetro a tener en cuenta es la posible fractura de la película de revestimiento sobre carga usando 25 MPa. Eso podría ser crítico en casos de baja adherencia, generando roturas en el material. Por esta razón, el material debe inspeccionarse, con el empleo de métodos específicos de revestimiento, para garantizar la mejor adherencia. El uso de proteína en el fluido, aumenta el coeficiente de fricción, esto sucede porque la proteína absorbe el líquido libre de proteína y produce una capa húmeda estable. La proteína puede aumentar la rugosidad de la superficie sobre la parte metálica lisa.
Para la prueba tribológica, la superficie recubierta con TiAlN, encontró valores de 0,02-0,06 de coeficiente de fricción. Este coeficiente es el mejor compromiso entre la rugosidad superficial y la adhesión de material de recubrimientos duros. Baja fricción no implica un bajo desgaste. Eso sucede porque el alto coeficiente de fricción es inducida por la modificación de la superficie. La superficie lisa, es más expuesta a la proteína que la superficie rugosa, aumentando el coeficiente de fricción.
El desgaste sobre la placa es mayor que el desgaste del pin debido a la fatiga. Se encontró un coeficiente de desgaste de 10-9 mm-3 N-1 m-1, con el uso de la película de TiAlN. El metal sobre metal podemos encontrar coeficiente de 7,10 mm-3 N-1 m-1, para el UHMWPE en el metal es el mismo coeficiente de 10,7 mm-3 N-1 m-1, en cerámica sobre cerámica el coeficiente es inferior 10,8 mm-3 N-1 m-1. La investigación en nuevos materiales para implantes ortopédicos se centra en material de revestimiento similar a la nanoestructura de las moléculas de los huesos, que reducen el rechazo de la prótesis de rodilla.
CONSIDERACIONES FINALES
Las pruebas y verificación en nuevos diseños, nuevos materiales y nuevos procedimientos quirúrgicos son necesarios para garantizar la seguridad del paciente durante la vida útil de una prótesis.
El uso de metal sobre metal, nuevo productos de polietileno, juntas de plástico que articulan en metal, han sido utilizados en reemplazos de rodilla hace más de 30 años, pero fracasaron debido a una pobre técnica de fabricación y el uso de materiales inadecuados. El desarrollo de materiales resistente al desgaste permite que sean usados como recubrimiento de la superficie de articulación en un reemplazo de rodilla, en lugar del material tradicional que presentan inconvenientes mecánicos y de biocompatibilidad.
El grupo de investigación VOLTA realiza pruebas en prótesis de rodilla, usando un nuevo material recomendado para mejora la vida útil del dispositivo y mejorar la compatibilidad. El objetivo es identificar materiales superiores para aplicaciones médicas.
En los equipos de laboratorio se realizan prueba de desgaste, simulando el sistema real cuando dos materiales están en contacto y en movimiento. La investigación toma implantes médicos recubriendo con material nuevo y se extrae información crítica relativa a la tasa de desgaste, pérdida de masa y la generación de material adicional (cantidad, volumen, morfología). El equipo de prueba simula la cinemática de la marcha humana. Las máquinas de prueba diseñadas por el grupo de investigación VOLTA realizan pruebas fatiga, desgaste y durabilidad mediante simulación, administrando alta carga y movimientos precisos con el cumplimiento de las normas ASTM e ISO.
El nuevo material de ensayo de recubrimiento bajo prueba es titanio nitruro de aluminio, el material es usado para el inserto femoral y tibial. El resultado de la investigación sobre los reemplazos de articulaciones es un material novedoso para recubrir implantes para mejorar la calidad de vida del paciente y el tiempo de vida útil de la prótesis.
Apoyo financiero
Por la vicerrectoría de investigación (ING-1572 UMNG 2014).
REFERENCIAS BIBLIOGRÁFICAS
1. Aksakal B, Yildirim ÖS, Gul H. Metallurgical failure analysis of various implant materials used in orthopedic applications. J Fail Anal Prev. 2004;4(3):17-23.
2. Amel-Farzad H, Peivandi MT, Yusof-Sani SMR. In-body corrosion fatigue failure of a stainless steel orthopaedic implant with a rare collection of different damage mechanisms. Eng Fail Anal. 2007;14:1205-17.
3. Catlege SA, Fries MD, Vohra YK. Nanostructured ceramic for Biomedical Implants. J Nanosci Nanotech. 2002;2:1-20.
4. Congmin X, Yaoheng Z, Guangxu C, Wensheng Z. Corrosion and electrochemical behavior of 316L stainless steel in sulfate-reducing and iron-oxidizing bacteria solutions. Chin J Chem Eng. 2006;14(6):829-34.
5. Dearnley PA. A brief review of test methodologies for surface engineered biomedical implant alloys. Surf Coat Technol. 2005;98:483-90.
6. Dee KC, Puleo DA, Bizios R. An introduction to tissue-biomaterial interactions. New York: Wiley-Liss; 2002. p. 53-88.
7. Fontana MG. Corrosion Engineering. McGraw-Hill Science/Engineering/ Math; Sub edition: (November 1, 1985). 2006;3:1-20.
8. Geetha M, Singh AK, Asokamani R, Gogia AK. Ti based biomaterials, the ultimate choice for orthopaedic implants – A review. Prog Mater Sci. 2009;54:397-425.
9. Héctor AV. Manual of biocorrosion.1st ed. UK: CRC-Press; 1997. p. 1-8.
10. Jiang P, He XL, Li XX, Yu LG, Wang HM. Wear resistance of a laser surface alloyed Ti-6Al-4V alloy. Surf Coat Technol. 2000;130:24-32.
11. Jun K, Noriyuki H, Yosuke O. The corrosion/wear mechanisms of Ti-6Al-4V alloy for different scratching rates. Wear 2007;263:412-8.
12. Kamachi MU, Baldev R. Corrosion science and technology: mechanism, mitigation and monitoring. UK: Taylor & Francis; 2008. p. 283-356.
13. Karen Ng. Stress corrosion cracking in biomedical (metallic) implants Titanium-Nickel (TiNi) alloyInc ©; 2000-2004.
14. Long ZY, Mitsuo N, Toshikazu A, Hisao F, Hiroyuki T. Corrosion resistance and biocompatibility of Ti-Ta alloys for biomedical applications. Mater Sci Eng A. 2005;398:28-36.
15. Manivasagam G, Mudali UK, Asokamani R, Raj B. Corrosion and microstructural aspects of titanium and its alloys. Corrosion Rev. 2003;21:125-59.
16. Mudali KU, Sridhar TM, Raj B. Corrosion of bio implants. Sadhama. 2003;28(3-4):601-37.
17. Okazaki Y. Effect of friction on anodic polarization properties of metallic biomaterials. Biomaterials. 2002;23:2071-7.
18. Singh R, Narendra B. Dahotre. Corrosion degradation and prevention by surface modification of biometallic materials. J Mater Sci: Mater Med. 2007;18:725-51.
Recibido: 16 de abril de 2015.
Aprobado: 22 de mayo de 2015.
Mauricio Plaza Torres. Universidad Militar Nueva Granada.