Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.34 no.3 Ciudad de la Habana jul.-set. 2015
Rev Cubana de Investigaciones Biomédicas. 2015;34(3)
PRESENTACIÓN DE CASO
Progresión de plasmocitoma óseo a mieloma múltiple y reporte de un caso
Progression of plasmacytoma of bone to multiple mieloma and a case report
Dr. Hermes Moreno Ramírez,I Dr. Julio César Villaseñor Moreno,II Dra. Adriana Beatriz Vázquez Maldonado III
I Universidad “Pablo Guardádo Chávez”. Tuxtla Gutiérrez, Chiapas. México.
II Hospital Regional 1º de Octubre. Colonia Magdalena de las Salinas, DF. México.
III Hospital General de Zona No 29. Colonia Unidad San Juan de Aragón, DF. México.
RESUMEN
El plasmocitoma óseo solitario y el mieloma múltiple son dos gammapatías monoclonales que pertenecen al mismo grupo de alteraciones neoplásicas de células plasmáticas. En ocasiones el plasmocitoma precede al mieloma. La localización esternal de un plasmocitoma es excepcional. Se reporta el caso de una persona de sexo masculino de 75 años, con dolor moderado en la región dorsal acompañado de disnea de medianos esfuerzos. La tomografía reveló lesiones osteolíticas localizadas en el tercio inferior del esternón, con características radiológicas de un plasmocitoma óseo solitario, además se observan lesiones en la 5ta. costilla izquierda y escápulas. La biopsia de médula ósea evidenció una plasmocitosis medular del 45 % y la inmunoelectroforesis, una concentración de 4210 mg/dl de Inmunoglobulina G. Se hace el diagnóstico de mieloma múltiple y se analizan las alteraciones que lo hicieron evolucionar hasta ese punto con el fin de tener presente la posibilidad de la evolución a mieloma múltiple en aquellos pacientes con plasmocitoma óseo. Se expone el siguiente caso con el objetivo de mejorar la calidad de vida de los pacientes a través del diagnóstico oportuno del plasmocitoma óseo, logrando así evitar la evolución a mieloma múltiple, y resultar en una mayor supervivencia.
Palabras clave: plasmocitoma esternal, mieloma, tumor óseo osteolítico.
ABSTRACT
Solitary plasmacytoma of bone and multiple myeloma are two monoclonal gammapathies that belong to the same group of neoplastic alterations of plasma cells. The plasmacytoma occasionally precedes myeloma. The sternal location of plasmocytoma is rare. This is the case of a man aged 75 years, with moderate pain in the dorsal region and short of breath when making medium efforts. The axial tomography showed osteolytic lesions in the lower third of sternum with radiological characteristics of a solitary plasmocytoma of bone in addition to lesions in the 5th left rib and scapulas. The bone marrow biopsy revealed 45% medullary plasmocytosis whereas immunoelectrophoresis showed Ig G concentration of 4210 mg/dl. Multiple myeloma was diagnosed and an analysis was made on the alterations leading to this result, with the purpose of bearing in mind the possibility of progression to a multiple myeloma in those patients with plasmocytoma of bone. The following case was presented in order to improve the quality of life of patients through timely diagnosis of plasmocytoma of bone and to avoid progression to multiple myeloma, thus achieving higher survival rates.
Keywords: sterna plasmocytoma, myeloma, osteolytic bone tumor
INTRODUCCIÓN
El plasmocitoma óseo solitario (POS) es una neoplasia de células plasmáticas (CP) monclonales con una localización fija en el hueso. El POS representa menos del 5 % de los mielomas de células plasmáticas, y en general se presenta como lesiones óseas dolorosas; sin embargo puede no existir dolor y su descubrimiento puede ser incidental en radiografías realizadas con otros propósitos.1
El desarrollo de la alteración ósea, es consecuencia de un aumento en la resorción mediada por osteoclastos y una supresión de la de la mineralización por parte de los osteoblastos.2 Estas lesiones ocurren sólo en zonas adyacentes a la neoplasia, sugiere, que las células tumorales producen factores que estimulan a los osteoclastos e inhiben a los osteoblastos que se encuentran en la periferia del tumor.3 Los factores liberados por el proceso de la resorción ósea, también incrementan el crecimiento de las células tumorales, crea un círculo vicioso de expansión tumoral y destrucción ósea.4,5
En condiciones normales, la maduración de las CP secretoras de anticuerpos, es estimulada por la exposición al antígeno para que comience la proliferación de células productoras de un tipo específico de inmunoglobulina (Ig). No obstante, en los trastornos de dichas células, se pierde el control del proceso, y aún en ausencia de un antígeno, comienza a haber una multiplicación de CP productoras de una gran cantidad de anticuerpos o fragmentos de anticuerpos monoclonales, llamados componente M (m, de monoclonal). Para que este componente pueda ser detectado por medio de inmunoelectroforesis, debe haber una concentración mínima de 500 mg/dl en el plasma. En cerca del 20 % de los mielomas se producen, exclusivo, cadenas ligeras que casi siempre se excretan por la orina como proteínas de Bence Jones, aunque esta puede estar ausente.6
Las células de las neoplasias linfoides conservan con frecuencia el fenotipo de superficie propio de estadios previos de su proceso de diferenciación. Así las proteínas como CD38 y CD138 son expresadas en las superficies de las células del mieloma múltiple (MM) y sirven como marcadores tumorales. El principal valor que tiene la identificación del fenotipo de la superficie celular es que ayuda a hacer el diagnóstico diferencial, de los tumores linfoides que tienen aspecto semejante en el examen con el microscopio óptico.6
En el MM también existe una acumulación de CP anormales en la médula ósea, que provoca lesiones líticas y dolor de origen óseo.7 La diferencia entre el POS y el MM, es que el primero no presenta otra lesión radiológica probada y no presenta cambios disproteinémicos, ni proteinuria,8 así como ausencia de anemia, hipercalcemia o afectación renal.9,10 Histológicamente el POS es idéntico al MM.11
El plasmocitoma solitario esternal es infrecuente, representa el 1 % de las neoplasias óseas. Los plasmocitomas, rara vez son hallados en la pared torácica y su localización esternal es excepcional.12,13
La base del tratamiento del plasmocitoma solitario es la radioterapia. La remisión ocurre en el 90 % de los casos, sólo con el control local de la lesión. Se debe realizar un monitoreo que incluye controles de laboratorio trimestrales o semestrales y exámenes repetidos de médula ósea según lo indiquen los resultados de laboratorio.1
El tiempo promedio de evolución del POS es de 2-3 años, con una supervivencia media de 10 años.1 En cambio, en ausencia de tratamiento, el pronóstico de supervivencia para el MM es menor a 2 años. Los pacientes, eventual, fallecen debido a fallo renal, anemia severa, infecciones o complicaciones secundarias a problemas neurológicos.8,14 Evitar la evolución a mieloma múltiple, y resultar en un mayor supervivencia y mejor calidad de vida para el paciente, a través del diagnóstico y manejo oportuno del plasmocitoma óseo solitario.
CASO CLÍNICO
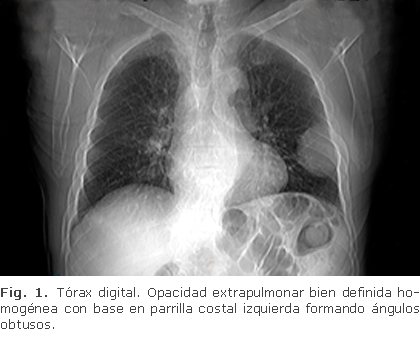
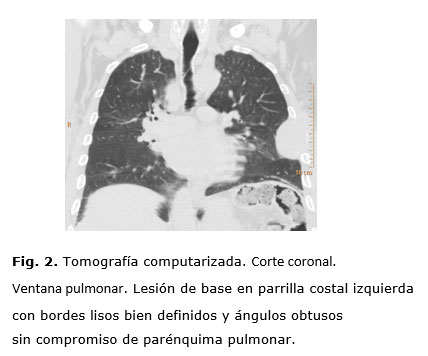
Paciente masculino de 75 años que inicia hace 6 semanas con dolor en la región dorsal, en hemitorax izquierdo de moderada intensidad, con irradiación hacia el tórax anterior, acompañado de disnea de medianos esfuerzos; con datos de insuficiencia renal aguda, deshidratación y síndrome de hiperviscosidad, anemia y EPOC sin tratamiento. Exfumador, comenzó a fumar desde los 17 años, consumió hasta 15 cigarrillos diarios, dejó de fumar hace 18 años. El examen físico revela una masa palpable, movible, no depresible, de consistencia semisólida en el tercio proximal de la 5ta. costilla; se ausculta murmullo vesicular disminuido. En la tomografía computarizada (TC) se evidencia una masa, que en su mayor parte ocupa el tercio proximal de la 5ta. costilla izquierda (Fig. 1 y 2), de dimensiones: 58.7 x 60 x 60 mm.
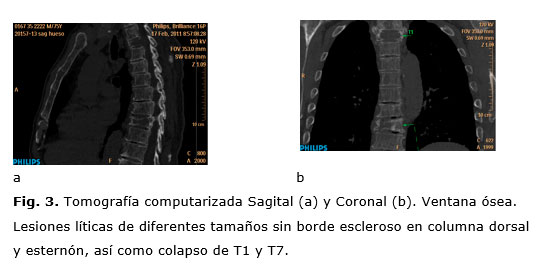
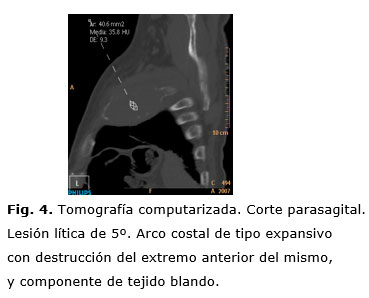
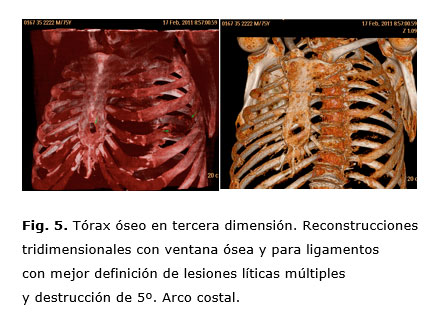
Se observan también diversas lesiones osteolíticas en costillas, escápulas y vértebras (Fig. 3), así como una lesión lítica circunscrita en el tercio inferior del esternón y una masa retroesternal (Fig. 4 y 5).
Se realizó aspiración de médula ósea, la cual se reporta con infiltración medular del 45 % por células plasmáticas anaplásicas, con celularidad incrementada ++, 2 megas por campo con la siguiente diferencial:
· Neutrófilos adultos 9 %.
· Neutrófilos jóvenes 6 %.
· Neutrófilos en banda 2 %.
· Linfocitos 1 %.
Se le realizó inmunofenotipo para mieloma múltiple: CD38 = 41,03 %, CD138 = 9,6 %. Inmunoelectroforesis de IgG 4210 mg/dl (rango normal 700 - 1800). Proteína de Bence Jones Negativa.
Los resultados de laboratorio reportaron:
· Viscosidad sérica 3,18.
· Hemoglobina 9,1 g/dl.
· Hematocrito 27.9 %.
· Volumen corpuscular medio 101.
· Leucocitos 5800.
· Neutrófilos 61 por campo.
· Linfocitos 26 %.
· Plaquetas 166000.
· Creatinina 2,34.
· Proteínas totales 13,6 g/dl.
· Globulina 11,4.
· DHL 263.
· Tiempo de protrombina (Tp) 18,7.
· Tiempo parcial de tromboplastina (TTp) 35,4.
· Tiempo de trombina (TT) 32 segundos.
· Depuración de creatinina 53 mg/dl.
· Viscosidad 3,18.
Se le inició manejo médico con hiperhidratación por insuficiencia renal aguda con la cual ingresó, furosemide 20 mg vía intravenosa cada 12 h, talidomida 100 mg vía oral cada 24 h, alopurinol 150 mg vía oral cada 24 h, bicarbonato 1 g vía oral cada 8 h, dexametasona 40 mg intravenosa cada 24 h; con respuesta favorable al tratamiento establecido con mejoría clínica y de los resultados de laboratorio por lo cual se decide su egreso del servicio y cita a consulta externa para su manejo.
DISCUSIÓN
Algunos autores coinciden con la idea de que el plasmocitoma solitario de hueso, es una etapa precoz en la evolución del Mieloma Múltiple, puede permanecer latente durante años.15 En la experiencia de Burt, hasta un 75 % de estos casos desarrollaron ulterior, un Mieloma Múltiple.16 Otros autores observan esta progresión en un 40 % de aproximado.17,18
En un estudio retrospectivo Bertanh y colaboradores19 encontraron que los pacientes que progresaron a MM, eran más jóvenes que aquellos quienes no lo eran; más de la mitad de los pacientes con POS no tratado progresaron a MM. La localización anatómica más afectada es la columna vertebral, y la mayoría de los pacientes eran hombres. El tiempo promedio de progresión a MM es alrededor de 41 meses.
La lesión esternal del paciente presentado, es indicativa de un plasmocitoma solitario, esto hace pensar en que dicho plasmocitoma evolucionó a la condición actual de MM. Más aún, cerca de 50 % de los casos el POS puede evolucionar y considerarse una variante clínica o estado inicial del MM.19
En un estudio publicado por Bataille y Sany,10 el 53 % de los pacientes con plasmocitoma progresan a MM, con un promedio de progresión de 31 meses. En algunos pacientes, la progresión ocurre 17 años después.20
Los resultados del tratamiento son mejores y el pronóstico es más favorable para POS que para MM.20 El 68,5 % de los casos de plasmocitoma logra una supervivencia mayor a 10 años.19 Este promedio de supervivencia es mejor que el encontrado en pacientes con MM, en quienes fueron administrados agentes alquilantes (promedio: 20 meses)22 o una combinación de fármacos antenioplásicos (promedio: 42 meses).10,23
CONSIDERACIONES FINALES
Cualquier médico que realice un hallazgo incidental de una lesión ósea circunscrita debería referir al paciente con un especialista, previene así, el avance del plasmocitoma solitario asintomático a mieloma múltiple sintomático. Una lesión osteolítica puede ser el único indicador, debido a que en el momento de la detección del plasmocitoma solitario no existe el componente M; la médula ósea no es compatible con mieloma múltiple, los datos de revisión del esqueleto de columna y pelvis son normales y no hay daño de órganos o tejidos, salvo la lesión solitaria del hueso. Esta detección temprana y su tratamiento mejoran el pronóstico del paciente.
En los pacientes con POS o plasmocitoma extramedulares cabe esperar que disfruten de una supervivencia prolongada, libre de enfermedad, después de una radioterapia local con unos 40 Grays (Gy). Debido a las características de la lesión osteolítica encontradas en el esternón, las cuales son indicadoras de plasmocitoma solitario (área circunscrita de destrucción ósea), hace pensar en que dicha lesión es primaria y con el transcurso del tiempo evolucionó a un mieloma múltiple. Consideramos que se debe tomar en cuenta la presencia de un plasmocitoma solitario como precursor del mieloma múltiple.
REFERENCIAS BIBLIOGRÁFICAS
1. Ross S. AM Report: Surprising pathology. Part 2. Internal Medicine. 2011 May [cited 2009 Sep 29] Available from: http://boards.medscape.com/forums?128@664.XPfWaeyk7Jd@.29f67b9d!comment=1&pa=14579269T1312682869064_13126828690641312682869068
2. Bataille R, Chappard D, Marcelli C. Recruitment of new osteoblasts and osteoclasts is the earliest critical event in the pathogenesis of human multiple myeloma. J Clin Invest. 1991;88(1):62–6.
3. Terpos E, Dimopoulos MA. Myeloma bone disease: pathophysiology and management. Ann Oncol. 2005;16(8):1223–31.
4. Abe M, Hiura K, Wilde J. Osteoclasts enhance myeloma cell growth and survival via cell–cell contact: a vicious cycle between bone destruction and myeloma expansion. Blood. 2004;104(8):2484–91.
5. Tanaka Y, Abe M, Hiasa M. Myeloma cell–osteoclast interaction enhances angiogenesis together with bone resorption: a role for vascular endothelial cell growth factor and osteopontin. Clin Cancer Res. 2007;13(3):816–23.
6. Anthony S, Braunwald E, Kasper D, Hauser S, Longo D, Jameson J, et al. Plasma cell disorders. Harrison´s principles of internal medicine, 17 th edition. McGraw-Hill; 2009. p. 689-701.
7. Kyle RA, Gertz MA, Witzig TE. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003;78(1):21–33.
8. Fassas A, Tricot G. Results of high-dose treatment with autologous stem cell support in patients with multiple myeloma. Semin Hematol. 2001;38:231-42.
9. Dimopoulos MA, Moulopoulos A, Delasalle K, Alexanian R. Solitary plasmacytoma of bone and asymptomatic multiple myeloma. Hematol Oncol Clin North Am. 1992;6:359-69.
10. Bataille R, Sany J. Solitary myeloma: clinical and prognostic features of a review of 114 cases. Cancer. 1981;48:845-51.
11. Dores GM, Landgren O, McGlynn KA, Curtis RE, Linet MS, Devesa SS. Plasmacytoma of bone, extramedullary plasmacytoma, and multiple myeloma: incidence and survival in the United States. Br J Haematol. 2009;144:86-94.
12. Rombolá C, León A, Muñoz S, Alix T. Plasmocitoma solitario de esternón: Presentación de un caso y revisión de la literatura. Oncología. 2006;29(9):378-81.
13. Fernández P, Sancho M, Gras A, Talavera S. Plasmocitoma solitario de cabeza y cuello: Presentación de tres casos y revisión de la literatura. Acta Otorrinolaringol Esp. 2001;52:715-20.
14. Olmo JA Del. Osteopatías hematológicas. In: Querol JR. Patología Ósea. Barcelona: Ed. Espaxs Publicaciones Médicas; 1983. p. 376-82.
15. Conklin R, Alexanian R. Clinical classification of plasma cell myeloma. Arch Intern Med; 1975. p. 135-41.
16. Burt M, Karpeh M, Ukoha O, Bains MS, McCormak PM, Rusch VW, et al. Medical tumors of the chest wall. Solitary plasmocytoma and Ewing’s sarcoma. J Thorac Cardiovasc Surg. 1993;105(1):89-96.
17. Burt M, Zakowski M. Rare Primary Malignant Neoplasms. En: Pearson FG, editor. Thoracic Surgery. New York: Churchill Livingstone Inc. 1995; p. 807-26.
18. Graeber GM, Jones DR, Pairolero PC. Primary Neoplasms. En: Pearson FG, editor. Thoracic Surgery. New York: Churchill Livingstone Inc. 1995; p.1237-1251.
19. Bertanha F, Boufelli G, Pires O, Baptista A, Tadeu M, Regina C, et al. Oncologic progression of bone plasmacytomas to multiple myeloma. Clinics. 2006;61(2):139-46.
20. Holland J, Trenkner DA, Wasserman TH, Fineberg B. Plasmacytoma, treatment results and conversion to myeloma. Cancer. 1992;69:1513-7
21. Quintero M, Rojas-Atencio A, Ruiz A, Gonzalez M, Herrera J, Atencio F, et al. Chromosome anomalies in Venezuelan patients with multiple mieloma. Invest Clin. 2003;44(4):327-35.
22. Bataille R, Donadio D, Morlock G, Rosenberg F, Blotman F, Sany J, et al. Multiple myeloma of bones. Retrospective study of prognostic factors based on a series of 243 patients. Rev Rhum Mal Osteoartic. 1979;46:77-83.
23. Bataille R, Morlock G, Rosenberg F, Lopitaux R, Blotman F, Sany J, et al. Value of successive chemotherapy in multiple myeloma of bone: Prospective study over 4 years. Rev Rhum Mal Osteoartic. 1980;47:77-82.
Recibido: 15 de abril de 2015.
Aprobado: 22 de mayo de 2015.
Hermes Moreno Ramírez. Universidad “Pablo Guardádo Chávez”. Tuxtla Gutiérrez, Chiapas. México.