Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Investigaciones Biomédicas
versão impressa ISSN 0864-0300versão On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.35 no.2 Ciudad de la Habana abr.-jun. 2016
Rev Cubana de Investigaciones Biomédicas. 2016;35(2)
ARTÍCULO ORIGINAL
Análisis biomecánico del disco óptico bajo la variación de presión intraocular y rigidez escleral
Biomechanical analysis of the optic disc under variations in intraocular pressure and scleral rigidity
Bernardo Calderín Pérez,I Raide Alfonso González Carbonell,II Matilde Landín Sorí,III Elsa Nápoles PadrónI
I Departamento de laboratorio clínico y óptica. Centro provincial de electromedicina. Camagüey, Cuba.
II Departamento Ingeniería Mecánica. Grupo de Biomecánica y Bioingeniería. Universidad de Camagüey “Ignacio Agramonte Loynaz”. Camagüey, Cuba.
III Centro Oftalmológico. Hospital Universitario “Manuel Ascunce Doménech”. Camagüey, Cuba.
RESUMEN
Introducción: el incremento de la presión intraocular y las alteraciones detectadas en la apariencia de la cabeza del nervio óptico constituyen factores importantes en la determinación de la progresión del daño glaucomatoso.
Objetivo: analizar el comportamiento del disco óptico bajo el efecto de la variación de la presión intraocular y de la rigidez escleral, a través de un modelo biomecánico.
Métodos: se emplea el método de los elementos finitos. Se definieron varios módulos de rigidez para la esclerótica de 3, 6 y 9 MPa y para la lámina cribosa 0,3 y 0,6 MPa. Todos los tejidos modelados fueron asumidos como materiales isotrópicos con comportamiento elástico e incompresible.
Resultados: la mayor concentración de tensiones se localizó en las zonas de la esclerótica peripapilar y en las paredes del canal escleral. Los máximos de tensión (97,523 kPa) y desplazamiento (95,64 µm) se obtuvieron cuando la esclerótica y la lámina cribosa fueron menos rígidas y con la mayor presión intraocular.
Conclusiones: la biomecánica del disco óptico influye en el desarrollo de la neuropatía óptica glaucomatosa. El mayor desplazamiento se encuentra en la zona central del disco óptico y está asociado a la pérdida de fibras nerviosas de la retina o al incremento de la excavación papilar en el mecanismo de daño glaucomatoso.
Palabras clave: biomecánica; disco óptico; daño glaucomatoso; presión intraocular; rigidez.
ABSTRACT
Introduction: Increase in intraocular pressure and alterations in the appearance of the optic nerve head are important factors in determining the progress of glaucomatous damage.
Objective: Analyze the behavior of the optic disc under the effect of variations in intraocular pressure and scleral rigidity using a biomechanical model.
Methods: The finite element method was used to define several rigidity modules for the sclera at 3.6 and 9 MPa and for the lamina cribosa at 0.3 and 0.6 MPa. All the tissues modeled were assumed to be isotropic materials with elastic, incompressible behavior.
Results: The highest concentration of tensions was located in areas of the peripapillary sclera and scleral canal walls. Tension and displacement peaks (97.523 kPa and 95.64 µm, respectively) were obtained when the sclera and the lamina cribosa were less rigid and intraocular pressure was highest.
Conclusions: The biomechanical characteristics of the optic disc influence the development of glaucomatous optic neuropathy. The greatest displacement is found in the central area of the optic disc, and it is associated with the loss of retinal nerve fibers or an increase in papillary excavation in the mechanism of glaucomatous damage.
Key words: biomechanics; optic disc; glaucomatous damage; intraocular pressure; rigidity.
INTRODUCCIÓN
El glaucoma es la segunda causa común de ceguera y existe una proyección de que para el año 2020 lo padezcan 11 millones de personas a escala mundial.1 Su mayor problema es que provoca una pérdida de visión irreversible. Autores cubanos definen el glaucoma de forma concreta como una neuropatía óptica progresiva con mecanismo isquémico o compresivo-mecánico debido a que la cabeza del nervio óptico no tolera su propia presión intraocular.2
La elevación de la presión intraocular (PIO) y las alteraciones detectadas en la apariencia de la cabeza del nervio óptico constituyen factores importantes en la determinación de la progresión del daño glaucomatoso. El glaucoma daña las estructuras internas del ojo, genera una pérdida progresiva de la capa de fibras nerviosas de la retina y produce excavaciones en el disco óptico o papila óptica.3
La hipertensión ocular o elevación de la PIO es uno de los principales factores de riesgo para desarrollar el glaucoma. La PIO puede considerarse como la relación entre la producción y la eliminación del humor acuoso dentro del ojo.
Dada la gravedad de esta enfermedad se han desarrollado múltiples medios de diagnóstico y tratamiento: tonómetros de contacto y de no contacto, analizadores de respuesta ocular, sistemas de adquisición de imágenes digitales (tomógrafos de retina, tomógrafos de coherencia óptica, polarímetros láser, lámparas de hendiduras, entre otros).4
En la actualidad no hay herramientas basadas en la ciencia que pronostiquen a qué nivel de PIO un disco óptico individual será dañado. La simulación computacional y el análisis por elementos finitos han sido usados en la búsqueda de predicciones en el campo de la Salud.5-8
El Método de Elementos Finitos (MEF) constituye la herramienta por excelencia empleada en la modelación de tejidos biológicos. Los análisis que se realizan con el MEF parten de la simplificación del objeto real a un modelo.9 El MEF aproxima la forma geométrica del modelo mediante la división del sólido continuo en elementos.
Este proceso se denomina discretización o mallado del continuo. Los elementos se unen a través de los nodos y conforman la malla. Es un método numérico y por tanto su solución es aproximada. La magnitud del error dependerá de la correcta definición del modelo y de la calidad de la malla.10
Para el caso del ojo, se han implementado en el estudio de la biomecánica de la cabeza del nervio óptico y en la caracterización de los tejidos biológicos implicados en el daño glaucomatoso;11 se considera su compleja geometría, sus propiedades mecánicas, y su repuesta biomecánica ante diversos niveles presión intraocular.12-14
El objetivo de este trabajo es analizar el comportamiento del disco óptico bajo el efecto de la variación de la presión intraocular y de la rigidez escleral a través de un modelo biomecánico.
MÉTODOS
El Método de Elementos Finitos (MEF) fue empleado como herramienta de simulación. El modelo biomecánico empleado consistió en la simplificación de la cabeza del nervio óptico y en su definición se emplean los mismos principios empleados en piezas mecánicas, compuesto por el modelo geométrico, el modelo de carga (interacción entre los elementos) y el modelo de material (leyes, principios e hipótesis).10,15,16 Se definieron 30 variantes del modelo biomecánico a través de la modificación la presión intraocular y la rigidez escleral y laminar. A continuación se explican los componentes del modelo biomecánico.
Modelo geométrico
Se desarrolló un modelo genérico tridimensional a partir del modelo en 2D obtenido por Sigal y colaboradores12 (Fig. 1). Los elementos se generaron de manera simétrica (sólidos en revolución). La esclerótica se confeccionó como un casquete esférico de espesor constante, excepto para la zona peripapilar donde se representó el adelgazamiento escleral, ya que se ha reportado en la literatura que es la zona de mayor influencia en la respuesta mecánica del disco óptico.17 En el tejido neural pre-laminar se disminuyó el espesor hacia la periferia de acuerdo a la anatomía real de la retina. El resto de los componentes (la lámina cribosa, el canal escleral, el tejido neural pre-laminar y la piamadre) se construyeron de forma circular.
Modelo de cargas y condiciones de contorno
Los valores de PIO seleccionados por otros autores se encuentran en el rango entre 5 y 50 mm Hg y responden a los intereses particulares de su investigación.12,14,18
Para este trabajo se utilizó la PIO en un rango entre 13 a 33 mm Hg con una variación de 5 mm Hg. La presión se aplicó en la superficie superior del tejido neural pre-laminar (tejido A de la Fig. 1).
Las condiciones de contorno se definieron mediante la eliminación de los desplazamientos radiales en el eje ecuatorial del ojo a través de una restricción fija en la superficie posterior de la esclerótica (tejido B de la Fig. 1). Equivale de forma aproximada a las restricciones que generan los músculos extraoculares. El resto de las restricciones se aplicaron en la superficie exterior de la piamadre (tejido C de la Fig. 1) de manera que el globo ocular solo se deforme en la dirección de su eje de simetría.
Modelo de Material
Las propiedades mecánicas para los tejidos biológicos implicados en la presente simulación se basaron en datos experimentales reportados en la literatura.19-21 En el presente estudio fueron utilizados los siguientes módulos elasticidad:
- Para la esclerótica tres valores: 3, 6 y 9 MPa.
- Para la piamadre: 3 MPa.
- Para la lámina cribosa dos valores: 0,3 y 0,6 MPa.
- Para los tejidos neurales pre-liminar y post-laminar: 0,03 MPa.
Todos los tejidos modelados fueron asumidos como materiales isotrópicos con comportamiento elástico e incompresible (coeficiente de Poisson de 0,49).
Generación de la malla y su sensibilidad
Se generó una malla sólida del tipo compatible basada en la curvatura. Con esta opción se asegura una correspondencia de nodo a nodo entre las entidades en contacto de las mallas de cada elemento, se logra, que dichos nodos fusionen para un contacto de unión rígida entre las entidades. También se crean de forma automática más elementos en las zonas de mayor curvatura. Se emplearon elementos sólidos tetraédricos 3D. Se empleó el método de mallado auto-adaptativo de subdivisión de elementos (método-h). Consiste en reducir el tamaño de los elementos en las zonas donde las tensiones son mayores, de manera que el cálculo de las mismas sea más preciso producto del incremento de la calidad de la malla en la región de interés del análisis. Se analizó la variación de las tensiones respecto a la malla de mayor densidad y se seleccionó la malla con un error inferior al 3 %.
RESULTADOS
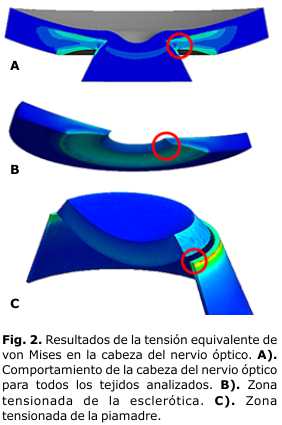
En la figura 2 se muestra resaltado en un círculo rojo la ubicación de la mayor concentración de tensiones, que se localizó en las zonas de la esclerótica peripapilar (fig. 2b) y en las paredes del canal escleral en el borde de superior de unión de la piamadre y la esclerótica (fig. 2c).
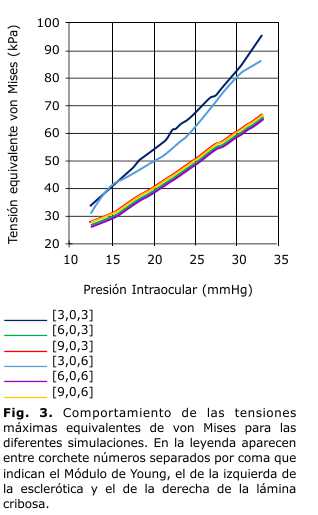
En la figura 3 se muestra el comportamiento de las tensiones máximas equivalentes de von Mises para las diferentes simulaciones, varía el módulo de Young de la esclerótica y la lámina cribosa. La tensión máxima obtenida fue de 97,523 kPa que constituye 22 veces la PIO normal (se emplea 15 mm Hg como PIO normal). Ocurrió para una presión intraocular de 33 mm Hg y cuando la esclerótica y la lámina cribosa fueron menos rígidas, con módulos de elasticidad de 3 y 0,3 MPa. La tensión mínima fue de 28,842 kPa, 17 veces la PIO normal. Se obtuvo para una presión intraocular de 13 mm Hg (el valor mínimo analizado) y los módulos de elasticidad de los tejidos escleral y laminar de 6 y 0,6 MPa.
Los desplazamientos resultantes provocados por la acción de la PIO sobre los tejidos biológicos de la papila óptica ocurrieron en la zona central de la cabeza del disco óptico. Los valores máximos estuvieron en el tejido neural pre-laminar, los que se trasmiten a la lámina cribosa y al nervio óptico. El mayor desplazamiento (95,64 µm) ocurrió para una esclerótica y lámina cribosa menos rígidas y con la mayor PIO. El mismo aumenta de forma lineal con el incremento de la PIO y disminuyen al incrementar la rigidez escleral. El valor mínimo (17,35 µm) se obtuvo para la esclerótica y lámina cribosa más rígidas y con menor valor de PIO.
DISCUSIÓN
Estudios relacionados con el comportamiento y las características físicas de los tejidos biológicos involucrados en el desarrollo de la neuropatía óptica glaucomatosa plantean que la esclerótica y la lámina cribosa son los tejidos más afectados.20 Es por lo que en el presente trabajo se realiza un análisis lineal estático a 30 variantes del modelo donde se varió la PIO, y las propiedades mecánicas de la esclerótica y de la lámina cribosa.
Cuando se analiza un objeto tridimensional sometido a cargas, como fue el caso de la cabeza del nervio óptico, surgen fuerzas internas que se oponen a las externas para mantener la forma geométrica y la integridad del cuerpo. De esta manera se originan las tensiones en el interior del cuerpo (densidad de fuerza por unidad de área). Si se considera un elemento infinitesimal en el interior del nervio óptico en forma de cubo, en cada una de las caras aparecen tensiones normales y tangenciales. A través de una de las teorías de resistencia se obtiene la tensión equivalente de cada elemento infinitesimal. Para determinar dichas tensiones, se seleccionó la teoría de la energía potencial de deformación o también conocida como de von Mises. La interpretación de los resultados se basó en las tensiones equivalentes máximas de von Mises expresadas en múltiplos de PIO normal, los desplazamientos resultantes y las deformaciones unitarias.
Las tensiones equivalentes de von Mises presentaron un comportamiento linealmente ascendente con el incremento de la carga y descendente respecto al aumento de la rigidez de la esclerótica. Se destaca que existe poca diferencia entre las curvas de tensiones equivalentes cuando la esclerótica tuvo un aumento del módulo de elasticidad a partir de 6 MPa, tampoco influyó que el tejido laminar variara la rigidez. Sin embargo, para valores menores de rigidez de la esclerótica si influenciaron las propiedades mecánicas, pues para la rigidez de 3 MPa las tensiones fueron superiores. De este resultado se puede plantear que los pacientes son susceptibles a padecer socavación con rigidez escleral y laminar baja.
Las propiedades mecánicas de los tejidos son más influyentes en la respuesta biomecánica de la papila óptica que su geometría. Los resultados dependen de las propiedades de la esclerótica peripapilar como el principal tejido encargado de soportar la carga interna dentro del ojo (PIO) y de mantener la integridad mecánica del globo ocular presurizado.20
Se reafirma la hipótesis de que las zonas de la esclerótica peripapilar y en las paredes del canal escleral constituye la región crítica que soporta la carga mecánica y sus fluctuaciones en la cabeza del nervio óptico. La cabeza del nervio óptico está tensionada incluso para valores bajos o normales de PIO.
Los valores de tensión equivalente obtenidos están en el rango de 17 a 22 veces la PIO y se corresponden cuantitativamente y cualitativamente con los calculados por Bellezza y colaboradores,18 los que en su estudio oscilaron entre 10 – 100 veces el valor de PIO normal en diferentes zonas de la papila óptica.
También se pudo observar la fuerte acción compresiva de la presión intraocular, lo que se traduce como adelgazamiento de las fibras neurorretinianas. Esta característica es apreciable mediante los medios de diagnóstico de imagenología (tomógrafos o polarímetros). Éste es un patrón de gran utilidad en la exploración de un paciente con sospecha de glaucoma o para el monitoreo de la evolución de la enfermedad como tal.
Como los pacientes que padecen glaucoma están sometidos a episodios de elevación de presión intraocular, los desplazamientos se convierten en deformaciones permanentes. Por lo tanto, la variación del desplazamiento se puede interpretar como la pérdida de fibras neurorretinianas o incremento de la excavación papilar en el mecanismo de daño glaucomatoso. Sobre la base de este complejo sistema de tensiones, desplazamiento y deformaciones se han desarrollado algoritmos de procesamiento de imágenes para monitorear la progresión del glaucoma a través de la tomografía de coherencia óptica.22
En todos los modelos se observó un desplazamiento posterior en la dirección del eje de simetría (flexión) de la esclerótica peripapilar, la que puede ser identificada en la literatura consultada como una expansión del canal escleral. Este efecto produce una tracción sobre la lámina cribosa, lo que también puede ser la causante del área de tensión observada en este trabajo en la unión con la piamadre y la esclerótica peripapilar.
Se ha generalizado un criterio consistente basado en simulaciones computacionales acerca de la lámina cribosa como el tejido más susceptible al daño glaucomatoso y la dependencia de su respuesta a las propiedades mecánicas de la esclerótica.13 Si la rigidez de la esclerótica cambia también lo hace la deformación del disco óptico. Por tanto se confirma que las propiedades de la esclerótica, en la parte peripapilar, pueden jugar un papel importante en la biomecánica de la neuropatía óptica glaucomatosa.
Los efectos biomecánicos de la PIO sobre los tejidos de la cabeza del nervio óptico juegan un papel crucial en el desarrollo y progresión de la enfermedad a todos los niveles de PIO.
La acción de la presión intraocular sobre la papila óptica está muy ligado con la respuesta biomecánica de sus tejidos constituyentes y con los eventos isquémicos y celulares impulsados por esta respuesta. Así, los globos oculares con una combinación particular de geometría y rigidez pueden ser más susceptibles a los daños para una PIO normal, mientras que otros con una combinación distinta de estas variables pueden presentar una resistencia mayor incluso a niveles mayores de PIO.
A modo de consideraciones finales se confirma que la biomecánica de la cabeza nervio óptico influyen en el desarrollo de la neuropatía óptica glaucomatosa. Los tejidos del nervio óptico se encuentran tensionados para todos los valores de presión analizados. La mayor concentración de tensiones se localizó en las zonas de la esclerótica peripapilar y en las paredes del canal escleral lo que reafirma las hipótesis que esta constituye la zona crítica que soporta la carga mecánica y sus fluctuaciones en la cabeza del nervio óptico. Los desplazamientos resultantes provocados por la acción de la PIO sobre los tejidos biológicos de la papila óptica ocurrieron en la zona central. Los valores máximos estuvieron en el tejido neural pre-laminar, los que se trasmiten a la lámina cribosa y al nervio óptico. Los valores más altos de deformación unitaria se ubicaron sobre el tejido neural pre-laminar y la zona posterior de la lámina cribosa; lo que puede ser la causa de la disminución de fibras neurorretinianas y la pérdida de la visión.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud. Ceguera y discapacidad visual. Nota descriptiva N° 282 [Internet]. Centro de prensa OMS; 2014 [citado 20 Oct 2014]. Disponible en: http://www.who.int/mediacentre/factsheets/fs282/es/.
2. Alemañy Martorell J, Villar Valdés R. Oftalmología. 5ta. ed: Editorial Ciencias Médicas; 2005. p. 271.
3. Carbonaro F, Hysi PG, Fahy SJ, Nag A, Hammond CJ. Optic disc planimetry, corneal hysteresis, central corneal thickness, and intraocular pressure as risk factors for glaucoma. Am J Ophthalmol [Internet]. 2014 Feb [citado 20 Feb 2015];157(2):441-6. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24211362.
4. Sigal IA, Wang B, Strouthidis NG, Akagi T, Girard MJ. Recent advances in OCT imaging of the lamina cribrosa. The British journal of ophthalmology [Internet]. 2014 Jul [citado 20 Feb 2015];98(Suppl 2):ii34-ii9. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24934221.
5. González Carbonell RA, Ortiz Prado A, Jacobo Armendáriz VH, Cisneros Hidalgo YA, Alpízar Aguirre A. 3D patient-specific model of the tibia from CT for orthopedic use. J Orthop [Internet]. 2015 Ene [citado 20 Feb 2015];12(1):11-6. Disponible en: http://www.sciencedirect.com/science/article/pii/S0972978X15000100.
6. González Carbonell RA, Ortiz Prado A, Cisneros Hidalgo YA, Alpizar Aguirre A. Bone Remodeling Simulation of Subject-Specific Model of Tibia under Torque. En: Braidot A, Hadad A, editores. VI Latin American Congress on Biomedical Engineering CLAIB 2014. Paraná, Argentina 29, 30 & 31 October 2014. IFMBE Proceedings. 49: Springer International Publishing; 2015. p. 305-8.
7. González Carbonell RA, Nápoles Padrón E, Calderín Pérez B, Cisneros Hidalgo Y, Landín Sorí M. Carácter interdisciplinario de la modelación computacional en la solución de problemas de salud. Humanidades Médicas [Internet]. 2014 Jul [citado 24 Jun 2015];14(3):646-58. Disponible en: http://humanidadesmedicas.sld.cu/index.php/hm/article/view/621.
8. Cisneros Hidalgo YA, González Carbonell RA, Ortiz Prado A, Jacobo Almendáriz VH, Puente Alvarez A. Modelo mecanobiológico de una tibia humana para determinar su respuesta ante estímulos mecánicos externos. Rev Cubana Inv Bioméd [Internet]. 2015 Ene [citado 20 Feb 2015];34(1):54-63. Disponible en: http://bvs.sld.cu/revistas/ibi/vol34_1_15/ibi06115.htm.
9. González Carbonell R, Álvarez Álvarez E, Campos Pérez Y. Tacón de torque. Análisis tensional y deformacional utilizando el Método de Elementos Finitos. Ingeniería Mecánica [Internet]. 2007 May [citado 20 Feb 2014];10(2):79-83.
10. González Carbonell R, Ortiz Prado A, Jacobo Armendáriz V, Cisneros Hidalgo Y, Morales Acosta L. Consideraciones en la definición del modelo específico al paciente de la tibia. Rev Cubana Inv Bioméd [Internet]. 2015 Abr [citado 20 Oct 2015];34(2):122-35. Disponible en: http://bvs.sld.cu/revistas/ibi/vol34_02_15/ibi06215.htm.
11. Calderín Pérez B, González Carbonell RA, Landín Sorí M, Nápoles Padrón E. Aplicabilidad de la simulación computacional en la biomecánica del disco Óptico. AMC [Internet]. 2015 Ene [citado 24 Feb 2015];19(1):73-82. Disponible en: http://www.revistaamc.sld.cu/index.php/amc/article/view/2715/1357.
12. Sigal IA, Flanagan JG, Tertinegg I, Ethier CR. Finite Element Modeling of Optic Nerve Head Biomechanics. Invest Ophthalmol Vis Sci [Internet]. 2004 Dic [citado 5 Jun 2014];45(12):4378-87. Disponible en: http://www.iovs.org/content/45/12/4378.full.pdf.
13. Sigal IA, Bilonick RA, Kagemann L, Wollstein G, Ishikawa H, Schuman JS, et al. The optic nerve head as a robust biomechanical system. Invest Ophthalmol Vis Sci [Internet]. 2012 May [citado 30 Nov 2014]; 53(6):2658-67. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/22427598.
14. Campbell IC, Coudrillier B, Ross Ethier C. Biomechanics of the posterior eye: a critical role in health and disease. J Biomech Eng [Internet]. 2014 Feb [citado 5 May 2015];136(2):021005. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/24356942.
15. González R, García E, Moya J. Tacón de Torque para uso Ortopédico: Propuesta de un Nuevo Diseño. En: Folgueras Méndez J, Aznielle Rodríguez TY, Calderón Marín CF, Llanusa Ruiz SB, Castro Medina J, Vega Vázquez H, et al., editores. V Latin American Congress on Biomedical Engineering CLAIB 2011 May 16-21. Habana, Cuba. IFMBE Proceedings. 33: Springer Berlin Heidelberg; 2013. p. 912-5.
16. Martín Carvajal L, García Domínguez A, González Carbonell RA, Calzadilla Méndez E, Hernández de la Torre J. Carros jaula ferroviarios: determinación de un escalón en diámetro para el reacondicionamiento de sus ejes. Ingeniería Mecánica [Internet]. 2013 Ene [citado 15 Jun 2014];16(1):52-8. Disponible en: http://www.ingenieriamecanica.cujae.edu.cu/index.php/revistaim/article/download/441/798 .
17. Coudrillier B, Boote C, Quigley H, Nguyen T. Scleral anisotropy and its effects on the mechanical response of the optic nerve head. Biomech Model Mechanobiol [Internet]. 2013 Oct [citado 15 Oct 2014];12(5):941-63. Disponible en: http://dx.doi.org/10.1007/s10237-012-0455-y.
18. Bellezza AJ, Hart RT, Burgoyne CF. The Optic Nerve Head as a Biomechanical Structure: Initial Finite Element Modeling. Invest Ophthalmol Vis Sci [Internet]. 2000 Oct [citado 28 Nov 2014];41(10):2991-3000. Disponible en: http://www.iovs.org/content/41/10/2991.full.pdf.
19. Sigal I, Flanagan J, Tertinegg I, Ethier CR. Modeling individual-specific human optic nerve head biomechanics. Part II: influence of material properties. Biomech Model Mechanobiol [Internet]. 2009 Abr [citado 30 Nov 2014];8(2):99-109. Disponible en: http://dx.doi.org/10.1007/s10237-008-0119-0.
20. Norman RE, Flanagan JG, Sigal IA, Rausch SM, Tertinegg I, Ethier CR, et al. Finite element modeling of the human sclera: influence on optic nerve head biomechanics and connections with glaucoma. Exp Eye Res [Internet]. 2010 Ene [citado 30 Nov 2014];93(1):4-12. Disponible en: http://dx.doi.org/10.1016/j.exer.2010.09.014.
21. Sigal IA, Flanagan JG, Lathrop KL, Tertinegg I, Bilonick R. Human lamina cribrosa insertion and age. Invest Ophthalmol Vis Sci [Internet]. 2012 Nov [citado 30 Nov 2014];53(11):6870-9. Disponible en: http://dx.doi.org/10.1167/iovs.12-9890.
22. Asejczyk-Widlicka M, Śródka W, Schachar RA, Pierścionek BK. Material properties of the cornea and sclera: A modelling approach to test experimental analysis. J Biomech [Internet]. 2011 Mar [citado 5 Jun 2014]; 44(3):543-6. Disponible en: http://www.sciencedirect.com/science/article/pii/S0021929010005488.
Recibido: 7 de enero de 2016.
Aprobado: 10 de febrero de 2016.
Raide Alfonso González Carbonell. Departamento Ingeniería Mecánica. Grupo de Biomecánica y Bioingeniería. Universidad de Camagüey “Ignacio Agramonte Loynaz”. Carretera Circunvalación Norte, entre Avenida Ignacio Agramonte y Camino Viejo de Nuevitas. CP – 74650. Camagüey, Cuba.
Correo electrónico: raide.gonzalez@reduc.edu.cu