Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Investigaciones Biomédicas
versión On-line ISSN 1561-3011
Rev Cubana Invest Bioméd vol.36 no.1 Ciudad de la Habana ene.-mar. 2017
ARTÍCULO ORIGINAL
Síntesis de látex de poliestireno y aplicación en la serotipificación de Neisseria meningitidis serogrupo W
Polystyrene latex synthesis and application in Neisseria meningitidis serogroup W serotyping
Grisel Marrero Claro,I Fidel Ramírez Bencomo,II Lilian Pérez Delgado,I Alexis Musacchio Lasa,III Elizabeth González Aznar,II Oscar Otero Alfaro,II Reinaldo Acevedo Grogues,II Nancy Bada Rivero,I Yohanna Amey Ramírez,I Dionisio Zaldívar Silva,IV Tamara Menéndez MedinaI
I Centro de Biomateriales (BIOMAT). Universidad de La Habana. La Habana, Cuba.
II Instituto Finlay de Vacunas. La Lisa, La Habana, Cuba.
III Centro de Ingeniería Genética y Biotecnología (CIGB). La Habana, Cuba.
IV Facultad de Química. Universidad de La Habana. La Habana, Cuba.
RESUMEN
Introducción: las esferas de poliestireno se utilizan como soporte sólido de biomoléculas en inmunoensayos de aglutinación de látex, con aplicaciones en el diagnóstico de enfermedades y la identificación de microorganismos.
Objetivos: sintetizar y caracterizar tres lotes consecutivos de látex de poliestireno y su aplicación en la elaboración de reactivos para la tipificación de la bacteria Neisseria meningitidis serogrupo W.
Métodos: la síntesis se realizó mediante polimerización en emulsión libre de surfactantes. La morfología y limpieza de las partículas se observó mediante microscopía electrónica de barrido. El diámetro y el potencial Z de las esferas se determinó mediante dispersión dinámica y electroforética de la luz. Se utilizó la espectroscopía infrarroja con transformada de Fourier (FT-IR) como ensayo de identidad. Para estudiar la capacidad de las esferas para adsorber proteínas se empleó el anticuerpo monoclonal (AcM) 5C11F1, específico para el polisacárido capsular de N. meningitidis serogrupo W.
Resultados: se obtuvieron tres lotes consecutivos de látex de poliestireno con esferas de diámetro medio en el intervalo de 0,8 ± 0,1 µm y se demostró su similitud con tres látex comerciales respecto a limpieza, morfología y espectros FT-IR. Los látex fueron estables al menos durante 24 meses, en coincidencia con los potenciales Z medidos por debajo de -30 mV. Las superficies de las partículas se saturaron en el intervalo de 48 a 63 µg de AcM por mg de esferas para los tres lotes de látex y para un látex comercial utilizado como control. Los reactivos de látex obtenidos por adsorción del AcM 5C11F1 a las esferas de poliestireno se aplicaron con éxito en la identificación de cepas de N. meningitidis serogrupo W.
Palabras clave: látex de poliestireno; tipificación bacteriana; serotipificación de Neisseria meningitidis.
ABSTRACT
Introduction: Polystyrene latex spheres are widely used as solid support for biomolecules in latex agglutination immunoassays, with applications in disease diagnosis and microorganism typing.
Objectives: To synthesize and characterize three consecutive batches of polystyrene latex and their application to obtain reagents for serotyping Neisseria meningitidis serogroup W strains.
Methods: Polystyrene particles were synthesized by a surfactant-free emulsion polymerization method. Cleanliness and morphology were assessed by scanning electron microscopy. Sphere mean diameter and Z potentials were determined by dynamic and electrophoretic light scattering, respectively. Fourier-Transformed Infrared Spectroscopy (FTIR) was used as identity test. Protein adsorption capacity of spheres was studied with the monoclonal antibody (MAb) 5C11F1, directed against N. meningitidis serogroup W capsular polysaccharide.
Results: Three consecutive batches of polystyrene latex with sphere mean diameter of 0.8 ± 0.1 µm were synthesized and their similarity with three commercial latexes regarding cleanliness, morphology and FT-IR spectra was demonstrated. Synthesized latexes were stable at least 24 months, in agreement with measured Z potentials below -30 mV. Particle surfaces saturated in the range of 48 to 63 µm of MAb per mg of spheres for the three latex batches and a commercial latex used as control. The latex reagents obtained by MAb 5C11F1 adsorption to the polystyrene spheres were successfully applied for serotyping N. meningitidis serogroup W strains.
Key words: Polystyrene latex; bacterial typing; Neisseria meningitidis serotyping.
INTRODUCCIÓN
Los polímeros obtenidos por polimerización en emulsión se conocen como látex y consisten en partículas de polímeros dispersos en un medio continuo, de manera usual agua.1 La polimerización en emulsión del estireno produce látex de poliestireno. Las partículas de látex de poliestireno se utilizan como soporte sólido de biomoléculas, principalmente proteínas, para inmunoensayos, con aplicaciones en el diagnóstico de enfermedades y la identificación de microorganismos.2,3 Las esferas de poliestireno recubiertas con antígenos o con anticuerpos se aglutinan en presencia de anticuerpos o de antígenos específicos, respectivamente, formando agregados visibles. Para la detección visual de la aglutinación, se pueden emplear esferas con diámetros de 0,2 a 0,9 µm,4 aunque son más frecuentemente utilizadas las de alrededor de 0,8 µm.5
En el Centro de Biomateriales (BIOMAT) de la Universidad de La Habana se sintetiza, mediante el método de polimerización en emulsión libre de surfactantes,6 látex de poliestireno que se ha utilizado, entre otras aplicaciones, para estudiar la adsorción de inmunoglobulinas humanas antirrábicas7 y como base para el desarrollo de un reactivo para detectar el Factor Reumatoide en sueros humanos.2
En el presente trabajo se estudia el proceso de obtención de látex de poliestireno en BIOMAT, mediante la síntesis de tres lotes consecutivos del mismo y su caracterización en paralelo con látex comerciales. El látex sintetizado se utiliza como soporte sólido para el acoplamiento de un anticuerpo monoclonal (AcM) dirigido contra el polisacárido capsular de la bacteria Neisseria meningitidis serogrupo W y los reactivos de látex obtenidos se aplican para la identificación de cepas del meningococo de este serogrupo.
MÉTODOS
MATERIALES
El estireno (Sigma-Aldrich, EEUU), se purificó por destilación al vacío antes del uso. Se utilizó agua doblemente destilada con una conductividad menor de 2 µS/cm en todos los experimentos. El persulfato de potasio se adquirió de Fluka, Suiza.
ANTICUERPO MONOCLONAL 5C11F1
El anticuerpo monoclonal (AcM) 5C11F1 es una inmunoglobulina IgG 1 que reconoce en específico el polisacárido capsular del serogrupo W de N. meningitidis. Se obtuvo en el Instituto de Vacunas Finlay (La Habana, Cuba).8
MUESTRAS DE NEISSERIA MENINGITIDIS
Las cepas del serogrupo W de N. meningitidis MK 222/02 y S4383 y la cepa Z6433 del serogrupo Y, empleada como control, se obtuvieron del Laboratorio de Ensayo Bactericida del Departamento de Inmunología del Instituto de Vacunas Finlay (La Habana, Cuba). Las muestras se inactivaron por calor y se diluyeron hasta 109 Unidades Formadoras de Colonias/ mL en caldo de triptona soja.
LÁTEX COMERCIALES
Se adquirieron, a tres firmas comerciales, látex de poliestireno con diámetro medio de partículas de 0,8 µm. Todas tienen un contenido de sólidos del 10 %.
SÍNTESIS Y LIMPIEZA DEL LÁTEX
Se realizó de forma básica según lo informado.7 Se mezclaron 25 mL de estireno destilado y 230 mL de agua en un reactor de vidrio de cuatro bocas y de fondo redondo, equipado con un agitador mecánico, un condensador y una entrada de nitrógeno. El reactor se colocó en un baño de aceite con temperatura controlada de 75 °C. El reactor se purgó con nitrógeno, y la velocidad de agitación se fijó en 250 rpm. Después de alcanzar el equilibrio térmico, se añadieron 20 mL de agua que contenían 0,16 g del iniciador de la reacción persulfato de potasio. La reacción procedió 24 h.
Las partículas de látex se lavaron mediante ciclos de centrifugación a 15 000 x g durante 15 min (centrífuga HITACHI SCR 20B, Japón). Los sobrenadantes se decantaron y el sedimento se resuspendió en agua hasta el volumen original. Los lavados se detuvieron cuando la conductividad sobrenadante fue inferior a 2 μS/cm; esto normalmente requirió alrededor de 15 lavados. La resuspensión de las partículas se asistió con un baño de ultrasonido. Las partículas lavadas se almacenaron de 4-8 °C.
DETERMINACIÓN DEL CONTENIDO DE SÓLIDOS Y DEL RENDIMIENTO
El contenido de sólidos en el látex (CS) se determinó gravimétricamente después de la síntesis y después de los lavados. Se pesó 1 mL de la suspensión de látex, para determinar el peso húmedo, y luego se secó en un horno convencional a 60 °C hasta obtener peso constante y de esa forma determinar el peso seco. El CS se calculó con la ecuación: CS (%)= (peso seco látex/peso húmedo látex) × 100. El proceso se realizó por triplicado, y se determinó un valor medio de CS. Después de los lavados, el CS del látex se ajustó a 10 %.
El rendimiento se calculó después de la síntesis para determinar el grado de conversión de monómero en polímero (rendimiento de la síntesis) y después de los lavados para determinar la pérdida de polímero a consecuencia de los lavados. En ambos casos se utilizó la ecuación: Rendimiento (%) = peso seco látex/ peso inicial de estireno × volumen total de látex × 100, utilizando el peso seco de 1 mL de látex, determinado inmediatamente después de la síntesis o después de los lavados, respectivamente.
MICROSCOPÍA ELECTRÓNICA DE BARRIDO
Se secó al vacío una muestra de látex y se observó en un microscopio electrónico de barrido (MEB) Hitachi TM 3000 (Japón) con un aumento de 7000 X.
DISPERSIÓN DE LUZ
Se utilizó un equipo Beckman Coulter Delsa Nano C (EE.UU.) para determinar el diámetro de las partículas y el índice de polidispersidad (IPD) por dispersión dinámica de la luz (DDL) y para determinar el potencial Z mediante dispersión electroforética de la luz (DEL). Se utilizaron muestras de látex diluidas en agua (pH 6,8) a 0,01 % (p/v) para ambos ensayos.
ESPECTROSCOPÍA INFRARROJA CON TRANSFORMADA DE FOURIER
Se secaron en horno de vacío a 40 °C durante 4 h muestras de 2 mg de látex. Se secó KBr en horno de vacío a 120 ºC durante 16 h. El látex seco se mezcló al 1 % (p/p) con el KBr seco y se prensó hasta obtener discos transparentes. Los espectros de transmisión se registraron con un espectrómetro infrarrojo con Transformada de Fourier FTIR- WQF-510 (Rayleigh, China) desde 4000 hasta 400 cm-1 con 2 cm-1 de resolución.
ESTUDIO DE LA ESTABILIDAD DEL LÁTEX
Desde la conclusión de los lavados los tres lotes de látex se chequearon cada tres meses mediante:
- Comprobación visual de la dispersión y el color de las suspensiones.
- Ensayo de auto-aglutinación: se colocaron 20μL de muestra en un portaobjetos de aglutinación (HELFA Diagnósticos, La Habana, Cuba) y se hizo girar suave durante tres minutos. La presencia o ausencia de aglomerados se observó a simple vista.
- La presencia de partículas individuales se comprobó mediante examen al microscópico óptico (Olympus CH2, Japón) con aumento 1000 X.
ESTUDIO DE LA CAPACIDAD DE ADSORCIÓN DE PROTEÍNAS
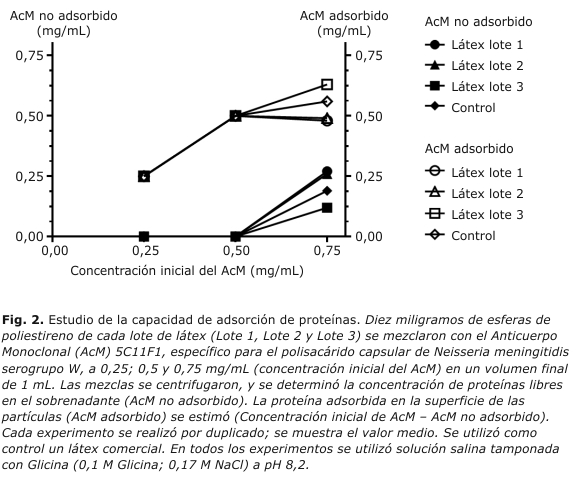
El estudio se hizo en solución salina tamponada con glicina (STG) a pH 8,2, Glicina 0,1 M y NaCl 0,17 M. Se realizaron tres experimentos independientes, donde se mezclaron en cada uno 10 mg de esferas de poliestireno con el AcM 5C11F1 a 0,25; 0,5 y 0,75 mg/mL (concentración inicial de AcM), para un volumen final de 1 mL. Estas concentraciones de AcM se corresponden teóricamente con 1,4; 2,7 y 4,2 veces la cantidad de proteínas necesarias para saturar la superficie de las partículas. Las mezclas se incubaron 2 horas a 37 °C con agitación orbital y luego se centrifugaron (15 min a 1100 x g). Los sobrenadantes se filtraron a través de filtros de 0,2 µm de acetato de celulosa (Sartorius, Göttingen, Alemania). La concentración de proteínas libres en el sobrenadante (AcM no adsorbido) se determinó con un juego de reactivos comerciales (BCA Protein Assay Kit, Pierce Biotechnology, Thermo Scientific, Rockford, EE.UU.). El sedimento obtenido después de la centrifugación se lavó con solución STG y se centrifugó en las mismas condiciones. Los reactivos de látex fueron obtenidos por adición de 1 mL de solución STG con albúmina de suero bovino al 0,2 % (p/v) como estabilizador y tiomersal al 0,02 % (w/v) pH 8,2 como conservante, a los sedimentos lavados. Los reactivos de látex se almacenaron a 4 °C.
La concentración de anticuerpos adsorbidos en la superficie de las partículas se calculó como la diferencia entre la concentración inicial de AcM y la concentración de AcM no adsorbido medida en el sobrenadante. Todos los experimentos se realizaron por duplicado. Los resultados se muestran como el valor medio para cada experimento. Se utilizó solución STG como blanco.
Para calcular el área superficial de las esferas y la cantidad de proteínas de forma teórica necesaria para saturar la superficie calculada, se utilizaron las ecuaciones de Bangs.9
PRUEBA DE AGLUTINACIÓN DE LÁTEX CON CEPAS DE NEISSERIA MENINGITIDIS
Muestras de 0,02 mL de cada cepa de N. meningitidis se colocaron en un portaobjetos de aglutinación y se mezclaron con igual volumen de cada reactivo de látex. El portaobjetos se agitó suave y la formación de aglomerados se comprobó de forma visual. El grado de aglutinación se puntuó como +++, ++ o + si aparecieron grumos dentro del primer, segundo o tercer minuto, respectivamente. La ausencia de aglutinación se puntuó como negativo. Todos los reactivos de látex se evaluaron con dos cepas de N. meningitidis serogrupo W y con solución STG. Los reactivos preparados con el AcM a 0,5 mg/mL se ensayaron con una cepa de N. meningitidis serogrupo Y, como control.
RESULTADOS
SÍNTESIS DE TRES LOTES DE LÁTEX DE POLIESTIRENO
La tabla 1 muestra la conductividad y el pH medido en los sobrenadantes después de la síntesis de los tres lotes consecutivos de látex y en el producto lavado final. Los rendimientos de la síntesis se encuentran dentro del rango informado para la polimerización de estireno en ausencia de surfactantes.6 La pérdida de sólidos debido a los lavados se mantuvo por debajo de 10 % para los tres lotes (tabla 1).
MORFOLOGÍA Y LIMPIEZA DE LAS PARTÍCULAS
El examen mediante MEB de los tres lotes de látex sintetizados reveló la presencia de partículas limpias y esféricas de diámetros alrededor de 0,8 µm, de manera similar a lo observado para los tres látex comerciales utilizados como control (Fig. 1).
DETERMINACIÓN DEL DIÁMETRO DE LAS PARTÍCULAS
Las mediciones realizadas por DDL revelaron partículas con diámetros medios de 0,84 ± 0,02 µm; 0,83 ± 0,02 µm y 0,72 ± 0,02 µm para los lotes 1, 2 y 3, respectivamente (media ± desviación estándar de seis mediciones). Las distribuciones del tamaño de las partículas, dadas como IPD, fueron de 0,09, 0,04 y 0,04 para los lotes 1, 2 y 3, respectivamente (media de seis mediciones). Los diámetros medios medidos para los tres látex comerciales coincidieron con los valores especificados por los fabricantes.
DETERMINACIÓN DEL POTENCIAL Z
Los valores de potencial Z, determinados mediante DEL a partir de la movilidad electroforética de las partículas, fueron de -35,3 mV, -35,7 mV y -32,1 mV para los lotes 1, 2 y 3, respectivamente.
ESPECTROSCOPÍA INFRARROJA CON TRANSFORMADA DE FOURIER (FTIR)
Los espectros FTIR registrados para los tres lotes de látex sintetizados en el presente trabajo, así como los registrados para los látex comerciales utilizados como control tuvieron las características de FT-IR descritas en la literatura para el poliestireno,10 como son las bandas de vibración de valencia del C-H aromático que aparecen de 3200 a 3000 cm-1 ; las bandas de vibración de valencia asimétrica y simétrica C-H del CH2 que aparecen a 2924 cm-1 y 2850 cm-1, respectivamente; la banda de vibración de valencia C-C del anillo en el plano a 1601 cm-1; la banda de vibración de valencia C-H del anillo en el plano a 1493 cm -1; la banda de vibración de doblaje en el plano H-C-H del CH2 a 1452 cm-1; las bandas de vibración de doblaje C-H del anillo en el plano a 1069 y 1028 cm-1 y las bandas de vibración de doblaje C-H del anillo fuera del plano a 756 y 698 cm-1.
ESTABILIDAD DE LAS SUSPENSIONES DE LÁTEX DE POLIESTIRENO
Después de 24 meses desde la fabricación las suspensiones de los tres lotes de látex continuaban dispersas y de color blanco, con resultados de auto-aglutinación negativos. Por microscopía óptica se observaron partículas individuales en los tres lotes.
DETERMINACIÓN DE LA CAPACIDAD DE ADSORCIÓN DE PROTEÍNAS
Luego de la incubación de 10 mg de esferas con el AcM 5C11F1 a 0,25 y 0,5 mg/mL no se detectaron proteínas libres en los sobrenadantes, lo que indica que en ambos experimentos todo el AcM se adsorbió a la superficie de las partículas para los tres lotes de látex. La incubación con AcM 5C11F1 a 0,75 mg/mL dió como resultado la detección de proteínas libres en los sobrenadantes a 0,27; 0,26 y 0,12 mg/mL para los lotes 1, 2 y 3, correspondiente a adsorciones de 0,49; 0,48 y 0,63 mg de AcM a 10 mg de látex, respectivamente. Diez mg de un látex comercial utilizado como control, adsorbió 0,56 mg de AcM. Los resultados se muestran en la figura 2.
APLICACIÓN DE LOS REACTIVOS BASADOS EN LÁTEX EN LA IDENTIFICACIÓN DE CEPAS DE NEISSERIA MENINGITIDIS DEL SEROGRUPO W
La tabla 2 muestra que todos los reactivos de látex mostraron reacción de aglutinación positiva contra las dos cepas de N. meningitidis serogrupo W, mientras que frente a una cepa del serogrupo Y no se formaron conglomerados. El control de ensayo con solución STG mostró el mismo patrón que con la cepa Y. Se observó el mismo patrón de reactividad intensa para los tres lotes de látex con los reactivos preparados a 0,5 y 0,75 mg/mL, mientras que se observó una reacción menos intensa con los reactivos preparados a 0,25 mg/mL de concentración de AcM. Una reactividad intensa fue observada con el reactivo comercial de látex utilizado como control y el AcM a 0,5 mg/mL.
DISCUSIÓN
Los componentes utilizados para la síntesis de poliestireno son el monómero estireno, agua como medio de dispersión y persulfato de potasio como iniciador. La aplicación de un protocolo de polimerización en emulsión libre de surfactantes ayuda a evitar las desventajas asociadas con el uso de los mismos cuando el látex se va a utilizar en la elaboración de reactivos para inmunoensayos, tales como la interferencia en la unión de las proteínas a las esferas de poliestireno y la inhibición de la reacción antígeno-anticuerpo.4,9
En el presente trabajo se demuestra que tres lotes consecutivos de látex de poliestireno, obtenidos siguiéndose el protocolo descrito, es similar a látex comerciales en cuanto a limpieza, morfología y composición. El diámetro medio de las partículas obtenidas se determinó dentro del intervalo de 0,8 ± 0,1 µm. Las diferencias observadas en cuanto al tamaño de partícula entre lotes se encuentran dentro de lo esperado ya que utilizamos un método de polimerización en "Batch".11 Este método es simple: los componentes de la reacción se cargan en un reactor agitado, que se calienta para comenzar la polimerización. Como no se añade o elimina ningún material durante toda la polimerización, las condiciones de la reacción cambian con el tiempo, lo que introduce elementos de variabilidad en el producto final de una producción a otra. Para todos los látex se obtuvieron valores de IPD por debajo de 0,1; por lo tanto, son suspensiones monodispersas, es decir que tienen una distribución estrecha del tamaño de las partículas.12 Tanto el tamaño de las partículas como la distribución de la talla de las mismas indican que el látex sintetizado en el presente trabajo es adecuado para aplicaciones diagnósticas con detección visual de los resultados.4
Los potenciales Z para los tres lotes de látex sintetizados en el presente trabajo se determinaron por debajo de -30 mV. Se esperaba un valor negativo debido a la metodología de síntesis que empleó persulfato de potasio como iniciador de la reacción. El potencial Z es un indicador de la estabilidad de una suspensión. Como regla general, en las suspensiones estabilizadas únicamente por repulsión electrostática, como en el presente caso, los potenciales Z por encima de 30 mV (valor absoluto) son indicativos de estabilidad física.13 La estabilidad de las suspensiones de látex se confirmó ya que, al menos durante los primeros 24 meses luego de la fabricación, los tres lotes se mantuvieron desagregados y de color blanco, con partículas individuales.
El AcM 5C11F1 se acopló a la superficie de las esferas de poliestireno empleándose un método de adsorción pasiva. Para los lotes 1, 2 y 3, la reorientación del AcM para acomodar el exceso, hasta la saturación, se produjo a una concentración de anticuerpo de 48, 49 y 63 µg de AcM por mg de esferas, respectivamente. La capacidad de adsorción más alta del lote 3 es resultado del diámetro de partícula inferior con respecto a los lotes 1 y 2, aunque estas diferencias en la cantidad de proteínas adsorbidas no tuvieron significado en el desempeño de los reactivos en la prueba de aglutinación de látex con cepas de N. meningitidis. Se eligió como control una cepa del serogrupo Y ya que las estructuras de los polisacáridos capsulares de ambos serogrupos son similares y podría ocurrir que los anticuerpos dirigidos contra uno de estos polisacáridos tengan reacción cruzada con el otro,14 aunque el AcM 5C11F1 es altamente específico, capaz de reconocer sólo el polisacárido homólogo, lo cual se demuestra en formato de ELISA y de Dot blot.8,15,16
CONSIDERACIONES FINALES
En el presente trabajo se demuestra la especificidad de los reactivos de látex obtenidos con el AcM 5C11F1 para identificar cepas de meningococo del serogrupo W. Estos reactivos pueden ser utilizados para la caracterización de colecciones de dicho microrganismo, en ensayos de identidad de vacunas antimeningocócicas polisacarídicas 17 o para el diagnóstico de la enfermedad meningocócica.
AGRADECIMIENTOS
Al Dr. Carlos Peniche por la ayuda con las mediciones de potencial Z, a la Dr. Bárbara Cedre y a la Lic. Sandra Madariaga por proporcionar las cepas de N. meningitidis y al Dr. Juan G. Arrieta por la revisión del manuscrito original.
APOYO FINANCIERO
Centro de Biomateriales, Universidad de La Habana y por el Programa Nacional de Cuba para el Desarrollo de las Ciencias Básicas (PNCB-2015, Código del proyecto P223LH001-061).
DECLARACIÓN DE CONFLICTOS DE INTERESES
No hay conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Odian G. Principles of polymerization. 3rd Ed. New York: John Wiley & Sons; 1991.
2. Marrero G, Delgado LP, Caroll H, Ortiz N, Musacchio A, Menendez T, et al. Development of a polystyrene latex-based reagent for rheumatoid factor detection. J Pol Eng. 2016;36:239-43.
3. Ortika BD, Habib M, Dunne EM, Porter BD, Satzke C. Production of latex agglutination reagents for pneumococcal serotyping. BMC Res Notes. 2013;6:49.
4. Molina Bolivar JA, Galisteo Gonzalez F. Latex Immunoagglutination Assays. J Macromol Sci Part C- Polymer Rev. 2005;45:59-98.
5. Gella FJ, Serra J, Gener J. Latex Agglutination Procedures in Immunodiagnosis. Pure & Appl Chem. 1991;63:1131-4.
6. Goodwin JW, Hearn J, Ho CC, Ottewill RH. The preparation and characterisation of polymer latexes formed in the absence of surface active agents. Brit Poly J. 1973;5:347-62.
7. Rosado E, Caroll H, Sanchez O, Peniche C. Passive adsorption of human antirrabic immunoglobulin onto a polystyrene surface. J Biomater Sci Polym Ed. 2005;16:435-48.
8. Reyes F, Amin N, Otero O, Aguilar A, Cuello M, Valdés Y, et al. Four monoclonal antibodies against capsular polysaccharides of Neisseria meningitidis serogroups A, C, Y and W135: its application in identity tests. Biologicals. 2013;41:275-8.
9. Bangs Laboratories Inc. Tech. Note 204 Rev. # 003. 2013 [citado 28 Abr 2016]. Disponible en http://www.bangslabs.com.
10. Liang CY, Krimm S. Infrared spectra of high polymers. VI. Polystyrene. J Polym Sci. 1958;27:241-54.
11. Anderson CD, Daniels ES. Emulsion polymerization and latex applications. Rapra Review Reports (Report 160). Shropshire, UK: iSmithers Rapra Publishing; 2003.
12. Beckman C. Inc. User's Manual. 2011 [citado 28 Abr 2016]. Disponible en http://www.beckmancoulter.com.
13. Müller RH, Jacobs C, Kayser O. Nanosuspensions as particulate drug formulations in therapy. Rationale for development and what we can expect for the future. Adv Drug Deliv Rev. 2001;47:3-19.
14. Moore SL, Uitz C, Ling CC, Bundle DR, Fusco PC, Michon F, et al. Epitope specificities of the group Y and W-135 polysaccharides of Neisseria meningitidis. Clin Vaccine Immunol. 2007;14:1311-7.
15. Reyes F, Otero O, Cuello M, Amin N, García L, Cardoso D, et al. Development of four sandwich ELISAs for quantitation of capsular polysaccharides from Neisseria meningitidis serogroups A, C, W and Y in multivalent vaccines. J Immunol Methods. 2014;407:58-62.
16. González Aznar E, Otero Alfaro O, Cabrera Blanco O, Ramírez Bencomo F, Fajardo Sánchez A, Mandariote Llanes A, et al. Evaluación de los anticuerpos monoclonales anti-polisacárido capsular de Neisseria meningitidis serogrupos A, C, Y, W y X para su uso en los ensayos de identidad. VacciMonitor, 2015;4:64-70.
17. Ramírez F, Otero O, Fajardo AB, Cedré B, González E. Reactivos látex basados en anticuerpos monoclonales para la serotipificación de cepas de Neisseria meningitidis. Bioprocesos. 2015;1:1-8.
Recibido: 3 de octubre de 2016.
Aprobado: 2 de noviembre de 2016.
Tamara Menéndez Medina. Centro de Biomateriales (BIOMAT). Universidad de La Habana, Ave. Universidad entre Ronda y G, Plaza, La Habana 10400, Cuba.
Correo electrónico: tamara@biomat.uh.cu