My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Investigaciones Biomédicas
Print version ISSN 0864-0300On-line version ISSN 1561-3011
Rev Cubana Invest Bioméd vol.37 no.1 Ciudad de la Habana Jan.-Mar. 2018
ARTÍCULO ORIGINAL
Validación de prueba diagnóstica. Valor del ultrasonido hidrogástrico en la detección del cáncer gástrico
Validation of diagnostic test. Value of hydrogastric ultrasound in the detection of gastric cancer
Alfredo Hierro González, Rodman Garcia Vaca, Sacha Lazo del Vallin, Ángela Elvírez Gutiérrez
Instituto de Gastroenterología. La Habana, Cuba.
RESUMEN
Introducción: el cáncer gástrico constituye la segunda causa de muerte por cáncer en el mundo.
Objetivo: validar el ultrasonido hidrogástrico en el diagnóstico del cáncer gástrico avanzado.
Métodos: el ultrasonido hidrogástrico fue realizado por dos observadores independientes a 100 pacientes, 30 con cáncer gástrico avanzado, confirmados por endoscopia y biopsia; y 70 pacientes sin cáncer gástrico.
Resultados: por regresión logística se determinó que el engrosamiento de la pared gástrica fue el único signo con valor como predictor de la presencia de cáncer gástrico. La sensibilidad, especificidad, certeza, valor predictivo positivo y valor predictivo negativo del ultrasonido hidrogástrico fueron de 83,3 %; 90, %; 88,0 %; 78,1 % y 92,6 % respectivamente.
Conclusiones: el ultrasonido hidrogástrico es una modalidad diagnostica útil en el diagnóstico del cáncer gástrico avanzado.
Palabras clave: cáncer gástrico; cáncer gástrico avanzado; ultrasonido hidrogástrico.
ABSTRACT
Introduction: gastric cancer still remains one of the most common malignancies worldwide.
Objective: validate the Conventional hydrogastric ultrasound in the diagnosis of the advanced gastric cancer.
Methods: the hydrogastric ultrasound was carried out by two independent observers 30 with cancer patients with advanced gastric cancer, confirmed by endoscopy and biopsy; and 70 patients without gastric cancer.
Results: for logistical regression it was determined that the thickening of the gastric wall was the only sign with value like predictor of the presence of advancedgastric cancer. The sensibility, specificity, certainty, value positive predictive and value negative predictive of the hydrogastric ultrasound in the diagnosis of gastric cancer were of 83,3%; 90;0%; 88,0%; 78,1% y 92,6% respectively.
Conclusions: the Hydrogastric ultrasound is a diagnostic modality useful in the diagnosis of the advanced gastric cancer.
Keywords: gastric cancer; hydrogastric ultrasound; advanced gastric cancer.
INTRODUCCIÓN
A pesar del descenso continuo de las tasas de incidencia y mortalidad por cáncer gástrico (CG), este continúa siendo unas de las principales causas de muerte por cáncer en el Mundo.1-4
La proporción de caso-fatalidad de CG es más alta que en el cáncer de colon, de mama y próstata debido a que presenta mayor malignidad en comparación con estos. A pesar de los avances en su diagnóstico, la enfermedad es usualmente detectada después de la invasión de la muscular propia.3,5
Según el Anuario Estadístico de Salud en el año 2016, el CG ocupó el octavo lugar entre las causas de muerte por neoplasias malignas (NM) y el segundo entre las digestivas.6
Desde 1976, Lutz H7 comenzó a hablar de la posible utilidad del ultrasonido abdominal convencional (USAC) para establecer ciertos patrones ultrasonográficos comunes que sugerían la presencia de algunas lesiones que ocupaban espacio en el estómago y en el intestino.
El ultrasonido hidrogástrico (USHG) es una técnica de utilidad en el estudio del CG que consiste en la realización de un USAC habiendo administrado previamente al paciente una cantidad variable de agua (generalmente, entre 100-500 mL). El objetivo es crear una interfase líquida en el estómago que permita una adecuada ventana acústica para la transmisión de los ultrasonidos y de esta manera, permitir la visualización de las capas de la pared gástrica de forma similar a como se observan mediante el ultrasonido endoscópico (USE) y así permitir el diagnóstico de patologías que se asienta en ella.8-11
Es una técnica de imagen rápida, de bajo costo y no invasiva, que puede ser útil para establecer el diagnóstico clínico y en los primeros pasos de la evaluación de las lesiones submucosas de la pared gástrica.9,12
Las diferentes capas de la pared gástrica se observan de manera similar a como se visualizan mediante el USE. Las lesiones que plantean mayor dificultad para su visualización son aquellas situadas en el fondo gástrico. Para una correcta exploración es necesario realizar cortes longitudinales, transversales y oblicuos, ayudándose de la movilización del paciente, con el fin de facilitar una correcta visualización de todo el estómago. Así, en decúbito lateral izquierdo se puede explorar fondo y porción proximal del cuerpo, en decúbito supino se visualizan cuerpo medio-distal y el antro; finalmente, en decúbito lateral derecho se explora el antro en su totalidad.9,11,13
El USHG es una técnica que puede detectar cambios en la estructura de la pared gástrica que incrementen el índice de sospecha de CG y priorizar el estudio endoscópico en los pacientes seleccionados. Es un proceder que complementa e incrementa el rendimiento del USAC. 9,11,13
Ambos tipos de ultrasonido están disponibles en todos los centros hospitalarios del país, donde se cuenta además con el personal altamente especializado en su realización.
¿En qué medida el USHG puede ser útil en el diagnóstico del CG? ¿Cuáles son las alteraciones a nivel de la pared gástrica que aumenten el índice de sospecha de CG?, ¿Sera útil en todos los en todas las localizaciones?
Estas y otras interrogantes continúan aún sin resolverse. Por tal motivo los autores se propusieron realizar la presente investigación que tiene como objetivo validar el ultrasonido hidrogástrico como medio de diagnóstico del cáncer gástrico avanzado en el Instituto de Gastroenterología en el período 2013-2015.
MÉTODOS
Investigación aplicada, donde se validó el USHG como técnica de diagnóstico del cáncer gástrico avanzado (CGA) de tipo epitelial. La investigación se ejecutó en el servicio de Endoscopia del tracto digestivo superior (TDS) y de Imagenología del Instituto de Gastroenterología, durante el período comprendido entre Mayo del 2014 a diciembre del 2016.
Se incorporaron al estudio todos los casos que asistieron a consulta especializada del TDS del Instituto de Gastroenterología, que por su sintomatología demandaron la realización de una endoscopia del TDS y que cumplían con los criterios de inclusión para el estudio, a los cuales se les indicó, además; previo a la endoscopia, dos ultrasonidos hidrogástricos. Se consideraron pacientes positivos aquellos de 19 años o más, de ambos sexos, con diagnóstico endoscópico de CG, confirmado histológicamente, que consintió participar en la investigación y negativos aquellos que demandaron la realización de endoscopia del TDS que no tuvieron lesión sugestiva de CG al momento de realizar el proceder y consintieron participar en el estudio. Finalmente, el universo quedó constituido por 100 pacientes (30 casos "positivos" y 70 casos negativos).
El estudio endoscópico (en pacientes positivos y negativos) se realizó en el departamento de endoscopia de acuerdo a los procedimientos vigentes, con dos video endoscopios (marcas "GIF-H260" y "GIF-FQ260Z") por diferentes endoscopistas, el diagnóstico se emitió según las recomendaciones establecidas.
Los USHGs fueron realizados en el 100 % de los casos con un Equipo Aloka 4000, con un transductor de abdomen 3,5 MHZ, en diferentes momentos por dos diferentes imagenólogos, con un intervalo de tiempo entre ellos no mayor de cinco días. Fue requisito indispensable que el imagenólogo no conociera los resultados del ultrasonido realizado por el otro especialista.
Las variables en estudio fueron la edad, sexo, localización endoscópica de la lesión y tipo de imagen (alteraciones de la distensibilidad ymotilidad, definición de las capas, engrosamiento de la pared, irregularidad de la mucosa, lesión que crece hacia la luz y su localización, otras alteraciones).
Para el análisis de la edad se utilizaron números absolutos y porcentajes, así como la media y desviación estándar. Para variables cualitativas como el sexo se utilizó números absolutos y porcentajes.
Para conocer el grado de concordancia entre los observadores al clasificar los pacientes según la imagen ultrasonográfica observada se calculó el coeficiente de Kappa (K).
El cálculo de la sensibilidad (S), la especificidad (E) y certeza (C), se realizó de forma automatizada. El valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) se calcularon por teoría Bayesiana.
Con la información recogida se creó una base de datos en Excel. El análisis estadístico se realizó mediante los paquetes estadísticos SPSSS versión 23.0 y Epidat 3.1. Se realizó el cálculo del cociente de probabilidad o razón de verosimilitud además del odds ratio diagnóstica.
La investigación se realizó según los preceptos establecidos en el Código Internacional de Ética Médica.14 y los que competen a las investigaciones biomédicas en humanos contemplados en la Declaración de Helsinki, adoptada por la 18 a Asamblea de la Asociación Médica Mundial en junio de 1964 y enmendadas en los años 1975, 1983, 1989, 1996 y 2000, junto a las notas de clasificación agregadas en el año 2002 y 2004. 15
RESULTADOS
Se incluyeron en la investigación un total de 100 pacientes, 30 casos fueron positivos a CG y 70 negativos, fue necesario excluir cinco pacientes del grupo "casos positivos" por presentar vómitos con la ingestión del agua en las cantidades mínimas requeridas para la realización del USHG.
La media de edad para los casos fue de 62,7 ±10,2. El grupo más afectado fue el de 60 años o más (56,7 %). Existió predominio de CG en los pacientes del sexo masculino (63,3 %).
En relación al USHG el índice de concordancia negativa inter-observadores fue mayor para las lesiones que crecen hacia la luz (80,0 %), mientras que existió mayor concordancia positiva para el engrosamiento mucoso (41 %). El mayor porcentaje de concordancia lo obtuvo la disminución de la distensibilidad de las paredes gástricas (92 %), que a su vez obtuvo el mayor valor del índice de Kappa (IK= 0,759, p 0,00), seguido de la disminución de la motilidad (IK= 0,688, p ,000) (tabla 1).
Fueron seleccionados como signos presentes, aquellos signos ultrasonográficos descritos por ambos observadores. Se realizó regresión logística para determinar cuáles de los signos tenían un valor como predictores de la presencia de CG.
El único signo con valor como predictor de la presencia de CG fue el engrosamiento de la pared gástrica, por lo tanto, definió la positividad de la prueba.
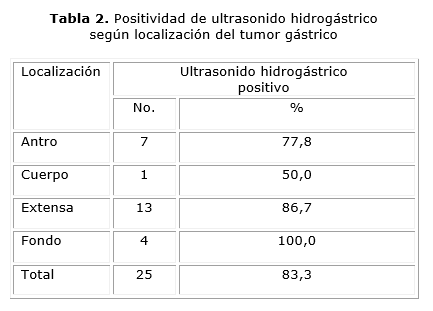
Con estas aclaraciones; podemos observar en la tabla 2, que el mayor porcentaje de positividad el USHG; fue a nivel del fondo (100 %), seguido de la localización extensa (86,7 %). En localizaciones como el antro la positividad fue de 77,8 %.
El 78,1 % de los casos positivos a CG y el 21,9 % de los negativos fueron positivos al USHG (presentaban engrosamiento de la pared). Su sensibilidad fue del 83,3 % (IC95 % entre 66,4 %-92,7 %), la especificidad fue del 90 % (IC95 % 80,8 %-95,1 %), el VPP fue 78,1 %,(IC 95 % 61,2 %-89,0 %) mientras que el VPN resultó del 92,6 %(IC95 % 83,9 %-96,8 %). Proporción de falsos positivos: 10,0 %; IC 95 % (4,9 %-19,2 %), proporción de falsos negativos: 16,7 %; IC 95 % (7,3 %-33,6 %), exactitud: 88,0 %; IC 95 % (80,2 %-93,0 %), Odds ratio diagnóstica: 45,0 %; IC 95 % (13,05 %-155,14 %), índice J de Youden de 0,7 (tabla 3).
DISCUSIÓN
La endoscopia convencional valora de forma deficitaria las lesiones submucosas del tracto digestivo por la imposibilidad de su observación directa, no permite determinar su tamaño de manera adecuada, establecer un diagnóstico etiológico en la mayoría de los casos, ni valorar la capa de origen del tumor. Sin embargo, la USE permite; en la mayoría de las ocasiones, diferenciar con cierta seguridad las lesiones malignas de las benignas, medir su tamaño y establecer su capa de origen, es la técnica de elección para establecer la presencia y las características de un tumor submucoso y si éste es subsidiario de tratamiento; permitiendo además seleccionar los casos que pueden ser extirpados endoscópicamente sin excesivos riesgos. Sin embargo, es una técnica compleja, que requiere conocimientos endoscópicos y ecográficos que no está disponible en todos los centros hospitalarios.16
El USHG puede ser una buena alternativa al USE para el estudio de las lesiones submucosas y la estadificación de tumores situados en el antro gástrico en los pacientes en que no se pueda disponer del USE o no se pueda realizar, es una técnica muy fiable, poco costosa, y muy bien tolerada por los pacientes. Esta permite una mejor visualización y mayor precisión de las capas del tubo digestivo, en comparación con el USAC.16
El USHG a pesar de ser un método inocuo en el que solo se le administra cierta cantidad de agua al pacientes, no está exento de molestias y dificultades en su realización, tal es el caso de los pacientes que presentan un obstáculo o dificultad al vaciamiento gástrico y no toleran la ingestión de la cantidad mínima necesaria de agua para la correcta visualización de las estructuras de la pared gástrica. En algunos casos, la necesidad de una conducta quirúrgica urgente con el fin de salvar la vida del paciente y/o mejorar su calidad de vida,hace imposible la realización del proceder ecográfico; todo esto, en conjunto con algunas reacciones indeseables, como las náuseas, vómitos y sobre todo la aparición o intensificación del dolor epigástrico, constituyeron aspectos negativos; que en algunos casos, impidieron la realización del proceder y en otros ocasionaron molestias que se deben señalar como aspectos negativos del USHG.
Los resultados obtenidos guardan similitud con otros estudios en relación al grupo etario.1,17,18
En las últimas décadas se ha observado un incremento de la frecuencia de los tumores en cuerpo y fondo (cáncer gástrico proximal) y de la unión esófago-gástrica, lo cual se sospecha está asociado al cambio en la prevalencia del tipo histológico hacia el tipo difuso.19
Todos los casos fueron canceres avanzados aspecto que se corresponde con lo reportado por Prieto Grave de Peralta A,20 pero difiere de Gómez Zulueta M y colaboradores.21
La detección del CG incipiente y la de los tumores en estadios temprano es baja (10-20 %). Más del 80 % de las NM son avanzadas al momento del diagnóstico y la posibilidad de curación es baja, con niveles de supervivencia entre el 10-15 % a los cinco años.22
En el 50 % el tumor abarcó más de un área del estómago, en segundo lugar de frecuencia el antro fue la región afectada.
Segura Cabral JM y colaboradores,8 asegura que el estudio de la patología gástrica en la actualidad tiene su base inicial obligada en la realización de una endoscopia oral; no obstante, todavía hoy los métodos diagnósticos complementarios a la misma presentan algunos inconvenientes, tales como su relativamente baja sensibilidad (radiología convencional con contraste) o su escasa disponibilidad y alto precio como la tomografía axial computarizada (TAC), la imagen de resonancia magnética nuclear y ultrasonido endoscópico.
Pérez I y colaboradores,23 hace referencia a que en Japón la TAC es el examen estándar en los centros de pesquisa para su estadiaje preoperatorio, pero tiene sus limitaciones para evaluar infiltración en la pared gástrica y masas hepáticas no precisas, así como metástasis menores de 5 mm, su exactitud es de 66 %. De allí la evolución de este estudio a la tomografía computarizada helicoidal con contraste endovenoso-oral positivo o negativo que mejoran la sensibilidad de la TAC. Más precisa aún, con una certeza de 85 % es la tomografía computarizada de multidetección. La tomografía computarizada por emisión de positrones (TC-PET) es la de mayor resolución y permite detectar metástasis linfática menores de 5 mm en un 85 %; detecta recidivas, señala el pronóstico, mide la respuesta terapéutica, tiene mayor sensibilidad para la detección de metástasis hepáticas y pulmonar, aunque no así para las pleurales, peritoneales y pobre sensibilidad en pacientes con tumores de células en anillo. Es un estudio costoso y su disponibilidad es limitada.
En cuanto a la imagen de resonancia magnética nuclear (IRM), sus resultados son comparables a los obtenidos con la TAC. Su indicación formal es cuando el medio de contraste combinado con yodo, está contraindicado por reacción anafiláctica o falla renal, también para confirmar la presencia de masas hepáticas imprecisas observadas en la TAC.23
Otro de los métodos diagnósticos disponibles es el USE, el cual contribuye eficazmente al estudio tumoral basado en el número de capas de la pared gástrica que están comprometidas en un 80 % y certeza de estadificación ganglionar (N) de un 70 %. Su mayor utilidad es en el CG precoz porque identifica tumores intramucosos, permitiendo la resección mucosa endoscópica en vez de realizar gastrectomía.22,23
Pérez Torres E y colaboradores,22 señalan además, que el ultrasonido y la radiografía de tórax para determinar la presencia de metástasis, ha sido superado por la TAC toraco-abdominal o bien, la IRM.
El estudio ecográfico convencional del tracto gastrointestinal ofrece dificultades porque el contenido aéreo en el interior de las asas interfiere con la transmisión de los ultrasonidos originando artefactos; por otra parte, la aparición de diversas imágenes formadas por asas intestinales conducen a diagnósticos erróneos. En condiciones normales no es posible diferenciar todas las partes del estómago, ya que el fondo y el cuerpo gástrico se encuentran tapados por la parrilla costal y además el contenido aéreo de su interior impide valorar correctamente su anatomía y posibles lesiones a estos niveles, sin embargo; el antro gástrico puede ser fácilmente reconocido.10 A pesar de ello, el USAC es cada vez más usado para la detección y evaluación de lesiones gastrointestinales.24-27
Por otra parte, si existe una distensión gástrica o se consigue ésta tras ingerir el paciente un volumen de aproximadamente medio litro de agua, tanto el fondo como el cuerpo gástrico pueden ser explorados con el paciente en decúbito lateral izquierdo y decúbito supino. El antro gástrico puede ser fácilmente reconocido con el transductor en epigastrio como una pequeña estructura en "Diana", a nivel de la línea media. La ecografía en tiempo real permite observar los movimientos peristálticos característicos del estómago. Por ello, hay autores que consideran que la USHG es una técnica que nos permite contribuir a mejorar la capacidad diagnóstica y terapéutica sobre determinados procesos gástricos, con las ventajas de la inocuidad, accesibilidad, facilidad de realización y bajo precio.8
Algunos autores como Segura Cabral JM y colaboradores,27 plantean que el USHG es una excelente alternativa en el estudio y valoración de tumores gástricos submucosos.
Con la realización de este trabajo se pretende demostrar que el USHG pueda ser un complemento a la endoscopia y una alternativa a otros métodos diagnósticos, por su inocuidad, fácil manejo, disponibilidad y de bajo costo.
Martínez Ares D y colaboradores,16 reconocen que el USE es la técnica de elección en la evaluación de lesiones submucosas, pero que desafortunadamente no está disponible en todos los centros hospitalarios. Plantean que el USHG puede ser útil en elestadiamiento de los tumores gástricos. Afirman que el antro gástrico, al contrario que el fondo, es fácil de explorar mediante esta técnica y permite estudiar con precisión los tumores situados en esta zona.
También, pudieron medir el tamaño del tumor, establecieron con claridad su capa de origen y, con las características ultrasonográficas que presentaba sospechar su naturaleza maligna. El diagnóstico se confirmó tras el estudio de la pieza quirúrgica. Estos autores señalan que al margen de las limitaciones que nos podemos encontrar en la exploración ecográfica de otras localizaciones, la exploración gástrica es sumamente sencilla, no requiere sedación y no es invasiva, lo que supone una gran ventaja con respecto al USE.
La disminución de la distensibilidad de la pared gástrica tuvo una fuerza de la concordancia "fuerte" (valor de K entre 0.61 - 0.80).
Para la valoración de la S, E, VPP y VPN fue seleccionado como signo presenteel engrosamiento de la pared gástrica, por ser el signo que con mayor frecuencia fue descrito por ambos observadores y por ende tuvo valor como predictor de la presencia de CG y definió la positividad de la prueba.
Los resultados no se corresponden con lo reportado por Segura Cabral JM y colaboradores8 quienes insisten en señalar las dificultades que se presentan durante la exploración ecográfica para la visualización de lesiones ubicadas en el fondo y el cuerpo gástrico.8
Segura Cabral JM y colaboradores8 exploraron por medio del USHG a 40 pacientes diagnosticados por endoscopia con diferentes tipos de neoplasias gástricas, para evaluar la utilidad de este método en la detección de tal lesión y analizar las características de las imágenes ultrasonográficas y su correlación con los hallazgos anátomo-patológicos.
La sensibilidad de la detección de las lesiones fue del 87,5 %, estando cerca del 100 cuando esta se localizan cerca del antro, mostrando más dificultades cuando se localizan en cuerpo y fondo debido al gas y a la interposición de la parrilla costal. De esta manera; refieren que, en cuanto a la capacidad de detección de las lesiones en función de su localización observaron que de las cuatro lesiones localizada en fondo, una no fue visualizada (25 % de falsos negativos). De las 17 lesiones localizadas en cuerpo tres no fueron visualizadas (17,6 % de falsos negativos) y de las 19 lesiones localizadas en antro solamente una no fue detectada en la exploración (5,8% de falsos negativos). Por otro lado al considerar los aciertos según la localización del tumor, detectaron una mayor sensibilidad en los situados en el antro gástrico (100 %), frente a los del cuerpo (69 %).
Los autores piensan que una explicación a las diferencias con respecto a lo reportado en la literatura, pudiera estar en relación con el grosor de la pared abdominal de los pacientes con lesiones a nivel del fondo y cardias gástrico, pues fueron aquellos que presentaron mayor afectación del estado nutricional, con gran pérdida de peso y del panículo adiposo a nivel de la pared abdominalen los meses previos. Otro aspecto que puede haber influido en estos resultados es el nivel de experiencia acumulada de las imagenólogas participantes en la investigación, quienes; a pesar de contar con un equipo de poca resolución han demostrado pericia y entrenamiento en la visualización de lesiones por medio del USC.
Los autores deben señalar que los pacientes negativos a CG, presentaban lesiones endoscópicas no neoplásicas que podrían perfectamente tener traducción ecográfica, aspecto que constituye una fuente de sesgo importante a la investigación.
En un estudio prospectivo realizado por Heng Xue y colaboradores,17 durante tres años, para comparar la utilidad del USC y el USC mejorado con contraste en pacientes con CG o gastritis, de los 82 casos estudiados, 52 tenían CG (confirmados histológicamente). Para el USC la estratificación de la pared abdominal no estaba preservada en 1/3 de los casos (21/58; 36,2 %), mientras que en los casos de gastritis (0/24, 0 %) no se comportó de esa manera (p < 0.001); sin embargo, este signo no fue incluido en nuestra investigación. Ellos demostraron engrosamiento difuso o segmentario de la pared gástrica por medio del USC en el 63,8 %, el grosor medio de la pared lesionada fue de 1,58 ± 0,53 cm (rango 0,7-3,3 cm).
El USHG en el estudio de la patología gástrica se basa fundamentalmente en dos aspectos: por un lado la visualización de las cinco capas que conforman la pared del estómago, que están constituidas por líneas hiperecogénicas que se alternan con otras bandas hipoecogénicas; así, la interfase cavidad gástrica-mucosa, la submucosa y la serosa están representadas por líneas hiperecogénicas, mientras que la mucosa y la musculares mucosa están representadas por bandas hipoecogénicas. Las enfermedades causantes de engrosamiento parietal gástrico son numerosas, pudiendo originar una imagen en "pseudorriñón".28
En el estudio realizado por Martínez Ares D y colaboradores,29 en el que se evaluó la precisión diagnóstica de la ecografía se incluyeron pacientes en los que se sospechaba específicamente la presencia de cáncer gástrico o de colon, o en el peor de los casos, algunos de los pacientes ya habían sido diagnosticados mediante técnicas endoscópicas o radiológicas. Este hecho podría tener gran repercusión sobre los resultados obtenidos. DE forma adicional, en estos pacientes la utilidad de la ecografía parece marginal ya que al día de hoy no existe ninguna duda de que el patrón oro en el diagnóstico de las neoplasias gástricas y colorrectales es la endoscopia con toma de biopsias. Así, en la mayoría de las guías de prácticas clínicas, consensos y recomendaciones de expertos se recoge la obligatoriedad de realizar una exploración endoscópica ante la presencia de los llamados síntomas de alarma que nos obligan a descartar una neoplasia gástrica o colorrectal.
Martínez Ares D y colaboradores,29 hacen referencia a un trabajo muy antiguo realizado por Worlicek y cols. en el que informaron una sensibilidad y una especificidad del 82,4 % (83,3 % en el caso nuestro) y 94,9 % (90 % en la presente investigación) respectivamente, empleando el USHG.
Kuntz C y colaboradores30 compararon la utilidad del USHG con el USE para el estadiamiento locorregional del CG. Obtuvieron una exactitud para "T" (clasificación TNM) del 74 % en el caso del USE vs 46 % para el USHG. La exactitud para "N" del USE fue de 86 % y 61 % que obtuvieron con el USHG, concluyen que el USHG no puede reemplazar el USE en el estadiamiento del CGA, sin embargo, señalan que cuando se realiza en conjunto con el USAC, proporciona información útil sobre la fase local del tumor, principalmente en los casos avanzados o estenóticos.
Segura Cabral JM,8 exploraron con el USHG a 40 pacientes diagnosticados por endoscopiacon diferentes tipos de neoplasias gástricas, con el objeto de evaluar la utilidad de este método en la detección de tal lesión y analizar las características de las imágenes ultrasonográficas y su correlación con los hallazgos anátomo-patológicos. La sensibilidad de la detección de las lesiones fue del 87,5 %, estando cerca del 100 cuando estas se localizaban cercanas al antro, las mayores dificultades en la detección de las lesiones se presentaron cuando estas se localizaban en el cuerpo y fondo. Una clara correlación fue observada entre las imágenes de las ultrasonografía y los hallazgos anátomo-patológicos. Concluyen que ésta puede ser una técnica complementaria a la gastroscopia en el diagnóstico de lesiones submucosas y las condensaciones extrínsecas de la pared gástrica. La infiltración de la pared puede delimitarse en las lesiones neoplásicas y así contribuir para corregir estratificación de "T" del tumor, aunque esto debe confirmarse en estudios más extensos. De los 40 casos estudiados lograron visualizar la lesión en 35, lo que supone un 87,5 % de verdaderos positivos. De las 27 lesiones excrecentes infiltrativas, cuatro no consiguieron ser visualizadas y una de las cinco lesiones localizadas de pared tampoco fue visualizada, mientras que todas las lesiones infiltrativas difusas y endoluminales no infiltrativas fueron visualizadas.
En esta misma publicación, Segura Cabral JM8 hace referencia a otro trabajo que tuvo como objetivo determinar la validez de la USHG en la evaluación preoperatoria del grado de infiltración transmural (T) del CG, estudiaron 22 pacientes previamente diagnosticados con adenocarcinoma gástrico mediante endoscopia y biopsia. Los resultados de la USHG se compararon con los obtenidos tras el estudio anátomo-patológico de la pieza quirúrgica, según la clasificación TNM. Todas las exploraciones se realizaron en la semana previa a la cirugía. El USHG clasificó correctamente 18 de los 22 pacientes (81,8 %). Los cuatro errores fueron por infravaloración: un T3 se clasificó como T1 y tres T4 como T3. Por otro lado al considerar los aciertos según la localización del tumor, detectaron una mayor sensibilidad en los situados en el antro gástrico (100 %), frente a los del cuerpo (69 %). El tiempo medio por exploración fue de 15 minutos y no se registraron complicaciones en relación con la prueba. Concluyen que la USHG fue una técnica altamente fiable en el diagnóstico preoperatorio del grado de infiltración transmural del CG (82 % en su experiencia) y por tanto competitiva frente a técnicas clásicas como la TAC, la RMN y el USE. La fiabilidad fue mayor en los cánceres localizados en el antro que en los proximales (cuerpo y fondo). Por otro lado la consideran una técnica inocua, no invasiva y barata.
Existen elementos importantes a tener en cuenta a la hora de analizar y comparar el comportamiento diferente de los niveles de S, E, VPP y VPN entre la presente investigación y el resto. En primer lugar, la forma de inclusión de los pacientes fue diferente, en todos los reportes del tema incluyen los pacientes a partir diagnostico endoscópico e histológico de CG y posteriormente realizan el USHG y realizan el análisis a partir de un solo observador. En presente estudio, partiendo de la sospecha clínica se realizaron ambos USHG previos al proceder endoscópico. La participación de dos observadores obligó a realizar un análisis del nivel de concordancia interobservadores y definir por medio de una regresión logísticacuáles signos tenían un valor como predictores de la presencia de CG.
Otro elemento a tener en cuenta en el análisis de las diferencias observadas, es la calidad de los equipos de ultrasonido utilizados en cada una de las investigaciones, en nuestro caso, se utilizó uno de muchos años de explotación.
En un estudio muy antiguo, Worlicek H y colaboradores,12 obtuvieron una sensibilidad y una especificidad empleando el USHG del 82,4 % y 94,9 % respectivamente. Estos resultados fueron muy similares a los nuestros.
Boyacioglu S y colaboradores31 también con técnica hidrogástrica, logran una sensibilidad inferior a la nuestra, de sólo el 78 %.
Tous F y colaboradores,32 publicaron el único estudio comparativo de la ecografía convencional y la ecografía hidrogástrica. La sensibilidad tanto de la técnica convencional (69 %) como de la exploración hidrogástrica (75 %) fueron menores de las esperadas, aunque obtuvieron una elevada especificidad (99 %).
Segura Cabral JM y colaboradores28 comunicaron una sensibilidad del USHG discretamente superior a la nuestra (87,5 %). Mientras que; Quiroz Moreno R y colaboradores33 en un estudio con tan sólo 20 tumores gástricos, refieren una sensibilidad aun mayor (del 95 %).
Lim JH y colaboradores34 establecieron una sensibilidad del 84 %, y finalmente, Richter y colaboradores35 en un estudio en el que comparan el USHG con la TAC abdominal, realizada también con repleción gástrica de líquido, obtienen una sensibilidad para la ecografía de 77 %.
CONSIDERACIONES FINALES
El ultrasonido hidrogástrico, es una técnica sencilla de realizar, de fácil acceso y rentable, que podría suponer una alternativa al ultrasonido endoscópico en el caso de no disponer del mismo o no ser posible su realización. Podría ser una técnica complementaria a la gastroscopia en el diagnóstico del cáncer gástrico avanzado por su elevada sensibilidad y especificidad.
Declaración de conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Hur H, Paik MJ, Xuan Y, Nguyen D-T, Ham I-H, et al. Quantitative Measurement of Organic Acids in Tissues from Gastric Cancer Patients Indicates Increased Glucose Metabolism in Gastric Cancer. PLoS ONE. 2014 [citado 5 Feb 2017];9(6):e98581. doi:10.1371/journal.pone.0098581
2. Abrams JA, Quante M. Adenocarcinoma of the stomach and other Gastric Tumors. En: Sleisenger and Fordtran's Gastrointestinal and Liver Disease. 10 ed. animprint of Elsevier Inc. 2016 [citado 5 Feb 2017]:901-20. Disponible en: https://www.clinicalkey.es/#!/content/3-s2.0-B9781455746927000545
3. Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J GastrointestOncol. 2012 [citado 25 Feb 2017];4(7):156-69. Disponible en: http://www.wjgnet.com/1948-5204office
4. Mellouki I, laazar N, Benyachou B, Aqodad N, Ibrahimi A. Epidémiologie du cáncer gastrique: expérienced'un centre hospitaliermarocain. Pan AfrMed J. 2014 [citado 5 Feb 2017];17:42. DOI: 10.11604/pamj.2014.17.42.3342
5. Tian T, Xiao L, Du J, Zhu X, Gu Y, Qin N, et al. Polymorphisms in CARS are associated with gastric cancer risk: a two-stage case-control study in the Chinese population. Gastric Cancer. PubMed PMID. 2017 Apr 13 [citado 5 Feb 2017]. doi: 10.1007/s10120-017-0717-6.
6. Cuba. Ministerio de Salud Pública. Dirección Nacional de Registros Médicos y Estadísticas de Salud. Anuario estadístico de salud 2016. La Habana. 2017 [citado 5 Feb 2017]:65-68. Disponible en: http://bvscuba.sld.cu/anuario-estadistico-de-cuba/
7. Lutz H. Ultrasound patterns of space ocupying lesions of the stomach and the intestine. Ultrasound Med Biol. 1976;2:129-32.
8. Segura Cabral JM. Ecografía hidrogástrica: su utilidad en el estudio de las lesiones neoformativas. Revista de la Sociedad Valenciana de Patología Digestiva. 1999 [citado 15 Feb 2017];18(2). Disponible en: http://www.elsevier.es/es-revista-revista-sociedad-valenciana-patologia-digestiva-160-articulo-ecografia-hidrogastrica-su-utilidad-el-13009921
9. López Cano A, Soria de la Cruz MJ, Rendón Unceta P, Moreno Gallego M, Guezmes Domingo A, Martín Herrera L, et al. Lipoma gástrico diagnosticado mediante ecografía transcutánea con llenado de líquido del estómago. Rev Esp Enferm Dig. 1991;80:261-3.
10. López Cano A, Álvarez MM, Báez JM, Soria MJ, Rodríguez R, Herrero MI, et al. Utilidad de la ecografía transcutánea con llenado de líquido del estómago: presentación de un leiomiomaepiteloide. Gastroenterol Hepatol 1990;13:352-5.
11. Tsai TL, Chagchien CS, Hu TH. Demostration of gastric submucosal lesions by high-resolution transabdominalsonography. J Clin Ultrasound. 2000;28:125-32.
12. Worlicek H, Dunz D, Engelhard K. Ultrasonic examination of the wall of the fluid-filled stomach. J Clin Ultrasound. 1989;17:5-14.
13. Segura Cabral JM, Olveira A, Conde Gacho P, Erdozain JC, Suárez J. HydrogastricSonography in the Preoperative Staging of Gastric Cancer. J Clin Ultrasound. 1999;27:499-504.
14. Italia. Código Internacional de Ética Médica [Internet]. Adoptado por la 3ra Asamblea General de la AMM en Londres, Inglaterra, octubre 1949 y enmendado por la 22a Asamblea Médica Mundial, Sydney, Australia, agosto 1968 y la 35a Asamblea Médica Mundial, Venecia, Italia. 1983 [citado 20 May 2009]. Disponible en: http://www.wma.net/s/policy/pdf/17a.pdf .
15. Tokio. Declaración de Helsinki de la Asociación Médica Mundial. Principios éticos para las investigaciones médicas en seres humanos. Tokio; 2004 [citado 20 May 2009]. Disponible en: http://www.wma.net./s/policy/pdf/17c.pdf
16. Martínez Ares D, Martínez Cadillaa J, Cáceres Alvaradob N, González Carreró-Fojónc J, Martín-Granizo Barrenecheaa I, Abel Pallarés Peral, et al. Tumor estromal gástrico de riesgo intermedio: diagnóstico mediante ecografía hidrogástrica. Gastroenterol Hepatol. 2006;29(10):622-4.
17. Heng Xue, Hui-yu Ge, Li-ying Miao, Shu-min Wang, Bo Zhao, Jin-rui Wang, et al. Differential diagnosis of gastric cancer and gastritis: the role of contrast-enhanced ultrasound (CEUS). AbdomRadiol. 2016 [citado 10 Ene 2017]. DOI: 10.1007/s00261-016-0952-z. Disponible en: http://health.springer.com/article/10.1007/s00261-016-0952-z
18. Hierro González A, Paulo de Uime Ferreira E, González Fabián L. Comportamiento clínico, epidemiológico, endoscópico e histológico del cáncer gástrico de tipo epitelial. Rev Cubana de Investigaciones Biomédicas. 2016;35(1):1-17.
19. Rodríguez Vargas B, Arevalo Suarez F, Monge Salgado E, Montes Teves P. Características histológicas y endoscópicas del cáncer gástrico diagnosticado en un hospital nacional del Callao, Peru. RevPeruMedExp Salud Pública. 2013 [citado 10 Ene 2017];30(1):12-7. Disponible en: http://web.ebscohost.com/ehost/pdfviewer/pdfviewer?vid=11&sid=1b0f1328-9f24-466b-9b53-0dd3cf5ec992%40sessionmgr10&hid=12
20. Prieto Grave de Peralta AC. Factores de riesgo asociados al cáncer gástrico. [Tesis para optar por el título de Especialista en Gastroenterología]. La Habana: MINSAP; 2012.
21. Gómez Zulueta M, Otero Regino W, Caminos JE. Cáncer gástrico en pacientes jóvenes en Colombia. Rev Col Gastroenterol. 2012 [citado 10 Ene 2017];27(3):166-72. Disponible en: http://web.ebscohost.com/ehost/pdfviewer/pdfviewer?vid=11&sid=1b0f1328-9f24-466b-9b53-0dd3cf5ec992%40sessionmgr10&hid=12
22. Pérez Torres E, Abdo Francis JM, Zavala Solares MR, Badillo Vázquez GY, Casillas Guzmán GB. Tratamiento quirúrgico del cáncer gástrico en el Servicio de Gastroenterología del Hospital General de México. Rev Med Hosp Gen Mex. 2010 [citado 10 Mar 2017];73(1):9-15. Disponible en: http://web.ebscohost.com/ehost/pdfviewer/pdfviewer?vid=11&sid=1b0f1328-9f24-466b-9b53-0dd3cf5ec992%40sessionmgr10&hid=12
23. Pérez I, Bastardo D, Álvarez S, Peña C, Yoraco G. Actualización en el Diagnóstico y Tratamiento del Cáncer Gástrico. INFORMED. 2010 [citado 10 Ene 2017];12(10):501-10. Disponible en: http://web.ebscohost.com/ehost/pdfviewer/pdfviewer?vid=11&sid=1b0f1328-9f24-466b-9b53-0dd3cf5ec992%40sessionmgr10&hid=12
24. Zhijun Liu, Jintao Guo, Shupeng Wang, Ying Zhao, Jing Li, Weidong Ren, et al. Evaluation of transabdominal ultrasound after oral administration of an echoic cellulose-based gastric ultrasound contrast agent for gastric cancer. BMC Cancer. 2015 [citado 10 Ene 2017];15:932. DOI 10.1186/s12885-015-1943-0. Disponible en: http://health.springer.com/article/10.1186/s12885-015-1943-0
25. Liu Z, Guo J, Sun S, Ren W, Tang S, Xie L, et al. Evaluation of transabdominal ultrasound after oral administration of an echoic cellulose-based gastric ultrasound contrast agent for demonstrating small gastric subepithelial masses. Abdom Imaging. 2014;39(2):424-31.
26. Liu Z, Guo J, Ren W, Sun S, Tang S, Xie L, et al. A gastric calcifying fibrous pseudotumor detected by transabdominal ultrasound after oral administration of an echoic cellulose-based gastrointestinal ultrasound contrast agent. Ultraschall Med. 2014;35(2):181-3.
27. Liu Z, Guo J, Li J, Wang S, Tang S, Xie L, et al. Gastric lesions: demonstrated by transabdominal ultrasound after oral administration of an echoic cellulose-based gastric ultrasound contrast agent. Ultra schallMed. 2015 [citado 10 Mar 2017]. Doi: http://dx.doi.org/10.1055/s-0034-1399719 .
28. Segura Cabral JM, Conde Gacho P, Comas Redondo C, Oliveira Martin A, Segura Grau A, Erdozain Sosa JC, et al. The usefulness of hydrogastric ultrasonography in the detection of neoplastic lesions of the gastric wall. Gastroenterología y Hepatología. 1999 [citado 10 Mar 2017];22(2):63-6. Disponible en: http://europepmc.org/abstract/med/10193088
29. Martínez Ares D, Alonso Aguirre PA, Souto Ruzo J, Granizo Barrenechea MI, Pereira Bueno S, Cid Gómez L, et al. La ecografía es una técnica sensible en el diagnóstico de las neoplasias gastrointestinales en pacientes sin síntomas localizadores. Rev. esp. enferm. Dig. 2009 [citado 10 Mar 2017];101(11). Disponible en: http://es.scribd.com/doc/11627030/Ecografia-Del-Tracto-Gastrointestinal#scribd
30. Kuntz C, Dux M, Pollock A, buhl K, Herfarth C. Hydrosonography as an alternative or supplement to endosonography in stomach carcinoma. Europe PMC plus. 1998 [citado 10 Mar 2017];69(4):438-42. Disponible en: http://europepmc.org/abstract/med/9612630
31. Boyacioglu S, Dolar E, Acar Y, Dalay R, Temucin G. Ultrasonographic scoring system: an auxiliary to differential diagnosis of gastric pathologies. J ClinUltrasound. 1993;21:97-101.
32. Tous F, Busto M. Assessment of abdominal sonography in the diagnosis of tumors of the gastroduodenal tract. J ClinUltrasound. 1997;25:243-7.
33. Quiroz Moreno R, Morales Guzman MI, Cervantes Monroy JA, Rueda Torre G, Diaz Caldelas L. Exactness of transcutaneous sonography in the diagnosis of gastric wall lesions. RevGastroenterolMex. 2003;68:245-52.
34. Lim JH, Ko YT, Lee DH. Transabdominal US staging of gastric cancer. AbdomImaging. 1994;19:527-31.
35. Richter GM, Dux M, Roeren T, Heuschen U, Kauffmann GW. Gastrointestinal diagnosis with hydrosonography and hydro-CT. 1: Stomach carcinoma. Rofo. 1996;164:281-9.
Recibido: 10 de octubre de 2017.
Aprobado: 15 de noviembre de 2017.
Alfredo Hierro González . Instituto de Gastroenterología. La Habana. Cuba.
Correo electrónico:ahierroglez@infomed.sld.cu