Introducción
Para devolver la forma y función de la pieza dentaria, y debido a la creciente demanda por restauraciones estéticas, el material restaurador más utilizado hoy en día es la resina compuesta o composites.1 Sin embargo, una de las causas más frecuentes en cuanto al fracaso de la restauración son las caries adyacentes al margen de esta, lo cual, generalmente, ocurre por la biodegradación de la interfaz adhesiva diente/restauración.2,3
Debido a lo anterior, se vuelve primordial el desarrollo de materiales con propiedades antibacterianas e inhibición enzimática para aumentar la durabilidad de la interfaz entre adhesivo y dentina sin afectar negativamente las propiedades mecánicas de los materiales.4,5,6 En este sentido, se ha demostrado que las nanopartículas metálicas exhiben actividades biocidas a bajas concentraciones y que la combinación de nanopartículas de óxido de zinc (ZnONP) y nanopartículas de cobre (CuNP) incorporadas en los adhesivos dentales podría tener un efecto antibacteriano sinérgico contra S. mutans.7
En virtud de lo anterior, se denota la falta de trabajos en la literatura in vivo que pudiesen obtener en distintos tiempos recuentos de las unidades formadoras de colonias (UFC) de Streptococcus mutans sobre las restauraciones de resina compuesta pinceladas con el sistema adhesivo Prime&Bond universal™ (Dentsply Sirona) dopado con ZnONP y CuNP, con metodologías utilizadas por Grez y otros.8
La incorporación de nanopartículas de óxido de zinc y cobre a un sistema adhesivo universal pincelado sobre restauraciones de resina compuesta comparado con un adhesivo universal convencional confiere propiedades antimicrobianas in vivo, que disminuyen el recuento de las unidades formadoras de colonias de Streptococcus mutans. El objetivo de este estudio fue determinar que el recuento de las UFC de S. mutans proveniente de la superficie de restauraciones de resina compuesta pinceladas con un adhesivo universal cargado con ZnONP y CuNP, es menor que al pincelar un adhesivo universal convencional sobre restauraciones de resina compuesta.
Métodos
Este estudio de tipo experimental, randomizado, doble ciego (para operador y paciente), la muestra estuvo conformada por 25 pacientes, derivado de un objetivo secundario del Fondo Desarrollo Ciencia y Tecnología - Gobierno de Chile (FONDECYT) N° 1170575, aprobado por el Comité de Ética Científico (CEC) de la Universidad de Chile.
El tamaño muestral se calculó a priori utilizando el programa estadístico G*Power©, versión 3.1.9.2,9 con un nivel de confianza del 95 % (α = 0,05), un potencial estadístico del 80 % y efecto del tamaño de 0,5. El análisis indicó que se requerirán al menos 25 pacientes para lograr resultados significativos.
La muestra consistió en 25 pacientes de la clínica de Ortodoncia de segundo año en la Facultad de Odontología de la Universidad de Chile, reclutados durante los meses de marzo y octubre del año 2019. Todos los pacientes firmaron un consentimiento aprobado por el Comité de Ética local en forma voluntaria y fueron debidamente informados sobre el procedimiento a realizar. Cada paciente presentó dos dientes premolares superiores contralaterales con indicación de extracción por ortodoncia, teniendo los siguientes grupos:
Grupo experimental: 25 dientes premolares a los que se les realizaron restauraciones oclusales de composite pincelados con el sistema adhesivo Prime&Bond universal™ dopado con ZnONp y CuNp.
Grupo control: 25 dientes premolares a los que se les realizaron restauraciones oclusales de composite pincelados con el sistema adhesivo Prime&Bond universal™ convencional.
Se consideraron como criterios de inclusión:
Pacientes con dos dientes premolares superiores contralaterales sanos con indicación de extracción por ortodoncia.
Muestras de saliva inicial positivas a la presencia de la bacteria Streptococcus mutans.
Se excluyeron del estudio aquellos pacientes:
Portadores de aparatos protésicos removibles o fijos, planos de relajación o cualquier artefacto acrílico presente en la cavidad oral.
En tratamiento con enjuagues u otro antiséptico bucal y/o pasta dental con concentraciones de fluoruro igual o mayor a 2500 ppm de iones fluoruro, en el momento del estudio o en los últimos tres meses.
Con alguna dificultad motriz que les impidiera ser responsables de su propia higiene oral.
Que masticaran chicle por lo menos cuatro días por semana.
En tratamiento con fármacos que disminuyeran el flujo salival, tales como antidepresivos, narcóticos, antihistamínicos, antihipertensivos, antieméticos y diuréticos.
Que se encontrasen bajo terapia antibiótica en el momento del estudio o en los últimos tres meses.
En tratamiento con fármacos inmunosupresores (corticoides).
Clasificados como ASA III, según la American Society of Anesthesiologic.
Procedimiento
Control positivo de la presencia de Streptococcus mutans en saliva
En los pacientes seleccionados mediante la estimulación de saliva con una lámina de papel Parafilm se obtuvo 1 mL (1000 µl) aproximadamente de saliva estimulada en tubos de ensayo estériles. El procesamiento de la muestra de saliva se realizó mediante la dilución, siembra, incubación, recuento e identificación de Streptococcus mutans desde las muestras.
Toma de muestra microbiológica inicial (T0)
Mediante la técnica de la cubeta, publicada por Vildósola y otros,10 se recogió la biopelícula depositada sobre la superficie de los dientes restaurados. Las cubetas de flúor gel fueron previamente esterilizadas en una campana de bioseguridad tipo II, bajo luz ultravioleta (UV), durante 20 minutos. Las cubetas colocadas en placas de Petri estériles se llenaron con 5 mL de agar TYCSB y se guardaron en un refrigerador hasta su posterior utilización. Previo a la utilización de las cubetas cargadas con agar TYCSB (Tryptone Yeast Extract Cystine w/Sucrose and w/o Bacitracin), estas se llevaron a una estufa de incubación por 24 horas a 37 °C para comprobar que los medios de cultivo no se encontrasen contaminados, como control de calidad.
La toma de muestras se realizó presionando suavemente la cubeta por un minuto sobre la superficie oclusal de los dientes en estudio, luego las cubetas se depositaron nuevamente en las placas de Petri estériles para su posterior procesamiento microbiológico.
Confección de las restauraciones de resina compuesta y aplicación del adhesivo Prime&Bond universal™ con y sin carga de ZnONp y CuNp
Un operador previamente calibrado en la confección de las restauraciones oclusales de resina compuesta realizó el procedimiento que se describe a continuación.
Utilizando la técnica anestésica infiltrativa se infiltró un tubo de mepivacaína 2 % con epinefrina 1:100 000 en cada zona a anestesiar. Se realizó una cavidad oclusal de medidas 3 × 3 × 2 mm (alto × ancho × profundidad) en cada premolar, con la ayuda de una sonda periodontal para precisar las medidas. Para acondicionar el tejido dentario se utilizó ácido ortofosfórico gel al 37 % (FGM), realizando una técnica de grabado total. Se utilizó el sistema adhesivo Prime&Bond universal™ dopado de ZnONp y CuNp (Adhesivo A) en una cavidad y en la contralateral se aplicó el adhesivo universal convencional (Adhesivo B). Mediante la técnica incremental se restauró con resina compuesta (composite Opallis EA3, FGM), en el que el último incremento de composite fue pincelado con su respectivo sistema adhesivo. Se comprobó la oclusión y se pulieron las restauraciones. El procedimiento fue doble ciego, debido a que paciente y operador no tuvieron conocimiento sobre cual restauración fue pincelada con el adhesivo dopado de nanopartículas.
Toma de muestra microbiológica siete días y treinta después (T1) de la confección de restauraciones y la aplicación del adhesivo A y B
Siete y treinta días después de la realización de las restauraciones oclusales, se tomaron las muestras de biopelícula mediante la técnica de la cubeta descrita previamente. Las cubetas se depositaron en las placas de Petri estériles, para su posterior procesamiento microbiológico.
Identificación y aislamiento de colonias de Streptococcus mutans
De las muestras microbiológicas se identificaron colonias de Streptococcus mutans sobre la base de la morfología macroscópica de las colonias y la adherencia al agar TYCSB observadas bajo una lupa estereoscópica y una fuente luminosa.
El recuento de unidades formadoras de colonias de S. mutans sobre la superficie oclusal de las restauraciones en premolares se expresó como UFC. Luego, las colonias compatibles con la adhesión y las características morfológicas de S. mutans se tomaron con un asa bacteriológica y se sembraron en una placa de Petri con agar TYCSB, fueron incubadas en una jarra con vela durante 48 horas a 37 °C. Posteriormente, con un asa bacteriológica se tomó una colonia bacteriana y se inoculó en un tubo estéril con 3 mL de caldo Todd Hewitt y fueron incubadas por 48 horas a 37 °C en estufa de cultivo. Para la criopreservación de las muestras, se mezclaron 500 µL de glicerol con 500 µL del caldo bacteriano en un tubo de microcentrífuga (tubo eppendorf) y se congelaron a -80 °C.
Pruebas bioquímicas para la identificación de Streptococcus mutans
Las muestras fueron sometidas a pruebas bioquímicas para diferenciar la especie Streptococcus mutans de Streptococcus sobrinus (especies del grupo Mutans Streptococci). Las muestras criopreservadas de S. mutans fueron sembradas en placas de Petri con agar TYCSB utilizando un asa bacteriológica y se incubaron durante 48 horas a 37 °C manteniendo las condiciones de microaerofilia. Se tomó la siembra y se inoculó en 3 mL de caldo Todd Hewitt, incubándose en jarra durante 48 horas a 37 ºC.
Posterior a las 48 horas, se realizaron las siguientes pruebas bioquímicas: fermentación de la rafinosa y melobiosa e hidrólisis de la esculina; las tres positivas solo para la especie Streptococcus mutans11.
Resultados
Control positivo de la presencia de Streptococcus mutans en saliva
A partir del cultivo de muestras de saliva, se obtuvieron colonias aisladas con características macroscópicas y de adherencia compatibles con Streptococcus mutans, observándose distintos tipos de morfología en las colonias.
Caracterización de pacientes
La muestra de participantes consistió en 60 % de género femenino y el 40 % al masculino. El promedio de edad fue de 22 años. El promedio de UFC/ml de S. mutans en saliva fue de 2,69 ×105, de moderado riesgo, y el promedio del índice CPOD (dientes con caries/ perdidos/ obturados) fue muy alto: 7,2.
Aislamiento e identificación de Streptococcus mutans
A partir del cultivo bacteriano de muestras de la biopelícula dental recogido mediante la técnica de la cubeta, se obtuvieron colonias aisladas con características macroscópicas y de adherencia compatibles con la bacteria Streptococcus mutans (Fig. 1).
 Nota: La línea roja representa el contorno del diente y la azul, el contorno de la restauración de la superficie oclusal. Las flechas indican las UFC de Streptococcus mutans adheridas al agar TYCSB. (Aumento 5x).
Nota: La línea roja representa el contorno del diente y la azul, el contorno de la restauración de la superficie oclusal. Las flechas indican las UFC de Streptococcus mutans adheridas al agar TYCSB. (Aumento 5x).Fig. 1 Aislamiento bacteriano de la superficie de la restauración, recogida mediante la técnica de la cubeta.
El frotis de cultivo de caldo Todd Hewitt a partir de una colonia de Streptococcus mutans teñido con Gram, mostró formas cocáceas, Gram positivo y agrupadas en cadenas, característico de bacterias del grupo Mutans Streptococci.
Del total de 25 pacientes, tres muestras no dieron resultados positivos para las pruebas de hidrólisis de la esculina y fermentación de la rafinosa y melobiosa, por tanto, esas muestras eran compatibles con la bacteria S. mutans solo por sus características macroscópicas y de adherencia. El frotis de cultivo de estas colonias teñido con Gram mostró formas cocáceas, Gram positivo y agrupadas en cadenas, característico de bacterias del grupo Mutans Streptococci.
Cuantificación de UFC de Streptococcus mutans
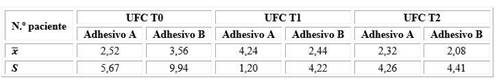
A partir del cultivo bacteriano de muestras de biopelícula obtenidas mediante la técnica de cubeta, se obtuvieron los recuentos de UFC de S. mutans descritos en la tabla 1.
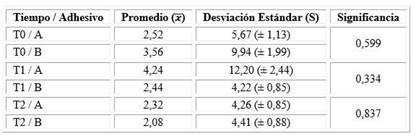
Tabla 1 Promedios y desviaciones estándar (s) de los recuentos de UFC de Streptococcus mutans de la superficie oclusal de los dientes premolares restaurados con resina compuesta; pincelados con el adhesivo Prime&Bond universal™ cargado con ZnONP y CuNP (A) y con el adhesivo Prime&Bond universal™ convencional (B); de forma previa a la restauración (T0), a los siete días (T1) y 30 días (T2) luego de realizar la restauración
Análisis estadístico mediante T-test
Los resultados obtenidos para las muestras en los tres tiempos fueron sometidos al T-Test. En la tabla 2 se resume el promedio, desviación estándar y significancia del recuento de las UFC de S. mutans en los tiempos T0, T1 y T2 para los adhesivos A y B.
Al ser p > 0,05, no hubo una diferencia estadísticamente significativa arrojada por el T-test.
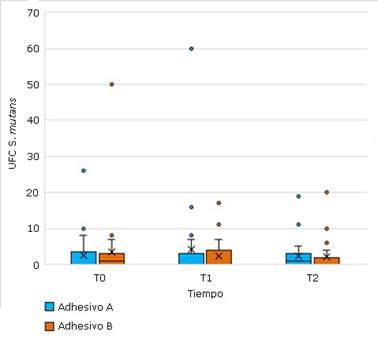
En la figura 2 se se muestra el número de UFC en la superficie de las restauraciones de resina compuesta con y sin ZnONp y CuNp en T0, T1 y T2.
Discusión
Este estudio clínico randomizado intentó demostrar el efecto sobre la colonización de S Mutans sobre la superficie de restauraciones de resina compuesta confeccionadas estandarizadamente y finalmente pinceladas con adhesivo cargado con nanopartículas metálicas y su respectivo control negativo. La hipótesis nula fue aceptada.
Aunque la evidencia actual respecto a la incorporación de ZnONp y CuNp en los sistemas adhesivos es escasa, se ha encontrado que estas nanopartículas agregan propiedades antimicrobianas a los materiales de restauración7,12. Gutierrez y otros señalan que la combinación de estas nanopartículas (cuando los adhesivos no estaban polimerizados) exhiben propiedades antimicrobianas conta S. mutans sin ser altamente citotóxico 7 y sin afectar negativamente a la resistencia a la tracción del sistema adhesivo. Mazzoni y otros han demostrado que la combinación de ZnONp y CuNp inhibe MMP-2, MMP-8 y MMP-9, las cuales son metaloproteinasas activas durante el proceso de caries,13 manteniendo así la estabilidad de la interfaz adhesiva diente/restauración.
En el presente estudio, cuando se compararon las UFC de S. mutans obtenidas de la biopelícula de la superficie de las restauraciones de resina compuesta utilizando la técnica de la cubeta, no se encontraron resultados estadísticamente significativos analizados mediante T-test (p > 0,05) entre los recuentos medidos en T0, T1 y T2, no confirmando nuestra hipótesis original. Estas diferencias entre los grupos de muestras observados en los tres tiempos no coinciden con la revisión de la literatura, que menciona la acción antibacteriana de las ZnONp y CuNp sobre S. mutans.
En este trabajo de investigación los dientes contralaterales restaurados fueron los mismos en el grupo control y el grupo experimental y las muestras de biopelícula depositadas sobre las restauraciones de ambos grupos fueron tomadas de los mismos pacientes (es decir, igual ecosistema oral e iguales características ecológicas). Además, las restauraciones fueron realizadas por el mismo operador, previamente calibrado y de forma estandarizada, al igual que las muestras de la biopelícula y su posterior procesamiento microbiológico, los que fueron realizados por un segundo operador, también previamente calibrado. Lo anterior significa que los procedimientos fueron realizados bajo condiciones homogéneas, indicando que las diferencias no significativas en los recuentos de UFC de S. mutans en las muestras se podría deber a otros factores, como el riesgo cariogénico bajo o moderado de los pacientes, la hora del último cepillado de los pacientes, el tiempo transcurrido para la toma de muestra en T2 y/o a características físicas y químicas propias del sistema adhesivo Prime & Bond universal™.
Debido a que los pacientes incluidos en este trabajo de investigación estaban en tratamiento de ortodoncia, la mayoría presentaron un riesgo de caries bajo o moderado, puesto que su higiene oral, lesiones de caries y/o restauraciones eran constantemente monitoreadas por sus odontólogos tratantes. Para lograr los objetivos de este trabajo, sería más adecuado realizar los estudios en pacientes con un alto riesgo cariogénico, ya que su recuento de UFC de S. mutans sería mayor.14
La hora del último cepillado de los pacientes fue difícil de controlar por parte del operador y, por ende, la acumulación de biopelícula sobre las restauraciones entre los tiempos T0, T1 y T2 de los pacientes, no fue homogénea. Esto habría sido un factor importante de controlar para poder determinar una flora bacteriana que se presentara con las mismas condiciones entre una y otra toma de muestra.
El tiempo transcurrido para la toma de muestra en T2 puede haber sido insuficiente, ya que para que ocurran cambios en las superficies de las restauraciones, estas deben exponerse al entorno oral durante un cierto periodo de tiempo,15 puesto que, luego de 30 días (T2), las restauraciones mantendrán características similares a las que tenían en el momento inmediatamente posterior a su realización (T0).
Todo lo anteriormente expuesto es indicativo de que se requiere estandarizar más aún la toma de impresiones de muestras de la biopelícula mediante la técnica de la cubeta, en cuanto al tiempo después del cepillado y la tercera impresión (T2). Además, la revisión de la literatura, al no revelar mayores estudios referentes a la incorporación de las nanopartículas en los sistemas adhesivos, es aún insuficiente para poder emitir una postura en cuanto a su capacidad antibacteriana contra especies cariogénicas in vivo. Se hacen necesarios más estudios clínico-microbiológicos, que den cuenta del efecto de las nanopartículas no solo en una especie específica, sino que, idealmente, señalen un efecto sobre el ecosistema oral. Esto permitirá entender que la caries es una enfermedad altamente compleja, en la que actúan múltiples microorganismos y factores en el entorno oral.
La importancia de medir la presencia de esta especie en la placa bacteriana de las restauraciones de resina compuesta se fundamenta en el poder observar en estudios longitudinales aquellas restauraciones con alto recuento de S. mutans. A su vez, tales investigaciones permiten monitorizar y controlar el porcentaje de restauraciones que desarrolla en el tiempo caries secundarias a las restauraciones. Y así, tomar medidas preventivas adecuadas al riesgo de cada de paciente.
Por lo tanto, sobre la base de la escasa evidencia presentada actualmente, creemos que la incorporación de nanopartículas a los sistemas adhesivos podría generar efectos antibacterianos sobre especies cariogénicas, de forma que contribuiría a la disminución de caries adyacentes a las restauraciones. Y entendiendo que se requieren aumentar y mejorar los estudios con respecto a este tema, los hallazgos de este trabajo de investigación aportan información clínica-microbiológica relevante en cuanto a la búsqueda de soluciones al proceso mencionado ut supra.
En conclusión, no existe diferencia en el recuento de las unidades formadoras de colonias de Streptococcus mutans sobre restauraciones de resina compuesta pinceladas con un sistema adhesivo universal cargado con nanopartículas de óxido de zinc y cobre, al ser comparado con un sistema adhesivo universal convencional.