Introducción
Las enfermedades cardiovasculares constituyen la primera causa de mortalidad y morbilidad en el mundo.1 Dichas tasas continúan creciendo paulatinamente en la misma medida en que aumenta la esperanza de vida. En Cuba, la cardiopatía isquémica (CI) es un problema nacional de salud y constituye la primera causa de muerte. La tasa de mortalidad por enfermedadesdel corazón fue de 228,2por cada 100 000 habitantes en el año 2018, superior a la tasa promedio a nivel mundial.2 Estas enfermedades tienen su origen en la aterosclerosis.3
En el empeño por disminuir la morbilidad y la mortalidad, se estudian los mecanismos involucrados en la aterogénesis y se identifican los factores de riesgo vascular en medicina preventiva, como pilar importante para el control de dichas enfermedades y la salud cardiovascular.4) Sin embargo, en todos los casos con diagnóstico de enfermedad cardiovascular no se identifica un factor de riesgo clásico. En este contexto se atribuye un papel protagónico, incluso predictor al ácido úrico (AU) 5 y a la enzima gamma-glutamiltransferasa (GGT).6
Tanto el AU como la GGT son biomarcadores de estrés oxidativo (EO).7,8Se reconoce al EO como un mecanismo de daño celular asociado a la fisiopatología primaria o a la evolución de las enfermedades cardiovasculares y los factores de riesgo vascular.1
Desde el siglo XIX se conoce la relación entre el AU, la CI y otras formas de enfermedad cardiovascular,9aunque el fundamento científico no pudo ser demostrado en esa época. En la segunda mitad de siglo XX, a partir de algunos estudios epidemiológicos, se notificó la asociación entre los niveles de AUy la hipertensión arterial (HTA), el síndrome metabólico (SM), la CI y la ECV.8,10,11,12
El AU es uno de los antioxidantes más abundantes en el plasma humano. Se reconoce su actividad protectora en la destoxificación de especies reactivas en condiciones fisiológicas en el ambiente extracelular; aunque existen evidencias crecientes que reconocen que el AU promueve efectos prooxidantes en las células, lo que contribuye al EO, efectos proinflamatorios y deletéreos sobre los vasos sanguíneos, disfunción endotelial y ECV.10,11,12
Se han sugerido diversos mecanismos por los que el AU podría desempeñar una función patogénica directa en la CI, aunque es todavía incierto si la hiperuricemia es directamente patogénica o si es simplemente un marcador de otros factores de riesgo.10,11,12) Concentraciones elevadas de AU se han asociado con los factores de riesgo aterosclerótico,13 relación que tiene especial fortaleza si se asocia con la actividad de la GGT.8,14,15
La GGT es la enzima responsable del catabolismo del glutatión, el principal antioxidante tiol intracelular en las células de mamíferos. En estudios epidemiológicos se ha sugerido el papel independiente de esta enzima en la patogenia y evolución clínica de enfermedades cardiovasculares. Asimismo, se reconoce la asociación de la actividad de esta enzima en el pronóstico de eventos fatales de formas crónicas de enfermedad cardiaca coronaria y de insuficiencia cardiaca congestiva.6
Sin embargo, el impacto de la asociación entre los niveles de AU, la actividad de la GGT y diversas condiciones cardiovasculares aún es controvertido. En este contexto los autores se preguntan qué relación existe entre la concentración de AU, la actividad de la GGT y las enfermedades cardiovasculares y si se justifica utilizar la concentración de dichos biomarcadores de EO en la evaluación de pacientes con enfermedades cardiovasculares isquémicas.
Dados los antecedentes mencionados, se desarrolló la presente revisión en función de fundamentar si el AU y la GGT pueden constituir biomarcadores de riesgo vascular relacionados con el EOy la ECV.
Métodos
Se realizó una búsqueda que incluyó las principales bases de datos y de gestores de la información (Pubmed/Medline, SciELO, Scopus, Chrocrane). Dicha pesquisa se desarrolló durante los meses de marzo de 2019 a febrero de 2020. Del total de artículos recomendados se seleccionaron los que abordaban la relación AU y GGT en la ECV.
Enfermedad cardiovascular como problema de salud
La incidencia y la prevalencia de las enfermedades crónicas no trasmisibles (ECNT) ocupan el primer lugar en las estadísticas de morbilidad y mortalidad a nivel mundial.16) En Cuba, la cardiopatía isquémica también constituye un problemade salud. Las tasas de morbilidad y mortalidad por enfermedades del corazón fueron creciendo paulatinamente a medida que aumentaba la esperanza de vida. La tasa de mortalidad por enfermedades isquémicas del corazón fue de 144,5 por cada 100 000 habitantes en el año 2018, superior al año 2011 (135,7) y al resto de las causas de muerte del corazón.2
A pesar de los avances en el conocimiento de los mecanismos patogénicos y a la disponibilidad de métodos para la valoración del riesgo cardiovascular desde los estudios de Framingham, la evaluación del diagnóstico temprano o de la progresión de la enfermedad continúa siendo un reto para las ciencias. Este estudio y otros de su tipo permitieron conocer los factores de riesgo clásicos de la CI: tabaquismo, diabetes mellitus (DM), HTA, obesidad y dislipidemias, además del sedentarismo.17El EO interviene en la fisiopatogenia de estos factores.
Estrés oxidativo y disfunción endotelial en la patogénesis de la enfermedad cardiovascular
Durante el metabolismo aerobio se producen especies reactivas del oxígeno (ERO) que, una vez generadas, promueven reacciones que dañan las biomoléculas que forman parte de las células. Entre las ERO se encuentran el anión superóxido, el peróxido de hidrógeno, el oxígeno singlete y el radical hidroxilo. Además de las ERO, se describen especies reactivas del nitrógeno, como el óxido nítrico y el peroxinitrito.18
El EO se expresa por un desbalance entre dichas especies reactivas de alto potencial oxidante, sus productos de oxidación y los sistemas antioxidantes, genéticamente controlados e influenciados por factores epigenéticos. En este desbalance predominarían los oxidantes,18y se producen o no alteraciones en la relación estructura y función de los diferentes niveles de organización biológica, en la expresión génica y en vías específicas de señalización y control redox de la célula.19
A bajas concentraciones, las ERO pueden inducir una respuesta adaptativa o un efecto benéfico en la célula o el organismo, no así cuando se alcanzan concentraciones elevadas. Esta respuesta hormética se realiza bajo mecanismos de regulación redox.18
Para contrarrestar las ERO o los productos de su acción, el organismo presenta un sistema antioxidante enzimático y no enzimático. Los principales antioxidantes del organismo están constituidos por las enzimas superóxido dismutasas, catalasa y tiol reductasas, y por compuestos como tocoferoles, tocotrienoles, carotenos, ascorbato, ácido lipoico, bilirrubina, ubiquinona, ácido úrico, glutatión y enzimas relacionadas con su metabolismo como la GGT, entre otros.18,20
El AU actúa sobre el radical hidroxilo y el oxígeno singlete, tiene afinidad por el peroxinitrito y acción quelante de hierro. El radical urato que se genera producto de su actividad puede ser reducido por el glutatión. En el metabolismo del glutatión participa la enzima GGT. Los productos de la actividad de esta enzima garantizan la síntesis intracelular de glutatión. Sin embargo, en presencia de altas concentraciones de AU, incremento en GGT, o ambas, se puede producir daño celular mediado por especies reactivas oxidantes y disfunción endotelial.21,22
El EO se asocia con disfunción endotelial y, por tanto, con la ECV. La disfunción endotelial es consecuencia de la disminución de la biodisponibilidad de óxido nítrico y se asocia con un aumento de la expresión de marcadores de daño endotelial, como el factor de necrosis tumoral, la adhesión leucocitaria y la expresión de moléculas de adhesión.1 En consecuencia, se produce una atenuación de la relajación vascular, aterosclerosisy ECV.
Las ERO,23) altas concentraciones de AU,21 elevadas concentraciones de ácido grasos,24 el envejecimiento,25 la oxidación de las lipoproteínas de baja densidad (LDL por sus siglas en inglés),26 la hiperglucemia,27 los niveles de adipocinas séricas,28 factores epigenéticos,29 e infecciones virales como el SARS-CoV-2,30) pueden conducir a disfunción endotelial y enfermedad vascular.
Tanto la concentración de AU como la actividad de la GGT se determinan con frecuencia como parte de los estudios de química sanguínea; sin embargo, poco se conoce de su utilidad en la evaluación vascular. En estudios realizados, además de reconocerse la potencialidad de factor independiente de ECV y sus factores de riesgo, se ha comprobado también su posible sinergismo en función de los cambios vasculares.8,14,15
El ácido úrico en medicina cardiovascular
El AU es un producto del catabolismo de las purinas en el hombre, que se obtiene por la actividad de la enzima xantinaoxidorreductasa. Este proceso se intensifica en condiciones de depleción energética, como ocurre en los fenómenos isquémicos consecuencia de la aterosclerosis.21,31)
Aunque se ha referido que el ácido úrico confiere un efecto protector sobre la vasculatura, dadas sus propiedades antioxidantes, también se ha demostrado que este metabolito induce un estado inflamatorio,31activa el sistema renina angiotensina aldosterona a nivel vascular, estimula la proliferación de las células musculares lisas vasculares32 y la producción de ERO y promueve la disfunción endotelial.21
Se plantea una asociación entre los niveles elevados de ácido úrico y el incremento del riesgo cardiovascular (Fig.1).33
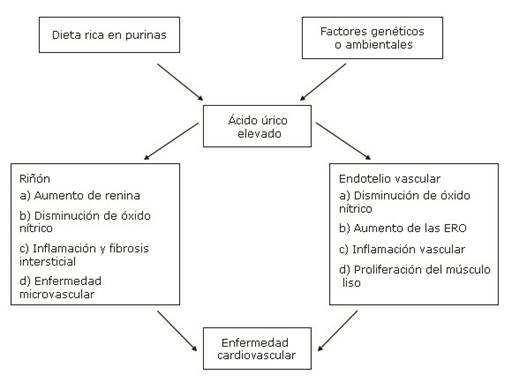
Fuente: Tomado y modificado de Cebollada y otro. (33
Fig.1- Enfermedad cardiovascular mediada por ácido úrico.
Gaubert y otros34, han demostrado asociación entre el AU y la aterosclerosis carotídea y coronaria y de inestabilidad de la placa, así como la presencia de AU en la placa de ateroma. La relación de las cifras elevadas de ácido úrico con la alteración del grosor de íntima media, reconocido indicador de enfermedad aterosclerótica temprana, se demostró también en los estudios de Qin y otros35 La concentración de AU fue mayor en los pacientes que tenían enfermedad arterial coronaria diagnosticada por angiografía, mientras que en el National Health and Nutrition Examination Survey I Epidemiologi cFollow-up Survey se describe una asociación independiente entre altos niveles de AU y la mortalidad cardiovascular.36
Se han sugerido diversos mecanismos por los que el AU podría desempeñar una función patogénica directa en la CI, aunque es todavía incierto si la hiperuricemia es directamente patogénica o si es simplemente un marcador de otros factores de riesgo, teniendo en cuenta que altas concentraciones de AU se han asociado con los factores de riesgo aterosclerótico. Esta relación tiene especial fortaleza si se asocia con la actividad de la GGT.8,14,15
Gamma-glutamiltransferasa y enfermedad cardiovascular
La enzima gamma-glutamiltransferasa o gammaglutamiltranspeptidasa (E.C.2.3.2.2) es una glicoproteína dimérica que se encuentra hacia el lado externo de las membranas de la mayoría de los tipos celulares. La actividad de la GGT es particularmente alta en tejidos con funciones secretoras y absortivas como el riñón, el sistema biliar, el intestino y el epidídimo. La mayor parte de la GGT del suero humano deriva del tejido hepático.6
La enzima cataliza la degradación del glutatión a glutamil y al dipéptido cisteinil-glicina; este último es posteriormente transformado por las dipeptidasas en cisteína y glicina. La degradación del glutatión en el espacio extracelular incrementa la disponibilidad de cisteína, aminoácido que se emplea por las células como precursor en la síntesis intracelular de glutatión.8 Por tanto, la GGT contribuye al mantenimiento de las concentraciones fisiológicas del glutatión en el citoplasma y a la defensa celular contra el estrés oxidativo. Sin embargo, en presencia de niveles altos de GGT se puede producir daño a las membranas de las células, liberándose metales que pueden desencadenar efectos prooxidantes.6
Se ha sugerido por diversos autores que la GGT se asocia con eventos cardiovasculares y con el riesgo de muerte (Fig.2).37,38
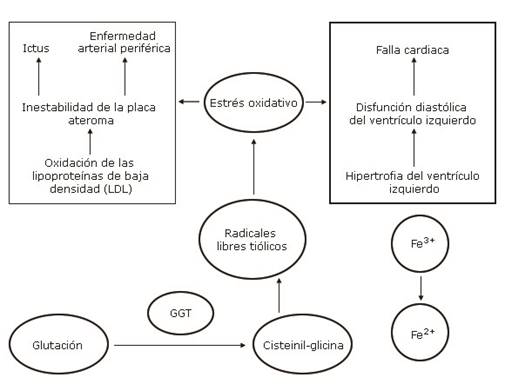
Fuente: Tomado y modificado de Seo y otro. (38
Fig.2- Posible mecanismo de la enzima Gamma-glutamiltransferasa como marcador de enfermedad cardiovascular basada en la hipótesis del estrés oxidativo.
Villegas y otros37destacan la presencia de la enzima GGT catalíticamente activa en placas ateroscleróticas carotídeas y coronarias. Estos autores demostraron en su estudio la asociación positiva entre valores séricos más altos de GGT y el riesgo aumentado de evento vascular cerebral isquémico.
En 2018, Kim y otros39 reportaron el valor predictivo de la GGT en relación con la mortalidad a largo plazo de los pacientes con Infarto del miocardio.
El Framingham Offspring Study fue uno de los primeros estudios epidemiológicos iniciados para comprobar la asociación de la GGT con el riesgo y la enfermedad cardiovascular. En este estudio se realizó el seguimiento a 3203 pacientes durante 10 años y se concluyó que la GGT se asoció con un mayor índice de masa corporal, un incremento de la presión arterial y de la concentración de las lipoproteínas de baja densidad, triglicéridos y glucosa.40
Acción sinérgica del ácido úrico y gamma-glutamiltransferasa
Varios autores 8,14,15 han demostrado la asociación del aumento de las concentraciones de AU en sangre y la actividad de la enzima GGT en los fenómenos adversos en medicina vascular.
Se plantean diferentes expresiones clínicas de dicho fenómeno en el cual subyace el mecanismo oxidativo. Las expresiones clínicas pueden ir desde la disfunción diastólica,14hasta las alteraciones como diabetes mellitus, intolerancia a la glucosa, síndrome metabólico,8,15 condiciones todas relacionadas con el daño cardiovascular.
En una investigación realizada por Yunus y otros, en la que se correlacionaron AU y GGT con obesidad, se obtuvo asociación positiva para hombres y mujeres obesas. Según los autores, esto se debe a que la obesidad causa aumento del tejido adiposo y consiguientemente aumento de la producción de xantinaoxidorreductasa y ácido úrico. Por otra parte, la obesidad también promueve el depósito de grasas en el hígado (hígado graso no alcohólico), la generación de ERO y el aumento de la GGT. Esta asociación aunque más débil, fue obtenida también en sujetos no obesos.41
Un resultado similar al anterior fue obtenido por Bertoli y otros, en la que obtuvieron asociación tanto para AU como para GGT con la presencia de tejido adiposo visceral. En el caso del ácido úrico hubo además correlación con la circunferencia de cintura.42) De la misma manera, Ortakoyloglu y otros demostraron asociación entre AU, GGT y proteína C reactiva con el desarrollo de hipertensión no dipper, lo cual pudiera justificar un mayor riesgo de complicaciones cardiovasculares en pacientes hipertensos con alteración sinérgica de las concentraciones de estas variables en sangre.22
Conclusiones
El AU y la GGT son biomarcadores de estrés oxidativo. Los niveles plasmáticos pueden reflejar el desarrollo de eventos cardiovasculares que se producen como consecuencia de la aterosclerosis y que involucran al estrés oxidativo como mecanismo fisiopatogénico. El estudio de estos biomarcadores resulta de utilidad para una prevención efectiva, un diagnóstico precoz y un tratamiento oportuno de las enfermedades cardiovasculares.















