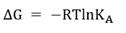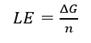Introducción
El estrés oxidativo es un fenómeno que está implicado en muchos procesos fisiopatológicos, tales como el cáncer, enfermedades cardiovasculares, neurodegenerativas, y diabetes, entre otras.1
En general, el estrés oxidativo y la inflamación están estrechamente relacionados. Como la oxidación de numerosas moléculas causa daño a las células y tejidos, esto puede activar la respuesta inflamatoria.2 Dicha respuesta es iniciada por la oxidación de ácidos grasos poliinsaturados, reacción catalizada por tres clases de enzimas: cicloxigenasas, isoformas de la citocromo P450 y lipoxigenasas.3
En particular, la enzima lipoxigenasa convierte los ácidos araquidónicos, linoleico y otros ácidos grasos poliinsaturados, en metabolitos biológicamente activos, como los leucotrienos, los cuales participan en las respuestas inflamatoria e inmune.4
Varios son los estudios en los que se reporta el papel de los leucotrienos en la mediación de la respuesta inflamatoria en enfermedades pulmonares. Actualmente para el caso de la COVID 19, investigadores como Huang5 plantean que la búsqueda de inhibidores del receptor de leucotrienos o antagonistas de la 5-lipoxigenasa como el zileuton, podría aprovecharse como una estrategia preventiva eficaz e inmediata para mitigar la inflamación pulmonar excesiva en pacientes sintomáticos, que pueden desarrollar una enfermedad grave por Covid-19.
Por esta razón, la inhibición de la lipoxigenasa es una estrategia potencialmente, útil en la prevención de la de enfermedades asociadas a la inflamación como: asma, alergia, artritis reumatoide, osteoporosis y aterosclerosis.4
En este sentido, los productos naturales desempeñan un significativo papel en la salud humana, relacionado entre otros aspectos, con la prevención y tratamiento de enfermedades inflamatorias.6
De ahí que, el consumo de alimentos funcionales/nutracéuticos, como las setas comestibles,7 con propiedades antinflamatorias, hepatoprotectoras, antidiabética y antioxidantes sea una alternativa efectiva para modular estos procesos.8
Los hongos comestibles medicinales, han sido consumidos como un alimento funcional, al presentar compuestos bioactivos/nutracéuticos como polisacáridos,9 proteínas,10) compuestos fenólicos,11 lectinas,12 terpenos y otros.13
Al respecto, se ha demostrado que, los compuestos fenólicos derivados de hongos -comestibles medicinales, muestran actividad antioxidante en sistemas biológicos, actuando como inhibidores de radicales libres, descomponedores de peróxido, inactivadores de metales y secuestradores de oxígeno.14
Dentro de las especies pertenecientes al grupo de hongos comestibles medicinales (Basidiomicetes) se encuentra Pleurotus ostreatus. Dicha especie ocupa el segundo lugar en cuanto a su cultivo y significación económica, dietética y medicinal.15
Estudios recientes refieren su uso en el desarrollo de alimentos funcionales, fármacos o nutracéuticos de interés para el tratamiento de muchas enfermedades que en el mundo representan un serio problema de salud.16
En este contexto, ha sido demostrado en esta especie, el efecto inmunomodulador y hepatoprotector,17 antioxidante,18,19,20 antitumoral21 y la presencia de compuestos fenólicos con potencial modulador sobre eventos epigenéticos.22
A partir de estos elementos, el presente trabajo estuvo dirigido a realizar una evaluación in silico del efecto de compuestos fenólicos de la seta comestible Pleurotus ostreatus sobre la proteína 5- lipoxigenasa (5-LOX), mediante la utilización del acoplamiento molecular y de la estimación de parámetros de similitud a un fármaco y de absorción, distribución, metabolismo, excreción/ toxicidad (ADME/T). La predicción de la inhibición o la activación de determinadas moléculas de interés farmacológico, frente a compuestos bioactivos presentes en las setas comestibles, reviste gran interés como herramienta complementaria a los estudios in vitro/in vivo y la dilucidación de los mecanismos de acción. Es por ello nuestro objetivo evaluar el efecto in silico de trece compuestos fenólicos presentes en la especie Pleurotus ostreatus sobre la enzima 5-LOX, al utilizar como compuesto de referencia la mangiferina.
Métodos
Ligandos y estructura de la enzima
Los cálculos se realizaron con el cluster del Departamento de Química de la Facultad de Ciencias Naturales y Exactas de la Universidad de Oriente. Se utilizó el sistema operativo Linux distribución Debian 7.0.
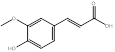
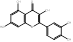
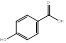
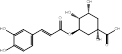
Se realizó una selección de los compuestos fenólicos encontrados en la composición química de P. ostreatus, teniendo en cuenta la revisión de la literatura y estudios de nuestro grupo de investigación.17,22 Al respecto, investigadores como Palacios,23 reportan en esta especie, la presencia de ácido p-cumárico, ácido felúrico, ácido gálico, ácido gentísico, ácido p- hidroxibenzoico, ácido homogentísico, mirecitina y ácido protocatecuico. Otros investigadores, refieren, la presencia de ácido cinámico,24 ácido vanílico,25 ácido p-hidroxibenzoico, cafeico, ácido siringico y la vanillina.26
Se empleó el programa ChemBioDraw Professional 15.0, Cambridge, USA27 para generar las estructuras de los compuestos fenólicos (Tabla 1). Por su parte, el programa, ChemBio3D Ultra 12.0, Cambridge, USA27 permitió la optimización de la geometría de dichas moléculas, utilizando el método de mecánica molecular MM2 y MMFF94 (en inglés Merck Molecular Force Field).
En el presente trabajo se utilizó como compuesto de comparación a la mangiferina (1,3,6,7-Tetrahydroxyxantona-C2-β-D-glucósido), debido a que posee una significativa actividad biológica relacionada con la captación de radicales libres,28 así como la inhibición del estrés oxidativo29) y la actividad de la enzima 5-LOX.30
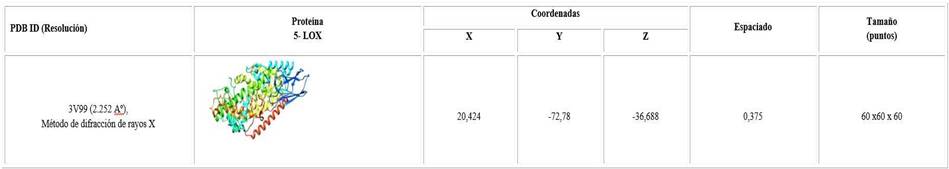
La estructura tridimensional, correspondiente a la difracción de rayos X del cristal de la enzima 5 lipoxigenasa, se obtuvo en formato .pdb de la Base de Datos de Proteínas (PDB, en inglés Protein Data Bank) del Centro Nacional para la Información en Biotecnología (del inglés, National Center for Biotechnology Information) (NCBI, USA). (PDB: código ID/3V99, resolución (2.252 Aº), depositada por Gilbert.31
A través del programa UCSF Chimera versión 1.10.227 (California, USA)32 se identificaron todos los residuos que no pertenecían a la proteína y podían interferir con su centro activo.
Tabla 1 Fórmula y estructuras químicas de los compuestos fenólicos seleccionados para el estudio de acoplamiento molecular
| Compuestos fenólicos | Fórmula | Estructura |
|---|---|---|
| Ácido cafeico | C9H8O4 | |
| Ácido p-cumárico | C9H803 | |
| Catequina | C15H14O6 | |
| Ácido ferúlico | C10H10O4 | |
| Quercetina | C15H10O7 | |
| Ácido cinámico | C9H8O2 | |
| Ácido gálico | C7H6O5 | |
| Ácido homogentísico | C8H8O4 | |
| Ácido p-hidroxibenzoico | C7H6O3 | |
| Ácido protocatecuico | C7H6O4 | |
| Ácido clorogénico | C16H18O9 | |
| Ácido gentísico | C7H6O4 | |
| Naringina | C27H32O14 | |
| *Mangiferina | C19H18O11 |
*Compuesto de referencia
Protocolo de acoplamiento molecular
El estudio de acoplamiento molecular se llevó a cabo con los programas AutoDock 4.2 y AutoDockTools 1.5.6, USA,33 y la estructura de 5 LOX se obtuvo con la base de datos de proteínas, PDB (www.wwpdb.org). La visualización 3D de las interacciones hidrofóbicas y por puente de hidrógeno de los complejos, se efectuó por el programa UCSF Chimera versión 1.10.227, California, USA.32
El programa AutoDock requiere de la realización de un pre-cálculo de los mapas grid para cada tipo de elemento presente en la macromolécula, ubicando el ligando alrededor de la región de interés (sitio activo) en la macromolécula. En la tabla 2 se muestran las coordenadas y tamaño de la caja Grid del sitio activo para la enzima 5- LOX.
Se utilizó el algoritmo genético Lamarkiano para explorar la mejor conformación espacial de los ligandos, con 50 poses por cada ligando.
Los parámetros físico- químicos utilizados en la investigación fueron ΔG y Ki. Estos parámetros se relacionan de forma directa. A medida que la energía libre de unión disminuye, la constante de inhibición también decrece, lo cual se traduce en una mayor estabilidad del complejo enzima-ligando. Por otra parte, los cambios de entalpía (ΔH) y de entropía (ΔS), deben ser considerados en la evaluación de la energía de unión. Dichas relaciones se observan en las ecuaciones 1.1 y 1.2, donde [E], [I] y [EI] son las concentraciones de proteína, inhibidor y el complejo proteína-inhibidor, respectivamente; en tanto, R= 8,314 JmoL/K es la constante universal de los gases, T= 298 K es la temperatura y KA, la constante de afinidad.
Por otro lado, también se tuvo en cuenta el cálculo de la eficiencia del ligando (LE).
La eficiencia del ligando y las propiedades termodinámicas constitutivas de ΔG (ΔH y ΔS), pueden proporcionar información sobre la unión de una molécula con su ligando, que va más allá de simples comparaciones de potencia inhibitoria.34
LE se obtiene al dividir la energía libre de unión de cada molécula entre el número de átomos (n) no hidrógenos, presentes en la estructura, y se describe, según la ecuación 1.3:
Propiedad de similitud a un fármaco y estudios ADME/T
Dentro del estudio de las propiedades de similitud a un fármaco, se encuentra el cumplimiento por parte de los compuestos estudiados, de las condiciones de la regla de Lipinski35. Esta regla define cinco rangos de parámetros fisicoquímicos: peso molecular ≤ 500, número de enlaces donores de hidrogeno ≤ 5, número de enlaces aceptores de hidrogeno ≤ 10, lipofilicidad (Log P) ≤ 5 y refractividad molar entre 40 a 130 Å2. Estos parámetros se verificaron a través de la metodología SwissADME (http://www.swissadme.ch).36
Para la determinación de los parámetros farmacológicos y farmacodinámicos ADME/T (absorción, distribución, metabolismo, eliminación y toxicidad) en los ligandos que mostraron los mejores modelos de acoplamiento con la enzima de estudio, se utilizó el programa ADMET lab.37)
Resultados
Simulación de acoplamiento molecular
Según el análisis realizado en la literatura, los residuos de aminoácidos que se reportan como activos en la 5-LOX31) son: Tyr-558, Phe-555, Asn-554, His-367, His-372, Ile-406, Ala 410 y Phe-177, que están rodeados del centro metálico de Fe2+.
Los parámetros del acoplamiento molecular de los compuestos fenólicos seleccionados de Pleurotus ostreatus y la enzima 5-LOX, se muestran en la tabla 3. Los resultados revelaron que los compuestos fenólicos muestran una buena afinidad hacia la enzima.
Tabla 3 Predicción de la energía libre de unión, la constante de inhibición y la eficiencia de ligando de compuestos fenólicos y la enzima 5 LOX
| Compuestos fenólicos | ΔG (Kcal/moL) | Ki ( M) | LE (kcal/mol/átomo no H) |
|---|---|---|---|
| Ácido cafeíco | -11,44 | 2,08 10-8 | -0,88 |
| Ácido p-cumárico | -11,50 | 3,70 10-9 | -0,95 |
| Catequina | -11,57 | 3,29 10-9 | -0,55 |
| Ácido ferúlico | -7,05 | 6,83 10-9 | -0,50 |
| Quercetina | -11,20 | 6,17 10-9 | -0,51 |
| Ácido cinámico | -11,37 | 4,61 10-9 | -1,03 |
| Ácido gálico | -10,72 | 1,39 10-8 | -0,89 |
| Ácido homogentísico | -11,81 | 2,19 10-9 | -0,98 |
| Ácido p-hidroxibenzoico | -11,25 | 5,68 10-9 | -1,13 |
| Ácido protocatecuico | -11,31 | 5,09 10-9 | -1,03 |
| Ácido clorogénico | -12,28 | 9,99 10-10 | -0.49 |
| Ácido gentísico | -11,67 | 2,79 10-9 | -1,06 |
| Naringina | -5,40 | 1,11 10-5 | -0,13 |
| *Mangiferina | -5,26 | 1,38 10-4 | -0,18 |
*Compuesto de referencia; en negrita se destacan los mejores valores en el acoplamiento.
Ello está sustentado en los valores de energía libre de unión (ΔG) y constante de inhibición (Ki). Los intervalos de los valores de energía de unión estuvieron entre -12,28 y -5,26 kcal/moL y los de la constante de inhibición de 9,99 10 -10 a 1,38 10-4 M.
En la tabla 3, se observaron además, los valores de Eficiencia de Ligando (LE) de todos los compuestos fenólicos evaluados. Los valores se encontraron en un rango entre -0,13 y -1,13 kcal/moL/átomo no hidrógeno.
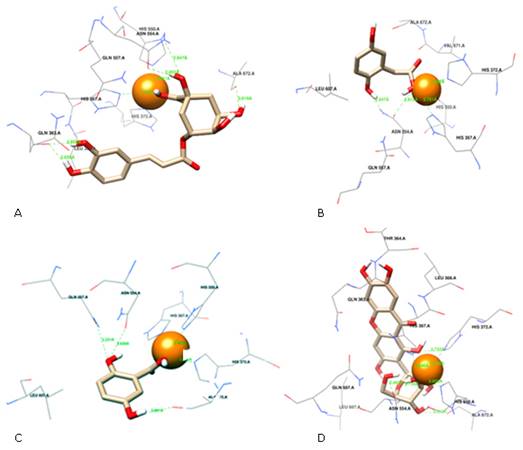
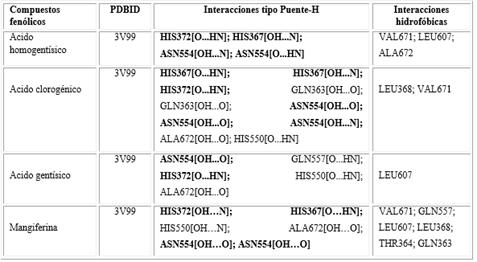
Por su parte, los mejores modelos de acoplamiento se presentan en la tabla 4. Se constata que los compuestos fenólicos: ácido homogentísico, clorogénico y gentísico, presentaron mejores valores de ΔG, con cuatro, diez y cinco interacciones por puente de hidrógeno, respectivamente, mientras que la mangiferina presentó seis.
Tabla 4 Interacciones observadas entre los mejores modelos de acoplamiento de los compuestos fenólicos y la proteína 5-LOX
En negrita se destacan los residuos de aminoácidos presentes en el centro activo de la enzima de P. ostreatus, el compuesto de comparación y
la proteína 5-LOX. A (ácido homogentísico), B (ácido clorogénico), C (ácido gentísico), D (mangiferina).
En la siguiente figura se muestran las interacciones 3D de estos mejores modelos de acoplamiento.
Propiedades de similitud a un fármaco y estudios ADME/T
La evaluación de las cinco reglas de Lipinski en los modelos de acoplamiento seleccionados para la proteína 5 LOX se muestra en la siguiente tabla. Se observa que, los ligandos seleccionados mostraron un peso molecular por debajo de 500 g/moL.
En cuanto al número de enlaces donores de hidrógenos, el ácido clorogénico y la mangiferina, presentaron valores de 6 y 8, respectivamente; por lo que estuvieron por encima de lo requerido para el parámetro (≤ 5). También la mangiferina, superó el número enlaces hidrógenos aceptores (≤ 10), con un valor de 11.
Por otro lado, los valores de la superficie topológica polar (TPSA, A2) evidencian que dos de los ligandos (ácido homogentísico y ácido gentísico), presentaron valores aceptables de TPSA; en cambio, el ácido clorogénico con 164,75 Å2 y la mangiferina con 201, 28 Å2, no se comportan de la misma forma, pues sus valores sobrepasan los establecidos para este parámetro.
Por su parte, la refractividad molar, reportó valores dentro de los límites establecidos para todos los ligandos seleccionados, entre 40 y 130. Los valores de la solubilidad Log S, estuvieron entre (-1,62 a -2, 44) (Tabla 5).
Tabla 5 Parámetros estimados de similitud a un fármaco para los compuestos fenólicos de P. ostreatus con mejores modelos de acoplamiento
| COMPUESTOS | ||||
|---|---|---|---|---|
| Propiedades de similitud a un fármaco | Ácido homogentísico | Ácido gentísico | Ácido clorogénico | Mangiferina |
| Peso molecular (g/mol) | 168,15 | 154,12 | 354,31 | 422,34 |
| Log Po/w consenso | 0,65 | 0,74 | -0,42 | -0,77 |
| Log S | -1,66 | -2,33 | -1,62 | -2,44 |
| Número de enlaces H aceptores | 4 | 4 | 9 | 11 |
| Número de enlaces H donores | 3 | 3 | 6 | 8 |
| Refractividad olar | 42,03 | 37,45 | 83,50 | 100,70 |
| Regla de Lipinski | Si | Si | Si | No |
| Regla de Ghose | Si | No | No | No |
| Regla de Veber | Si | Si | No | No |
| Regla de Egan | Si | Si | No | No |
| Regla de Muegge | No | No | No | No |
| Puntuación de la biodisponibilidad | 0,56 | 0,56 | 0,11 | 0,17 |
| TPSA (Å2) | 77,76 | 77,76 | 164,75 | 201,28 |
| Número de enlaces rotables | 2 | 1 | 5 | 2 |
Los resultados derivados del análisis de ADME/T de la presente investigación, se muestran en la tabla 6. La evaluación permitió determinar las propiedades farmacodinámicas de los fenoles seleccionados al interactuar con la enzima de estudio.
Tabla 6 Resultados de la evaluación in silico de las propiedades farmacocinéticas y farmacodinámicas (ADME/T) de los ligandos fenólicos de P. ostreatus con mejores modelos de acoplamiento y la enzima 5 LOX
| Clase | Propiedades | Ácido homogentísico | Ácido gentísico | Ácido clorogénico | Mangiferina |
|---|---|---|---|---|---|
| Absorción | Permeabilidad Caco-2 | -5,118 | -5,099 | -6,58* | -6,512* |
| Inhibidor Pgp | No inhibidor | No inhibidor | No inhibidor | No inhibidor | |
| Sustrato Pgp | No sustrato | No sustrato | No sustrato | No sustrato | |
| Absorción Intestinal Humana (HIA) | HIA positivo | HIA negativo | HIA negativo | HIA negativo | |
| Distribución | Unión proteínas plasmáticas | 35,14% | 36,48% | 50,68 % | 67,43 % |
| Barrera hematoencefálica (BBB) | BBB positivo | BBB negativo | BBB positivo | BBB positivo | |
| Metabolismo | Inhibidor CYP450 1 A2 | No inhibidor | No inhibidor | No inhibidor | No inhibidor |
| Sustrato CYP450 1 A2 | No sustrato | No sustrato | No sustrato | No sustrato | |
| Inhibidor CYP450 3 A4 | No inhibidor | No inhibidor | No inhibidor | No inhibidor | |
| Sustrato CYP4503 A4 | No sustrato | No sustrato | Sustrato | No sustrato | |
| Inhibidor CYP450 2 C9 | No inhibidor | No inhibidor | No inhibidor | No inhibidor | |
| Sustrato CYP450 2 C9 | Sustrato | Sustrato | No sustrato | No sustrato | |
| Inhibidor CYP450 2 C19 | No inhibidor | No inhibidor | No inhibidor | No inhibidor | |
| Sustrato CYP450 2 C19 | Sustrato | No sustrato | No sustrato | No sustrato | |
| Inhibidor CYP450 D6 | No inhibidor | No inhibidor | No inhibidor | No inhibidor | |
| Sustrato CYP450 D6 | No sustrato | No sustrato | No sustrato | No sustrato | |
| Excreción | T1/2 (h) | 0,49 | 0,36 | 0,44 | 1,26 |
| Toxicidad | Bloqueadores hERG | No bloqueadores | No bloqueadores | No bloqueadores | No bloqueadores |
| Hepatotoxicidad humana | H -HT negativo | H-HT negativo | H- HT positivo | H-HT negativo | |
| Mutagenicidad AMES | AMES negativo | AMES negativo | AMES negativo | AMES positivo | |
| Sensibilización cutánea | No sensible | No sensible | No sensible | No sensible | |
| Lesión hepática inducida por fármacos (DILI) | DILI negativo | DILI negativo | DILI negativo | DILI positivo | |
| Dosis diarias máximas recomendadas (FDAMDD) | FDAMDD positivo | FDAMDD positivo | FDAMDD negativo | FDAMDD positivo |
Discusión
La 5 lipoxigenasa (5-LOX), es una enzima clave que cataliza el primer paso de la biosíntesis de leucotrienos. Los inhibidores específicos de la 5- lipoxigenasa, pueden ser considerados como potenciales fármacos para varias enfermedades relacionadas con patologías inflamatorias.38
Los resultados del presente trabajo, mostraron que los fenoles derivados de la seta P. ostreatus, de manera general se acoplaron satisfactoriamente con la enzima 5-LOX, teniendo una adecuada interacción con los residuos del sitio activo.
Cabe señalar que los fenoles - ácido homogentísico, clorogénico y gentísico -presentan una gran variedad de interacciones por puente de hidrógeno, siendo comunes tres residuos de aminoácidos reportados en el sitio activo de la proteína (Asn-554, His-367 y His-372). El ácido clorogénico, en particular, presentó una Ki muy pequeña, lo que sugiere un mejor acoplamiento con el sitio activo de la enzima (Tabla 3).
En estudios realizados por Lee,39 se observó que cuatro especies de la familia Hymenochatacea, una especie de la familia Tricholomatacea y dos especies de Boletaceae, mostraron potentes actividades de inhibición en más de un 50 % hacia la lipoxigenasa. Específicamente Collybiama culata, Tylopilus neofelleus, Strobilomyces confusus, Phellinus gilvus, P. linteus, P. baumii e Inonotus mikadoi, a una concentración de 100 µg/mL, alcanzaron actividades inhibitorias de la lipoxigenasa en porcientos de 73,3; 51,6; 52,4; 66,7; 59,5; 100 y 85,2, respectivamente.
Los valores en cuanto a los parámetros físicos- químico evaluados en los ácidos homogentísico y gentísico, resultaron promisorios para estudios futuros en cuanto a su potencial actividad farmacológica. De manera general, la potencial actividad inhibitoria 5- LOX de los compuestos fenólicos estudiados, podría estar relacionada con la disminución de la peroxidación lípidica y menores valores de malonildialdehido (MDA) detectados en modelos in vitro de membrana de eritrocitos, donde se han evaluado extractos acuosos de P. ostreatus .16)
En el presente estudio, se compararon, además, los resultados de los mejores modelos de acoplamiento entre los fenoles de Pleurotus ostreatus y la enzima de estudio, respecto a los valores obtenidos con el compuesto de referencia (mangiferina).
La farmacología de la mangiferina ha ganado gran atención debido a su función protectora contra el daño oxidativo a diversos tejidos. Se ha demostrado, que la mangiferina reduce la expresión de varios mediadores inflamatorios. Las propiedades antioxidantes de esta sustancia también pueden contribuir a su actividad antiinflamatoria y a su efecto hepatoprotector.40 La mangiferina puede inhibir citoquinas inflamatorias, como el TNFα, la producción de óxido nítrico y la expresión de NFκB, tanto en modelos in vitro como in vivo.41 Además, modula diversos factores de transcripción, incluyendo NFκB y Nrf-2, y la expresión múltiple de cascadas de señalización proinflamatoria.
Se ha postulado que el enlace C-glucosilo y los grupos hidroxilo en la mangiferina, contribuyen significativamente a su actividad de eliminación de radicales libres.42
Por otra parte, según los valores definidos por Hopkins,43 la eficiencia del ligando (LE), (excelentes LE > -0,4, buenos LE > -0,3 y malos LE ≤ -0,2), se observó que en el caso de los mejores modelos del acoplamiento entre los compuestos fenólicos y la proteína 5-LOX, los ácidos homogentísico, clorogénico y gentísico (Tabla 3), presentaron valores de LE excelente. Estos resultados brindan información de la fortaleza de la unión entre los ligandos y la enzima.
Por otro lado, al analizar los mejores modelos de acoplamiento de los compuestos fenólicos con la proteína 5-LOX, se constató que el ácido clorogénico mostró valores que indicaron una fortaleza de unión mayor. Esto puede estar basado en la existencia de diez interacciones por puente de hidrógeno y dos electrostáticas con el Fe2+, que se encuentran más cerca del sitio activo de la proteína.
Los ácidos homogentísico, clorogénico y gentísico presentaron varias interacciones por puente de hidrógeno. Fueron los más comunes los tres residuos de aminoácidos reportados como activos (Asn-554, His-367 y His-372) como se pudo observar (Tabla 4).
En la tabla 5, evidenciamos que todos los ligandos de los mejores modelos de acoplamiento con la enzima evaluada, tuvieron valores ≤ 10, lo cual puede suponer una mayor flexibilidad conformacional.
Por otro lado, los valores de la superficie topológica polar (TPSA) fueron elevados en dos de los compuestos: ácido clorogénico y el compuesto de referencia, la mangiferina, lo cual afectaría la disponibilidad de absorción de los mismos.
El número de enlaces donores de hidrógenos (≤ 5), enlaces aceptores de hidrógenos (≤ 10) y la refractividad molar más baja fue apreciada en dos de los compuestos: ácido homogentísico y ácido clorogénico. Los resultados reflejaron que el ácido homogentísico fue el ligando en el que se verificaron casi todas las reglas evaluadas: Lipinski, Veber, Ghose y Egan, por lo que pudiera ser un candidato para evaluaciones farmacológicas futuras.
Con respecto a la utilización de los parámetros ADME/T (absorción, distribución, metabolismo, excreción y toxicidad), existen numerosos factores que influyen en la biodisponibilidad de los fármacos; estos pueden ser fisicoquímicos y biológicos. Los fisicoquímicos comprenden las propiedades intrínsecas del fármaco, como pKa, tamaño molecular, lipofilicidad y solubilidad; por su parte, los biológicos incluyen la permeabilidad de la membrana gástrica e intestinal, tiempo de tránsito, pH de la luz y tasa de flujo sanguíneo de la mucosa, entre otros.44
En este sentido, la prueba de la permeabilidad en células Caco-2 es una medida indirecta de la absorción intestinal humana. De manera que permitiría predecir si la absorción intestinal y el metabolismo podrían reducir la disponibilidad de un fármaco o molécula en el organismo.45
Los parámetros de absorción reflejaron que, los mejores valores de permeabilidad con las células Caco 2, fueron para los compuestos ácido clorogénico y mangiferina, al encontrarse por encima del valor reportado en la literatura (> -5,15). Al respecto, Llauradó y otros,46 evaluaron el efecto antitumoral selectivo de varios extractos de cuerpos fructíferos de Pleurotus sp, con diferentes polaridades, en el crecimiento de diferentes líneas celulares tumorales (U937, N2A y células tumorales Caco2, comparadas con células Vero), lo cual es una evidencia experimental de la permeabilidad in vitro de las células Caco 2 frente a estos preparados en cuya composición están presentes los compuestos fenólicos (138 mg/ 100 g).
Todos los compuestos evaluados resultaron no inhibidores y no sustrato de la glicoproteína P, una proteína transportadora de membrana asociada al fenómeno de resistencia a múltiples fármacos.
La absorción intestinal o HIA (por sus siglas en inglés) en cierta medida podría ser un indicador alternativo para la biodisponibilidad oral y, por lo tanto, también desempeña un papel importante en la evaluación preclínica de medicamentos. En este sentido, solo el ácido homogentísico, resultó positivo a este marcador.
Con respecto a la distribución, los porcentajes de unión a proteínas plasmáticas estuvieron por debajo del 90 % en todos los ligandos, mientras que tres de los compuestos (ácido homogentísico, ácido clorogénico y la mangiferina), resultaron positivos en cuanto a la barrera hematoencefálica. Es conocido que, cuanto menos unido esté un fármaco a las proteínas plasmáticas, más fácilmente podrá atravesar las membranas celulares o difundirse, lo que puede condicionar la distribución y eliminación del mismo.
Por otro lado, el metabolismo, mostró que, ninguno de los ligandos, incluido el compuesto de referencia, la mangiferina, fueron inhibidores de las isoformas de la enzima CYP450. Sin embargo, el ácido homogentísico resultó ser sustrato de dos de ellas (CYP450 2C9 y CYP450 2C19). El ácido gentísico, fue sustrato de la CYP450 C9 y el ácido clorogénico de la CYP450 3 A4.
Con respecto a la toxicidad, ninguno de los compuestos, resultaron bloqueadores de los canales hERG. Solo el ácido clorogénico mostró ser positivo a la posible hepatotoxicidad humana. En este sentido, estudios realizados por Llauradó,17 refirieron el restablecimiento de la función hepática en ratones BALB/C malnutridos y administrados por vía oral con un extracto crudo de cuerpos fructíferos de Pleurotus ostreatus. En dicho estudio in vivo no se evidenciaron manifestaciones de hepatotoxicidad.
Dichos investigadores constataron en el perfil de HPLC, la presencia de compuestos fenólicos, específicamente el ácido homogentísico. Este tipo de fenol se reporta como un buen candidato para la captación del radical 1- hidroxietil, y útil en la protección del hígado después del consumo de etanol.47)
Ninguno de los compuestos causó sensibilización cutánea y la mayoría, excepto el ácido clorogénico, pueden ser recomendados para una dosis máxima diaria.
Si bien los parámetros a considerar dentro de los estudios de toxicidad son variados, lo más importante es que los resultados apunten a un fármaco o producto que sea seguro desde el punto de vista de su aplicación.
Muchos agentes terapéuticos potenciales pueden no tener éxito en los ensayos clínicos debido a que sus parámetros ADME/T (absorción, distribución, metabolismo, excreción y toxicidad) no son favorables, además de no verificarse sus indicadores de similitud a un fármaco. De ahí que los estudios in silico constituyan herramientas útiles para futuros ensayos in vitro/ in vivo, así como para la realización de ensayos clínicos.
Conclusiones
El estudio predictivo in silico del acoplamiento molecular, las propiedades de similitud a un fármaco y las propiedades farmacodinámicas (ADME/T) revelaron las potencialidades de la fracción rica en fenoles de Pleurotus ostreatus, y en particular, del ácido homogentísico, como inhibidor de la enzima 5-LOX. Ello justifica el desarrollo de estudios confirmativos in vitro/ in vivo que corroboren sus efectos antioxidantes y antinflamatorios.