Introducción
El paracetamol, también conocido como acetaminofén, es un antipirético, analgésico no opioide y un antiinflamatorio no esteroideo (AINE), aunque carece de las acciones antiinflamatoria periférica y antiplaquetaria vista en este grupo de fármacos,1 tiene reacciones adversas a medicamentos (RAM) muy similares a los provocados por los AINE,2,3 por lo que se considera dentro de este grupo farmacológico.1 Es uno de los analgésicos y antipiréticos más empleados a nivel mundial para tratar la fiebre y dolores leves y moderados en una amplia población de pacientes. Su nombre proviene de la nomenclatura tradicional de la química orgánica N - acetil - para - aminofenol y para - acetil - aminofenol.2,4
Este fármaco fue sintetizado después de varios intentos de reducir o eliminar las RAM que provocaron en los pacientes sus dos precursores (acetanilida y fenacetina). Se reconoció como el principal metabolito activo de la cascada metabólica de la acetanilida y fue introducido al mercado en 1953, donde ganó gran popularidad por sus “escasas” RAM.2,4,5 Desde entonces, es uno de los analgésicos más utilizados en todo el mundo,4 y lamentablemente en algunos países se adquiere sin regulación a la prescripción, lo cual hace más irracional su uso.
A pesar de su aparente seguridad, no son pocos los autores que refieren RAM provocadas por el paracetamol, que incluyen desde la bastante estudiada hepatotoxicidad,3,4,5,6 hasta algunas afectaciones renales, respiratorias y cardiovasculares.2,4 Sin embargo, son escasos los estudios que se enfocan en esclarecer los mecanismos de acción del paracetamol que intervienen en estas RAM, sobre todo en las cardiovasculares. Cuando se conocen estos mecanismos, es posible establecer los límites de uso en la salud humana y contribuir a trazar estrategias de prevención de RAM que guíen a los profesionales de la salud para el uso racional de medicamentos. Con este estudio se evaluaron los posibles efectos directos vasculares y cardiacos del paracetamol, sobre la fuerza de contracción de anillos de aorta torácica, y sobre la actividad eléctrica y contráctil de corazones aislados y perfundidos de ratas Wistar.
Métodos
Se emplearon ratas Wistar machos adultos (7-8 semanas de vida y 200-250 g de peso) obtenidas del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB, La Habana, Cuba). Previo a los experimentos, los animales fueron adaptados por siete días en condiciones homogéneas de iluminación, alimentación y temperatura. Todos los procederes en los animales fueron conducidos acorde con las guías internacionales para el uso y cuidado de animales de laboratorio7 y fueron aprobados por el Comité de Ética de la Investigación del Instituto de Cardiología y Cirugía Cardiovascular. Las ratas fueron anestesiadas con tiopental sódico (30 mg/kg de peso corporal) y se les administró heparina sódica (5000 UI/kg de peso corporal), de acuerdo con los procedimientos aprobados por el CENPALAB.
Se extrajo un segmento de la aorta torácica que fue diseccionada para obtener anillos de unos 4 mm de largo aproximadamente. El endotelio vascular de los anillos fue denudado mecánicamente con el propósito de verificar posibles acciones directas del paracetamol sobre la musculatura lisa vascular. Los anillos se fijaron en un soporte que permitió controlar adecuadamente la tensión aplicada y registrar las contracciones mediante un transductor fuerza- desplazamiento, acoplado a un amplificador biofísico. Los anillos se bañaron en solución Tyrode estándar a 37 ºC (condición control) de la siguiente composiciόn (mmol/L): NaCl 140; KCl 2,5; MgCl2 0,5; CaCl2 2; Tris-hidroximetilaminometano 10; Glucosa 5, gaseada con oxígeno (pH = 7,4). La tensión de reposo fue ajustada a un valor de 0,8 g. Se utilizó la acetilcolina (Ach, agente vasodilatador) a 10 μmol/L para comprobar la ausencia o presencia de endotelio vascular y se dejaron estabilizar por 30 min, acorde con los procederes de Galán-Martínez y otros,8 con ligeras modificaciones. Una vez estabilizados, se indujo la contracción con una versión de la solución Tyrode a 60 mmol/L de KCl.
Durante el experimento fueron aplicadas concentraciones crecientes de paracetamol a la preparación, una vez que se alcanzaba la máxima tensión inducida. Luego de la aplicación de las diferentes concentraciones, se obtuvieron las relaciones concentración - efecto.
Se realizó la técnica de corazón aislado perfundido de Langendorf.8 Se utilizaron tres corazones (unidades muestrales) en los experimentos con paracetamol, (BioCubaFarma, Cuba). Los corazones fueron extraídos de las ratas previamente anestesiadas y heparinizadas. Posterior a la extracción, los corazones se depositaron en una disolución Tyrode estándar fría (~10 °C) con la misma composición dada anteriormente. Después de haber sido eliminados los restos de tejidos indeseables, los corazones se canularon de manera retrógrada por la aorta y se montaron en un sistema de perfusión termorregulado (~37 °C). El flujo se estableció a razón de 10 mL/min. El ápex cardiaco se ató a la palanca de un transductor fuerza-desplazamiento para el registro de la amplitud de la fuerza de contracción cardiaca. Se colocó en el epicardio izquierdo un electrodo de registro para obtener un electrograma de superficie y en la unión aurículo ventricular se colocó un electrodo de estimulación.
Cada corazón fue perfundido 30 minutos con disolución control (Tyrode) para alcanzar la estabilidad de la preparación, y a continuación se le perfundieron secuencialmente concentraciones crecientes del fármaco, hasta finalizar con disolución control nuevamente, para observar si el corazón recuperó su actividad inicial.
Durante el experimento se registraron los parámetros fisiológicos siguientes: frecuencia cardiaca espontánea (intervalo RR), intervalo QT, QT corregido (QTc = QT/√RR), complejo QRS y amplitud de la fuerza de contracción. La amplitud de la fuerza de contracción se midió solamente en presencia de estimulación, la misma se estableció a una frecuencia de 3,33 Hz con pulsos de 2 ms de duración y de dos veces la amplitud de corriente umbral.
Para la generación de pulsos de voltaje y el registro de los trazos de voltaje y fuerza de contracción, se utilizó una computadora (compatible a IBM) equipada con un conversor análogo digital (LabMaster DMA, 125 MHz, Scientific Solutions, USA) y el programa de adquisición ACQUIS1 (versión 2; Licencia CNRS, Francia).
Se calculó el porcentaje de inhibición de la fuerza de contracción para cada concentración aplicada, y se hizo un ajuste a una función de Hill para determinar el valor de concentración para el cual se alcanza el 50 % del efecto (IC50). La función de Hill está dada por la ecuación: y = vmax (xn/ kn + xn), donde “y” es el porcentaje de inhibición de la fuerza de contracción, “vmax” es el porcentaje de inhibición máximo de la fuerza de contracción, “x” es la concentración estudiada, “k” es IC50 y “n” es la constante de Hill.
Para el procesamiento estadístico se realizó una prueba t de Student para muestras pareadas, habiéndose comprobado previamente que los datos cumplían con las premisas de normalidad y homogeneidad de varianza. Se tomó como nivel mínimo de significación p < 0,05, y se expresaron los resultados como valores medios y errores estándar de la media. La elaboración de los gráficos y el procesamiento estadístico se hicieron en el programa OriginPro 8 SRO v8.0724 (MA, USA).
Resultados
En la figura 1 se observa un registro de la fuerza de contracción inducida con 60 mmol/L de KCl extracelular de un anillo de aorta aislado de rata con la aplicación de diferentes concentraciones de paracetamol. Al aplicar 10 μmol/L de acetilcolina (Ach) no ocurrió vasodilatación, por lo que se puede afirmar que el anillo aórtico no presentaba endotelio.
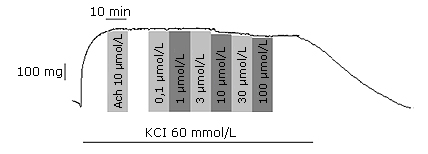
Fig. 1- Registro de la contracción de un anillo de aorta torácica de rata Wistar, perfundido extracelularmente con concentraciones crecientes de paracetamol.
Cada concentración se aplicó durante 10 min. La contracción de los anillos de aorta fue inducida por una solución Tyrode con KCl 60 mmol/L. Se comprobó la presencia o no de endotelio con acetilcolina (Ach) 10 μmol/L. Las rayas horizontales y el ancho de los rectángulos representan el tiempo durante el que se aplicaron las diferentes condiciones.
El paracetamol no tuvo efectos sobre el músculo liso vascular en ninguno de los anillos de aorta estudiados (n = 3). Se determinó que el porcentaje de la variación de la fuerza de contracción por paracetamol no fue estadísticamente significativo (Tabla 1).
Tabla 1- Efecto del paracetamol sobre la fuerza de contracción del músculo liso vascular
| Concentración de paracetamol (μmol/L) | % ± SE | p |
|---|---|---|
| 0, 10 | 1,75 ± 0,75 | 0, 89 |
| 1, 00 | 2,73 ± 1,53 | 0, 91 |
| 3, 00 | 1,17 ± 3,58 | 0, 93 |
| 10, 0 | 0,37 ± 4,79 | 0, 93 |
| 30, 0 | - 1,40 ± 7,10 | 0, 91 |
| 100 | - 1,43 ± 4,74 | 0, 94 |
Los valores representan el máximo efecto del paracetamol como porcentaje medio incrementado o disminuido (-) sobre el efecto del KCl (60 μmol/L) (Control) ± el error estándar de la media (% ± SE). * p < 0,05 con respecto al control; n = 3 para cada condición.
Los parámetros electrocardiográficos no mostraron variaciones significativas bajo ninguna de las concentraciones de paracetamol empleadas, por lo que se demostró que este fármaco no tiene efectos sobre la actividad eléctrica cardiaca (Tabla 2).
En la figura 2 se comparan los electrocardiogramas de un corazón aislado de rata en la condición control y en las condiciones de mayores concentraciones (100 μmol/L y 300 μmol/L) de paracetamol.
Tabla 2- Efectos del paracetamol sobre los parámetros electrocardiográficos comparados con la condición control (Tyrode estándar)
| Condición | RR (ms) | p | QRS (ms) | p | QT (ms) | p | QTc (ms) | P |
|---|---|---|---|---|---|---|---|---|
| Control | 212,1 ± 18,7 | - | 11,3 ± 1,6 | - | 53,3 ± 0,9 | - | 119,1 ± 7,1 | - |
| Paracetamol 1 μmol/L | 200,4 ± 4,9 | 0,11 | 13,1 ± 1,5 | 0,49 | 56,1 ± 0,7 | 0,11 | 126,4 ± 5,5 | 0,52 |
| Paracetamol 3 μmol/L | 215,5 ± 8,1 | 0,21 | 12,1 ± 1,9 | 0,76 | 58,4 ± 3,4 | 0,21 | 127,4 ± 8,8 | 0,50 |
| Paracetamol 10 μmol/L | 210,7 ± 8,9 | 0,32 | 11,5 ± 1,4 | 0,91 | 57,2 ± 3,3 | 0,32 | 124,4 ± 5,7 | 0,59 |
| Paracetamol 30 μmol/L | 215,4 ± 5,4 | 0,29 | 14,0 ± 2,0 | 0,36 | 51,8 ± 0,2 | 0,29 | 117,9 ± 4,9 | 0,91 |
| Paracetamol 100 μmol/L | 187,6 ± 5,4 | 0,76 | 13,1 ± 1,5 | 0,50 | 53,7 ± 0,2 | 0,76 | 122,2 ± 5,9 | 0,78 |
| Paracetamol 300 μmol/L | 198,6 ± 6,4 | 0,82 | 13,8 ± 2,2 | 0,41 | 53,7 ± 1,7 | 0,82 | 120,9 ± 7,9 | 0,88 |
Valores medios ± el error estándar de la media. * p < 0,05 con respecto al control; n = 3 para cada condición.

Fig. 2- Registros electrocardiográficos de un corazón aislado perfundido de rata Wistar, sometido a tres condiciones experimentales: control, 100 μmol/L y 300 μmol/L de paracetamol. No se observan diferencias significativas entre ninguna de las condiciones anteriores.
No se observaron arritmias en ninguno de los corazones estudiados, ni en presencia de paracetamol ni en condiciones controles.
Los experimentos mostraron que el paracetamol tiene un efecto inotrópico negativo sobre el miocardio de manera dependiente de la concentración. En la figura 3 se representa el registro de la fuerza de contracción cuando se somete un corazón aislado a algunas de las concentraciones de paracetamol utilizadas en los experimentos.
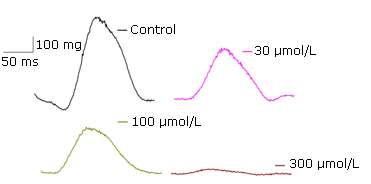
Fig. 3 - Curso temporal de la fuerza de contracción cardiaca en un corazón de rata Wistar aislado y perfundido en condición control y con diferentes concentraciones de paracetamol (30, 100 y 300 μmol/L).
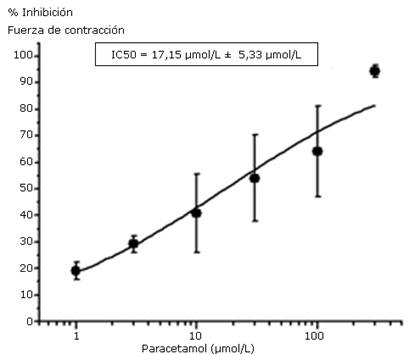
Para la mínima concentración de paracetamol empleada (1 µmol/L) el porcentaje de inhibición de la fuerza de contracción fue de 19,15 % ± 3,35 %, mientras que a concentraciones mayores como 100 y 300 µmol/L, los porcentajes de inhibición alcanzaron valores de 64,1 % ± 17,2 % y 94,3 % ± 2,3 %, respectivamente. La IC50 estimada fue de 17,15 ± 5,33 µmol/L (Fig. 4).
Fig. 4- Efecto del paracetamol sobre la actividad contráctil de corazones aislados y perfundidos de ratas Wistar, sometidos a concentraciones crecientes del fármaco.
Los puntos representan las medias ± errores estándares de tres experimentos para cada concentración. Se han ajustado las medias experimentales a una función de Hill. IC50: concentración para la que se alcanzó el 50 % de la inhibición de la fuerza de contracción.
Discusión
Los resultados obtenidos en este estudio muestran que el paracetamol no tiene efecto significativo sobre el músculo liso vascular en anillos de aorta torácica de ratas denudados de endotelio vascular, previamente contraídos con 60 mmol/L de KCl para las concentraciones aplicadas. Esto concuerda con lo obtenido por Keeble y otros, quienes para concentraciones semejantes demostraron que el paracetamol provoca una mínima relajación (menor del 10 % a 100 µmol/L) de anillos de aorta de rata, aunque estos fueron precontraídos con noradrenalina y tenían endotelio vascular.9 En el reciente estudio de van der Horst y otros, en 2020, tampoco encontraron efectos directos del paracetamol sobre el músculo liso vascular de ratas.10
Chiam y otros (2018) comprobaron los cambios hemodinámicos en pacientes de cirugía cardiaca al administrar paracetamol intravenoso y observaron una disminución significativa de la presión arterial comparada con el placebo salino.11 Otros estudios llevados a cabo en niños en terapia intensiva también encontraron un efecto hipotensor del paracetamol intravenoso.12,13 Por su parte, Kelly y otros (2016) compararon el efecto del paracetamol intravenoso con el oral en pacientes en la Unidad de Cuidados Intensivos con ventilación mecánica y determinaron que la mayor cantidad de eventos de hipotensión ocurría en los pacientes que fueron administrados por vía parenteral.14
En toda la literatura revisada resalta la mayor cantidad de autores que reflejan un efecto hipotensor del paracetamol administrado por vía intravenosa, mientras que son pocos los que observaron este mismo efecto en el administrado por vía oral.15 Este hecho no parece fortuito, pues la investigación reciente de van der Horst y otros lo asoció con la incapacidad de los vasos sanguíneos de eliminar, de forma eficiente, el metabolito tóxico del paracetamol N - acetil - p - benzoquinona - imina (NAPQI) al ser inyectado, a diferencia del hígado que sí puede hacerlo luego de una administración oral del fármaco.10 En dicho estudio se comprobó que el NAPQI y la N - araquidonoilfenolamina (AM404), otro metabolito del paracetamol, activan canales de potasio Kv7 en arterias mesentéricas aisladas de ratas Wistar precontraídas con metoxamina, provocando vasodilatación. Sin embargo, demostraron que el paracetamol per se no tiene efecto sobre el músculo liso vascular,10 resultado muy similiar a los obtenidos en este estudio. Por tanto, los efectos hipotensores del paracetamol observados en muchos estudios pudieran ser inducidos por estos dos metabolitos analizados.
Asimismo, en la literatura hay evidencias del efecto hipertensor del paracetamol.3,4 Un mecanismo fisiológico que parece explicar el desarrollo de hipertensión inducida por paracetamol pudiera ser su papel en la inhibición de la ciclooxigenasa 2 (COX-2), que disminuye la síntesis de las prostaglandinas vasodilatadoras PGI2 y PGE2. La inhibición de la PGI2 provoca la vasoconstricción del músculo liso vascular en el riñón y, por tanto, la disminución del flujo sanguíneo renal, que conlleva a disminuir la cantidad de líquido filtrado y por tanto al incremento de la presión arterial; mientras que la inhibición de la PGE2 provoca la disminución de la natriuresis, que produce un aumento del volumen plasmático, provocando también un incremento de la presión arterial.4
Ninguna concentración de paracetamol empleada en este estudio mostró efectos estadísticamente significativos sobre los parámetros electrocardiográficos medidos.
Los resultados del presente estudio sobre el intervalo RR como medida de la frecuencia cardiaca concuerdan con lo observado por van der Horst y otros en ratas anestesiadas, que al administrarles una dosis de paracetamol intravenoso de 14,12 mg/kg (equivalente a 1 g de paracetamol en un humano de 70 kg), no observaron cambios significativos en la frecuencia cardiaca.10
Igualmente, Merrill (2002) no observa efecto del paracetamol sobre la frecuencia cardiaca en corazones de cobayas,16 en tanto Merrill y otros (2004) no evidencian eventos arrítmicos en perros tratados con dicho fármaco en condiciones de isquemia - reperfusión y tienen mayor estabilidad eléctrica que los tratados con el vehículo de solución salina.17Merrill y otros (2007) tampoco observaron efectos del paracetamol sobre la frecuencia cardiaca en perros anestesiados, y en condiciones de isquemia - reperfusión, las arritmias ventriculares fueron significativamente menores en presencia de paracetamol, comparado con el vehículo, lo cual demuestra las propiedades antiarrítmicas del paracetamol.18 Estos resultados ratifican los obtenidos en el presente estudio, donde no se observaron arritmias en ninguno de los corazones tratados con paracetamol.
En clínica se han encontrado casos de pacientes con prolongación de los intervalos QRS y QTc del electrocardiograma con el consumo a sobredosis de paracetamol, pero administrado concomitantemente con otros medicamentos como propoxifeno y dextropropoxifeno, donde los cambios en el electrocardiograma estuvieron atribuidos a estos últimos debido a su ya estudiada cardiotoxicidad en animales y en humanos.19 Igualmente, existen reportes de casos de pacientes con prolongación del intervalo QT y arritmias del tipo “Torsión de puntas” polimedicados con medicamentos que incluyen al paracetamol, pero este efecto de igual manera fue provocado por los medicamentos administrados simultáneamente como metoclopramida, paroxetina, entre otros.20
En contraste con lo observado en los parámetros electrocardiográficos en el presente estudio, la fuerza de contracción cardiaca sí mostró variaciones estadísticamente significativas durante la perfusión del corazón aislado con concentraciones ascendentes de paracetamol. Se observó un efecto inotrópico negativo inducido por el fármaco, que inhibió la fuerza de contracción en un valor cercano al 20 % con la mínima concentración empleada (1 μmol/L) y cerca del 95 % con la máxima concentración (300 μmol/L). Merrill y otros (2001) difieren con estos resultados, pues muestran un efecto inotrópico positivo estadísticamente significativo causado por paracetamol con las mayores concentraciones utilizadas: 350 μmol/L y 600 μmol/L.21 Estas diferencias pudieran ser debidas a que las dos concentraciones son mayores que la más alta empleada en este estudio, además, el efecto inotrópico positivo encontrado por Merrill y otros (2001) fue medido indirectamente como la tasa de cambio de la presión con respecto al tiempo,21) y no de forma directa como la amplitud de la fuerza de contracción (como se realizó en este estudio).
La concentración plasmática máxima de paracetamol a dosis terapéuticas fue determinada por Forrest y otros (1982) y tiene un valor aproximado de 131 μmol/L. Cabe destacar que el paracetamol alcanza el tejido cardiaco al administrarse tanto por vía oral como por vía intravenosa.22 Según los resultados obtenidos en el presente estudio, esta concentración es capaz de inhibir la fuerza de contracción cardiaca en un 74 % aproximadamente, por lo que es un factor que pudiera estar muy relacionado con los eventos de hipotensión inducida por paracetamol observados en la clínica al aplicarse el fármaco por cualquiera de las dos vías de administración.1,15
Una concentración de 300 μmol/L de paracetamol (la mayor de las empleadas en el estudio) inhibió la fuerza de contracción en un 94,3 % ± 2,3 %. Valores de concentración del paracetamol en el plasma sanguíneo mayores que la concentración plasmática máxima a dosis terapéuticas (131 μmol/L) pueden observarse en pacientes con sobredosis del fármaco.5 Este hallazgo revela una relación estrecha entre el consumo a sobredosis de paracetamol y el desarrollo de diferentes patologías cardiovasculares como la elevación o depresión del intervalo ST, inversión de la onda T, arritmias auriculares y ventriculares, necrosis y hemorragias del miocardio.5
La hipotensión observada en algunos pacientes luego de la administración de paracetamol por vía oral o intravenosa pudiera tener otra explicación plausible si se analiza su efecto sobre la fuerza de contracción cardiaca. La presión arterial (PA) es directamente proporcional al gasto cardiaco (GC) y a la resistencia periférica total (RPT) según la ecuación: PA = GC × RPT
El gasto cardiaco depende directamente, a su vez, del gasto o volumen sistólico y de la frecuencia cardiaca (HR, por sus siglas en inglés): GC = VS × HR, mientras que el volumen sistólico depende tanto del retorno venoso como de la fuerza de contracción.23 Por tanto, una disminución de la amplitud de la fuerza de contracción disminuye el gasto cardiaco y por consiguiente la presión arterial se reduce también. Un mecanismo similar también explicaría los casos de hipotensión en pacientes con sobredosis de paracetamol. El fallo hepático que sufren estos pacientes conduce a la disminución de la resistencia vascular, y el gasto cardiaco incrementa en orden de regular la presión arterial. Esta descompensación conlleva a la hipotensión.5
Por otra parte, la selectividad tisular mostrada por el paracetamol al influir sobre la fuerza contráctil del músculo cardiaco, y en mucha menor medida sobre el músculo liso vascular, es un elemento destacable. Algunos fármacos bloqueadores de canales de calcio, como el verapamilo y el diltiazem, muestran una selectividad cardiaca24 muy similar a la manifestada por el paracetamol. Esta selectividad de acción de los antagonistas del calcio se debe a varios factores que influyen individualmente o en combinación. Entre estos se encuentran: los factores farmacocinéticos como son la distribución y acumulación de los fármacos en el tejido, el modo de movilización del Ca2+, las diferencias en los sitios de unión (originado por la existencia de disímiles familias y subfamilias de canales de calcio), las interacciones dependientes del estado de apertura de los canales de calcio y las condiciones fisiopatológicas del tejido.24 Por tanto, uno de estos factores pudiera ser determinante en la preferencia selectiva del paracetamol sobre el músculo cardiaco.
Conclusiones
Los resultados de los estudios observacionales y de intervención no siempre resultan confiables debido a que pueden estar influenciados por muchos factores difíciles de controlar. Esto conlleva a que existan algunos que tengan resultados contradictorios, por lo que el efecto real del paracetamol no está totalmente claro. Dado que hay mecanismos descritos sobre los efectos del paracetamol sobre la presión sanguínea, este fármaco debe ser utilizado cuidadosamente en pacientes con enfermedades cardiovasculares. No obstante, los resultados del presente estudio sugieren que las acciones cardiovasculares directas del paracetamol son modestas, lo cual contribuye al buen margen de seguridad para su uso en clínica en pacientes sin enfermedad cardiovascular.